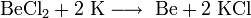бериллий это какой металл
Бериллий – полезные свойства, уникальность и опасность металла
Это вещество соперничает с алюминием, сталями, благородными металлами.
Бериллий приходит на Землю из Космоса. Им покрыты зеркала телескопов, он есть в Большом адронном коллайдере.
Что представляет собой
Бериллий – элемент №4 таблицы Менделеева. Сероватый металл легок, с приглушенным блеском.
Имеет в составе один стабильный изотоп Ве-9.
Его материалом служит вещество межзвездных скоплений. Доставляется на Землю лучами из глубин Космоса.
Проблемы классификации
Бериллий относится к щелочноземельным металлам. Однако с классификацией определились не сразу.
По химическим свойствам его легко отличить от остальных металлов этой группы. Он не реагирует с водой, его гидроксид – не щелочь.
Однако сегодня, согласно номенклатуре Международного союза теоретической и прикладной химии (ИЮПАК), все элементы второй группы таблицы Менделеева, а значит и бериллий, считаются щелочноземельными металлами.
Как был открыт
К открытию элемента причастны европейские химики, физик и русский ученый:
Интересна история названия элемента. За сладкий вкус растворяемых водой соединений его окрестили глицинием. Бериллием его предложили именовать химики Мартин Клапрот (Германия) и Андерс Экеберг (Швеция).
Термин «берилл» восходит к названию индийского города Белур в окрестностях Мадраса. Здесь веками добывали ювелирную разновидность берилла – изумруд.
Формы нахождения в природе
В природе металл представлен россыпями и коренными залежами минералов.
Таких минералов три десятка, из них половина – силикаты, еще четверть – фосфаты. Самые известные – берилл, фенакит, хризоберилл.
Тонна земной коры содержит 3,8 г бериллия (щелочные породы – до 70 г). Литр морской воды – 0,000006 мг.
Попадаются кристаллы с габаритами в несколько метров и тонн. Их добывают из пегматитов.
На особом счету драгоценные разновидности берилла – аквамарин, изумруд, гелиодор. Голубой, зеленый, желтый цвет создают примеси других элементов в составе.
Месторождения
Месторождения бериллиевых руд распределены по планете. Наибольшие запасы – в обеих Америках (США, Бразилия, Аргентина), Африке, Казахстане, России.
Источники сырья в России – Бурятия, Свердловская, Мурманская области.
Физико-химические характеристики
Бериллий – необычный металл. С изменением температуры кристаллическая структура его решетки меняется с гексагональной на кубическую.

Ученые выявили уникальные физические и химические свойства элемента:
Твердость средняя (5,5 по Моосу), но это больше, чем у других «легких» металлов.
| Свойства атома | |
|---|---|
| Название, символ, номер | Бери́ллий / Beryllium (Be), 4 |
| Атомная масса (молярная масса) | 9,012182(3) а. е. м. (г/моль) |
| Электронная конфигурация | [ He ] 2s² |
| Радиус атома | 112 пм |
| Химические свойства | |
| Ковалентный радиус | 90 пм |
| Радиус иона | 35 (+2e) пм |
| Электроотрицательность | 1,57 (шкала Полинга) |
| Электродный потенциал | −1,69 В |
| Степени окисления | +2 ; 0 |
| Энергия ионизации (первый электрон) | 898,8 (9,32) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 1,848 г/см³ |
| Температура плавления | 1551 K (1278 °C, 2332 °F) |
| Температура кипения | 3243 K (2970 °C, 5378 °F) |
| Уд. теплота плавления | 12,21 кДж/моль |
| Уд. теплота испарения | 309 кДж/моль |
| Молярная теплоёмкость | 16,44 Дж/(K·моль) |
| Молярный объём | 5,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=2,286 Å; c=3,584 Å |
| Отношение c/a | 1,567 |
| Температура Дебая | 1000 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 201 Вт/(м·К) |
| Номер CAS | 7440-41-7 |
На воздухе металл покрывается оксидным щитом-пленкой. Поэтому химическая активность запускается только при высоких температурах.
Технология получения
Бериллиевую руду доставляют на обогатительную фабрику.
Здесь получают соли вещества:
Переработка руды налажена в США, КНР, Казахстане, России.
Глобальный объем производства бериллия – 260-310 тонн ежегодно.
Обработка бериллия проблематична, опасна для здоровья, поэтому главные способы производства – точное литье и порошковая металлургия. Размолотый металл спрессовывают, создавая форму по заданным параметрам либо универсальную заготовку (труба, пруток).
Обработку затрудняет хрупкость. Этот недостаток устранили в 1970-х годах, выяснив, что пластичен чистый бериллий.
Где используется
Две трети бериллия либо соединений забирает промышленность. Каждый сегмент использует нужные для себя достоинства вещества. Самые красивые находки достаются ювелирам и коллекционерам.
Металлургия
Первые в цепочке потребителей руды – металлурги. Добавка микродоз бериллия к сталям и сплавам повышает их утилитарные характеристики: прочность, твердость, невосприимчивость к ржавчине.

Особо популярна бериллиевая бронза (рандоль). Идет на диски, пружины, другие комплектующие, работающие в экстремальных условиях.
Всего 0,5% бериллия в составе сплава на порядки увеличивает количество рабочих циклов изделия, предотвращает искрение. Внешне сплав неотличим от благородного металла, за что назван «цыганским золотом».
Другие отрасли
Продукцию металлургов закупают производители оборудования для разных сфер:
ФАКТ! Из бериллия сделан «трубопровод» Большого адронного коллайдера. Им покрыты зеркала телескопов Хаббла, Спитцера, Уэбба, работающих в открытом космосе.
На российском рынке представлены разные продукты из металла.
Цена определяется видом продукции (руб./ кг):
Такой же расклад на мировом рынке.
Опасность
Роль вещества для биологических систем невелика. Однако металл скапливается в почках, способен вытеснить из скелета магний.
Каждый день в организм человека с пищей поступает 0,01 мг бериллия.
Металлический бериллий нетоксичен. Опасность исходит от пыли, порошка, растворимых, летучих соединений. Они провоцируют аллергию и онкологию.
Особо ощущают вредность металла работники, занятые на добыче и обогатительных предприятиях. Их профессиональное заболевание – бериллиоз. То есть поражение дыхательной системы (особенно легких).
По стандартам РФ, кубометр воздуха не должен содержать более 0,001 мг бериллия.
История открытия и свойства металла бериллий
Бериллий — металл светло-серого цвета, отличающийся повышенной хрупкостью. Он находится в периодической таблице Менделеева под 4 номером. Это хрупкий металл светло-серого цвета. Он применяется в разных сферах деятельности. Его часто используют в ядерной энергетике.

История открытия
Металл был открыт в 1798 году благодаря работам известного французского химика Луи Никола Воклена. Ученый назвал новый элемент глюцинием. Большой вклад в изучение этого металла внес известный русский химик Иван Авдеев. Он изучал природные соединения, минералы, которые содержат это вещество.
Выведение бериллия в чистом виде произошло в 1828 году. Открытие произвел французский химик Антуан Бюсси. Практически одновременно с ним, но независимо от его работ, этот элемент получил немецкий химик Фридрих Велер. Получить чистый бериллий получилось у Поля Лебо в 1898 году. Он добился успеха благодаря электролизу расплавленных солей этого элемента.
Свое наименование элемент получил от минерала, в котором он содержится в большем количестве, — берилла. Первое название «глюциний или глиций» появилось из-за того что соединения этого элемента при растворении в воде давали сладковатый привкус.
Запасы и месторождения
Основная масса бериллия находится в магматических породах, в которых он замещает кремний. Металл присутствует в мусковитах, темноцветных минералах. В щелочных породах он практически полностью рассеивается.
Металл содержится более чем в 30 минералах. Шесть из них встречаются достаточно часто. К ним относятся — фенакит, бертрандит, хризоберилл, даналит, гельвин, берилл.
Добыча и промышленное получение
Добыча начинается с разработки карьеров. Процесс промышленного получения состоит из нескольких этапов:
Альтернативные способы получения:
При использовании таких способов получения бериллий подвергают дополнительной обработке — зонной плавке, электронному рафинированию или дистилляции в вакууме.
Минерал берилл (Фото: Instagram / chemicator)
Свойства и характеристики
Бериллий имеет уникальные свойства, которые выделяют его среди других металлов. От них зависят сферы применения материала.
Физические
При нормальном состоянии бериллий — хрупкий металл светло-серого цвета.
Химические
Химические свойства металла:
Степени окисления — +1 или +2. По химическим характеристикам его можно сравнить с алюминием. Металлический бериллий при комнатной температуре практически не вступает в реакции с другими веществами.
Механические
Механические свойства этого металла зависят от наличия сторонних примесей, легирующих добавок, методов обработки, которые применялись при его получении, величины зерен.
Показатель пластичности начинает повышаться при нагревании до 200°.
Где используется бериллий?
Основное направление применения бериллия — легирование металлических сплавов. Этот компонент повышает прочность, твердость, коррозийную стойкость металлов.
Влияние на организм
Бериллий содержится в тканях разных представителей фауны, флоры. При небольшом содержании металл безвреден для организма. Если внутренние органы, системы функционируют в нормальном режиме, большая часть этого металла выводится из организма с мочой. Около 30% оседает в костях, 8% — в почках, печени.
Вредной является пыль бериллия, которая образуется при его добыче, промышленном получении. Чтобы избежать отравления бериллием, нужно использовать защитный костюм, респиратор и очки.
Сплавы
Сплавы на основе бериллия начали получать популярность с 1950 годов. Его содержание в смеси с другими компонентами могло составлять от 5 до 80%. Для повышения пластичности к нему добавляют магний, медь или алюминий.
Бериллий — опасный токсичный металл, пыль которого может вызвать тяжелые заболевания дыхательных путей. Если при его добыче и переработке использовать защитные костюмы, можно свести негативное влияние к нулю. Металл используется в разных направлениях промышленности.
Бериллий — металл с удивительными свойствами
Бериллий — простое вещество, элемент таблицы Менделеева 
Открыт новый элемент был в середине 18-го века во Франции Луи Вокленом, который исследовал, чем состав берилла отличаются от изумруда. Сам металл он выделить не смог, но получил оксид бериллия, установил существование неизвестного ранее металла, который предложил назвать глюцинием, от греческого слова glykуs («сладкий»). Такое название он объяснял тем, что соединения бериллия сладкие на вкус. Во Франции и сейчас этот элемент часто называют глюцинием и обозначают Gl.
Химически чистый металл был получен лишь спустя 100 лет французом Полем Лебо с помощью электролиза. Металлический порошок тоже оказался на вкус сладким.
Бериллий считается редким металлом, мировые запасы оцениваются всего в 80 тыс. тонн. Содержится преимущественно на суше, в морях и океанах его почти нет. Существует более 30-ти минералов, в состав которых входит бериллий, но практически все они очень редкие. Только берилл, хризоберилл, бертрандит, гельвин, даналит, фенакит встречаются относительно часто. Промышленно значимым является только берилл.
 |  |
| Маска полнолицевая ЗМ 6800 средний размер | Костюм «Л-1» с хранением |
Свойства
Серебристый металл с масляным блеском. На воздухе за пару часов покрывается серой пленкой окиси. Отличается высокой твердостью и хрупкостью, что значительно осложняет его обработку. Очень легкий (легче алюминия) и прочный (проволока толщиной 1 мм выдерживает вес около 80 кг, подобная алюминиевая проволока — только 12 кг). При нагреве свыше +400 °С теряет лишь 50% прочности (для сравнения, дюралюминий — 80%). Обладает более высокой упругостью, чем стали, причем упругость сохраняется даже при высоких температурах. Еще одно замечательное качество — в нем почти не накапливается усталость металла. У Be аномально высокие температуры кипения и плавления. Теоретически он должен плавиться при t не более +400 °С, на деле — при +1278 °С. Отличается высокой теплоемкостью, теплопроводностью, низким электросопротивлением.
В обычных условиях химически малоактивен, это объясняется строением атомного ядра с электронами на s-орбиталях. Нужны экстремальные условия или очень активные вещества, чтобы отобрать электроны с этих орбиталей. Дополнительную защиту дает тончайшая пленка оксида, образующаяся на поверхности. Поэтому в химические реакции бериллий вступает, большей частью, после сильного нагревания. Основная валентность — два.
Химически сходен с алюминием. В нормальных условиях взаимодействует с разбавленными щелочами и минеральными кислотами (кроме концентрированной азотной). Кристаллы устойчивы к воздействию воды даже при сильном нагревании. Порошкообразное вещество горит, одновременно реагируя с кислородом и азотом воздуха, образуя окись и нитрид. Реагирует с галогенами, халькогенами (группа кислорода, серы и селена), аммиаком, углеродом, но при нагревании до 600-1200 °С и выше. Ни при каких условиях напрямую не взаимодействует с водородом.
Меры предосторожности
Крайне токсичен. В микродозах распространен по всей земной коре, присутствует в растениях, организме животных и человека. Человек получает его с пищей — это безвредно.
Опасность представляет пыль Be и его производных, 
Бериллий: способы получения и химические свойства
Бериллий Be — это cветло-серый, легкий, хрупкий металл. На воздухе покрывается оксидной пленкой. Восстановитель.
Относительная молекулярная масса Mr = 9,012; относительная плотность для твердого и жидкого состояния d = 1,85; tпл = 1287º C; tкип = 2507º C.
Способ получения
1. В результате электролиза расплава хлорида бериллия образуются бериллий и хлор :
3. Оксид бериллия легко восстанавливается магнием при 700 — 800º С, образуя бериллий и оксид магния:
BeO + Mg = MgO + Be
4. Фторид бериллия также легко восстанавливается магнием при 700 — 750º С с образованием бериллия и фторида магния:
BeF2 + Mg = Be + MgF2
Качественная реакция
Качественная реакция на бериллий — окрашивание пламени горелки в коричнево — красный цвет.
Химические свойства
1.1. Бериллий взаимодействует с азотом при 700 — 900º С образуя нитрид бериллия:
1.2. Бериллий сгорает в кислороде (воздухе) при 900º С с образованием оксида бериллия:
2Be + O2 = 2BeO
Be + Br2 = BeBr2
1.4. С серой бериллий реагирует при температуре 1150º C с образованием сульфида бериллия:
Be + S = BeS
1.5. С углеродом бериллий реагирует при 1700 — 1900º С и вакууме, образуя карбид бериллия:
2Be + C = Be2C
2. Бериллий активно взаимодействует со сложными веществами:
2.2. Бериллий взаимодействует с кислотами:
2.2.1. Бериллий реагирует с разбавленной соляной кислотой, при этом образуются хлорид бериллия и водород :
Be + 2HCl = BeCl2 + H2 ↑
2.2.2. Реагируя с разбавленной и горячей азотной кислотой бериллий образует нитрат бериллия, газ оксид азота (II) и воду:
2.2.3. В результате реакции концентрированной фтороводородной кислоты и бериллия образуется осадок тетрафторобериллат водорода и газ водород:
2.3. Бериллий может взаимодействовать с основаниями:
2.3.1. Бериллий взаимодействует с гидроксидом натрия в расплаве при температуре 400 — 500º С, при этом образуется бериллат натрия и водород:
2.4. Бериллий вступает в реакцию с газом аммиаком при 500 — 700º С. В результате данной реакции образуется нитрид бериллия и водород:
2.5. Бериллий может вступать в реакцию с оксидами :
В результате взаимодействия бериллия и оксида магния при температуре 1075º С образуется оксид бериллия и магний:
Be + MgO = BeO + Mg
3. Бериллий взаимодействует с органическими веществами :
Бериллий может вступать в реакцию с ацетиленом при 400 — 450º С, образуя карбид бериллия и водород:
Бериллий
мягкий металл серебристо-белого цвета
Бериллий химический элемент главной подгруппы второй группы, второго периода периодической системы химических элементов Д.И.Менделеева, с атомным номером 4. Обозначается символом Be ( Beryllium ). Простое вещество бериллий (CAS-номер: 7440-41-7)— мягкий высокотоксичный металл серого цвета, имеет весьма высокую стоимость.
История
Открыт в 1798г. французским химиком Луи Никола Вокленом. Большую работу по установлению состава соединений бериллия и его минералов провёл русский химик И.В.Авдеев (1818—1865). Именно он доказал, что оксид бериллия имеет состав BeO, а не Be2O3, как считалось ранее.
Происхождение названия
Определение элемента бериллий произошло от названия минерала берилла (beryllos) (силикат бериллия и алюминия, Be3Al2Si6O18), которое восходит к названию города Белур (Веллуру) в Южной Индии, недалеко от Мадраса; с древних времён в Индии были известны месторождения изумрудов— разновидности берилла. Из-за сладкого вкуса растворимых в воде соединений бериллия элемент вначале называли «глюциний» (от греч. glykys— сладкий).
Нахождение в природе
Изотоп 8 Be отсутствует в природе, поскольку является крайне нестабильным и имеет период полураспада 10 −18 с. Стабильным является 9 Be. Кроме 9 Be в природе встречаются радиоактивные изотопы 7 Be и 10 Be.
Содержание бериллия в земной коре— около 3,5 г/т, обычно он встречается как примесь к различным минералам. Известно более 30 собственно бериллиевых минералов, но только 6 из них считаются более-менее распространёнными: берилл, хризоберилл, бертрандит, фенакит, гельвин, даналит. Промышленное значение имеет в основном берилл, в РФ (Республика Бурятия) разрабатывается фенакит-бертрандитовое Ермаковское месторождение.
Разновидности берилла считаются драгоценными камнями: аквамарин — голубой, зеленовато-голубой, голубовато-зеленый; изумруд— густо-зеленый, ярко-зеленый; гелиодор — желтый; известны ряд других разновидностей берилла, различающихся окраской (темно-синие, розовые, красные, бледно-голубые, бесцветные и др.). Цвет бериллу придают примеси различных элементов.
Физические свойства
Бериллий— мягкий, но не пластичный (легко разрушается) металл серебристо-белого цвета. Имеет высокий (в связи с чем ему ошибочно приписывается высокая твёрдость) модуль упругости— 300 ГПа (у сталей— 200—210 ГПа). На воздухе активно покрывается стойкой оксидной плёнкой BeO.
Модуль продольной упругости (модуль Юнга) 300 ГПа (312кгс/мм2). Механические свойства Бериллия зависят от чистоты металла, величины зерна и текстуры, определяемой характером обработки. Предел прочности Бериллия при растяжении 200—550 Мн/м2(20-55 кгс/мм2), удлинение 0,2-2%, что при таком высоком модуле упругости обеспечивает его хрупкость. Обработка давлением приводит к определенной ориентации кристаллов. Возникает анизотропия, становится возможным значительное улучшение свойств. Предел прочности в направлении вытяжки доходит до 400—800 Мн/м2(40-80 кгс/мм2), предел текучести 250—600 Мн/м2(25-60 кгс/мм2), а относительное удлинение до 4-12%. Механические свойства в направлении, перпендикулярном вытяжке, почти не меняются. Бериллий— хрупкий металл; его ударная вязкость 10-50 кДж/м2 (0,1-0,5 кгс·м/см2). Температура перехода Бериллия из хрупкого состояния в пластическое 200—400°C.
Химические свойства
Получение
В виде простого вещества в XIX веке бериллий получали действием калия на безводный хлорид бериллия:
В настоящее время бериллий получают, восстанавливая его фторид магнием:
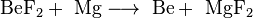
либо электролизом расплава смеси хлоридов бериллия и натрия. Исходные соли бериллия выделяют при переработке бериллиевой руды.
Применение Бериллия
Легирование сплавов
Бериллий в основном используют как легирующую добавку к различным сплавам. Добавка бериллия значительно повышает твёрдость и прочность сплавов, коррозионную устойчивость поверхностей изготовленных из этих сплавов изделий. В технике довольно широко распространены бериллиевые бронзы типа BeB (пружинные контакты). Добавка 0,5% бериллия в сталь позволяет изготовить пружины, которые пружинят при красном калении.
Рентгенотехника
Бериллий слабо поглощает рентгеновское излучение, поэтому из него изготавливают окошки рентгеновских трубок (через которые излучение выходит наружу).
Ядерная энергетика
В атомных реакторах из бериллия изготовляют отражатели нейтронов, его используют как замедлитель нейтронов. В смесях с некоторыми α-радиоактивными нуклидами бериллий используют в ампульных нейтронных источниках, так как при взаимодействии ядер бериллия-9 и α-частиц возникают нейтроны: 9 Ве + α → n + 12 C. Оксид бериллия является наиболее теплопроводным из всех оксидов и служит высокотеплопроводным высокотемпературным изолятором, и огнеупорным материалом(тигли), а кроме того наряду с металлическим бериллием служит в атомной технике как более эффективный замедлитель и отражатель нейтронов чем чистый бериллий, кроме того оксид бериллия в смеси с окисью урана применяется в качестве очень эффективного ядерного топлива. Фторид бериллия в сплаве с фторидом лития применяется в качестве теплоносителя и растворителя солей урана, плутония, тория в высокотемпературных жидкосолевых атомных реакторах.
Лазерные материалы
В лазерной технике находит применение алюминат бериллия для изготовления твердотельных излучателей (стержней, пластин).
Аэрокосмическая техника
В производстве тормозов для аэрокосмической техники, тепловых экранов и систем наведения с бериллием не может конкурировать практически ни один конструкционный материал. Конструкционные материалы на основе бериллия обладают одновременно и лёгкостью, и прочностью, и стойкостью к высоким температурам. Будучи в 1,5 раз легче алюминия, эти сплавы в то же время прочнее многих специальных сталей. Налажено производство бериллидов применяемых как конструкционные материалы для двигателей и обшивки ракет и самолетов, а так же в атомной технике.
Ракетное топливо
| Окислитель | Удельная тяга(Р1,сек) | Температура сгорания °С | Плотность топлива г/см³ | Прирост скорости, ΔVид,25, м/сек | Весовое содерж.горючего% |
|---|---|---|---|---|---|
| Фтор | 323,3 сек | 4328°C | 1,547 | 5014 м/сек | 13% |
| Тетрафторгидразин | 310,8 сек | 4234°C | 1,19 | 4204 м/сек | 11% |
| ClF3 | 277,4 сек | 4075°C | 1,85 | 4696 м/сек | 13% |
| ClF5 | 289,6 сек | 4176°C | 1,762 | 4791 м/сек | 13% |
| Перхлорилфторид | 242,6 сек | 3593°C | 1,709 | 3953 м/сек | 13% |
| Окись фтора | 308,6 сек | 4177°C | 1,561 | 4986 м/сек | 13% |
| Кислород | 235,4 сек | 3637°C | 1,21 | 3213 м/сек | 15% |
| Перекись водорода | 276,8 сек | 3472°C | 1,503 | 4231 м/сек | 18% |
| Азотная кислота | 256 сек | 2728°C | 1,574 | 4005 м/сек | 24% |
Стоит отметить высокую токсичность и высокую стоимость металлического бериллия, и в этой связи приложены значительные усилия для выявления бериллийсодержащих топлив имеющих значительно меньшую общую токсичность и стоимость. Одним из таких соединений бериллия является гидрид бериллия.
| Окислитель | Удельная тяга(Р1,сек) | Температура сгорания °С | Плотность топлива г/см³ | Прирост скорости, ΔVид,25, м/сек | Весовое содерж.горючего% |
|---|---|---|---|---|---|
| Фтор | 354,9 сек | 4244°C | 1,298 | 5029 м/сек | 13% |
| Тетрафторгидразин | 335,6 сек | 4133°C | 1,065 | 4270 м/сек | 10% |
| ClF3 | 298,8 сек | 3885°C | 1,573 | 4674 м/сек | 10% |
| ClF5 | 314,5 сек | 3979°C | 1,481 | 4773 м/сек | 11,25% |
| Перхлорилфторид | 309,5 сек | 2932°C | 1,114 | 4037 м/сек | 34% |
| Окись фтора | 342,9 сек | 3027°C | 1,054 | 4338 м/сек | 35% |
| Кислород | 331,4 сек | 3079°C | 0,867 | 3744 м/сек | 45% |
| Перекись водорода | 353,1 сек | 2932°C | 0,98 | 4285 м/сек | 41% |
| N2O4 | 316,1 сек | 2558°C | 0,93 | 3721 м/сек | 48% |
| Азотная кислота | 322,1 сек | 3085°C | 1,047 | 4060 м/сек | 35% |
Огнеупорные материалы
Оксид бериллия применяется в качестве очень важного огнеупорного материала в специальных случаях. Считается одним из лучших огнеупорных материалов и при этом это самый теплопроводный огнеупорный материал.
Биологическая роль и физиологическое действие
В живых организмах бериллий не несёт какой-либо значимой биологической функции. Однако бериллий может замещать магний в некоторых ферментах, что приводит к нарушению их работы. Нормальное содержание бериллия в организме взрослого человека (при массе тела 60 кг) составляет 0,031мг, ежедневное поступление с пищей— около 0,01мг.
Бериллий— ядовит: Летучие (и растворимые) соединения бериллия, в том числе и пыль, содержащая соединения бериллия, высокотоксичны. Для воздуха ПДК (предельно допустимые концентрации) вещества в пересчёте на бериллий составляет 0,001 мг/м³. Бериллий обладает ярко выраженным аллергическим и канцерогенным действием. Вдыхание атмосферного воздуха содержащего бериллий приводит к тяжёлому заболеванию органов дыхания — бериллиозу.
Дополнительная информация по Бериллию
Бериллий, Beryllium, Be (4)
Содержащие бериллий минералы (драгоценные камни) — берилл, смарагд, изумруд, аквамарин и др.- известны с глубокой древности. Некоторые из них добывались на Синайском полуострове еще в XVII в. до н. э. В Стокгольмском папирусе (III в.) описываются способы изготовления поддельных камней. Название берилл встречается у греческих и латинских (Beryll) античных писателей и в древнерусских произведениях, например в «Изборнике Святослава» 1073 г., где берилл фигурирует под названием вируллион. Исследование химического состава драгоценных минералов этой группы началось, однако, лишь в конце XVIII в. с наступлением химико-аналитического периода.
Первые анализы (Клапрот, Биндгейм и др.) не обнаружили в берилле ничего особенного.
Клапрот, будучи противником наменования новых элементов по случайным свойствам их соединений, предложил именовать глюциний бериллием (Beryllium), указав, что сладким вкусом обладают соединения и других элементов. Металлический бериллий был впервые получен Велером и Бусси в 1728 г. путем восстановления хлорида бериллия металлическим калием. Отметим здесь выдающиеся исследования русского химика И.В.Авдеева по атомному весу и составу окисла бериллия (1842). Авдеев установил атомный вес бериллия 9,26 (совр.9,0122), тогда как Берцелиус принимал его равным 13,5, и правильную формулу окисла.
О происхождении названия минерала берилл, от которого образовано слово бериллий, существует несколько версий. А. М. Васильев (по Диргарту) приводит следующее мнение филологов: латинское и греческое названия берилла могут быть сопоставлены с практритским veluriya и санскритским vaidurya. Последнее является названием некоторого камня и происходит от слова vidura (очень далеко), что, по-видимому, означает какую-то страну или гору. Мюллер предложил другое объяснение: Vaidurya произошло от первоначального vaidarya или vaidalya, а последнее от vidala (кошка). Иначе говоря, vaidurya означает приблизительно «кошачий глаз». Рай указывает, что в санскрите топаз, сапфир и коралл считались кошачьим глазом. Третье объяснение дает Липпман, который считает, что слово берилл обозначало какую-то северную страну (откуда поступали драгоценные камни) или народ. В другом месте Липпман отмечает, что Николай Кузанский писал, что немецкое Brille (очки) происходит от варварско-латинского berillus. Наконец, Лемери, объясняя слово берилл (Beryllus), указывает, что Berillus, или Verillus, означает «мужской камень».
В русской химической литературе начала XIX в. глюцина называлась — сладимая земля, сладозем (Севергин, 1815), сладкозем (Захаров, 1810), глуцина, глицина, основание глицинной земли, а элемент именовался глицинием, глицинитом, глицием, сладимцем и пр. Гизе предложил название бериллий (1814). Гесс, однако,придерживался названия глиций; его употреблял в качестве синонима и Менделеев (1-е изд. «Основ химии»).
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород | 2 He Гелий | ||||||||||||||||
| 2 | 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 3 | 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 4 | 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 5 | 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | (43) Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 6 | 55 Cs Цезий | 56 Ba Барий | * | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Tl Таллий | 82 Pb Свинец | 83 Bi Висмут | (84) Po Полоний | (85) At Астат | 86 Rn Радон |
| 7 | 87 Fr Франций | 88 Ra Радий | ** | (104) Rf Резерфордий | (105) Db Дубний | (106) Sg Сиборгий | (107) Bh Борий | (108) Hs Хассий | (109) Mt Мейтнерий | (110) Ds Дармштадтий | (111) Rg Рентгений | (112) Cp Коперниций | (113) Uut Унунтрий | (114) Uuq Унунквадий | (115) Uup Унунпентий | (116) Uuh Унунгексий | (117) Uus Унунсептий | (118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний | (120) Ubn Унбинилий | ||||||||||||||||
| Лантаноиды * | 57 La Лантан | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | (61) Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмй | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | |||
| Актиноиды ** | 89 Ac Актиний | 90 Th Торий | 91 Pa Протактиний | 92 U Уран | (93) Np Нептуний | (94) Pu Плутоний | (95) Am Америций | (96) Cm Кюрий | (97) Bk Берклий | (98) Cf Калифорний | (99) Es Эйнштейний | (100) Fm Фермий | (101) Md Менделевий | (102) No Нобелей | (103) Lr Лоуренсий | |||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда