бета лактамы это какие антибиотики
ß-Лактамы
СТАЙЛАБ предлагает тест-системы для определения бета-лактамных антибиотиков в различных пробах, а также стандарты бета-лактамных антибиотиков.
| Иммуноферментный метод анализа (ИФА), стрипованный планшет | 5091PEN Penicillin ELISA |
| 5091CEF Cefalexin ELISA | |
| Иммунохроматографический метод анализа, тест-полоски | Лактест |
| Стандарты | 9143-10 Сухое цельное молоко с содержанием Пенициллина G 4 мкг/л, 1 флакон (5 мл) + стерильная вода 4,5 мл |
| 9152 Сухое молоко с содержанием клоксациллина 30 мкг/кг, 1 флакон (5 мл) + стерильная вода 4,5 мл | |
| 9151 Сухое молоко с содержанием ампициллина 4 мкг/кг, 1 флакон (5 мл) + стерильная вода 4,5 мл |
К бета-лактамным антибиотикам относятся пенициллины, монобактамы, карбапенемы и цефалоспорины. Некоторые из этих антибиотиков имеют природное происхождение, другие же были синтезированы в искусственных условиях. И природные, и синтетические бета-лактамы обладают схожей структурой: в молекулах этих веществ есть бета-лактамное кольцо. Это свойство позволяет определять содержание суммы этих антибиотиков в пробе, что удобно при скрининге.
Организмы, синтезирующие бета-лактамные антибиотики, с древних времен использовались человеком для обработки ран. В записях, найденных в Китае и относящимся приблизительно к 3000-м годам до нашей эры рассказывается, как использовать в этих целях плесневелые соевые бобы. В качестве лекарств применяли и другие продукты, зараженные плесневыми грибами. Но понять, какие именно вещества обладают антибиотическим эффектом, удалось только в XX веке, когда химик Александр Флеминг выделил пенициллин из культуры плесневых грибов Penicillium notatum. Пенициллин был первым антибиотиком, полученным человеком и первым из бета-лактамных антибиотиков.
Бета-лактамы имеют очень широкий спектр действия: они эффективны против множества микроорганизмов, в том числе стрептококков, стафилококков, кишечной палочки, а также цианобактерий (сине-зеленых водорослей, живущих в водоемах). Эти антибиотики позволили снизить смертность от таких заболеваний, как дифтерия, менингиты, боррелиоз, ангина, сибирская язва, скарлатина и других болезней. Однако бактерии могут вырабатывать резистентность к ним, в том числе, и перекрестную. Это связано со сходством механизмов действия у антибиотиков этой группы: все они нарушают синтез клеточной стенки бактерий и препятствуют их делению. Такую устойчивость выработал метициллин-резистентный стафилококк (MRSA). Вначале эти бактерии вызывали сепсисы и пневмонии в больницах, а затем стали причиной сложноизлечимых кожных инфекций, распространявшихся вне медицинских учреждений. В настоящее время к этим антибиотикам устойчивы многие бактерии.
Чтобы увеличить эффективность бета-лактамов их иногда используют в сочетании с ингибиторами бактериального фермента бета-лактамазы, который позволяет микроорганизмам обезвреживать эти антибиотики.
Бета-лактамные антибиотики неэффективны против хламидий, риккетсий и других внутриклеточных паразитов, а микобактерии (возбудители туберкулеза и других заболеваний) устойчивы к воздействию этих веществ из-за особенностей состава клеточной стенки.
Бета-лактамные антибиотики используются не только для лечения заболеваний у человека, но и в животноводстве. Их применяют для профилактики и лечения сальмонеллеза, рожи, дизентерии, копытной гнили. Некоторые бета-лактамы, например, амоксициллин, подходят для лечения бронхитов и пневмоний. Пенициллин и другие антибиотики применяют для лечения маститов у коров.
Некоторые бета-лактамы, например, ампициллин и амоксициллин, не разрушаются в желудке и хорошо всасываются в кишечнике. Другие, такие, как пенициллин, напротив, всасываются плохо и частично разрушаются. В основном эти вещества способны проникать в ткани. Многие из них преодолевают плацентарный барьер, а также выделяются с молоком.
Аллергические реакции являются достаточно частым осложнением при использовании бета-лактамных антибиотиков. Особенно чувствительны к этим веществам дети, у которых они способны вызвать аллергию даже при первом применении.
К другим побочным эффектам бета-лактамов относят возникновение кандидозов (грибковых инфекций), поскольку эти антибиотики уничтожают нормальную микрофлору, тем самым освобождая место для патогенных грибков и бактерий.
Технические Регламенты Таможенного Союза ТР ТС 021/2011 («О безопасности пищевой продукции») и ТР ТС 033/2013 («О безопасности молока и молочной продукции») устанавливают максимально допустимую концентрацию пенициллина в молоке на уровне 4 мкг/л. Для амоксициллина, ампициллина и других пенициллиновых антибиотиков «Единые санитарно-эпидемиологические и гигиенические требования к товарам, подлежащих санитарно-эпидемиологическому надзору (контролю)» определяют максимальное содержание как 30 мкг/л. С актуальными законодательными нормативами можно ознакомиться на сайте compact24.com.
Для анализа бета-лактамов в пробах используют микробиологические методы анализа. Однако в качестве скринингового метода удобно использовать иммунохроматографические методы. Они позволяют быстро оценить содержание антибиотиков в пробе и очень просты.
Антибиотики XXI века
Поделиться:
В первой части статьи мы рассказали про основные мифы связанные с антибиотиками и подробно описали пенициллиновую группу, а сейчас перейдем к антибиотикам следующего поколения.
ЦЕФАЛОСПОРИНЫ
Микробы часто поступают если не разумно, то вполне логично.
Если им угрожают антибиотики пенициллинового ряда, микробы начинают разрушать пенициллины (вот бы нам так — нам что-то мешает, а мы это раз! — и стерли с лица земли).
Слабое звено пенициллинов — это так называемое бета-лактамное кольцо (вы не раз встретите в описании препаратов этот термин, поэтому его лучше запомнить). Вот это бета-лактамное кольцо микробы и научились разрывать. А инструментом для разрыва служат специальные ферменты, бета-лактамазы.
Так что, если говорить коротко, то антибиотики цефалоспориновой группы — все те же пенициллины, которые работают точно так же, но вот бета-лактамаз они не боятся. И значит, могут расправиться с микробами, с которыми не справляется все тот же ампициллин или даже амоксициллин с клавулановой кислотой.
«Гонка вооружений» между микробами и фармацевтами со временем породила второе, третье, а потом и четвертое поколение цефалоспориновых антибиотиков (при произнесении некоторых названий этих лекарств пугаются даже врачи, сразу представляющие, против какой флоры эти антибиотики предназначены).
КОГДА ВРАЧИ НАЗНАЧАЮТ ЦЕФАЛОСПОРИНЫ
При аллергии на обычные пенициллины.
Конечно, химическая структура пенициллинов и цефалоспоринов похожа, но шанс, что пациент не выдаст аллергической реакции на цефалоспорины, все же очень высок; Если пенициллиновые антибиотики не справляются с инфекцией. Такое часто бывает, если пациент заражается каким-нибудь стафилококком или стрептококком уже в больнице: микробы там травлены уже чем угодно, а потому особенно стойкие к таблеткам из обычной аптеки.
Микробы, к сожалению, быстро учатся и быстро эволюционируют. Оно и понятно: для смены поколений им нужно всего-то 20 минут.
И все же врачам всегда рекомендуют начинать лечение с антибиотиков из группы пенициллинов, чтобы не плодить антибиотикоустойчивую флору.
АНТИБИОТИКИ ГРУППЫ МАКРОЛИДОВ
Что оставалось делать ученым? Только разрабатывать новые антибиотики.
Пенициллин начал массово применяться в 1943 году (в США и СССР, и почти одновременно). А уже в 1949 году Альберто Агилар на Филиппинах нашел новый (после зеленой плесени, из которой был выделен пенициллин) особый грибок, подавляющий рост бактерий.
В США год спустя другой ученый, МакГуир, выделил из него новый антибиотик — эритромицин (в Википедии почему-то упорно пишут, что его выделил Элай Лилли, но это не так — просто МакГуир на него работал).
Эритромицин работает до сих пор: оказалось, что к нему бактерии умеют приспосабливаться намного хуже, чем к пенициллину.
ЧТО УМЕЮТ МАКРОЛИДЫ?
Во-первых, бактерии действительно приспосабливаются к макролидам намного медленнее, чем к пенициллинам.
Но тоже приспосабливаются. Именно поэтому эритромицин сейчас оброс огромным семейством из «младших братьев» — полусинтетических макролидов и азалидов, которые некоторые фармацевты выделяют еще в одну отдельную группу — четвертую и последнюю группу антибиотиков, применяющихся в педиатрии.
Во-вторых, макролиды не убивают бактерий — они лишают их способности размножаться, в результате чего бактериальные клетки, не принося вреда человеку, очень быстро помирают своей смертью или становятся жертвами иммунной системы.
В-третьих, макролиды могут проникать внутрь клеток и настигать бактерий, которые так любят там селиться, — хламидий и микоплазм.
КОГДА ВРАЧИ НАЗНАЧАЮТ МАКРОЛИДЫ?
— у пациента есть аллергия на пенициллины;
Читайте также:
Русская рулетка, или Самолечение антибиотиками
— имеются веские основания полагать, что мы имеем дело с хламидийной инфекцией или микоплазменной пневмонией — пенициллины тут будут бессильны.
ВАЖНО! Пенициллины убивают микробов в момент их размножения. Макролиды лишают микробов способности размножаться. Значит, если врач одновременно назначит, скажем, пенициллин и эритромицин (а пусть, мол, они всю флору одновременно и накроют), эти два антибиотика на самом деле будут… защищать микробов друг от друга.
КОГДА МОЖНО И НУЖНО ПРИНИМАТЬ АНТИБИОТИКИ
— при высокой температуре, длящейся более 3 дней;
— при начале «второй волны» инфекции: лечили-лечили ребенка от вируса, он вроде бы уже и поправляться стал, а тут вдруг снова высокая температура, вялый, да еще вдобавок какой-нибудь кашель присоединился;
— если присутствует четко локализованное инфекционное поражение, например при остром среднем отите, гайморите с гнойными выделениями, бронхите;
— при изменениях в общем анализе крови, характерных для бактериальной инфекции и активного воспаления: высокая СОЭ и большое общее количество лейкоцитов на фоне преобладания в лейкоцитарной формуле нейтрофилов над лимфоцитами.
И конечно, антибиотики нужно принимать только по назначению врача.
Мнение автора может не совпадать с мнением редакции
БЕТА-ЛАКТАМНЫЕ АНТИБИОТИКИ
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
The paper presents a detailed analysis of the most numerous group of antibacterial agents, b-lactam antibiotics, their classification and microbiological characteristics. Recommendations of their clinical use are given
С.В. Сидоренко, кафедра микробиологии и клинической химиотерапии Российской медицинской академии последипломного образования
С.В. Яковлев, кафедра клинической гематологии и интенсивной терапии Московской медицинской академии им. И.М.Сеченова
S.V. Sidorenko, Department of Microbiology and Clinical Chemotherapy, Russian Medical Academy of Postgraduate Training
S.V. Yakovlev, Department of Clinical Hematology and Intensive Care Therapy, I.M. Sechenov Moscow Medical Academy
1. Классификация и микробиологическая характеристика бета-лактамных антибиотиков (БЛА)
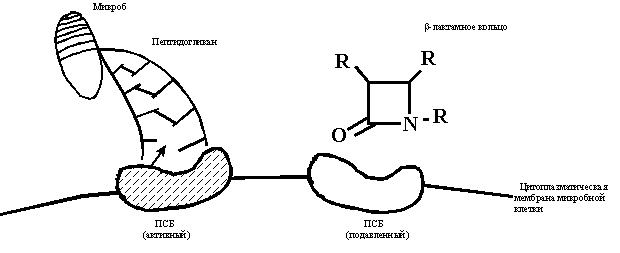
Общим фрагментом в химической структуре БЛА является бета-лактамное кольцо, именно с его наличием связана микробиологическая активность этих препаратов. Схематическое изображение механизмов действия БЛА и устойчивости к ним микроорганизмов приведено на рисунке.
| I. Пенициллины | |||
| 1. Природные: бензилпенициллин, феноксиметилпенициллин | |||
| 2. Полусинтетические | |||
| 2.1. Пенициллиназостабильные | 2.2. Аминопенициллины | 2.3.Карбоксипенициллины | 2.4. Уреидопенициллины |
| метициллин | ампициллин | карбенициллин | азлоциллин |
| оксациллин | амоксициллин | тикарциллин | мезлоциллин |
| пиперациллин | |||
| II.Цефалоспорины | |||
| I поколение | II поколение | III поколение | IV поколение |
| Парентеральные | Парентеральные | Парентеральные | Парентеральные |
| цефалотин | цефуроксим | цефотаксим | цефпиром |
| цефалоридин | цефамандол | цефтриаксон | цефипим |
| цефазолин | цефокситин* | цефодизим | |
| Оральные | цефотетан* | цефтизоксим | |
| цефалексин | цефметазол* | цефоперазон** | |
| цефадроксил | Оральные | цефпирамид** | |
| цефрадин | цефаклор | цефтазидим** | |
| цефуроксим-аксетил | моксалактам | ||
| Оральные | |||
| цефиксим | |||
| цефподоксим | |||
| цефтибутен | |||
| III. Комбинированные препараты | IV. Карбапенемы | V. Монобактамы | |
| ампициллин/сульбактам | имипенем | азтреонам | |
| амоксициллин/клавуланат | меропенем | ||
| тикарциллин/клавуланат | |||
| пиперациллин/тазобактам | |||
| цефоперазон/сульбактам | |||
| П р и м е ч а н и е: *препараты, обладющие выраженной антианаэробной активностью (цефамицины); **препараты, обладающие выраженной активностью в отношении P. aeruginosa и неферментирущих микроорганизмов. | |||
| Таким образом, индивидуальные свойства отдельных БЛА определяются их аффинностью к ПСБ, способностью проникать через внешние структуры микроорганизмов и устойчивостью к гидролизу бета-лактамазами. |
1.2. Характеристика микробиологической активности БЛА и область их применения
Как уже было отмечено, БЛА обладают весьма широким спектром действия, однако с клинической точки зрения существует группа микроорганизмов, являющихся исключением из спектра их активности. Речь идет об облигатных и факультативных внутриклеточных паразитах (риккетсии, хламидии, легионеллы, бруцеллы и др.). Отсутствие или низкий уровень клинической эффективности при инфекциях, вызываемых этими микроорганизмами, связан с ограниченной способностью БЛА проникать внутрь клеток макроорганизма, прежде всего фагоцитов, где и локализуется возбудитель.
Данные об уровне природной активности БЛА в отношении основных клинически значимых микроорганизмов суммированы в табл. 3. В ней также приведены ориентировочные данные о частоте распространения среди этих микроорганизмов приобретенной устойчивости к отдельным БЛА. При общей характеристике БЛА используется принцип сопоставления активности отдельных БЛА в отношении различных микроорганизмов.
Как следует из материалов таблицы, в отношении одного и того же микроорганизма высокий уровень микробиологической активности могут одновременно проявлять многие представители класса БЛА. Соответственно возникает проблема выбора оптимального средства. При решении этой проблемы до получения результатов оценки антибиотикочувствительности целесообразно руководствоваться следующими соображениями. Из группы препаратов, обладающих равной активностью в отношении известного возбудителя, лучше назначать антибиотики с более узким спектром действия. При эмпирической терапии, кроме спектра действия, который должен перекрывать максимальное количество вероятных патогенов, необходимо учитывать устойчивость препарата в отношении известных для этих микроорганизмов механизмов резистентности. Обязательным условием назначения БЛА является наличие подтвержденной клинической эффективности.
Механизм действия бета-лактамных антибиотиков. Обязательным компонентом наружной мембраны прокариотических микроорганизмов (кроме микоплазм) является пептидогликан, представляющий собой биологический полимер, состоящий из параллельных полисахаридных цепей. Пептидогликановый каркас приобретает жесткость при образовании между полисахаридными цепями поперечных сшивок. Поперечные сшивки образуются через аминокислотные мостики, замыкание сшивок осуществляют ферменты карбокси- и транспептидазы (ПСБ). Бета-лактамные антибиотики способны связываться с активным центром фермента и подавлять его функцию. Специфическая активность антибиотиков определяется наличием бета-лактамного кольца. Боковые радикалы определяют фармакокинетические особенности, устойчивость к действию бета-лактамаз и другие второстепенные свойства.

 Читайте также:
Читайте также: