Что лучше афлубин или гриппферон для детей
Новые возможности местной терапии аденоидитов у детей
Различные заболевания ЛОР-органов были и остаются одной из основных проблем и оториноларингологии, и педиатрии. Структура ЛОР-патологии несколько меняется по мере роста и развития детского организма. В первые годы жизни (дошкольный
Различные заболевания ЛОР-органов были и остаются одной из основных проблем и оториноларингологии, и педиатрии. Структура ЛОР-патологии несколько меняется по мере роста и развития детского организма. В первые годы жизни (дошкольный и ранний школьный периоды) лидирующее положение среди заболеваний ЛОР-органов у детей занимают патологические изменения аденоидных вегетаций. Прослеживается отчетливая тенденция к росту данной патологии: в 1960-е гг. XX в. гипертрофия глоточной миндалины встречалась у 4–16% детей, в 1970–80 гг. у 9,9–29,2%, а в 1999 г. ее доля выросла до 37–76% (F. Levy, 1999; Э. Г. Нейвирт, С. М. Пухлик, 2000).
В 32,8% случаев аденоидные вегетации сопровождаются воспалительным процессом (Г. Д. Тарасова, Л. С. Страчунский, 2000), т. е. имеет место аденоидит (острый или хронический), что может быть причиной возникновения, рецидивирования и хронизации заболеваний верхних и нижних дыхательных путей. По другим данным, аденоидит встречается почти у половины (43,8%) дошкольников.
Одна из возможных причин этого — бактериальная обсемененность глоточной миндалины. Микробиологический состав носоглотки достаточно разнообразен. По данным ряда авторов (A. V. Talaat и соавт.; 1989; G. Cantella и соавт., 1989), инфекционный фактор влияет на степень гипертрофии аденоидных вегетаций. Ученые еще не пришли к единому мнению относительно того, какой именно фактор считать ведущим инфекционным агентом. Одни (З. М. Грекова, В. Р. Савин, 1977; И. М. Будник, 1998) полагают, что это стрептококки, другие — что стафилококки, третьи (Ю. А. Лоцманов и др., 1994; А. С.-У. Батчаев, 2002) говорят о сочетании патогенных и непатогенных форм стрептококков и стафилококков. Cantella и соавторы (1989) при микробиологическом исследовании ткани глоточной миндалины выявили 93 вида аэробных и 56 анаэробных микроорганизмов. Вместе с тем, по некоторым данным, различий в показателях обсемененности микробной флорой носоглотки больных и здоровых детей не существует. Есть также данные об отсутствии патогенных микроорганизмов в лимфоидной ткани в условиях острого воспаления. В последние годы появляются сведения о доминирующей роли Haemophilis influenzae, Streptococcus pneumonia, Moraxella catarrhalis в патогенезе гипертрофии и воспалительных изменений глоточной миндалины. Неоднозначно мнение о роли грибковой флоры в патогенезе гипертрофии и воспалении ткани глоточной миндалины.
Клинически аденоидит проявляется частыми насморками или заложенностью носа, кашлем, частыми простудными заболеваниями. При эндоскопическом осмотре определяется скопление патологического отделяемого в задних отделах полости носа и носоглотке. Возможны выделения из полости носа, а чаще — стекание отделяемого по задней стенке глотки (с развитием вторичного фарингита). Характерен кашель по утрам или после дневного сна. В ряде случаев аденоидит сопровождается экссудативным средним отитом (ЭСО) (в том числе и двусторонним). Особенно это актуально для детей дошкольного возраста, которые не жалуются на снижение слуха (а болевой синдром при ЭСО, как правило, не выражен).
Наиболее точной является эндоскопическая диагностика, которая позволяет оценить не только размер, но и расположение лимфоидной ткани в носоглотке, состояние глоточного устья слуховой трубы. На эндоскопической оценке степени перекрытия сошника лимфоидной тканью и основывается классификация степени гипертрофии аденоидных вегетаций:
1-я степень — лимфоидная ткань перекрывает сошник на 1/3;
2-я степень — лимфоидная ткань перекрывает сошник до 2/3;
3-я степень — лимфоидная ткань перекрывает сошник более 2/3.
В план консервативной терапии аденоидитов входит уменьшение явлений воспаления лимфоидной ткани, снижение сенсибилизации и повышение иммунологической реактивности организма.
Начинать консервативное лечение рекомендуется с элиминационной терапии, способствующей очищению полости носа и носоглотки от патологического содержимого. Для этого используются солевые растворы, муколитические препараты (при густом и вязком секрете). После этого применяются антисептические средства и/или препараты для местной антибактериальной терапии.
Антимикробные средства для местного воздействия на слизистые оболочки могут назначаться как часть комбинированного лечения, так и в виде монотерапии. Один из таких препаратов — октенисепт. Октенисепт обладает широким спектром антимикробного действия, эффективен в отношении аэробных-анаэробных и грамположительных/грамотрицательных бактерий, в том числе возбудителей внутрибольничных инфекций; микобактерий туберкулеза, хламидий, микоплазм, грибов рода Candida и дрожжеподобных, простейших, а также вирусов (герпеса, гепатитов В, С и Д; ВИЧ). Действие препарата начинается практически сразу же (через минуту) и длится в течение часа. Токсического действия препарат не оказывает, не всасывается через неповрежденную слизистую оболочку. В разведении 1:5 (1:6) не угнетает функцию мерцательного эпителия верхних дыхательных путей.
Нами была пролечена группа детей (50 человек — 100%) с различными формами аденоидита: острый аденоидит был выявлен у 43 (86%) детей, хронический — у 7 (14%) детей. Среди них было 34 (68%) мальчика и 16 (32%) девочек. Возраст детей колебался от 2 до 12 лет, средний возраст составил 5 лет.
Всем больным проводились:
Препарат октенисепт назначали в разведении 1:5 для промывания носоглотки 2 раза в день по 5–10 мл в каждую ноздрю на процедуру в качестве монотерапии. Анализ результатов применения препарата октенисепт через 1 мес выявил следующее.
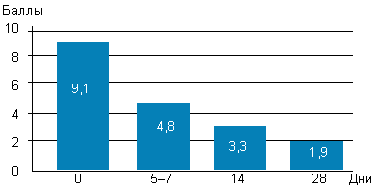 |
| Рисунок 1. Динамика балльной оценки симптомов у детей с аденоидитами |
До начала лечения все больные или их родители предъявляли жалобы на заложенность носа, наличие выделений (либо из полости носа, либо по задней стенке глотки), кашель, снижение слуха различной степени выраженности. Предлагалось оценить выраженность каждого из симптомов в баллах: 0 — симптом отсутствовал, 3 — симптом был выражен максимально. Из данных, представленных на рисунке 1, можно сделать вывод, что уже к 5–7-му дню использования препарата выраженность симптомов снизилась почти вдвое, к 14-му дню — была небольшой, а к 28-му дню — минимальной. Как видно из рисунка 2, дольше всего детей беспокоило снижение слуха (чаще всего проявляющееся заложенностью ушей, причем непостоянной, и связанной с интенсивным или неправильным отсмаркиванием ребенка), при этом заложенность носа, выделения и кашель почти отсутствовали.
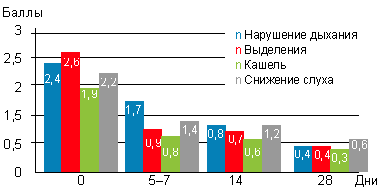 |
| Рисунок 2. Динамика жалоб, предъявляемых больными с аденоидитами (или их родителями) на фоне применения препарата октенисепт |
На фоне монотерапии препаратом октенисепт отмечено, что гнойные выделения почти полностью прекращались уже к 5–7-му дню лечения (рис. 3).
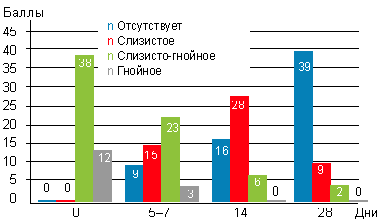 |
| Рисунок 3. Динамика отделяемого в носоглотке у детей c аденоидитами на фоне использования препарата октенисепт при эндоскопическом осмотре |
Важно изменение степени гипертрофии аденоидных вегетаций (рис. 4). До начала лечения у 32 детей (64%) выявлены аденоиды 2-й степени, у 18 детей (36%) — аденоиды 3-й степени. После курса лечения у 5 детей (10%) аденоиды сократились до 1-й степени, а аденоиды 3-й степени определялись только у 7 детей (14%).
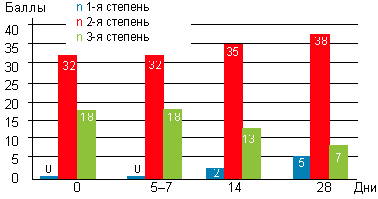 |
| Рисунок 4. Динамика размера аденоидных вегетаций у детей с аденоидитами при эндоскопическом осмотре |
На основании полученных данных (результаты клинического осмотра), а также опроса пациентов и их родителей можно сделать следующие выводы:
Все вышеизложенное позволяет рекомендовать препарат октенисепт для использования в качестве монотерапии аденоидитов у детей.
Е. Ю. Радциг, доктор медицинских наук
РГМУ, Москва
Особенности терапии ОРВИ у пациентов с аллергическими заболеваниями
В последние десятилетия неуклонно растет заболеваемость вирусными респираторными инфекциями, причем все чаще встречаются случаи резистентные к проводимой противовирусной терапии. В то же время отмечается и увеличение числа аллергопатологий. Не удивительно, что врачи общей практики почти ежедневно имеют дело с пациентами, у которых аллергия сочетается с вирусной инфекцией.
Проблемой терапии является, однако, не столько сосуществование двух независимых диагнозов и необходимость учитывать взаимодействие назначенных разными специалистами средств, сколько взаимное потенцирование заболеваний, резко ухудшающее самочувствие пациента и путающее клиническую картину.
Взаимосвязь аллергии и инфекции
Инфекция провоцирует обострение атопического процесса и осложняет его течение. ОРВИ – наиболее частая причина обострения бронхиальной астмы: только в одном случае из десяти инфицирование риновирусом или респираторно-синцитиальным вирусом не приводит к появлению свистящих хрипов.
Сочетание вирусной инфекции и аллергии повышает уровень сенсибилизации к аллергену. Однако в роли аллергена может выступать и сам вирус. При атопическом ответе организма на вирусный агент появляются вирус-специфические IgE, причем их концентрация коррелирует с вероятностью обострения БА.
В свою очередь аллергические заболевания, в особенности длительные и вялотекущие, увеличивают восприимчивость пациента к ОРВИ и гриппу, в разы повышают риск их бактериальных осложнений. Кроме того, атопия видоизменяет клиническую картину респираторной инфекции, утяжеляет симптоматику, затрудняет диагностику и подбор адекватной терапии.
Лечение сочетанной патологии
Терапия вирусной инфекции при бронхиальной астме или других атопических заболеваниях имеет ряд особенностей, которые необходимо учитывать во избежание ятрогенных состояний.
Лечение гриппа и ОРВИ, как в данном случае, так и в принципе, подразумевает назначение этиотропных, симптоматических и иммуномодулирующих средств.
Препараты прямого противовирусного действия, как правило, активны в отношении узкого спектра вирусов. При отсутствии возможности идентифицировать патологический агент их назначение пациентам с аллергией чревато крайне малой эффективностью при высоких рисках развития побочных эффектов и усугубления и так обостренного атопического процесса.
Все чаще западные коллеги рекомендуют в качестве препаратов выбора при ОРВИ интерфероны и их индукторы. Их назначение особенно оправданно из-за того, что атопия сопровождается специфическим нарушением иммунитета в звене распознавания вирусной РНК TLR-рецепторами. Это приводит к нарушению функционирования системы интерферона, а следовательно, и к значимой вероятности присоединения бактериальной инфекции.
Современные инновационные разработки позволили создать уникальный препарат Эргоферон, который, стимулируя систему интерферона одновременно оказывает и симптоматическое действие (противовоспалительное, антигистаминное). Богатая палитра терапевтических возможностей позволяет назначить одно средство вместо целого ряда препаратов, избежать дополнительной нагрузки на печень и минимизировать риск побочных эффектов и лекарственного взаимодействия.
В качестве симптоматического средства у больных с вирус-индуцированной бронхиальной астмой и ХОБЛ сегодня также активно применяется препарат Ренгалин, сочетающий противокашлевые, противовоспалительные, анальгезирующие и антигистаминные свойства.
Эргоферон
Эргоферон – противовирусный препарат, в состав которого входят аффинно очищенные антитела к ИФН-у. Целый ряд фундаментальных и экспериментальных работ показал, что РА-антитела к ИФН-у изменяют пространственное расположение молекулы интерферона и ее функциональную активность, что влияет на всю систему противовирусной защиты: эффективнее вовлекаются в реализацию своих физиологических эффектов ИФН-а, ИЛ-2, натуральные киллеры, повышается фагоцитарная активность макрофагов. Под действием РА-антител усиливается и продукция, и рецепция ИФН-у.
Интенсивность синтеза интерферона четко коррелирует с фазой инфекционного процесса: по мере выздоровления организм включает «нормальный режим» его продукции, но в случае ре- или суперинфекции система снова начинает работать активнее.
Своим противовоспалительным и антигистаминным действием 3 Эргоферон обязан содержанию РА антител в CD4 и гистамину. Антиаллергическое действие обусловлено также способностью препарата восстанавливать нарушения в системе Th1/Th2, что позволяет нормализовать систему иммунного ответа при атопии.
Благодаря богатым терапевтическим возможностям Эргоферона, физиологичности его воздействия, препарат можно рекомендовать пациентам с сочетанной патологией на любой стадии и при любой тяжести атопического и инфекционного процесса.
Ренгалин
Клиническая эффективность
Доказательная база Эргоферона и Ренгалина представлена рандомизированными и инициативными клиническими исследованиями, которые проводились в последние годы в различных медицинских учреждениях с участием, в том числе, пациентов с заболеваниями аллергического профиля.
Широкий спектр терапевтических возможностей и благоприятный профиль безопасности Эргоферона и Ренгалина, доказанные в ходе многочисленных исследований, позволяют рекомендовать оба препарата пациентам с бронхиальной астмой и другими аллергическими заболеваниями при ОРВИ и гриппе. Применение данных средств помогает быстро добиться лечебного эффекта, снизить лекарственную нагрузку, избежать негативных последствий взаимодействия с препаратами постоянной терапии и бактериальных осложнений, свойственных данной группе пациентов.
Лечение коронавируса: рекомендации Минздрава
Вспышка пандемии COVID-2019 в прошлом году поставила перед медицинскими работниками непростые задачи, связанные с диагностикой и лечением больных с новой инфекцией. Не исключение и Минздрав, который регулярно создает, редактирует и перевыпускает рекомендации направленные на борьбу с COVID-19.
Почему рекомендации постоянно обновляются?
Когда врачи столкнулись с инфекцией впервые, у них было недостаточно знаний о коронавирусе и мало опыта в лечении пациентов, заразившихся COVID-19. Симптомы болезни сходны с ОРВИ, что затрудняло в первое время диагностику. Также было мало информации о протекании заболевания у детей и беременных женщин.
Как изменился протокол лечения?
В обновленном документе прописаны новые схемы лечения коронавируса, которые позволяют лечить больных в амбулаторных условиях при наличии необходимых условий. Лечиться дома разрешается взрослым пациентам, находящимся в состоянии средней тяжести.
Рентгенография или КТ не являются обязательными процедурами перед выпиской.
Препараты, рекомендованные для лечения
Единой методики лечения COVID сегодня не существует. В первую очередь терапия направлена на предупреждение развития таких грозных осложнений, как пневмония, сепсис, ОРДС.
В зависимости от тяжести состояния и выраженности симптомов, назначают препараты:
Основу терапии составляют противовирусные средства. За время пандемии врачи использовали разные препараты этой группы, но нет оснований говорить о том, что какой-то из этих препаратов действительно эффективен.
Использование интерферонов в профилактике и лечении респираторных вирусных инфекций у взрослых и детей
В статье представлен анализ отечественных и зарубежных публикаций, отражающих эпидемиологические особенности гриппа и респираторных вирусных инфекций. Показана эффективность вакцинации против гриппа, проводимой на протяжении последних 17 лет. Представлены
The article analyzes national and foreign publications covering epidemiologic features of influenza and respiratory viral infections. Efficiency of vaccinations against influenza which has been held during the last 17 years, was shown. The results of interferon application, starting from the first years since it was discovered, were presented. The structure of ARVI and influenza morbidity, with allocation of age groups which were mostly involved in the epidemiologic process, was described. The material analysis allows to conclude that, in the period of epidemiologic increase in ARVI morbidity, timely application of recombinant interferon preparations for prevention and treatment allows to reduce influenza and ARVI morbidity, first of all, in organized groups of children and among the contingent under the risk.
Респираторные вирусные инфекции, в число которых входит и грипп, всегда представляли серьезную проблему общественного здравоохранения [1, 2]. Только за последние 100 лет зарегистрировано, описано и изучено 4 пандемии и 2 глобальные эпидемии гриппа, во время которых по разным оценкам умерло более 50 млн человек [3]. Несмотря на то, что человечество борется с гриппом на протяжении столетия, значительные успехи в борьбе с этой инфекцией достигнуты лишь в последние десятилетия.
За время изучения вирусов гриппа после их выделения от больных людей (1933 г. — вирус гриппа типа А; 1940 г. — вирус гриппа типа В; 1947 г. — вирус гриппа типа С) было установлено, что только вирус гриппа типа А способен к пандемическому распространению. Он вызывает ежегодные сезонные эпидемии и поражает не только людей, но и различных животных [4, 5]. Вирусы гриппа вызывают ежегодные сезонные эпидемии среди населения, а разные его подтипы широко циркулируют среди животных. У вирусов гриппа типа A обнаружено 17 вариантов гемагглютинина (H) и 10 вариантов нейраминидазы (N). Вирусы гриппа типа А подразделяют на подтипы, в соответствии с сочетаниями 2 видов белков вируса (H и N), расположенных на его поверхности.
Гемагглютинин связывает вирус гриппа с рецепторами клеток-мишеней человека, а нейраминидаза участвует в высвобождении новых вирусных частиц. РНК вируса гриппа состоит из фрагментов, которые кодируют синтез различных вирусных белков. Эта фрагментарность и определяет изменчивость вируса, так как при воспроизведении РНК легко возникают «ошибки» в расположении этих фрагментов по отношении друг к другу, что и приводит к мутациям и рекомбинациям [5].
У вируса гриппа постоянно происходят мутации в генах, кодирующих структуру гемагглютинина и нейраминидазы. Такие изменения называют «антигенным дрейфом». В результате этого возникают сезонные эпидемии, когда в основном болеют дети и те взрослые, которые раньше не встречались с похожим вирусом. Если же в клетки человека, птицы или животного попадут одновременно два разных подтипа вируса гриппа, то между ними возможна рекомбинация генов (реассортация). Возникает новый подтип вируса, у которого на поверхности будет находится «смесь» родительских антигенов «Н» и «N». Такие изменения называют «антигенный шифт».
Этот новый подтип вируса гриппа может за один-два года поразить на нашей планете огромное количество людей любого возраста, поскольку у них нет к нему адаптивного иммунитета. При этом заболевание может протекать тяжелее, возрастет в несколько раз летальность от гриппа и от его осложнений. Такие глобальные эпидемии (пандемии) на разных полушариях начинаются в разные сезоны года [5].
Антигенная изменчивость вируса позволяет ему ускользать от воздействия иммунной системы организма человека. Благодаря этому новый антигенный подтип вируса гриппа избегает сдерживающего эффекта коллективного иммунитета, приобретенного населением в период предыдущих эпидемий. Появление совершенно новых вариантов вируса гриппа типа А происходит нерегулярно. Эти события непредсказуемы и, как правило, могут быть неожиданными [6].
В отличие от большинства вирусов, вызывающих острые респираторные вирусные инфекции (ОРВИ), вирус гриппа отличается высокой вирулентностью, контагиозностью, низкой иммуногенностью и чрезвычайно высокой изменчивостью. Кроме того, разные подтипы вируса гриппа типа А способны инфицировать и циркулировать в организме не только человека, но и животных. Поэтому существует реальная угроза появления новых вирусов гриппа за счет реассортации «свиного», «птичьего» и других вирусов на основе скрещивания свиного, птичьего и других вирусов [6].
Благодаря значительным и впечатляющим успехам в результате применения программ вакцинопрофилактики в борьбе с инфекционными болезнями удалось добиться многократного снижения заболеваемости, прежде всего инфекциями дыхательных путей.
Вместе с тем ежегодно в мире до 2 млрд человек переносят инфекционные заболевания, из которых около 17 млн умирают. Ежегодно возникают эпидемии сезонного гриппа и респираторных вирусных инфекций, во время которых регистрируют до 5 млн случаев тяжелого гриппа, из которых до 500 000 имеют летальный исход [2].
По данным Всемирной организации здравоохранения ежегодно каждый взрослый человек «болеет» острыми респираторными инфекциями 2–4 раза, школьник — до 4–5 раз, дошкольник — до 6 раз, а ребенок в возрасте до 1 года имеет от 2 до 12 эпизодов болезни [2, 7].
Во время сезонных подъемов заболеваемости ОРВИ и гриппа в эпидемический процесс вовлекается до 20% населения, половину которых составляют дети в возрасте до 14 лет.
Анализ помесячной динамики заболеваемости ОРВИ и гриппом в Российской Федерации за 2015–2017 гг. показывает, что случаи заболеваний регистрируются круглый год, и только в течение трех месяцев с июня по август отмечается спад заболеваемости. В период эпидемического сезона с октября по апрель выявляют самые высокие показатели заболеваемости, особенно в январе-марте (рис. 1).
Для современной эпидемической ситуации ОРВИ и гриппа характерно распространение заболеваний в основном среди городских жителей, на долю которых приходится около 85% всех заболеваний. При ОРВИ на долю детей в возрасте до 17 лет приходится более 70% всех заболеваний.
Наиболее вовлечены в эпидемический процесс ОРВИ и гриппа дети первых лет жизни и подростки. Причем среди заболевших на детей возрастной группы от 3 до 6 лет, посещающих детские дошкольные организации, приходится более 80% случаев (рис. 2).
На протяжении последнего десятилетия в Российской Федерации ежегодно регистрируют до 35 млн случаев инфекционных (паразитарных) заболеваний, из них более 90% случаев приходится на ОРВИ и грипп, которыми в течение года переболевает до 30% населения Российской Федерации [7]. На долю заболеваний, вызываемых респираторными вирусами и вирусами гриппа, приходится до 40% больничных листов, а экономический ущерб от них составляет до 100 млрд рублей в год, т. е. более 80% совокупного ущерба от инфекционных заболеваний [6, 7].
Для нашей страны, также как и для всех стран мира, значительный социально-экономический ущерб от ОРВИ обусловлен высокими показателями заболеваемости, разнообразием вирусов, вызывающих клинически сходную картину. В настоящее время известно более 200 вирусов, вызывающих сходные заболевания [5, 7].
В Российской Федерации и странах северного полушария в настоящее время ОРВИ, включая грипп, остаются по-прежнему массовыми инфекционными болезнями [6].
По мнению ВОЗ самым эффективным научно обоснованным методом борьбы с гриппом является вакцинопрофилактика. Эффективность вакцинации против гриппа доказана многолетним мировым опытом и может составлять 70–90%. Для достижения эффекта вакцинации необходимо ежегодно охватывать прививками против гриппа не менее 75% людей в каждой группе высокого риска заражения [2, 8].
Результаты вирусологического мониторинга, проводимого ВОЗ, показали растущую резистентность штаммов вирусов к противовирусным препаратам. Наличие нежелательных явлений при их приеме, противопоказаний и ограничений к применению подчеркивает большую значимость вакцинопрофилактики [8].
Ежегодно увеличивающийся охват населения прививками против гриппа в Российской Федерации привел к снижению заболеваемости среди контингентов населения, входящих в группы риска, что подтверждено данными Минздрава России и Роспотребнадзора, среди которых достигается наиболее высокий процент охвата вакцинации. Постоянное планомерное увеличение объема прививок против гриппа среди контингентов, подлежащих вакцинации, позволило достичь в 2017 г. самого высокого охвата прививками за все годы проведения иммунизации (67,3 млн человек, т. е. 46,6% населения).
В 2017 г. по сравнению с 2000 г. на фоне увеличения охвата населения прививками против гриппа в 4,3 раза показатель заболеваемости гриппом в Российской Федерации снизился в 85 раз (с 2973,3 на 100 тыс. нас. до 34,93 на 100 тыс. нас. соответственно) (рис. 3).
Несмотря на резкое снижение заболеваемости гриппом за последние десятилетия в стране, по данным Роспотребнадзора, ежегодно около 30 млн случаев заболеваний ОРВИ, включая грипп, регистрируются во всех субъектах Российской Федерации (табл.).
Только вакцинопрофилактика гриппа не может решать в полной мере проблему ОРВИ, так как у привитых формируются антитела только к штаммам вируса гриппа, входящим в состав вакцины, а в этиологической структуре ОРВИ в настоящее время вирусы гриппа занимают от 5% до 15% (рис. 4). Против других респираторных вирусных заболеваний специфическая профилактика не разработана. Кроме того, не все вакцинируемые отвечают формированием протективного иммунитета, а также вакцины против гриппа не могут использоваться в разгар эпидемии [7].
Поэтому профилактика гриппа и ОРВИ должна быть комплексной, включая проведение неспецифической профилактики с широким применением противовирусных препаратов и лекарственных средств, которые могут оказывать существенное влияние как на предупреждение возникновения заболеваний, так и на благоприятный исход возникшего заболевания.
Среди средств неспецифической профилактики гриппа и ОРВИ особое место занимают препараты интерферонового ряда. Впервые интерферон (ИФН) был получен в 1957 г. и описан английским вирусологом Аликом Айзексом как «белок, значительно меньший, чем иммуноглобулины, который производится клетками различных видов животных после заражения живыми или инактивированными вирусами и способный ингибировать рост разнообразных вирусов в клетках тех же видов животных в дозах, нетоксичных для клеток». Первые исследования интерферона, проведенные английскими учеными, показали его эффективность при лечении кератита, вызванного вирусом осповакцины [9].
Антибактериальные препараты бессильны против болезней, возбудителями которых являются вирусы. Поэтому некоторые исследователи называют интерферон «противовирусным антибиотиком» широкого спектра действия, так как интерферон образуется живыми клетками и способен угнетать вирусы и задерживать размножение почти всех известных вирусов, в то же время оставаясь безвредным для организма [9].
В 1960 г., уже через три года после открытия ИФН, в Советском Союзе в лаборатории новых антибиотиков Центрального института усовершенствования врачей (ныне ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России), которую возглавляла Зинаида Виссарионовна Ермольева, впервые был получен противовирусный препарат интерферона — человеческий лейкоцитарный ИФН для интраназального введения [9].
В 1961 г. английский вирусолог Д. А. Тиррелл впервые исследовал на себе и на своих сотрудниках перспективу интраназального применения ИФН для профилактики респираторных заболеваний и гриппа. Предварительное закапывание в нос ИФН и последующее заражение вирусом Коксаки вызывало лишь легкое недомогание, но не заболевание, в то же время никаких побочных симптомов от применения интерферона у испытуемых не отмечалось [9].
В СССР уже в 1962 г. на добровольцах был получен адъювантный эффект отечественного ИФН при вакцинации, и он был впервые применен для лечения тяжелой формы гриппа, а также как профилактическое средство. В 1964 г. этот препарат с успехом применялся в глазной клинике для лечения вирусного кератоконъюнктивита. В дальнейшем исследования подтвердили безопасность и эффективность лечения вирусных конъюнктивитов с помощью ИФН [9].
Отечественный человеческий лейкоцитарный ИФН для интраназального введения стал первым препаратом, получившим широкое применение в практике здравоохранения Советского Союза.
Во время эпидемии гонконгского гриппа 1968–1969 гг. в СССР была показана высокая эффективность интраназального применения лейкоцитарного ИФН у детей и взрослых.
Однако оказалось, что человеческий лейкоцитарный ИФН имеет недостатки, заключающиеся в низкой степени очистки от вирусных частиц (например, вирусов гепатитов и др.). Эта проблема была решена в середине 80-х гг. прошлого столетия, когда с помощью методов генной инженерии был получен рекомбинантный ИФН, идентичный ИФН человека по аминокислотному составу [9].
После проникновения вируса в организм человека, в большинстве случаев иммунная система реагирует выработкой антител, защитный титр которых появляется на 10–14 день, достигая максимума еще через две недели. Преимущество интерферона заключается в том, что его выработка начинается практически сразу после проникновения вируса в организм, достигая максимума уже на 2-й день. Поэтому ИФН считают первой линией защиты организма от вирусов (рис. 5).
Интерфероны как эндогенные иммуномодуляторы можно отнести к полифункциональным биорегуляторам. Они определяют феномен невосприимчивости клеток к повторному заражению вирусом и обладают комбинированным свойством этиотропного и иммуномодулирующего действия, что позволяет включать их в комплексное лечение гриппа и ОРВИ [8].
В настоящее время наиболее изученными и широко применяемыми являются интерфероны первого типа: ИФН-α и ИФН-β. Действие этих ИФН защищает генетическую информацию клеток хозяина от изменений генома, вызываемого вирусами, и ограничивает пролиферацию поврежденных клеток. При обнаружении патогенных микроорганизмов, вирусов и бактерий макрофаги и дендритные клетки производят ИФН 1-го типа (ИФН-α и ИФН-β). Плазмоцитоидные дендритные клетки вырабатывают ИФН-α, а фибробласты и эпителиальные клетки — ИФН-β. При действии ИФН 1-го типа на дендритные клетки и макрофаги усиливается воздействие на Т- и В-клетки, приводящее к увеличению выработки специфических к вирусу антител.
Интерфероны оказывают действие на все клетки иммунной системы, на продукцию ИФН-α, синтезируемого на первых этапах иммунного ответа, и служат мощными активаторами продукции ИФН-γ, еще задолго до начала его синтеза Т-лимфоцитами [8].
Следует учитывать, что не у всех людей иммунная система способна адекватно реагировать как на внедрение в организм вируса, так и на введение вакцины.
Оптимальная комплексная профилактика ОРВИ, включая грипп, должна проводиться по двум основным направлениям: специфическая иммунопрофилактика и неспецифическая, направленная на усиление иммунорезистентности организма, преимущественно школьников и других возрастных групп риска, с применением в том числе препаратов ИФН.
Одна из основных причин частых и повторных ОРВИ и более тяжелого течения гриппа — несостоятельность местного иммунитета. Учитывая это обстоятельство, неспецифическая профилактика гриппа и ОРВИ в первую очередь должна быть направлена на усиление защитных свойств слизистых оболочек верхних дыхательных путей, что возможно при использовании иммуномодуляторов местного действия. Многочисленные исследования по применению, в рамках профилактических программ, ИФН-α2b, доказывали его эффективное противовирусное действие при всех респираторных инфекциях.
Установлено, что местное применение препаратов рекомбинантного интерферона (капли, мази и др.) оказывается эффективным за счет достижения высоких концентраций активного вещества непосредственно в очаге поражения, при этом развитие аутоиммунных процессов минимизируется [8].
В современных условиях в практике здравоохранения успешно применяют различные противовирусные средства, среди которых достойное место занимают интерферонсодержащие препараты (Гриппферон, Генферон, Реаферон, Виферон, Альфаферон).
Исследования, проводимые на протяжении последних лет, подтвердили, что одним из наиболее эффективных, безопасных и доступных препаратов рекомбинантного интерферона, которые применяются как с профилактической, так и лечебной целью при гриппе и различных ОРВИ, является препарат интерферона — Гриппферон. Данный препарат производится в виде готовых форм — стабильные назальные капли и спрей дозированного применения, а для людей с аллергическим ринитом выпускается мазь назальная с лоратадином.
Гриппферон содержит ИФН-α2b человеческий рекомбинантный не менее 10000 МЕ/мл. Полимерная основа в составе препарата обеспечивает более прочный контакт с клетками слизистой оболочки носа и способствует проникновению интерферона в межклеточное пространство. Препарат не имеет аналогов в мире и разрешен к применению у взрослых и детей с первых дней жизни.
Многолетний опыт изучения Гриппферона подтверждает его противовирусное действие для большинства респираторных вирусов, вызывающих ОРВИ. Особенность Гриппферона — прямое воздействие на первопричину заболевания — препарат предотвращает репродукцию вирусов в зараженном организме. Профилактическое использование препарата в организованных коллективах способствовало снижению заболеваемости гриппом и ОРВИ в 2,5–3,5 раза. Своевременное назначение ИФН-α2b, особенно на ранних стадиях заболевания, приводит к сокращению продолжительности болезни на 30–50%. Преимуществом препарата Гриппферон является то, что он может использоваться не только для профилактики, но и для лечения гриппа и ОРВИ у новорожденных, детей, беременных, взрослых, пожилых людей и пациентов с сопутствующими хроническими инфекциями, вариантами аллергозов, независимо от состояния их иммунного статуса [10–12].
Убедительная клиническая эффективность и переносимость препарата Гриппферон была показана на 7500 пациентах, применявших препарат как с лечебной, так и профилактической целью, не было зарегистрировано осложнений и побочных эффектов [13].
Клинико-лабораторная оценка использования препарата Гриппферон, капли назальные у детей с острой респираторной патологией в лечебных и оздоровительных учреждениях достоверно подтвердила его эффективность — сокращение сроков проявления катарального синдрома (ринит, кашль, гиперемия зева), интоксикации и лихорадки. При использовании препарата в санаториях бронхолегочного профиля было установлено, что снижалась частота повторных ОРВИ [14].
При изучении действия препарата Гриппферон, капли назальные у недоношенных детей в первые 7 недель жизни, имевших контакты с заболевшими ОРВИ, было показано снижение случаев заболевания (в 3,5 раза), а также сокращение как длительности заболевания (в 1,3 раза), так и частоты развития осложнений (в 9,2 раза). Индекс профилактической эффективности составил 9,2 [15].
Проведенное в Ивановском НИИ материнства и детства им. В. Н. Городкова (ФГБУ Ивановский НИИ материнства и детства им. В. Н. Городкова МЗ РФ) изучение эффективности применения препарата Гриппферон у недоношенных детей, родившихся с низкой массой тела и контактировавших с больными ОРВИ, показало, что у 38,5% детей из группы наблюдения заболевание не наступило, тогда как в группе сравнения заболело 96,2% детей. Средняя продолжительность клинического проявления заболевания была почти в два раза короче у детей из группы наблюдения по сравнению с детьми контрольной группы (6,4 против 11,5 дня соответственно). Частота осложнений в группе наблюдения составила 5,7%, тогда как в группе сравнения — у каждого пятого ребенка [16]. Аналогичный результат, показавший эффективность применения препарата Гриппферон, был получен и у детей в возрасте от 3 месяцев до 3 лет, контактировавших с больными ОРВИ.
На кафедре инфекционных болезней РМАНПО (ФГБОУ ДПО Российская медицинская академия непрерывного профессионального образования МЗ РФ) была проведена неспецифическая профилактика ОРВИ и гриппа препаратом Гриппферон среди медицинских работников групп риска в период эпидемического сезона 2016–2017 гг. В группу риска вошли все сотрудники кафедры, а также медицинский персонал инфекционного отделения больницы.
Профилактическое применение препарата Гриппферон проведено в два этапа: первый совпал с пиком заболеваемости гриппом в осенне-зимний период, а второй — с началом второй волны эпидемической заболеваемости, что позволило всем наблюдаемым из группы риска избежать заболевания ОРВИ и гриппом.
Таким образом, в рамках неспецифической профилактики гриппа и ОРВИ важное значение имеет своевременное применение, как с профилактической, так и с лечебной целью, препаратов, содержащих интерферон. Широкое использование в практике здравоохранения препаратов на основе рекомбинантных интерферонов, в частности препарата Гриппферон, уже сегодня может привести к значительному снижению заболеваемости населения ОРВИ и гриппом, а также снизить частоту эпидемических вспышек, в первую очередь в организованных коллективах и среди контингентов, относящихся к группам риска.
Литература
ФГБОУ ВО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Использование интерферонов в профилактике и лечении респираторных вирусных инфекций у взрослых и детей/ Н. Д. Ющук, О. С. Хадарцев
Для цитирования: Лечащий врач № 3/2018; Номера страниц в выпуске: 67-72
Теги: вакцинация, заболеваемость, вирусные инфекции, профилактика

.gif)
.gif)
.gif)
.gif)
.gif)
.gif)