Что лучше амоксициллин или цефалексин
Антибиотики нового поколения: за и против
Антибиотики – это вещества биологического или полусинтетического происхождения. Применяются в лечебной практике для борьбы с болезнетворными микробами, вирусами. До появления этих медпрепаратов статус неизлечимых болезней был у брюшного тифа, дизентерии, пневмонии, туберкулеза. Сегодня лечение заболеваний инфекционного характера возможно с применением 1-6 поколения антибиотиков.
На этот момент фармакологическая индустрия выпускает более 2000 разновидностей лекарственных средств подобного типа. Медики описали действие около 600 позиций, а во врачебной практике используются порядка 120-160 препаратов.
Важно! При любом заболевании принимать антибиотики рекомендуется после консультации с врачом. В противном случае может развиться антибиотикорезистентность (снижение чувствительности патогенных микроорганизмов к антибактериальным средствам).
Классификация антибиотиков
Все антибактериальные средства можно разделить на 5 категорий по характеристикам и спектру применения. Рассмотрим эту классификацию подробнее:
Спектр действия
Различают антибактериальные средства:
По составу
Антибактериальные препараты делят на 6 групп:
Поколения препаратов. У передовых антимикробных препаратов насчитывается уже шесть генераций. Например, пенициллин был первым средством природного происхождения, тогда как третья или шестая генерация – это уже улучшенная версия, которая включает в состав сильнейшие ингибиторы. Зависимость прямая: чем новее генерация, тем эффективнее воздействие препаратов на патогенную микрофлору.
По способу приема. Пероральные – принимают через рот. Это различные сиропы, таблетки, растворимые капсулы, суспензии. Парентеральные – вводятся внутривенно или внутримышечно. Они быстрее дают эффект, чем пероральные лекарства. Ректальные препараты вводятся в прямую кишку.
Важно! Принимать антибиотики допускается только после консультации с врачом, иначе разовьется антибиотикорезистентность.
Антибактериальные средства нового поколения
Отличие последних генераций антибиотиков от их ранних версий в более совершенной формуле действующего вещества. Активные компоненты точечно устраняют только патологические реакции в клетке. Например, кишечные антибиотики нового поколения не нарушают микрофлору ЖКТ. При этом они борются с целой «армией» возбудителей инфекций.
Новейшие антибактериальные препараты делятся на пять групп:
Рассмотрим несколько известных противомикробных средств импортного и российского производства.
Амоксициллин – импортный противомикробный препарат из группы пенициллинов. Используется во врачебной практике для лечения бактериальной инфекции. Эффективен при кишечных инфекциях, гайморите, ангине, болезни Лайма, дизентерии, сепсисе.
Авелокс – медпрепарат последней генерации из группы фторхинолонов. Отличается сильнейшим воздействием на бактериальные и атипичные возбудители. Не вредит почкам и ЖКТ. Используется при острых, хронических заболеваниях.
Цефалоспорины – антибиотики третьего поколения. К этой группе относят Цефтибутен, Цефтриаксон и другие. Используются для лечения пиелонефрита, пневмонии. В целом это безопасные средства с малым количеством побочных действий. Однако их нужно принимать только после консультации с врачом. Медпрепаратов много, а какой именно выбрать – порекомендует специалист.
Дорипрекс – импортный противомикробный препарат синтетического происхождения. Показал хорошие результаты при лечении пневмонии, запущенных интраабдоминальных инфекций, пиелонефритах.
Инваз – антибактериальное средство из группы карбапенемов. Выпускается в ампулах для парентерального способа применения. Показывает быстрый эффект при лечении бактериальных расстройств кожи, мягких тканей, инфекциях мочевыводящих путей, пневмонии, септицемиях.
Аугметин – полусинтетический пенициллин третьей генерации с добавлением усиливающих ингибиторов. Педиатрами признается лучшим комплексным медпрепаратом для лечения детских гайморита, бронхита, тонзиллита и других инфекций дыхательных путей.
Цефамандол – антибактериальное средство российского производства. Относится к группе цефалоспоринов третьего поколения. Используется для лечения кишечных инфекций, возбудителей инфекций половых органов. Как противомикробное средство обширного диапазона воздействия применяется при простудных заболеваниях.
Лучшие антибактериальные препараты широкого диапазона действия
Противомикробные средства новой генерации обычно синтезируют из природного сырья и стабилизируют в лабораториях. Это помогает усилить эффект лекарства на патогенную микрофлору.
Какие препараты самые сильные? Врачи относят к таким антибактериальные средства широкого спектра воздействия. Приведем ниже краткий список препаратов по названиям:
Резюме
Мы рассмотрели российские и импортные антибиотики широкого спектра действия, кратко описали классификацию препаратов. Ответим на вопрос: какие антибактериальные средства выбрать?
Важно понимать, противомикробные лекарства для обширного применения обладают токсичностью, поэтому негативно влияют на микрофлору. Кроме того, бактерии мутируют, а значит препараты теряют свою эффективность. Поэтому антибактериальные средства с новейшей структурой будут в приоритете, чем их ранние аналоги.
Самолечение антибиотиками опасно для здоровья. При инфекционном заболевании первым делом нужно обратиться к врачу. Специалист установит причину болезни и назначит эффективные антибактериальные средства. Самолечение «наугад» приводит к развитию антибиотикорезистентности.
Антибиотики в арсенале участкового педиатра для лечения болезней органов дыхания
Хотя диагностика и лечение респираторной патологии у детей занимают ведущее место в работе педиатра, антибактериальная терапия требуется практически всего 6–8% больным этой категории — в основном с отитом, синуситом, стрептококковой ангиной, л
Хотя диагностика и лечение респираторной патологии у детей занимают ведущее место в работе педиатра, антибактериальная терапия требуется практически всего 6–8% больным этой категории — в основном с отитом, синуситом, стрептококковой ангиной, лимфаденитом, пневмонией, а также при бронхитах, вызванных только микоплазмой и хламидиями. К сожалению, и у нас, и за рубежом далеко не изжито избыточное применение этих препаратов — их применяют подчас у 30–80% детей с острыми респираторными вирусными инфекциями (ОРВИ). Не принося пользы, такая практика повышает риск развития устойчивости флоры и побочных явлений, дезориентируя к тому же врача: не получив эффекта от антибиотика при вирусной инфекции, врач переходит на резервные препараты, которые также не дают эффекта. Поэтому основной вопрос — показаны ли антибиотики данному больному? — решать положительно следует при только доказанной (или вероятной тяжелой) бактериальной инфекции. И хотя доказать бактериальную природу острых респираторных заболеваний (ОРЗ) удается редко, накопленные данные позволяют врачу с высокой вероятностью не только выявить таких детей, но и очертить круг вероятных возбудителей и их чувствительность к антибиотикам. В табл. 1 представлены формы респираторной патологии, при которых показано и не показано назначение антибиотика, а также симптомокомплекс, позволяющий заподозрить пневмонию в отсутствие четких физикальных данных, и значения маркеров воспаления, при которых введение антибиотика оправдано.
В табл. 2 представлены основные возбудители бактериальных ОРЗ; очевидно, что спектр возбудителей ОРЗ у детей невелик, что облегчает выбор препарата, который действует на вероятных возбудителей конкретного заболевания. Эти данные для антибиотиков, которые следует применять в амбулаторных условиях, приведены в табл. 3.
К счастью, резистентность к пенициллину циркулирующих среди населения России пневмококков (менее 10% штаммов) во много раз ниже, чем, например, в странах Юго-Запада Европы (40–50%). Но следует учитывать, что среди детей в детских дошкольных учреждениях (ДДУ) и особенно в интернатах 50–60% выделенных штаммов пневмококков устойчивы к пенициллину. Пневмококки сохраняют 100-процентную чувствительность к амоксициллину (а также к цефтриаксону), но устойчивы к ко-тримоксазолу, тетрациклину, гентамицину и другим аминогликозидам. Устойчивость пневмококков к пенициллинам не связана с выработкой лактамазы (она обусловлена потерей пенициллин-связывающих белков), поэтому применение ингибитор-защищенных пенициллинов не повышает эффективности лечения. Устойчивость пневмококков к макролидам растет быстрее (до 15–20% штаммов в некоторых регионах), в меньшей степени она растет к 16-членным макролидам: джозамицину, мидекамицину, спирамицину.
Haеmophilus influenzae (как бескапсульные, так и типа b) в России чувствительны к амоксициллину, доксициклину, цефалоспоринам 2 и 3 поколений, всем аминогликозидам. Но эти возбудители не чувствительны к пенициллину, цефалексину, цефазолину, большинству макролидов — кроме азитромицина (его применение при отитах и синуситах ограничено низкой его концентрацией в соответствующих полостях).
Под влиянием лечения H. influenzae вырабатывает лактамазы, инактивирующие лактамные препараты (в т. ч. пенициллин и амоксициллин), поэтому у детей, леченных ранее (а также у детей из ДДУ), применяются с начала лечения амоксициллин/клавуланат или цефуроксим аксетил.
Бета-гемолитический стрептококк группы А (БГСА) чувствителен ко всем антибиотикам, кроме аминогликозидов, однако в ряде регионов частота устойчивых к макролидам штаммов может достигать 15%. Moraxella catarrhalis, способная продуцировать лактамазу, выделяемая обычно у леченых ранее детей, чувствительна к макролидам, цефалоспоринам, аминогликозидам, но резистентна к амоксициллину.
Золотистый стафилококк редко вызывает «амбулаторные» формы поражения дыхательных путей (гнойный синусит, шейный лимфаденит); он, как правило, не чувствителен к пенициллинам, есть и штаммы, резистентные к цефалексину и амоксициллину/клавуланату, а его чувствительность к макролидам быстро снижается, если лечение длится более 5–7 дней. Препаратами выбора является цефалексин внутрь, а при более тяжелых формах — оксациллин (парентерально), а в случае устойчивости к нему — ванкомицин.
В амбулаторной практике назначают препараты первого выбора, если нет оснований предполагать наличие лекарственной устойчивости (табл. 4). При подавляющем большинстве форм эффективны оральные формы пенициллинов, цефалоспоринов первого-второго поколений и макролидов, их надежнее всего вводить в детской лекарственной форме — гранулах, диспергируемых таблетках Солютаб или сиропе, позволяющей точное дозирование.
Наиболее используемый препарат первого выбора — амоксициллин (Флемоксин Солютаб и др.), на него приходится (по весу) 1/3 всех выпускаемых в мире антибиотиков. Его биодоступность выше, чем у ампициллина внутрь, что вытеснило последний из арсенала педиатра. Другие препараты первого выбора: феноксиметилпенициллин (сироп Оспен) и цефалексин используют только для лечения стрептококкового тонзиллита, а макролиды — «атипичных» инфекций (микоплазмоз и хламидиоз), а также для лечения кокковых инфекций у больных с аллергией на пенициллины.
С препаратов второго выбора начинают лечение только в случае предшествующей (за последние 2–3 месяца) терапии антибиотиками, а также при внутрибольничной инфекции (у ребенка, заболевшего через 1–3 суток после выписки из стационара). Наиболее используемый препарат — амоксициллин/клавуланат — Амоксиклав, Аугментин, Флемоклав Солютаб), эффективный как против пневмо- и стрептококков, так и гемофильной палочки и моракселл. Цефалоспорины второго поколения (цефуроксим аксетил — Зиннат, который намного активнее цефаклора в отношении пневмо- и стрептококков) также эффективны как препараты второго выбора. Используются возрастные дозировки, однако для амоксициллина/клавуланата и Зинната в ряде инструкций указаны заниженные (20–30 мг/кг/сут) дозы, которые могут оказаться недостаточными (см. наблюдение) — они не должны быть ниже 45–50 мг/кг/сут.
Средства третьего выбора (резервные, обычно парентеральные) применяют только в случаях полирезистентности, обычно в условиях стационара.
Не используют при респираторной патологии ко-тримоксазол и тетрациклин ввиду роста устойчивости к ним пневмотропной флоры, а также оральные цефалоспорины третьего поколения — цефтибутен (Цедекс) и цефиксим (Супракс), которые могут быть недостаточно активными в отношении кокковой флоры, в частности, пневмококков.
Оральные антибиотики не используют при тяжелых острых процессах. К ним относится гнойный синусит (протекает с отеком щеки или окологлазной клетчатки), он часто требует оперативного вмешательства, лимфаденит с признаками гнойного воспаления (спаянность с гиперемированной кожей, флюктуация). У детей с крупом важно исключить эпиглоттит — бактериальное воспаление надгортанника, также вызывающее инспираторный стридор как при вирусном крупе, но с фебрильной температурой, интоксикацией, болями при глотании при отсутствии лающего кашля, дисфонии. Для эпиглоттита характерно усиление диспноэ в положении на спине, нейтрофильный лейкоцитоз, он требует ранней интубации для профилактики асфиксии. Эти заболевания, как и осложненная плевритом и деструкцией пневмония, требуют госпитализации, перед которой следует ввести парентерально препарат широкого спектра — цефтриаксон (80 мг/кг), который должен быть в укладке скорой и неотложной помощи и у каждого участкового врача.
В остальных случаях используются оральные препараты (табл. 4). При подозрении на острый средний отит (или его диагностике при отоскопии) адекватно назначение амоксициллина в дозе 50 мг/кг/сут, или амоксициллина/клавуланата в той же дозе (преодоление устойчивости некапсульного гемофилюса и моракселл), или, у леченного недавно ребенка, в дозе 80–100 мг/кг/сут амоксициллина для преодоления возможной сниженной чувствительности пневмококков в полости среднего уха. В последнем случае желательно использовать Аугментина или Флемоклава Солютаб с соотношением амоксициллина и клавулановой кислоты 7:1. Срок лечения — 10 дней у детей до двух лет и 7 дней — у старших.
Та же лечебная тактика эффективна при негнойном бактериальном синусите, который диагностируют на второй-третьей неделе ОРЗ при сохранении заложенности носа, часто также лихорадки, болей в проекциях пазух.
Большие сложности возникают при лечении острого тонзиллита, который лишь в 30% случаев вызывается БГСА, а в остальных — аденовирусом или вирусом Эпштейна–Барр (инфекционный мононуклеоз). Для них одинаково характерны острое начало, лихорадка с ознобом или без, боль в горле при глотании, гиперемия, отечность миндалин, часто также язычка и мягкого неба, гнойный детрит в лакунах, налеты, увеличение лимфоузлов (без нагноения). Стрептококковый тонзиллит отличается от вирусного отсутствием кашля и катара, конъюнктивита, болезненностью лимфоузлов и падением температуры через 24–48 ч после назначения антибиотика. Аденовирусный тонзиллит отличают конъюнктивит и назофарингит, мононуклеоз — назофарингит, увеличение печени и селезенки, появление в крови широкоплазменных лимфоцитов. Положительный высев делает диагноз БГСА-инфекции бесспорным, как и повышение антистрептолизина-О (АСЛ-О), поэтому во всех случаях острого тонзиллита показаны такие исследования.
При доказанном стрептококковом тонзиллите, как и при неясности этиологического диагноза (особенно у детей старше 6 лет и в весеннее время), назначают один из пенициллинов, цефалексин или макролид, которые приводят к падению температуры через 14–36 часов, подтверждая диагноз стрептококкового тонзиллита; в этих случаях лечение следует продолжить до 10 дней (для азитромицина — в дозе 12 мг/кг/сут — 5 дней). При отсутствии эффекта антибиотик можно отменить, оставив лишь симптоматическое лечение.
При поражении нижних дыхательных путей (его признаки — тахипноэ или диспноэ, наличие хрипов, укорочение перкуторного звука) важно дифференцировать вирусный бронхит от пневмонии, в подавляющем большинстве случаев — бактериальной.
Вирусный бронхит — самую частую форму поражения нижних дыхательных путей (75–300 на 1000 детей) — важно дифференцировать с бактериальной пневмонией, частота которой существенно ниже (4–15 на 1000 детей). Это тем более важно, что осложнение вирусного бронхита, в т. ч. бронхиолита у грудных детей, бактериальной пневмонией наблюдается крайне редко. Против пневмонии говорит субфебрильная температура (исключение — хламидийные формы в первые месяцы жизни, при которых ведущий симптом — тахипное) или если фебрильная поначалу температура в течение 1–3 дней снижается до субфебрильной. Типичное для бронхита обилие хрипов или признаки обструкции наблюдаются лишь при «атипичной» микоплазменной пневмонии — при этом они асимметричны и нередко сопровождаются укорочением перкуторного звука. Асимметрия хрипов наблюдается и при вызванном микоплазмой бронхите, что является показанием для рентгенографии. Для типичной (пневмококковой, гемофилюсной) пневмонии хрипы если и есть, то локальные, часто на фоне жесткого или ослабленного дыхания над участком легкого, нередко с укорочением перкуторного звука (наблюдение). К сожалению, эти локальные признаки определяются далеко не у всех больных пневмонией.
Таким образом, на основании физикальных данных обычно нетрудно исключить типичную пневмонию и назначить симптоматическую терапию вирусного бронхита. При подозрении на пневмонию (при отсутствии угрожающих симптомов) стартовый препарат — амоксициллин 50 мг/кг/сут, а у недавно леченых детей амоксициллин/клавуланат 50 мг/кг/сут или цефуроксим аксетил — 40–60 мг/кг/сут, которые, как правило, дают быстрый эффект. Отсутствие эффекта обычно указывает на «атипичную» этиологию пневмонии и требует смены препарата на макролид.
Инфекцию микоплазмой, обусловливающей у детей старше 5 лет около половины всех пневмоний (между пневмонией и бронхитом при неплотном легочном инфильтрате трудно провести грань), следует заподозрить при стойкой (5–10 дней) высокой температуре, обычно с нерезким токсикозом (не вызывающим сильной тревоги родителей), с необильными катаральными симптомами и конъюнктивитом, с обильными, мелкопузырчатыми (как у грудных детей с бронхиолитом) хрипами, но выслушиваемыми асимметрично. Характерный признак — отсутствие эффекта от назначения амоксициллина и других лактамных препаратов; назначение любого макролида в возрастной дозе приводит в течение 1–3 дней к апирексии и уменьшению явлений бронхита.
Участковые педиатры часто неверно интерпретируют симптомы этих двух видов пневмоний, назначая при более «шумных» (сопровождающихся обилием хрипов) атипичных пневмониях «более сильные» цефалоспорины, не дающие эффекта, а при типичных пневмониях с минимумом хрипов — «более слабые» макролиды. В ряде случаев типичной пневмонии макролиды дают быстрый эффект, однако вследствие роста устойчивости пневмококка они могут не давать эффекта. Поэтому следует стремиться делать стартовые назначения соответственно более вероятной форме пневмонии. Полагаться при этом на выявление, например, антител к микоплазме не надежно, т. к. на первой неделе IgM-антител может еще не быть, а ПЦР может выявлять антиген у носителей.
Для подтверждения или исключения бактериальной инфекции обычно используются так называемые маркеры бактериального воспаления — уровни лейкоцитоза, С-реактивного белка, в последнее время — также прокальцитонина. Нередко приходится видеть ребенка с ОРВИ без видимых бактериальных очагов, который получает антибиотики только потому, что у него выявлен лейкоцитоз порядка 10–15×10 9 /л. У большинства таких больных ОРВИ течет гладко без применения антибиотиков. Доказано, что только лейкоцитоз > 15×10 9 /л, абсолютное число нейтрофилов > 10×10 9 /л и/или палочкоядерных > 1,5×10 9 /л (а также С-реактивный белок (СРБ) > 30 мг/л и прокальцитонин > 2 нг/мл) более или менее надежно указывают на возможность бактериальной инфекции, тогда как более низкие цифры встречаются при вирусных инфекциях достаточно часто. Так, у детей с ОРВИ, бронхитом, крупом лейкоцитоз 10–15×10 9 /л встречается у 1/3, СРБ 15–30 мг/л — у 1/4 больных. При тонзиллитах, вызванных аденовирусами и вирусом Эпштейна–Барр, у 1/3 детей лейкоцитоз лежит в пределах 10–15×10 9 /л, а 1/3 — выше 15×10 9 /л, уровни СРБ 30–60 мг/л выявляются у 1/4 детей, а у 1/3 — выше 60 мг/л.
Следует учитывать и то, что при бактериальных инфекциях лейкоцитоз наблюдается далеко не всегда: так, при гнойном отите и типичной пневмонии у 40% больных лейкоцитоз не превышает 15´109/л, а при катаральном отите и атипичной пневмонии — у 90%.
Литература
В. К. Таточенко, доктор медицинских наук, профессор
НЦЗД РАМН, Москва
Наблюдение
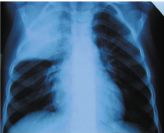
Настя К. 4,5 лет поступила на 4-й день болезни, сопровождавшейся температурой 39 °C, кашлем. Две дозы Флемоклава Солютаба по 15 мг/кг эффекта не дали.
При поступлении: навязчивый кашель, покраснение правой щеки, укорочение над правым легким сверху, хрипов нет. Кровь: Л — 31,6 ´ 109/л, п/я — 29%, с/я 57%, СОЭ 36 мм/час, СРБ 60 мг/л, ПКТ 10 нг/мл.
Доза Флемоклава Солютаба 45 мг/кг привела к падению Т° к концу дня, быстрому улучшению состояния и нормализации картины в легких через 2 недели. Курс лечения — 5 дней.
Диагноз: крупозная пневмония
Ошибки в антибактериальной терапии инфекций дыхательных путей в амбулаторной практике
Опубликовано в журнале:
Лечащий врач, 2003, №8 Л. И. Дворецкий, доктор медицинских наук, профессор
С. В. Яковлев, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
При выборе способа антибактериальной терапии в амбулаторной практике необходимо учитывать и решать как тактические, так и стратегические задачи. К тактическим задачам антибиотикотерапии относится рациональный выбор антибактериального препарата, обладающего наибольшим терапевтическим и наименьшим токсическим воздействием.
Стратегическая задача антибиотикотерапии в амбулаторной практике может быть сформулирована как уменьшение селекции и распространения резистентных штаммов микроорганизмов в популяции.
В соответствии с этими положениями следует выделять тактические и стратегические ошибки при проведении антибактериальной терапии инфекций дыхательных путей в амбулаторной практике (см. таблицу 1).
Таблица 1. Ошибки антибактериальной терапии в амбулаторной практике.
Тактические ошибки антибактериальной терапии
1. Необоснованное назначение антибактериальных средств
Особую категорию ошибок представляет неоправданное применение антибактериальных препаратов (АП) в тех ситуациях, когда их назначение не показано.
Показанием для назначения антибактериального препарата является диагностированная или предполагаемая бактериальная инфекция.
При всех трудностях принятия решения в подобных ситуациях необходимо отдавать себе отчет в том, что антибактериальные препараты не оказывают влияния на течение вирусной инфекции и, следовательно, их назначение при ОРВИ не оправдано (см. таблицу 2). В то же время предполагаемая возможность предотвращения бактериальных осложнений вирусных инфекций с помощью назначения антибактериальных препаратов не находит себе подтверждения в клинической практике. Кроме того, очевидно, что широкое неоправданное применение антибактериальных препаратов при ОРВИ чревато формированием лекарственной устойчивости и повышением риска возникновения нежелательных реакций у пациента.
Таблица 2. Инфекционные заболевания дыхательных путей преимущественно вирусной этиологии
и не требующие антибактериальной терапии.
Часто врач назначает нистатин или другой антимикотик в случае обнаружения в полости рта или в моче грибов рода Candida. При этом он ориентируется лишь на данные микробиологического исследования и не учитывает наличие или отсутствие симптомов кандидоза, а также факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.).
Выделение грибов рода Candida из полости рта или мочевых путей пациентов в большинстве случаев служит свидетельством бессимптомной колонизации, не требующей коррегирующей противогрибковой терапии.
II. Ошибки в выборе антибактериального препарата
Пожалуй, наибольшее число ошибок, возникающих в амбулаторной практике, связано с выбором антибактериального средства. Выбор антибиотика должен производиться с учетом следующих основных критериев:
Пероральные антибиотики: «сильные» и «слабые»
Мифы и научные факты об эффективности и безопасности антибактериальных препаратов
Ученые утверждают, что бактерии существуют на Земле как минимум 3,8х10 9 лет, в то время как антибиотики используются в клинической практике лишь с 40‑х годов прошлого века [1]. Но и этого времени хватило, чтобы препараты указанной группы обросли множеством мифов, которые мешают эффективной антибиотикотерапии. Несмотря на то что лечение антимикробными средствами априори невозможно без непосредственного руководства врача, современный «пациент разумный», подверженный влиянию околонаучных данных, вносит свой «неоценимый вклад» в дело антибиотикорезистентности и прочих негативных последствий некорректного применения антибиотиков. Предостеречь его от опрометчивых решений может грамотный фармспециалист, который владеет корректной информацией об антимикробных средствах и готов поделиться ею с клиентом.
Миф. Современные антибиотики настолько «сильные», что перед ними не устоит ни одна бактерия
Правда. На самом деле одной из самых актуальных проблем современной фармакологии и здравоохранения в целом является стремительное развитие резистентных штаммов бактерий, устойчивых в том числе и к современным антибиотикам последних поколений. Возникновение устойчивости зарегистрировано к каждому без исключения классу антимикробных препаратов. Она может развиваться на любом этапе достижения терапевтического эффекта (и даже на нескольких сразу). Основные механизмы развития устойчивости [1, 2]:
Устойчивость к антибиотикам — глобальная проблема, которая может иметь непредсказуемые последствия для каждого из нас. Увы, но огромный вклад в ее существование вносят сами потребители. Об этом уместно напомнить покупателям с рецептами на антибиотики, подчеркнув, что существенно снизить риски развития устойчивых штаммов позволяет прием антимикробных препаратов только по назначению врача и четкое соблюдение дозы и режима антибиотикотерапии.
Миф. Чтобы вылечиться побыстрее, нужны «сильные» антибиотики широкого спектра действия
Правда. Все зарегистрированные антибактериальные препараты можно смело относить к мощным, то есть «сильным», однако выраженность их противомикробного эффекта зависит от множества факторов, объединенных принципами антибиотикотерапии [2]:
В российских реалиях, когда контроль за приемом антибиотиков, откровенно говоря, недостаточен, особенно остро стоит вопрос некорректного подбора препаратов. Известно, что его осуществляют двумя способами: этиотропным и эмпирическим. В первом случае антибиотик применяется целенаправленно против определенного, точно установленного возбудителя. Без сомнения, это рационально и оправданно. Однако идентификация микроорганизма, вызвавшего инфекцию, требует времени, обычно это занимает несколько суток. Когда процесс протекает остро и больному требуется немедленная помощь, выделение возбудителя — неоправданная роскошь. В такой ситуации назначают эмпирическую терапию, подбирая препарат с учетом наиболее вероятных возбудителей [3]. Например, самый частый возбудитель пневмонии — пневмококк, цистита — кишечная палочка и так далее.
Если антибиотик был подобран корректно и все остальные принципы антибиотикотерапии были соблюдены, он, без сомнения, окажется «сильным». А вот тот же препарат, применяемый неправильно (независимо от того, на каком этапе была сделана ошибка), может проявить «слабость» и не оказать терапевтического действия.
Миф. Хотя многие сульфаниламидные препараты почти ушли в прошлое, ко-тримоксазол по‑прежнему сохраняет свои позиции в ряду антимикробных препаратов
Правда. Сульфаниламиды стали первыми эффективными химиотерапевтическими средствами, успешно применяемыми для профилактики и лечения бактериальных инфекций. И хотя область их применения значительно сузилась с появлением пенициллина, а позже и других антибиотиков, некоторые их представители длительное время занимали нишу в ряду антимикробных препаратов. Речь в первую очередь идет о синергической комбинации триметоприма и сульфаметоксазола, известной под МНН ко-тримоксазол.
Ко-тримоксазол представляет собой мощный селективный ингибитор микробной дигидрофолатредуктазы — фермента, восстанавливающего дигидрофолат до тетрагидрофолата. Блокирование этой реакции обеспечивает нарушение образования пуриновых и пиримидиновых оснований, нуклеиновых кислот и таким образом подавляет рост и размножение микроорганизмов [4]. Однако в последние годы резко увеличилось количество штаммов бактерий, резистентных к ко-тримоксазолу, и распространенность устойчивости продолжает быстро нарастать.
Предполагается, что ранее чувствительные к препарату микроорганизмы в ходе эволюции приобрели внехромосомные молекулы ДНК (плазмиды), которые кодируют измененную дигидрофолатредуктазу. Благодаря им устойчивость к ко-тримоксазолу формируется практически у каждого третьего изолята кишечной палочки в моче [4]. Ситуация с остальными штаммами ранее чувствительных к препарату бактерий ненамного лучше. В связи с этим сегодня применение ко-тримоксазола резко ограничено, и препарат практически уступил место более эффективным и безопасным антимикробным препаратам [5].
Миф. Пероральные цефалоспорины такие же «сильные», как и парентеральные
Цефалоспорины (ЦС) — один из самых обширных классов антимикробных препаратов, представленных как в пероральной, так и парентеральной форме. При этом выраженность антибактериального эффекта в первую очередь определяется принадлежностью к одному из четырех поколений. Антибиотики цефалоспорины 1 поколения — парентеральный цефазолин и пероральный цефалексин — имеют самый узкий спектр активности, схожий со спектром аминопенициллинов (ампициллина, амоксициллина) [3]. Цефалоспорины II поколения (парентеральный цефуроксим, пероральный цефаклор) активны в отношении грамотрицательных бактерий, при этом по действию на стафилококки и стрептококки они близки к предшественникам. Таким образом, мощность представителей антибиотиков первого и второго поколений практически не зависит от лекарственной формы. Но с цефалоспоринами последующих поколений всё не так просто.
Известно, что антибиотики 3 поколения обладают более высокой по сравнению с ЦС-I и ЦС-II активностью в отношении грамотрицательных бактерий, пневмококков и стрептококков. Однако их пероральные формы цефиксим и цефтибутен определенно обладают более узким спектром активности, чем парентеральные цефтриаксон, цефтазидим и цефоперазон. В частности, препараты для приема внутрь не действуют в отношении пенициллинорезистентных пневмококков, что связывают с их относительно невысокой биодоступностью. Так, биодоступность цефиксима составляет всего 40–50 %, в то время как у парентеральных форм она приближается к 100 % [3].
Тем не менее, цефиксим считается мощным антибиотиком, применение которого оправдано при инфекциях мочевыводящих путей, а также среднем отите и фарингите. Цефтибутен применяют гораздо реже: он показан только для терапии острых бактериальных осложнений хронического бронхита, среднего отита, фарингита и тонзиллита. Существенный недостаток этого препарата — низкая активность в отношении золотистого стафилококка [4]. В то же время парентеральные цефалоспорины третьего поколения широко применяются для лечения тяжелых инфекций верхних, нижних дыхательных путей, желчевыводящих путей, мягких тканей, кишечных инфекций, сепсиса и других [3].
Миф. Хлорамфеникол — «сильный» безопасный антибиотик при кишечных инфекциях
Правда. С одной стороны, хлорамфеникол действительно имеет широкий спектр активности, включающий грамположительные и грамотрицательные кокки, грамотрицательные палочки, в том числе кишечную и гемофильную, а также других возбудителей кишечных инфекций — сальмонелл, шигелл и так далее. Но, с другой стороны, препарат связан с не менее широким спектром неблагоприятных реакций.
Известно, что хлорамфеникол угнетает кроветворение, вызывая тромбоцитопению, анемию и даже фатальную апластическую анемию (хотя и всего в 1 случае на 10 000–40 000 пациентов) [3]. Кроме того, он оказывает гепатотоксическое, нейротоксическое действие и проявляет другие побочные эффекты. Ввиду крайне неблагоприятного профиля безопасности хлорамфеникол считается антибиотиком резерва и назначается исключительно в случаях, когда польза от его применения превышает риск побочных эффектов. Это происходит, как правило, если по каким‑то причинам не удается подобрать другой препарат антибактериального действия [3, 5].
Миф. Тетрациклины традиционно «слабые» антибиотики, значительно менее мощные, чем пенициллины
Правда. На самом деле тетрациклины имеют широкий спектр антибактериальной активности, причем современные их представители действуют в отношении еще большего количества бактерий, чем их предшественники, включая ряд возбудителей, устойчивых к другим классам антибиотиков. Так, тигециклин, появившийся на рынке только в середине 2000‑х, был разработан в рамках программы по борьбе с растущей антибиотикорезистентностью таких «сложных» в этом плане возбудителей, как золотистый стафилококк и кишечная палочка [6].
Тетрациклины, в том числе и применяемые на протяжении десятилетий тетрациклин и доксициклин, способны проникать внутрь клетки, поэтому они и сегодня широко применяются для лечения внутриклеточных инфекций, передающихся половым путем (хламидиоза, уреаплазмоза, микоплазмоза). К показаниям к их назначению относится и хеликобактерная инфекция — в составе эрадикационной терапии. Благодаря эффективности в отношении Propionibacterium acne тетрациклины наряду с макролидами применяются для лечения угревой болезни. Миноциклин, чей спектр включает Neisseria meningitidis, используется для профилактики менингококковой инфекции [2].
В качестве ложки дегтя следует упомянуть и о том, что для большинства тетрациклинов (за исключением современных представителей) свойственны высокий уровень вторичной резистентности многих бактерий и к тому же перекрестная устойчивость микроорганизмов [3]. И это, несомненно, во многих случаях снижает их актуальность.
Миф. Фторхинолоны — слишком «сильные» антибактериальные ЛС, поэтому их не применяют для лечения детей
Правда. Фторхинолоны — обширная группа антимикробных препаратов, включающая представителей четырех поколений. Сегодня используются хинолоны последних трех поколений, причем наибольшей активностью обладают антибиотики, принадлежащие к III (левофлоксацин, спарфлоксацин, гатифлоксацин) и IV (моксифлоксацин, клинафлоксацин) поколениям. Их спектр активности включает пневмококков, в том числе пенициллинорезистентных, атипичных возбудителей (хламидии, микоплазмы), большинство грамотрицательных бактерий, стрептококков, анаэробов и другие. К безусловным преимуществам современных хинолонов относятся устойчивость к бета-лактамазам, медленное развитие резистентных штаммов, высокая биодоступность пероральных форм препаратов, низкая токсичность, а также длительность действия, позволяющая назначать многие препараты 1 раз в сутки [7].
Фторхинолоны являются препаратами выбора при инфекциях мочевыводящих, желчевыводящих, дыхательных путей, инфекциях, передаваемых половым путем, гинекологических заболеваниях и так далее [7]. Но при всех своих преимуществах фторхинолоны имеют и ряд недостатков, среди которых возможность поражения хрящевых точек роста костей у детей. Впрочем, этот эффект был выявлен во время токсикологических исследований на неполовозрелых животных. Согласно клиническим данным, общее число побочных эффектов фторхинолонов — как по количеству, так и по качеству — у детей и взрослых не отличается [8]. Более того — во всем мире распространена практика использования антибактериальных этой группы у детей [9], хотя в России возраст до 18 лет по‑прежнему остается противопоказанием к их применению.
Миф. Эритромицин — «слабый» макролид, намного уступающий современным представителям этого класса препаратов
Правда. Эритромицин, так же как и другие макролиды, обратимо связывается с 50S субъединицей рибосом, нарушая процесс транслокации и образования пептидных связей между молекулами аминокислот и блокируя синтез белков чувствительных бактерий. Несмотря на существование современных представителей класса — азитромицина, кларитромицина и других, — эритромицин по‑прежнему считается препаратом выбора для лечения ряда инфекций, в частности, микоплазменной инфекции у детей, легионеллеза, дифтерии и коклюша [2].
Наряду с высокой активностью, эритромицин выделяется недостаточно хорошей переносимостью. Известно, что у 30–35 % пациентов он вызывает диспепсию, а также имеет ряд других побочных эффектов [3]. В связи с этим на практике нередко отдают предпочтение современным представителям этой группы.
Миф. Амоксициллин такой же сильный антибиотик, как амокисициллина клавуланат – по сути, это один и тот же препарат
Правда. Амоксициллин наряду с ампициллином относится к аминопенициллинам расширенного спектра, действующим в отношении грамположительных и грамотрицательных бактерий. Он и сегодня считается самым активным среди всех пероральных лактамных антибиотиков в отношении пенициллин-чувствительных и пенициллин-резистентных пневмонийных стафилококков [4]. Однако нельзя не учитывать, что ряд бактерий выработали устойчивость к пенициллинам и аминопенициллинам в частности. Так, широко распространены устойчивые штаммы гемофильной палочки, пневмококка, энтеробактерий. Выходом из этой ситуации является применение ингибиторозащищенных аминопенициллинов, таких как амоксициллин/клавуланат и ампициллин/сульбактам, устойчивых к действию бета-лактамаз и имеющих, соответственно, более широкий спектр активности [4].
Таким образом, назначение аминопенициллинов обосновано при легких и неосложненных инфекциях, в то время как при тяжелых и рецидивирующих формах показаны ингибиторозащищенные препараты. При этом путь введения (парентеральный или пероральный) выбирают в зависимости от тяжести инфекции [3].



