Что лучше дифлюкан или итраконазол
Современные методы лечения онихомикоза
Онихомикоз является наиболее распространенным заболеванием ногтей. Установлено, что 50 % случаев изменений ногтевых пластинок связано с микотической инфекцией. Эпидемиологические исследования, проведенные в России и зарубежных странах, выявили высокую з
Онихомикоз является наиболее распространенным заболеванием ногтей. Установлено, что 50 % случаев изменений ногтевых пластинок связано с микотической инфекцией. Эпидемиологические исследования, проведенные в России и зарубежных странах, выявили высокую заболеваемость онихомикозом, которая составила в общей популяции населения от 2 до 13 % [1, 2, 3]. Риск развития онихомикоза наиболее высок у больных старшего возраста. Например, у людей старше 70 лет распространенность онихомикоза стоп может составлять 50 % и выше [2, 4, 5]. Считается, что этому способствуют медленный рост ногтевых пластинок, нарушения периферического и магистрального кровообращения у лиц пожилого возраста [6]. Высокую частоту онихомикоза выявляют также у больных с иммунодефицитными состояниями (в том числе у больных СПИДом) и у больных сахарным диабетом [6, 7, 8].
Часто больные и некоторые врачи воспринимают онихомикоз как исключительно эстетическую проблему. Однако это серьезное заболевание, которое протекает хронически и в случаях возникновения иммунодефицитного состояния, декомпенсации эндокринных заболеваний может стать причиной развития распространенного микоза кожи и ее придатков. Нередко онихомикоз сопровождается развитием тяжелых осложнений, например диабетической стопы, хронического рожистого воспаления конечностей, лимфостаза, элефантиаза [9, 10]. У больных, получающих цитостатическую или иммуносупрессивную терапию, болезнь может стать причиной развития инвазивных микозов. Вот почему лечение онихомикоза является необходимым и должно проводиться своевременно [11].
Всего несколько десятилетий назад лечение онихомикоза было трудоемким, длительным и малоперспективным. Лекарственные препараты, применявшиеся для лечения грибковых заболеваний кожи и ее придатков, отличались низкой эффективностью и высокой токсичностью. Для достижения положительного результата требовалось длительное лечение или увеличение дозы препаратов, что нередко сопровождалось тяжелыми осложнениями. Некоторые методы лечения были потенциально опасны для жизни пациентов. Например, рентгенотерапия, применение таллия и ртути приводили к развитию у пациентов онкологических заболеваний кожи, заболеваниям головного мозга и внутренних органов.
Появление высокоэффективных и малотоксичных антимикотических препаратов значительно облегчило лечение грибковых заболеваний кожи и ее придатков. Однако результаты применения новых антимикотиков оказались недостаточно удовлетворительными. Контролируемые клинические испытания показали, что эффективность применения системных антимикотиков после окончания лечения составляет от 40 до 80 %, а через 5 лет — от 14 до 50 % [12]. В то же время эффективность терапии онихомикоза повышается при применении комплексных методов лечения, которые предусматривают использование этиотропных препаратов и средств, влияющих на звенья патогенеза [13]. Также в результате клинических испытаний, проведенных в странах Европы, было установлено, что эффективность лечения онихомикоза можно повысить в среднем на 15 % при сочетанном применении антимикотиков системного действия и антифунгального лака, содержащего аморолфин [14].
Лечение
Аллиламины являются синтетическими антимикотиками. Аллиламины преимущественно действуют на дерматомицеты, при этом они оказывают фунгицидное действие. Механизм их действия заключается в ингибировании фермента скваленэпоксидазы, которая принимает участие в синтезе эргостерола — основного структурного компонента клеточной мембраны дерматомицетов. К аллиламинам относятся тербинафин и нафтифин.
Аллиламины активны в отношении большинства дерматомицетов (Epidermophyton spp., Trichophyton spp., Microsporum spp., Malassezia spp.), возбудителя хромомикоза и некоторых других грибов.
Показаниями для назначения тербинафина внутрь являются онихомикоз, распространенные формы дерматомикозов кожи, микоз волосистой части головы, хромомикоз. Показаниями для наружного применения тербинафина и нафтифина служат ограниченное поражение кожи при микозах, отрубевидный лишай, кандидоз кожи. Тербинафин обладает высокой биодоступностью, хорошо всасывается в ЖКТ независимо от приема пищи. В высоких концентрациях препарат накапливается в роговом слое кожи, ногтевых пластинках, волосах, выделяется с секретами потовых и сальных желез. Абсорбция тербинафина при местном применении составляет менее 5 %, нафтифина — 4–6 %. Концентрация тербинафина и нафтифина в коже и ее придатках значительно превышает МПК для основных возбудителей дерматомикозов. Коррекция режима дозирования тербинафина может потребоваться при сочетанном назначении его с индукторами (рифампицин) или ингибиторами микросомальных ферментов печени (циметидин), так как первые повышают его клиренс, а вторые его понижают.
В результате многочисленных контролируемых многоцентровых сравнительных клинических испытаний было установлено, что тербинафин является наиболее эффективным антимикотиком в терапии онихомикоза [12] (табл. 1).
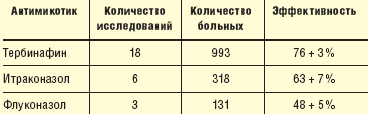 |
| Таблица 1. Сравнительная эффективность антимикотиков в терапии онихомикоза (по результатам метаанализа 27 рандомизированных исследований) |
Тербинафин применяют при распространенном поражении кожи, онихомикозе, хромомикозе, в таких случаях тербинафин назначают перорально. Тербинафин является препаратом выбора в терапии онихомикоза, так как наиболее эффективен по отношению к основных возбудителям онихомикоза — дерматомицетам. Противопоказаниями для назначения аллиламинов являются аллергические реакции на препараты группы аллиламинов, беременность, кормление грудью, возраст до 2 лет, заболевания печени, сопровождающиеся нарушением ее функции (повышением трансаминаз).
Азолы — самая многочисленная группа синтетических антимикотиков. В 1984 г. был внедрен в практику первый системный противогрибковый препарат из группы азолов — кетоконазол, в 1990 г. — флуконазол, в 1992 г. — итраконазол.
Азолы, применяемые в качестве системных препаратов, обладают преимущественно фунгистатической активностью. Важным преимуществом азолов перед другими препаратами является их широкий спектр противогрибковой активности. Итраконазол активен in vitro в отношении большинства возбудителей онихомикоза — дерматомицетов (Epidermophyton spp., Trichophyton spp., Microsporum spp.), Candida spp. (C. albicans, C. parapsilosis, C. tropicalis, C. lusitaniae и др.), Aspergillus spp., Fusarium spp., S. Shenckii и др. Флуконазол активен против дерматомицетов (Epidermophyton spp., Trichophyton spp., Microsporum spp.) и Candida spp. (C. albicans, C. parapsilosis, C. tropicalis, C. lusitaniae и др.), но не действует на Aspergillus spp., Scopulariopsis spp., Scedosporium spp.
Фармакокинетика у разных азолов различна. Флуконазол (90 %) хорошо всасывается в ЖКТ. Для хорошего всасывания итраконазола необходим нормальный уровень кислотности. Если у пациента, принимающего эти препараты, кислотность понижена, то всасываемость их уменьшается и, следовательно, снижается биодоступность. Всасываемость раствора итраконазола выше, чем у капсул с итраконазолом. Итраконазол в капсулах следует принимать с пищей, а в растворе — натощак.
Итраконазол метаболизируется в печени и выводится из организма через ЖКТ. В небольших количествах он также выделяется сальными и потовыми железами. Флуконазол метаболизируется частично и в основном выводится в неизмененном виде почками (80 %).
Итраконазол взаимодействует со многими лекарственными препаратами. Биодоступность кетоконазола и итраконазола уменьшается при приеме антацидов, холиноблокаторов, Н2-блокаторов, ингибиторов протонной помпы, диданозина. Итраконазол является активным ингибитором изоферментов цитохрома Р450 и может изменять метаболизм многих лекарственных препаратов. Флуконазол влияет на метаболизм лекарственных средств в меньшей степени. Недопустим прием азолов с терфенадином, астемизолом, цизапридом, хинидином, так как могут развиться смертельно опасные желудочковые аритмии. Совместный прием азолов и пероральных антидиабетических препаратов требует постоянного контроля за содержанием глюкозы в крови, так как может развиться гипогликемия. Прием непрямых антикоагулянтов группы кумарина и азолов может сопровождаться гипокоагуляцией и кровотечениями — следовательно, необходим контроль гемостаза. Итраконазол может повышать концентрацию в крови циклоспорина и дигоксина, а флуконазол — теофиллина и вызывать развитие токсического эффекта. Требуется корректировка доз и постоянный мониторинг за концентрацией препаратов в крови. Противопоказано совместное применение итраконазола с ловастатином, симвастатином, рифампицином, изониазидом, карбамазепином, циметидином, кларитромицином, эритромицином. Флуконазол не следует применять с изониазидом и терфенадином.
Итраконазол применяют при дерматомикозах (эпидермофитии, трихофитии, микроспории), отрубевидном лишае, кандидозе кожи, ногтей и слизистых оболочек, пищевода, кандидозном вульвовагините, криптококкозе, аспергиллезе, феогифомикозе, споротрихозе, хромомикозе, эндемичных микозах, для профилактики микозов при СПИДе.
Флуконазол применяется для лечения генерализованного кандидоза, всех форм инвазивного кандидоза, в том числе и у иммуноскомпрометированных больных, генитального кандидоза, кандидоза кожи, ее придатков и слизистых. Последнее время благодаря своей безопасности и хорошей переносимости все чаще флуконазол применяется для терапии больных дерматомикозами с поражением как кожи, так и ее придатков (ногтей и волос).
Аморолфин входит в состав лака, применяемого для лечения онихомикоза. Механизм действия аморолфина заключается в нарушении синтеза эргостерола — основного компонента клеточной мембраны гриба. Он оказывает фунгистатическое и фунгицидное действие. Обладает широким спектром действия. Концентрация аморолфина в ногтевой пластинке значительно превышает МПК для основных возбудителей дерматомикозов в течение 7 дней. Поэтому аппликация препарата может осуществляться не чаще 1–2 раз в неделю, что делает его применение экономически выгодным. Противопоказания: аллергические реакции на аморолфин, грудной и детский младший возраст. Лак в качестве монотерапии назначают при поражении не более 1–3 ногтевых пластинок и не более чем на 1/2 по площади с дистального конца. Также аморолфин можно использоваться в сочетании с системными антимикотиками при более распространенном поражении ногтей (табл. 2).
Циклопирокс обладает фунгистатическим действием. Активен в отношении дерматомицетов, дрожжеподобных и мицелиальных грибов, плесеней, а также некоторых грамотрицательных и грамположительных бактерий. Циклопирокс (лак) применяется в качестве монотерапии при поражении не более 1–3 ногтевых пластинок не более чем на 1/2 по площади с дистального конца. Также циклопирокс можно использовать в сочетании с системными антимикотиками при более распространенном поражении ногтей. Противопоказания: аллергические реакции на циклопирокс, грудной и младший детский возраст, беременность и лактация.
Перечень рекомендуемых лабораторных исследований при назначении системных антифунгальных препаратов.
Лечение фоновых заболеваний. Эффективность применения антимикотиков повышается при коррекции патологических состояний, способствовавших развитию онихомикоза. Перед началом антимикотической терапии у больных с соматическими, эндокринными, неврологическими заболеваниями, с нарушениями кровообращения в конечностях необходимо провести обследование для выявления основного симптомокомплекса, способствовавшего развитию дерматомикозов. Так, основными задачами патогенетической терапии являются улучшение микроциркуляции в дистальных отделах конечностей, венозного оттока конечностей, нормализация уровня тиреотропных гормонов у больных с заболеваниями щитовидной железы, углеводного обмена у больных сахарным диабетом и т. д. В результате многолетних исследований, проведенных в Военно-медицинской академии и Санкт-Петербургской медицинской академии последипломного образования, установлено, что одной из основных причин развития дерматомикозов являются нарушения со стороны системы гипофиз–гипоталамус–гонады. Это приводит к расстройству кровообращения в дистальных отделах конечностей, нарушениям микроциркуляции, периферической иннервации. Комплекс мероприятий, направленный на коррекцию этих нарушений, включает иглорефлексотерапию, транскраниальную электростимуляцию подкорковых центров головного мозга, назначение препаратов, корригирующих работу симпатической и парасимпатической вегетативной нервной системы. Все это позволяет добиться более быстрого клинического эффекта при терапии дерматомикозов. Проведение патогенетической терапии у больных дерматомикозами с фоновыми заболеваниями целесообразно назначать до начала этиотропного лечения и продолжать ее во время всего курса приема антифунгальных препаратов.
Симптоматическая терапия дерматомикозов, направленная на уменьшение субъективных жалоб больных и объективных проявлений заболевания, не может заменить этиотропную терапию. Однако ее применение в сочетание с антифунгальными препаратами позволяет быстрее добиться улучшения состояния больных, уменьшить чувство дискомфорта и устранить косметический дефект. При онихомикозах наибольшее беспокойство больным доставляют деформированные, значительно утолщенные (гипертрофированные) ногтевые пластинки — онихогрифоз. Для коррекции этого состояния применяют аппаратный педикюр. С помощью аппарата, напоминающего стоматологическую турбину, за короткий промежуток времени механическим путем удаляются измененные участки ногтей, гиперкератотические, роговые массы с кожи, омозолелости. При этом не происходит травматизации матрикса ногтя, и пациент после процедуры остается работоспособен.
При ограниченном поражение ногтей (не более 3 ногтевых пластинок и не более чем на 1/2 по площади с дистального края) применяются препараты для местного применения. Лечение рекомендуется начинать с подчистки пораженного участка ногтевой пластинки при помощи набора «Микоспор», аппаратного педикюра или кератолитических средств. Далее на пораженную ногтевую пластинку наносятся антифунгальные препараты. Раствор аморолфина, содержащий циклопирокс, наносится на ногтевую пластинку 1–2 раза в неделю. Перед нанесением лака не нужно предварительно очищать ногтевую пластинку от предыдущих слоев препарата. Лак наносится ежедневно до полного отрастания здоровой ногтевой пластинки. На 7-й день ногтевая пластинка очищается с помощью любого косметического средства для снятия лака. В литературе встречаются противоречивые сообщения об эффективности этого метода лечения. Указывается процент излеченности больных от 5–9 до 50 %.
При распространенном поражении ногтевых пластинок на пальцах кистей комплекс лечебных мероприятий должен включать назначение системного антимикотика, подчистку ногтей и наружную терапию антифунгальными препаратами. С целью профилактики повторного заражения необходимо обработать перчатки больного, подвергнуть дезинфекции предметы личной гигиены (мочалки, полотенца, пилочки для ногтей, терки и скребки для обработки кожи и ногтей).
Препаратом выбора при лечении онихомикоза любой локализации является тербинафин. Его назначают взрослым и детям весом более 10 кг по 250 мг в сутки в течение 6 нед. Детям от 2 лет весом менее 20 кг тербинафин назначают из расчета 67,5 мг/кг в сутки, от 20 до 40 кг — 125 мг/кг в сутки в течение 6 нед. Препаратами резерва являются средства, содержащие итраконазол и флуконазол. Итраконазол применяется по двум схемам: по 200 мг ежедневно в течение 3 мес или по 200 мг дважды в день в течение 7 дней на первой и пятой неделях с начала терапии. Для лечения онихомикозов у детей итраконазол не назначается. Флуконазол рекомендуется принимать по 150 мг 1 раз в неделю в течение 3–6 мес.
Проведение комплексной терапии, состоящей из приема системного антимикотика, подчистки ногтей, местного применения антифунгальных препаратов, а также противоэпидемиологические мероприятия, обеспечивают высокую эффективность излечения онихомикоза стоп. Тербинафин назначают взрослым и детям весом более 10 кг по 250 мг в сутки в течение 12 и более недель. Детям от 2 лет весом менее 20 кг препарат назначают из расчета 67,5 мг/кг в сутки, от 20 до 40 кг — 125 мг/кг в сутки в течение 12 нед. Флуконазол рекомендуется применять по 150–300 мг 1 раз в неделю в течение 6–12 мес. Итраконазол применяется по двум схемам: по 200 мг ежедневно в течение 3 мес или по 200 мг дважды в день в течение 7 дней на первой, пятой и девятой неделях. При поражении больших пальцев стоп рекомендуется проводить 4-й курс пульс-терапии на тринадцатой неделе от начала терапии. Для лечения онихомикозов у детей итраконазол не применяется.
Критериями микологической излеченности онихомикоза являются отрицательные результаты микроскопического и культурального исследования ногтевой пластинки. После окончания лечения итраконазолом и тербинафином здоровые ногтевые пластинки отрастают не полностью, поэтому полное клиническое выздоровление можно наблюдать только спустя 2–4 мес после окончания приема антифунгальных препаратов.
Литература
Л. П. Котрехова, кандидат медицинских наук, доцент
К. И. Разнатовский, доктор медицинских наук, профессор
Н. Н. Климко, доктор медицинских наук, профессор
СПбМАПО, Санкт-Петербург
Кандидоз: симптомы и схема лечения
Кандидоз – инфекционное заболевание, вызванное дрожжеподобными грибами, принадлежащими к роду Candida. Кандида входит в нормальную микробную флору организма даже у совершенно здоровых людей и размножается, не причиняя никакого вреда. При появлении благоприятных условий грибок начинает размножаться и провоцирует развитие различных нарушений.
Кандидоз включает в себя различные типы инфекций, начиная от самого поверхностного и заканчивая системным уровнем. Поверхностные инфекции, вызванные Candida, ответственны за местное воспаление, которое часто связано с сильным дискомфортом. Редкие, но более опасные системные инфекции, которые могут стать причиной таких осложнений, как абсцессы легких, эндокардит или менингит.
Виды кандидоза
Защитные функции организма, естественная микрофлора кишечника и влагалища в норме ингибируют рост Candida albicans. Как правило, при этом не возникает неприятных симптомов, которые указывают на его присутствие в организме. Грибок активизируется, когда сопротивление организма снижается.
Таблица – Виды кандидоза, причины и симптомы
незащищенные половые акты;
использование полотенец или белья инфицированного человека;
дисбаланс вагинальной или кишечной бактериальной флоры;
мытье интимных мест агрессивными средствами;
использование слишком плотного или нейлонового нижнего белья;
Признаки вагинального кандидоза заключаются в появлении сильного зуда на слизистой оболочке половых органов, раздражения и отека, жжения при мочеиспускании. Также появляется дискомфорт при половых актах.
Возникает как острое или хроническое воспаление и приводит к частым рецидивам. Причинные факторы заключаются в нерациональном применении антибактериальных препаратов и патологическое течение новорожденного периода. Симптомы молочницы во рту у ребенка могут появиться на фоне кишечных инфекций, снижения иммунитета и травмы слизистой оболочки.
Симптомы орального кандидоза заключаются в появлении налета на слизистой оболочке ротовой полости, а также в покраснении и отеке задней части языка. В запущенных случаях наблюдается покраснение и инфильтрация губ, наличие эрозий и сильная боль. Мелкие трещины покрываются серо-белой пленкой.
признаки тяжелой интоксикации;
повышение температуры тела;
сильные боли в животе;
жидкий стул с примесями крови.
Диагностика кандидоза
Молочница во рту у взрослых и детей диагностируется только при сочетании характерных клинических проявлений и положительных дополнительных результатов обследования. При поражении гениталий проводятся соответствующие исследования в кабинете уролога и гинеколога.
Лечение кандидоза
Предлагаем список эффективных препаратов для лечения кандидоза. Рейтинг составлен на основе безопасности лекарственных средств и соотношения цена-качество. Предварительная консультация с врачом – залог скорейшего выздоровления.
№1 – «Флуконазол» (Озон ООО и Оболенское ФП, Россия).
Противогрибковый препарат, которое является селективным ингибитором образования стеролов в клеточных структурах возбудителя. Назначается для проведения системного лечения кандидоза у мужчин и женщин при тяжелых формах микозов.
Производитель: Оболенское ФП, Россия
№2 – «Мирамистин» (Инфамед, Россия).
Антисептический раствор для местного применения. Обладает широким спектром действия, подавляя госпитальные штаммы, устойчивые к антибиотикам. Выпускается во флаконах по 50, 150 и 500 мл.
Производитель: Инфамед ООО, Россия
№3 – «Пимафуцин» (Astellas Pharma Inc., Нидерланды).
Вагинальные суппозитории (макролидный антибиотик), обладающие противогрибковым действием. Назначается в гинекологии для местного применения.
Производитель: Astellas Pharma Inc. [Астеллас Фарма], Нидерланды
№4 – «Флюкостат» (Фармстандарт-Лексредства, Россия).
Противогрибковый препарат на основе флуконазола. Назначается при осложненных или генерализованных формах заболевания, преимущественно для лечения кандидоза кишечника. Выпускается в упаковке по 1, 2 и 7 (производитель: Вертекс, Россия) капсул.
Производитель: Фармстандарт-Лексредства, Россия
№5 – «Экзодерил» (Sandoz, Австрия).
Раствор для наружного применения на основе нафтифина гидрохлорида. Эффективен против грамположительных и грамотрицательных микроорганизмов, вызывающих бактериальные инфекции.
Производитель: Sandoz [Сандоз], Австрия
№6 – «Дифлюкан» (Pfizer, Франция).
Противогрибковые капсулы, разработанные на основе флуконазола. Триазольное средство обладает высокой активностью против большинства возбудителей грибковых инфекций.
Производитель: Pfizer [Пфайзер], Франция
№7 – «Микодерил» (ФармЛек, Россия).
Противогрибковый раствор, содержащий нафтифина гидрохлорид. Используется для лечения кандидоза кожи, слизистых и ротовой полости
Производитель: Фармстандарт-Лексредства, Россия
№8 – «Ламизил» (Novartis Pharma, Швейцария).
Крем для наружного применения на основе тербинафина гидрохлорида. Назначается при дрожжевых инфекциях кожи, паховых складок и разноцветного лишая.
Производитель: Novartis Pharma [Новартис Фарма], Швейцария
Профилактика развития кандидоза
КАНДИДОЗ ПИЩЕВОДА
Кандидоз — инфекционное заболевание слизистых оболочек, кожи и внутренних органов, вызванное дрожжеподобными грибами рода Candida. Кандидоз пищевода (КП), являющийся проявлением висцерального кандидоза, занимает видное место среди инфекционных поражений пищевода. В последние годы прослеживается тенденция нарастания частоты КП, особенно у пациентов с нарушением иммунитета. Рост кандидозной инфекции в значительной степени обусловлен увеличением количества больных с ВИЧ-инфекцией, успехами в трансплантологии и иммуносупрессивной терапии, бесконтрольным использованием антибиотиков. КП встречается у 0,7-1,5% больных гастроэнтерологического профиля [5, 6].
Проблема тяжелых грибковых инфекций, вызываемых оппортунистическими патогенами, состоит в том, что они трудно поддаются лечению и могут приводить к летальному исходу. Было обнаружено, что смертность при инвазивных кандидозных инфекциях составляет 34% [16].
Благоприятные условия для развития инфекционного процесса создают различные нарушения физиологических, анатомических и иммунологических механизмов защиты организма. В качестве факторов, провоцирующих возникновение эзофагеального кандидоза, можно назвать использование антибиотиков, ингаляционных или инъекционных кортикостероидов, антацидную терапию или гипохлоргидрическое состояние, сахарный диабет, алкоголизм, последствия интоксикации, недоедание, пожилой возраст, нарушение моторики пищевода или пищеводную обструкцию, трансплантацию органов и костного мозга, энтеральное и особенно парентеральное питание и др. Ослабление иммунной системы может привести к возникновению кандидозной инфекции. При сахарном диабете повышенный уровень глюкозы в крови способствует росту грибов, так как гипергликемия ослабляет функцию гранулоцитов. Гипофункция паращитовидных желез и надпочечников приводит к нарушению кальциево-фосфорного обмена, что вызывает скрытую спазмофилию пищевода, тем самым снижая его местные защитные возможности [9]. Нарушения нутритивного статуса из-за недостатка белка в организме и низкой калорийности пищи влияют на состояние иммунной системы и создают предпосылки для развития кандидоза [3]. К факторам риска заболевания кандидозом относится снижение кислотности желудочного сока (рН 7,4 является оптимальной для роста грибов Candida, а при сдвиге рН до 4,5 рост грибов полностью угнетается) [3, 4, 7].
Патологические проявления КП разнообразны. Сначала пораженные участки пищевода имеют вид отдельных беловатых или желтоватых очажков, приподнятых над слизистой оболочкой. Позднее эти очажки могут сливаться, образуя плотные налеты с внедрением гриба в подслизистую оболочку или псевдомембранозные наложения с проникновением гриба в мышечную оболочку и сосуды [9]. Пленки, образующиеся на слизистой пищевода в особенно тяжелых случаях, могут почти полностью закрывать просвет пищевода. Налет состоит из слущенных эпителиальных клеток, которые смешиваются с грибками, клетками воспаления и бактериями. Микроскопическое исследование позволяет выявить равномерно окрашенные дрожжеподобные клетки и нити мицелия грибов Candida [9]. Истинное язвообразование наблюдается нечасто и в большинстве случаев отмечается у иммуносупрессированных больных с гранулоцитопенией [29]. Иногда возникает некроз стенки пищевода и развивается флегмонозное воспаление пищевода и средостения, что может стать одной из причин смерти больного [1].
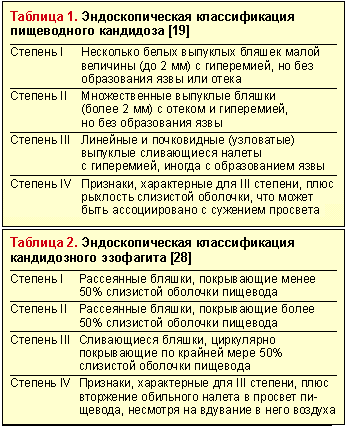
Существует морфологическая классификация, согласно которой все случаи КП подразделяются на три группы в зависимости от степени тяжести процесса, то есть в зависимости от глубины поражения его стенки: 1-я группа — отдельные беловатые налеты с внедрением псевдомицелия гриба между эпителиальными клетками; 2-я группа — пленчатые налеты, сливающиеся между собой и образующие обширные поля, при этом нити псевдомицелия прорастают не только слизистую, но и подслизистую оболочку; 3-я группа — псевдомембранозные наложения, сочетающиеся с глубокими изменениями, при которых нити гриба глубоко проникают в толщу мышечной ткани [10].
Клинические проявления и осложнения. Симптомы заболевания практически отсутствуют у 25-30% пациентов, страдающих КП, особенно у иммунокомпетентных лиц. Тем не менее большинство пациентов предъявляют жалобы, связанные с поражением желудочно-кишечного тракта. Наиболее типичные клинические проявления КП — дисфагия и несколько реже одинофагия. Степень выраженности пищеводных симптомов колеблется от умеренного затруднения при глотании до резко выраженной боли, результатом чего являются неспособность принимать пищу и развитие вторичной дегидратации. При тяжелой одинофагии возможно наличие других причин или коинфекции, особенно у больных со СПИДом. Гораздо реже больные могут жаловаться на загрудинные боли, не связанные с глотанием, изжогу, тошноту, иногда рвоту с выделением пленок (псевдомембран), снижение аппетита и веса, появление жидкого стула со слизью (см. рисунок) [4, 9, 29].
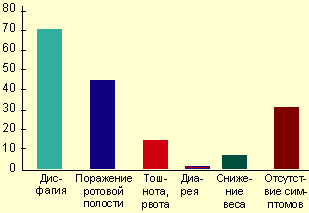 |
| Симптомы кандиозного эзофагита (R. S. Orlando, 1996) |
При КП может быть полезно физикальное исследование. Приблизительно две трети пациентов со
СПИДом и пищеводным кандидозом имеют кандидозный стоматит. КП наблюдается у больных с хроническим слизисто-кожным кандидозом, который относится к тяжелым формам кандидозной инфекции и чаще наблюдается при дисфункции надпочечников и околощитовидных желез [29].
Осложнения пищеводного кандидоза наблюдаются редко. Эзофагеальное кровотечение может наблюдаться при тяжелом течении болезни, сопровождающемся образованием эрозий, язв, и ассоциироваться с коагулопатией; возможно развитие перфорации. Описана вторичная обструкция просвета мицетомой. Редко возникает некроз с развитием флегмонозного воспаления пищевода и средостения [1]. В тяжелых случаях специфический эзофагит может осложниться развитием кандидамикозного сепсиса [6].
Диагностика. Подозрение на пищеводный кандидоз должно возникнуть у любого больного при наличии факторов риска развития пищеводной инфекции и жалоб на дисфагию и одинофагию. Наличие кандидозного стоматита подтверждает этот диагноз, но при его отсутствии поражение пищевода также не исключается.
Рентгенография пищевода с использованием бария обычно применяется для начальной оценки перед проведением эндоскопии. Однако на ранних стадиях кандидозного эзофагита рентгенологическое исследование пищевода не имеет большого диагностического значения, так как оно отражает лишь неспецифические изменения, общие для всех эзофагитов [2]. Классическими рентгенологическими признаками острого эзофагита, вызванного Candida spp., являются линейные или неправильной формы дефекты наполнения с четкими краями. При тяжелом течении кандидозного эзофагита происходит слияние повреждений, из-за чего большие дефекты наполнения иногда образуют скопления в виде гроздьев винограда [2]. Пищевод при этом приобретает «косматый» («ворсистый») вид, симулируя ульцерацию [25]. Наличие больших, хорошо очерченных язв не является признаком кандидозного эзофагита. Могут наблюдаться нарушение моторики и сужение просвета пищевода за счет псевдомембран. Следует помнить о том, что нормальная рентгенограмма пищевода с использованием бария не исключает пищеводного кандидоза. Из-за тяжелой одинофагии больной не сможет выпить барий, что затрудняет рентгеногрфию пищевода [29].
Более информативным для диагностики кандидозного эзофагита считается рентгенологический метод двойного контрастирования, эффективность которого достигает 70% [26].
Цитологическая щетка и баллонный катетер используются для быстрой диагностики пищеводных инфекций без эндоскопии. Эти инструменты могут быть легко введены через носовые ходы или рот сквозь защитный зонд, который предотвращает контаминацию. Материал, полученный на защищенной щетке или баллонном катетере после того, как они будут изъяты из пищевода, оценивается цитологически и культурально. Методика с использованием защищенных щеток имеет чувствительность 88% и специфичность почти 100% [26].
Цитологический метод предполагает окраску мазков-отпечатков или осадка смыва с цитологической щетки в поисках активных форм Candida — почкующихся дрожжевых клеток, псевдомицелия и мицелия. Культуральный метод предполагает помещение исследуемого материала на обогащенную глюкозой среду Сабуро или другие среды, чтобы затем по характеру образующихся колоний судить об этиологии инфекционного процесса в пищеводе.
Эндоскопическое исследование пищевода — наиболее чувствительный и специфический метод диагностики пищеводного кандидоза. Эндоскопическая картина КП характеризуется чаще всего наличием легко снимающихся фибринозных рыхлых наложений белого или желтого цвета, под которыми обнаруживается легкоранимая и/или отечная слизистая. Реже наблюдаются катаральный и эрозивно-язвенный эзофагит [19]. Candida spp. редко вызывает истинное язвообразование. Наличие язвы при кандидозном эзофагите нередко служит признаком дополнительного патологического процесса в пищеводе [29]. Существуют различные эндоскопические классификации пищеводного кандидоза (табл. 1 и 2).
В ходе эндоскопии пораженные участки слизистой могут быть подвергнуты щеточной биопсии для цитологического исследования или биопсии для гистологической диагностики. Когда эндоскопически идентифицируются язвы, многократное проведение биопсии помогает исключить наличие сосуществующих патологических процессов. Цитологическое исследование материала, полученного с помощью браш-биопсии, имеет более высокую ступень чувствительности, чем гистологическое исследование образцов биопсии при умеренном поверхностном кандидозе, потому что микроорганизмы могут быть вымыты с поверхности ткани при обработке биопсийного материала [19]. В редких случаях позитивная цитология при наличии отрицательной гистологии указывает на то, что речь идет скорее о колонизации, чем об инфекции. При более тяжелом кандидозном поражении пищевода наибольшее диагностическое значение имеет гистологическое исследование биоптатов слизистой с использованием специальной окраски на нейтральные мукополисахариды по Шиффу PAS (ШИК-реакция) или по Gomori гексаметилентетрамином серебра. Только гистологическое исследование демонстрирует инвазию мицелия или псевдомицелия гриба в глубь ткани пищевода.
Кожное тестирование и серологические тесты малоинформативны для диагностики пищеводного кандидоза.
Лечение. Существует множество пероральных и внутривенных медикаментов, которые используются для лечения кандидозного эзофагита. Несмотря на относительно широкий выбор препаратов, лечение КП является актуальной проблемой, так как некоторые лекарственные средства недостаточно эффективны, другие имеют серьезные побочные эффекты; кроме того, в настоящее время отмечается рост резистентности к антигрибковым препаратам.
При лечении КП первоначально должна быть назначена пероральная терапия, внутривенное введение используется лишь в случае рефрактерного течения заболевания или если имеются противопоказания к пероральному использованию медикаментов. Больным с умеренной степенью тяжести заболевания и минимальным нарушением иммунитета необходим сокращенный курс терапии с использованием системных абсорбируемых лекарственных препаратов типа орального азола. Иммунокомпрометированных больных после трансплантации и больных СПИДом с КП лучше лечить более длинными курсами азола. У пациентов с гранулоцитопенией, когда имеется существенный риск диссеминации Candida инфекции, оправданно использование внутривенных препаратов системного действия (азолов, амфотерицина B) [29].
Арсенал современных противогрибковых средств достаточно широк. Для лечения пищеводного кандидоза используют антигрибковые препараты нескольких групп. Наиболее эффективны препараты из группы азола. Перорально используют невсасывающиеся азолы (клотримазол, миконазол); однако более эффективны препараты системного действия из этой группы (кетоконазол, флуконазол и итраконазол). Эти препараты, подобно другим из группы азола, изменяют проницаемость клеточной мембраны грибов посредством цитохром P450 (CYP)-зависимого вмешательства в биосинтез эргостерола, что приводит к повреждению грибной клетки и ее смерти. Новые триазолы (итраконазол и флуконазол) имеют большее аффинное подобие, чем имидазолы (миконазол и кетоконазол) для грибных CYP-энзимов [14]. Хотя другие средства, такие, как миконазол, клотримазол и нистатин, могут быть использованы для лечения кандидозного стоматита, а также для профилактики пищеводного поражения, эти лекарственные средства менее эффективны в качестве основной группы препаратов для терапии КП [24].
Клотримазол и миконазол — препараты имидазолового ряда. В настоящее время выпускаются клотримазол в таблетках и миконазол для перорального применения. Однако они не всасываются в желудочно-кишечном тракте. Эти препараты могут использоваться при легком кандидозном поражении пищевода у лиц без иммунодефицита.
Кетоконазол (низорал, ороназол) является производным имидазола и при ежедневном приеме в дозе от 200 до 400 мг дает хороший эффект в лечении пищеводного кандидоза. У больных СПИДом, которым обычно требуются более высокие дозы кетоконазола, дневная доза может быть увеличена, если не возникает тошноты, до максимальной (800 мг). Кетоконазол хорошо проникает в различные органы и ткани, но плохо — через гематоэнцефалический барьер. Препарат хорошо всасывается в желудочно-кишечном тракте, но для оптимального всасывания требуется кислая среда. При желудочной гипохлоргидрии и использовании антацидных средств его биодоступность уменьшается. Для улучшения всасывания кетоконазол следует принимать за 2 часа до приема противоязвенных препаратов. Приблизительно у 10-25% больных СПИДом наблюдается снижение желудочной кислотной секреции. Кетоконазол же может вызвать временную блокаду синтеза тестостерона и кортизола [6, 8, 29].
Итраконазол (споранокс) относится к группе триазолов, подобно кетоконазолу, назначается в дозе 200 мг в день. Дальнейшее увеличение дозы удлиняет период полураспада препарата и повышает его эффективность. Всасывание интраконазола уменьшается при снижении pH желудочного сока [23]. Кетоконазол и итраконазол метаболизируются в печени и выделяются с желчью. Период полураспада этих двух препаратов составляет от 7 до 10 часов и от 24 до 42 часов соответственно [14]. Коррекции дозы у больных с почечной недостаточностью не требуется.
Флуконазол (дифлюкан, дифлазон, форкан, флюкостат — отечественный флуконазол) представляет собой водорастворимый триазол и назначается в дозе 100 мг в день. Флуконазол — это препарат, всасывание которого не зависит от pH желудочного сока и который значительно более эффективен при лечении пищеводного кандидоза при СПИДе, чем кетоконазол (200 мг ежедневно) [21]. Флуконазол доступен для перорального и внутривенного применения. Он минимально метаболизируется и выделяется неизмененным с мочой. Флуконазол отличается высоким тканевым тропизмом и не влияет на синтез андрогенов, хорошо проникает через гематоэнцефалический барьер. В отличие от кетоконазола и интраконазола он хорошо растворим в воде и минимально связывается белком. Препарат обладает длительным периодом полураспада (приблизительно 30 часов, если не нарушена функция почек, а наличие пищи или гипохлоргидрия не изменяют всасывание), что позволяет принимать его один раз в сутки. Показано, что введение флуконазола улучшает иммунные показатели по Т- и В-системам [18]. И флуконазол, и итраконазол можно принимать перорально в виде растворов. Эти формы могут быть более эффективны, чем таблетки, потому как усиливают локальный эффект и улучшают всасывание.
Неблагоприятные воздействия кетоконазола, флуконазола и итраконазола прежде всего зависят от дозировки и проявляются в виде тошноты, гепатотоксичности, замедления продукции стероидов и метаболизма циклоспорина [14]. В редких случаях кетоконазол может вызывать фатальный гепатит [12]. Незначительное увеличение аминотрансфераз — общий побочный эффект для всех трех препаратов, однако это не должно служить оправданием для их отмены. Влияние на стероидогенез наиболее выражено у кетоконазола. Обратимое замедление гонадального и надпочечного синтеза стероидов под воздействием кетоконазола может наблюдаться, когда доза превышает 400 мг в сутки [27]. В рекомендуемых дозах флуконазол и итраконазол не влияют на стероидогенез. В результате воздействия на печеночные микросомальные ферменты все три азола ингибируют метаболизм циклоспорина, что приводит к увеличению уровня циклоспорина в крови; этот эффект наиболее ярко выражен у кетоконазола [14].
Новейшим классом противогрибковых препаратов являются кандины, вмешивающиеся в синтез грибковой стенки. Они эффективны в отношении большинства видов Candida, в том числе C. krusei. Первые исследования показали, что капсофунгин, представляющий эту группу препаратов, оказался столь же эффективен при КП, как и амфотерицин В [16].
При лечении больных КП следует учитывать наличие резистентности, которая из-за широкого применения азолов в настоящее время значительно возросла. При развитии резистентности часто бывает полезно увеличить дозу азола. Если этого оказывается недостаточно, переходят на другой препарат из этой группы или используют пероральный раствор итраконазола [13], который нужно назначать в более высоких дозах из-за часто наблюдающейся перекрестной резистентности. Когда высокой дозы (то есть 400 мг ежедневно) флуконазола недостаточно, переходят на внутривенное введение амфотерицина B, при этом результат достигается в 90% случаев. Резистентность к амфотерицину наблюдается редко [29].
В табл. 3 представлено лечение кандидозного эзофагита в зависимости от функции лимфоцитов и гранулоцитов.
При лечении кандидозного эзофагита у больных СПИДом препаратами первого ряда являются кетоконазол и флюконазол, причем предпочтение следует отдавать флюконазолу. Из-за лучшей переносимости он прежде всего показан пациентам, находящимся на поздней стадии болезни, которые имеют много сопутствующих заболеваний. При нарушении глотания могут применяться парентеральные формы флуконазола. При неэффективности препаратов первого ряда используют лекарственные средства из группы резерва (амфотерицин В, итраконазол), которые более токсичные и/или более дорогие. Этиотропная терапия кандидоза пищевода, кроме основного курса лечения, требует проведения поддерживающего лечения, которое может быть пожизненным (табл. 4) [4].
Лечение кандидоза на фоне тяжелого иммунодефицита и лейкопении — задача сложная. Наряду с антигрибковой терапией актуально восстановление пула нейтрофильных лейкоцитов и их функциональной активности, так как нейтрофильные лейкоциты являются одним из основных звеньев механизма защиты от Candida spp. Предлагается в качестве дополнительного средства при лечении кандидозной инфекции на фоне нейтропении использовать гранулоцитарный колониестимулирующий фактор, который сокращает дефицит миелопероксидазы в нейтрофильных лейкоцитах и усиливает их кислородозависимую антикандидозную активность [7]. Получен хороший эффект от эндоскопического введения больным КП концентрата гранулоцитов и высокоинтенсивного импульсного лазерного излучения, что улучшает иммунные функции [5].
Таким образом, для достижения успеха у больных с тяжелыми грибковыми инфекциями, в том числе с кандидозом, целесообразен комплексный подход к диагностике и лечению. Повышению выживаемости будет способствовать оперативная диагностика с последующими подбором эффективной специфической противогрибковой терапии и проведением лечебных мероприятий, направленных на повышение числа гранулоцитов и стимуляцию фагоцитоза [16].
По вопросам литературы обращайтесь в редакцию