Что лучше энтеросгель или лактофильтрум при дерматите
Опыт применения энтеросорбентов в комплексном лечении атопического дерматита у детей
Распространенность аллергических заболеваний у детей остается высокой. Это подтверждается многочисленными клиническими наблюдениями и результатами эпидемиологических исследований.
Распространенность аллергических заболеваний у детей остается высокой. Это подтверждается многочисленными клиническими наблюдениями и результатами эпидемиологических исследований. В структуре аллергических заболеваний атопический дерматит занимает ведущее место. Атопический дерматит — системное аллергическое заболевание со сложным патогенезом и характерной возрастной эволюцией клинических проявлений. Характеризуется упорным течением, частыми обострениями и недостаточной эффективностью существующих методов лечения.
На протяжении многих лет совершенствовались и углублялись знания о природе заболевания, появлялись новые концепции патогенеза, менялась терминология. Согласно современной концепции в основе развития атопического дерматита лежат иммунологические механизмы и нарушения (дисфункция) эпидермального барьера. Основные патоморфологические изменения, возникающие при атопическом дерматите, происходят в эпидермисе, затрагивая дерму при тяжелом, непрерывно-рецидивирующем течении болезни.
В настоящее время сформировалась научная точка зрения, что атопический дерматит развивается под влиянием генетических и внешнесредовых факторов. Антигенная нагрузка на организм факторов экзогенного и эндогенного происхождения играет одну из важнейших ролей в механизмах развития заболевания.
К экзогенным факторам относятся разнообразные аллергены (пищевые, бытовые, клещевые, пыльцевые, грибковые, эпидермальные, лекарственные) и неспецифические стимулы (климат, стресс, курение, холод). Эндогенные факторы составляют патологические состояния, ассоциирующиеся с атопическим дерматитом. У 80–90% детей с атопическим дерматитом наблюдаются патологические изменения в желудочно-кишечном тракте, у 20–30% — в дыхательной системе и у 15–18% — в почках. Нарушение барьерной функции внутренних органов способствует более быстрому поступлению в организм экзоаллергенов. При длительном, непрерывно-рецидивирующем течении болезни у подавляющего большинства больных нарушаются процессы их элиминации. Происходит накопление в тканях и биологических жидкостях продуктов нарушенного метаболизма, повышается содержание желчных кислот, концентрация биологически активных веществ (гистамина, серотонина, эйкозаноидов, цитокинов и т. д.), образующихся в организме в процессе значительной антигенной стимуляции. Развивается синдром эндогенной интоксикации. Клинически синдром эндогенной интоксикации проявляется в виде мраморности кожи, акроцианоза, сероватого оттенка кожи, сухости и шелушения.
С целью детоксикации используется эфферентная терапия, направленная на выведение из организма аллергенов и токсинов. Наиболее эффективными из них являются сорбционные методы. В педиатрической практике наиболее часто используется метод энтеросорбции — метод, основанный на связывании и выведении из организма аллергенов, различных экзогенных и эндогенных соединений, патогенных микроорганизмов и продуктов их жизнедеятельности.
Энтеросорбция — это метод лечения, основанный на способности энтеросорбентов связывать и выводить из организма различные экзогенные вещества, микроорганизмы и их токсины, промежуточные и конечные продукты обмена веществ. Эти вещества способны накапливаться или проникать в просвет ЖКТ.
На фоне энтеросорбции происходит повышение функциональной активности клеточного и гуморального иммунитета, увеличивается число Т-лимфоцитов, уменьшается выраженность эозинофилии, снижается уровень циркулирующих иммунных комплексов, уменьшается зуд кожных покровов и отек, снижается частота и тяжесть приступов бронхиальной астмы.
Энтеросорбенты (ЭСБ) — препараты медицинского назначения, обладающие высокой сорбционной емкостью, не разрушающиеся в ЖКТ и способные связывать экзо- и эндогенные вещества путем адсорбции, ионообмена или комплексообразования.
Существенным является то, что сорбенты позволяют уменьшить дозу гормонов, а в некоторых случаях даже отменить.
В клинической практике используется широкий ассортимент сорбционных средств. Лечебный эффект сорбента достигается за счет физико-химических свойств сорбирующего вещества, способного связывать и выводить из организма экзогенные и эндогенные соединения. Решающую роль играет пористость, характеризующая наличием пор между зернами, слоями, кристаллами. Сорбенты могут иметь микропоры, мезопоры, макропоры. Поэтому выбор сорбента с разной пористой структурой влияет на адсорбцию тех или иных токсинов, что определяет терапевтический эффект сорбента.
Энтеросорбенты подразделяются по таким характеристикам:
К современным энтеросорбентам предъявляются следующие требования:
Особый интерес представляют сорбенты, в состав которых входит пребиотик. К таким средствам относится Лактофильтрум. Препарат содержит пребиотик (лактулозу) и сорбент (лигнин).
Свойства Лактофильтрума обусловлены высокой сорбционной способностью природного энтеросорбента на основе лигнина. Лигнин гидролизный — сложное природное органическое соединение, продукт гидролизной переработки древесины, энтеросорбент. Обладает неспецифическим дезинтоксикационным действием. Связывает, удерживает и выводит из организма различную патогенную микрофлору, экзо- и эндотоксины, лекарственные препараты, соли тяжелых металлов, алкоголь, аллергены, избыток некоторых продуктов обмена веществ (билирубина, холестерина, гистамина, серотонина, мочевины, иных метаболитов, ответственных за развитие эндогенного токсикоза). За счет большой площади поверхности и развитой системы пор лигнин обладает высокой сорбционной емкостью. Лигнин не токсичен, не всасывается, полностью выводится из кишечника в течение 24 часов.
Второй компонент Лактофильтрума — лактулоза — синтетический дисахарид, состоящий из остатка галактозы и остатка фруктозы. В толстом кишечнике лактулоза ферментируется нормальной микрофлорой кишечника в качестве пищевого субстрата. Лактулоза стимулирует рост бифидобактерий и лактобактерий в толстом кишечнике, способствует нормализации обмена белков, жиров и углеводов, правильному всасыванию витаминов, макро- и микроэлементов, а также стимулирует неспецифический иммунитет. В результате гидролиза лактулозы образуются органические кислоты (молочная, уксусная и муравьиная), подавляющие рост патогенных микроорганизмов и уменьшающие вследствие этого продукцию азотсодержащих токсических веществ. Описанный процесс приводит к увеличению осмотического давления в просвете толстого кишечника и стимулированию перистальтики. Лактулоза не усваивается человеческим организмом.
Преимущество Лактофильтрума в его двойном действии: сорбент нейтрализует патогенные микроорганизмы и выводит кишечные токсины, а пребиотик стимулирует рост полезной микрофлоры (бифидо- и лактобактерий). Комплексное воздействие компонентов Лактофильтрума приводит к формированию мощного защитного фактора — нормальной микрофлоры кишечника, ликвидации клинических проявлений дисбактериоза, более быстрому исчезновению симптомов аллергических заболеваний и к эффективной детоксикации организма.
Способ применения и дозы
Ниже представлен опыт применения Лактофильтрума в комплексной терапии детей с атопическим дерматитом. Под наблюдением находилось 36 детей в возрасте от двух до пяти лет (n = 26 — основная группа, n = 10 — контрольная группа). Мальчиков было 20, девочек — 16. Длительность заболевания колебалась от одного года до 4,5 лет. По тяжести заболевания: у 16 детей наблюдалось среднетяжелое течение болезни (индекс SCORAD = 38,4 ± 1,8 балла), у 10 больных тяжелое течение атопического дерматита (индекс SCORAD = 56,5 ± 1,5 балла). Группу сравнения составили 10 детей со среднетяжелым течением атопического дерматита, получавших только традиционную терапию.
У детей со среднетяжелым течением атопического дерматита кожный процесс был локализован в области лица, шеи с переходом на кожу предплечий и локтевых сгибах, на сгибательной поверхности лучезапястных суставов, тыла кистей и в подколенных ямках. Патологический процесс носил островоспалительный характер и был представлен гиперемией, отеком, очагами экссудации, экскориациями, корочками, шелушением. Кожа вне очагов поражения была сухой, со сниженным тургором и эластичностью. Отмечался зуд кожных покровов умеренной интенсивности.
У детей с тяжелым течением атопического дерматита процесс был распространенным, отмечалась яркая гиперемия и отечность, выраженные и обширные очаги экссудации, папулезные элементы, сливающиеся в очаги стойкой инфильтрации. Лихенификация была ярко выраженной, наблюдались глубокие линейные трещины, экскориации, серозно-геморрагические корочки. У всех больных наблюдался выраженный зуд, нарушение сна.
Лактофильтрум назначали внутрь 3 раза в день между приемами пищи (за 1–1,5 часа до или после еды или приема других лекарственных средств).
Возрастные дозировки: детям от трех до пяти лет по 1 таблетке 3 раза в день; а детям от двух до трех лет по 1/2 таблетки 3 раза в день. Длительность курса приема 2 недели.
Включение в комплексную терапию атопического дерматита, сопровождающегося синдромом эндогенной интоксикации, энтеросорбента Лактофильтрум позволило существенно уменьшить выраженность кожного процесса, зуда и сухости кожных покровов. При этом индекс SCORAD у детей основной группы уменьшился до 14,6 ± 2,1 и 28,4 ± 1,4 балла соответственно (рис. 1), в то время как у детей из группы сравнения не наблюдалось столь выраженного регресса кожных высыпаний.
У пациентов основной группы на фоне применения Лактофильтрума отмечалась нормализация имеющихся нарушений со стороны стула. Курсовое использование Лактофильтрума позволило сократить период обострения (рис. 2), продлить ремиссию заболевания в среднем на 4,6 ± 2,3 месяца у детей в основной группе по сравнению с больными из группы сравнения (2,9 ± 1,8 месяца).
Таким образом, включение в состав комплексной терапии детей с атопическим дерматитом препарата Лактофильтрум в возрастной дозе в течение 14 дней повышало клиническую эффективность лечения, способствуя более быстрому разрешению кожного процесса, что показывает не только положительный краткосрочный эффект, но и позитивные долгосрочные результаты. Препарат удобен для приема, не токсичен, не вызывает развитие побочных эффектов.
Литература
В. А. Ревякина, доктор медицинских наук, профессор
НИИ питания РАМН, Москва
Энтеросгель: особенности применения
Интоксикация – это состояние, которое хотя бы однажды испытывает любой человек. Причем отравление бывает не только экзогенным – спровоцированным несвежей пищей, повышенной дозировкой лекарства или злоупотреблением спиртными напитками. Токсины могут вырабатываться и самими организмом. К таковым относятся избыточные количества мочевины, билирубина, холестерина, жиров и других продуктов метаболизма.
Признаки интоксикации часто наблюдаются при острых респираторных инфекциях, аллергических реакциях, беременности у женщин. Природа отравлений необычайно широка, но в современной медицине присутствуют универсальные способы решения проблемы. Одним из таковых является «Энтеросгель» – энтеросорбент нового поколения.
Указана минимально возможная цена на товар в городе.
Цены на товар в разных аптеках отличаются.
Особенности и показания к приему «Энтеросгеля»
Что эффективнее – «Полисорб» или «Энтеросгель»?
Как принимать «Энтеросгель»?
Паста «Энтеросгель» полностью готова к употреблению, поэтому данная форма является наиболее популярной среди потребителей. Нужное количество препарата проглатывается и запивается большим количеством воды. Гель смешивается в ¼ стакана теплой кипяченой воды и тщательно размешивается.
После приема лекарство запивают чистой водой.
«Энтеросгель» при поносе
«Энтеросгель» при ротавирусе
Поможет ли «Энтеросгель» при похмелье?
Похмелье – это следствие алкогольной интоксикации, которая является прямым показанием к приему «Энтеросгеля».
Использовать препарат можно как во время приема алкоголя (для нейтрализации токсичности продуктов распада этилового спирта), так и по факту наступившего постинтоксикационного состояния.
Как выбрать пробиотики для кишечника: список препаратов
Правильное, сбалансированное содержание белков, жиров и углеводов является ключом к здоровью на долгие годы. Продукты не способны в полной мере обеспечить организм человека всем необходимым. Есть целый перечень лекарств, которые помогают держать себя в хорошей форме и не болеть от легкого дуновения ветра.
Предлагаем список лучших пробиотиков. Перед началом терапии рекомендуется проконсультироваться с врачом, чтобы исключить наличие противопоказаний и правильно рассчитать дозировку.
Полезные свойства
Пробиотики – живые микроорганизмы, которые могут принести пользу человеку. В большинстве случаев это бактерии, но могут быть и другие представители микробов (например, дрожжи). Пробиотики несут пользу для кишечника, нормализуя микрофлору и устраняя дисбактериоз.
Нормы и различные вариации
Пробиотики колонизируют кишечник полезными бактериями, противодействуют патогенной (вредной) флоре, вызывающей запор или диарею, повышают иммунитет.
Основную массу бактерий – пробиотиков можно разделить на 2 вида: лакто- и бифидобактерии. В каждом из них существует значительное количество подвидов. Они оказывают то или иное благотворное влияние на организм человека.
Отклонения от нормы
Чем отличаются пробиотики от пребиотиков?
Могут ли навредить пробиотики?
Пробиотики практически не имеют противопоказания. Не рекомендуется принимать при онкологических заболеваниях, поражении лимфатический и кровеносной системы, ВИЧ. С осторожностью рекомендуется принимать в период беременности и лактации. Маленьким детям допустимо давать только те препараты, которые не имеют возрастных ограничений.
Как выбрать пробиотики для кишечника?
Лучшие пробиотики для восстановления кишечника может посоветовать только врач. Должны быть учтены основные критерии: возраст пациента, состояние организма, характер дисфункций, противопоказания и пр. Самолечение может не дать должного результата и привести к развитию проблем со здоровьем.
В список препаратов включены лучшие пробиотики для восстановления микрофлоры кишечника. Рейтинг основан на эффективности, безопасности и соотношении цена-качество.
№1 – «Нормофлорин-Д» (Бифилюкс, Россия)
Биологически активная добавка разработана на основе лактобактерий и их метаболитов. Используется в комплексном лечении язвы двенадцатиперстной кишки и желудка, при ожирении и метаболическом синдроме. Назначается после антибактериальной терапии для восстановления нарушенного микробиоценоза.
Производитель: Бифилюкс, Россия
№2 – «Бифиформ» (Ferrosan, Дания)
Противодиарейный препарат регулирует равновесие микрофлоры кишечника. Содержит Bifidobacterium longum и Enterococcus faecium. МИБП-эубиотик назначается при непереносимости лактозы, для восстановления микрофлоры кишечника и для лечения хеликобактерной инфекции в составе комплексной терапии.
Производитель: Ferrosan [Ферросан], Дания
№3 – «Линекс» (Lek d. d., Словения)
Находится в первых рядах списка пробиотиков для кишечника. Основные активные компоненты этого препарата стимулируют изменение рН путем брожения лактозы. Это тормозит развитие патогенных и условно-патогенных микроорганизмов и создает благоприятные условия для пищеварительных ферментов.
Активные вещества, входящие в «Линекс» устойчивы к антибиотикам. Они оказывают влияние не только на нижние отделы кишечника, но и на верхние (этими свойствами обладают далеко не все пробиотики). Многокомпонентное средство, пригодно практически для всех пациентов, включая детей (даже тех, кто находится на искусственном питании).
Производитель: Lek d. d. [Лек д.д.], Словения
№4 – «Хилак Форте» (Merckle, Германия)
Комбинированный препарат для нормализации кислотности желудка в соответствии с физиологической нормой. Биологически восстанавливает микрофлору кишечника. Таким образом, создает неблагоприятную среду для жизнедеятельности патогенных и условно-патогенных бактерий.
Производитель: Merckle [Меркле], Германия
№5 – «Линекс Форте» (Sandoz, Словения)
Пробиотик регулирует равновесие микрофлоры кишечника. Разработан на основе молочнокислых живых бактерий, которые представляют собой составляющие естественной микрофлору. Широко используется при дисбактериоза, запорах и хеликобактериозе у детей и взрослых.
Производитель: Sandoz [Сандоз], Словения
№6 – «Бифидумбактерин» (Ланафарм, Россия)
Лучший пробиотик для восстановления микрофлоры, который устойчив ко многим лекарственным средствам и антибиотикам. «Бифидумбактерин» является антагонистом достаточно широкого спектра болезнетворных и условно болезнетворных микроорганизмов. Выпускается в форме ректальных суппозиториев и капсул.
Эффективность препарата обусловлена сильной концентрацией бифидобактерий. Быстро нормализует микрофлору кишечника, которая, будучи естественной, накапливает токсические вещества (как поступающие в организм извне, так и находящиеся в нем) и разлагает их на нетоксичные компоненты. Нельзя давать детям, страдающим непереносимостью молочных продуктов.
Производитель: Ланафарм, Россия
№7 – «Бак-Сет Форте» (Probiotics International, Великобритания)
Мульти-пробиотик нового поколения, который включает в состав 14 видов пробиотических живых бактерий. Они дополняют действие друг друга, устраняя проблемы с пищеварением у детей от 3-х летнего возраста и у взрослых. Усовершенствованная микрокапсулированная технология способствует сохранению полезных свойств бактерий на протяжении всего срока хранения препарата.
Производитель: Probiotics International [Пробиотикс Интернейшенал], Великобритания
№8 – «Бифиформ Баланс» (Pfizer, Россия)
Один из лучших пробиотиков для восстановления микрофлоры кишечника. разработан на основе лакто- и бифидобактерий. Биологически активная добавка к пище назначается для лечения дисбактериоза различной этиологии и поддерживает микрофлору кишечника. Способствует коррекции функциональных нарушений желудочно-кишечного тракта.
Производитель: Pfizer [Пфайзер], Россия
№9 – «Флорин Форте» (Партнер, Россия)
Лакто- и бифидобактерии, входящие в состав, принимают участие в процессах синтеза аскорбиновой кислоты, калия, витаминов группы В. В результате повышается устойчивость к агрессивным воздействиям окружающей среды. Также действующие компоненты участвуют в обменных процессах желчных кислот и пигментов. В их присутствии происходит синтез веществ, оказывающих антибактериальное действие. Также препарат повышает иммунную-реактивность человеческого организма.
Производитель: Партнер, Россия
№10 – «Бактериофаг» (Микроген НПО, Россия)
Стафилококковый раствор входит в список лучших пробиотиков для кишечника для взрослых и детей. Используется преимущественно в составе комплексной терапии с антибактериальными препаратами и другими лекарственными средствами.
Производитель: Микроген НПО, Россия
№11 – «Секстафаг» (Микроген НПО, Россия)
Завершает список препаратов пробиотиков для кишечника. Иммунобиологический препарат специфически лизирует бактерии стрептококков и стафилококков, протеи, кишечной и синегнойной палочки. Назначается при энтеральных и гнойно-воспалительных заболеваниях. При необходимости может быть использован в составе комплексной терапии.
Производитель: Микроген НПО, Россия
Пробиотические средства нормализуют процессы пищеварения, активируя перистальтику кишечника и восстанавливая микрофлору. Препараты способствуют синтезу полиаминов, укрепляют клеточный цитоскелет и регенерируют кишечный эпителий, повышая защитные функции организма. Они не только уменьшают газообразование, н и тормозят рост вредоносных микроорганизмов.
Какие пробиотики принимать в том или ином случае может посоветовать врач. Специалист отталкивается от показаний и общего состояния организма пациента, исключая развитие передозировки или побочных реакций.
Энтеросорбция в лечении атопического дерматита у детей
Атопический дерматит (АД) у детей в последние годы приобретает все большее медико-социальное значение, так как его распространенность неуклонно растет, составляя в различных странах мира от 6% до 25%, а в России &md
Атопический дерматит (АД) у детей в последние годы приобретает все большее медико-социальное значение, так как его распространенность неуклонно растет, составляя в различных странах мира от 6% до 25%, а в России — до 35%. Существенно изменился патоморфоз АД у детей: отмечено более раннее появление первых признаков заболевания у детей c 1–2-месячного возраста (по нашим данным в 47% наблюдений); увеличилась частота тяжелых форм АД с расширением площади поражения кожи; возросла доля больных с хроническим рецидивирующим течением, торпидным к традиционной терапии.
Факторы риска. По современным представлениям АД — мультифакториальное заболевание, формирование которого тесно связано с генетическими дефектами иммунного ответа и отрицательными влияниями неблагоприятных факторов внешней среды. Причем сочетанное действие этих факторов определяет темпы развития АД, особенно у детей раннего возраста [4].
Ведущим фактором риска развития АД у детей является, прежде всего, наследственная предрасположенность к аллергии (82% наблюдений), которая проявляется изменениями системных механизмов наследования, связанными как с особенностями генетически запрограммированного иммунного ответа на антиген, так и с нарушениями генетического контроля продукции цитокинов, особенно интерлейкина-4 (ИЛ-4), что сопровождается повышением продукции IgЕ, специфической реакцией на определенный аллерген и генерализованной гиперчувствительностью [5].
В реализации наследственной предрасположенности особую роль играет высокий уровень антигенной нагрузки на плод (57%), связанной с патологическим течением беременности и родов, с нарушениями питания матери во время беременности и лактации; курением, поздним прикладыванием к груди, c ранним искусственным вскармливанием, а также с ранним введением прикорма и продуктов, не соответствующих возрасту ребенка [5, 6]. Несомненна роль таких факторов, как частые вирусные и паразитарные инфекции и наличие очагов хронической инфекции у детей (56%) [6]. Доказана значимость нарушений функционального состояния центральной и вегетативной нервной систем, которые контролируют активацию иммунокомпетентных клеток и механизмы зуда посредством специфических нейропептидов. Установлено значение аутоаллергенов, освобождающихся из воспалительно-измененных тканей, особенно при расчесывании, которые поддерживают иммунный ответ, первично вызванный аллергенами окружающей среды.
Существенным фактором риска АД являются также нарушения экологии, среды обитания и микроокружения ребенка, которые могут усиливаться «современными стандартами жизни» [1, 7]. Большое значение имеет также органическая и функциональная патологии различных органов и систем желудочно-кишечного тракта (ЖКТ) — ферментопатии, хеликобактерная инфекция, нарушения микробиоценоза кишечника. Возникающие при этом нарушения вызывают повреждения пищеварительного барьера слизистой оболочки ЖКТ, что сопровождается снижением активности факторов неспецифической защиты, уменьшением продукции секреторного IgA, способствует повышенному накоплению гистамина, кининов, провоспалительных цитокинов, приводит к увеличению проницаемости слизистой оболочки для аллергенов и их усиленному всасыванию, что является одним из значимых пусковых механизмов сенсибилизации и реализации аллергического воспаления в коже [5, 7].
В последние годы особенное внимание уделяется дисбиозу кишечника как фактору формирования АД, так как нормальная микрофлора кишечника играет важнейшую роль в становлении иммунной системы ребенка и обладает протективным действием в формировании атопии. Показано, что ранние нарушения микрофлоры кишечника у младенцев вызывают дефицит специфических микробных штаммов, обеспечивавших в норме защиту от избыточной антигенной сенсибилизации, путем повышенной продукции таких цитокинов, как ИЛ-10 и трансформирующий фактор роста бета (TФР-бета) [8]. Эта концепция была подтверждена после того, как было установлено, что перинатальное и постнатальное системное назначение пробиотической флоры, особенно Lactobacillus rhamnosus, привело к 50% снижению развития АД у детей группы риска [8].
У 86% детей с АД нами были выявлены различные формы патологии ЖКТ. При этом абдоминальный синдром разной степени выраженности был установлен у 78% больных АД. Патология гастродуоденальной зоны выявлялась в 68% наблюдений: симптомы желудочной диспепсии (отрыжка, изжога, тошнота, рвота) отмечались у 45%, а симптомы кишечной диспепсии (метеоризм, запоры, жидкий стул) — у 39% больных АД. Патология гепатобилиарной системы у больных АД была выявлена в 42%, патология поджелудочной железы — в 51%, а дисбиоз кишечника — в 82% наблюдений у больных АД [9].
Ведущими причинно-значимыми аллергенами при АД являются пищевые аллергены, особенно у детей первого года жизни (99% случаев). По существу, пищевая аллергия является стартовой сенсибилизацией, на фоне которой путем перекрестных реакций формируется гиперчувствительность к другим аллергенам. Частыми пищевыми аллергенами по нашим данным являются белки коровьего молока (84%), куриное яйцо (91%), рыба (52%), глютен (40%), говядина (36%), бананы (32%), злаковые (27%), соя (26%) [5]. Однако доминирующая роль пищевой аллергии постепенно уменьшается с ростом ребенка, но увеличивается значимость аэроаллергенов, прежде всего бытовых (38%), эпидермальных (35%), пыльцевых (32%), бактериальных (20%) и грибковых (15%) аллергенов [1, 9].
Патогенез. В основе патогенеза АД лежат иммунные механизмы с ведущей ролью Т-лимфоцитов и клеток Лангерганса. Причем клетки Лангерганса являются основными клетками, ответственными за IgE-опосредованное накопление аллергенов в коже и их презентацию Т-лимфоцитам. Их количество у больных АД значительно выше, чем у здоровых. В этом видят одну из главных причин преимущественного поражения кожи при АД. Клетки Лангерганса играют важную роль в поддержании низкого уровня митотической активности кератиноцитов и инициируют апоптоз, ограничивающий их пролиферацию. Получив информацию, клетки Лангерганса перемещаются в лимфатические узлы, где вступают во взаимодействие с Th0-лимфоцитами, что способствует активации Т-хелперов и усилению дифференцировки их в сторону Th2-лимфоцитов [9, 11]. Этот процесс сопровождается выделением цитокинов. Th2-лимфоциты продуцируют ИЛ-4, ИЛ-5, ИЛ-10, ИЛ-13 и способствуют активации В-лимфоцитов с локальной гиперпродукцией специфических IgE. Преобладание в среде цитокинов ИЛ-4 и ИЛ-13 способствует увеличению числа Th2-клеток и переключению В-клеток на продукцию IgE. При этом уменьшается продукция гамма-интерферона и активность Th1-лимфоцитов. В то же время антиген может соединяться и с рецепторами IgE тучных клеток, которые продуцируют ИЛ-4, ИЛ-5, эозинофильный хемотаксический фактор, а также гистамин и триптазу. При повторном поступлении аллергена происходит дегрануляция тучных клеток с выделением медиаторов воспаления и хемотаксических агентов, которые запускают раннюю фазу аллергической реакции, клинически проявляющуюся выраженным зудом, гиперемией, отеком. Под действием ИЛ-5, ИЛ-6, ИЛ-8 происходит усиление миграции эозинофилов и макрофагов в воспалительный очаг, что определяет темпы хронизации аллергического воспаления кожи. В этом процессе особое значение имеют эозинофилы-долгожители, которые менее подвержены апоптозу, продуцируют высокие уровни основного белка эозинофилов, что способствует активации Th1-лимфоцитов с преимущественной продукцией интерферона-гамма [9, 11]. Наряду с иммунными механизмами в патогенезе АД имеют значение повреждения рогового слоя эпидермиса и водно-липидной пленки в результате аллергического воспаления. Патофизиология АД заключается в том, что в результате аллергического воспаления кожи у детей снижаются ее барьерные функции и увеличивается склонность к вторичному инфицированию, так как существенное увеличение трансэпидермальных потерь воды приводит к патологической сухости и усилению зуда кожи, нарушениям физиологической десквамации эпидермиса с утолщением рогового слоя и выраженным шелушением.
Вместе с тем нужно отметить, что многие механизмы повреждений кожи при АД еще недостаточно изучены. В частности, не ясно, почему у детей грудного возраста проявления АД бывают только на лице или могут иметь распространенный характер, а у детей старшего возраста отмечается преимущественно складчатый характер поражений кожи.
Клиника АД у детей проявляется зудом кожи, возрастной морфологией высыпаний (папулы, везикулы, экссудация, лихеноидные папулы, экскориации), типичной локализацией, возрастной стадийностью и хроническим течением. Обычно манифестация АД происходит на первом году жизни. В своем развитии болезнь проходит три стадии, которые могут быть разделены периодами ремиссии или могут переходить одна в другую [1, 10].
Младенческая стадия АД развивается у детей в возрасте до двух лет и в 70% случаев характеризуется наличием выраженной экссудации и мокнутия с развитием острого воспаления кожи в виде эритемы, отека, высыпаний в виде папул и микровезикул (так называемая экссудативная форма). Эти проявления локализованы чаще всего на лице или имеют распространенный характер с поражением кожи туловища и конечностей. Для 30% больных характерны гиперемия, инфильтрация и легкое шелушение кожи без экссудации — это проявления эритемато-сквамозной формы АД.
Детская стадия АД выявляется у детей от 2 до 13 лет и проявляется складчатым характером поражения кожи, ее утолщением, гиперкератозом, наличием эритематозных папул. Затем формируются лихеноидные папулы и очаги лихенификации с типичной локализацией в складках кожи, характеризующие лихеноидную форму АД. У 52% детей в этой стадии АД характерно поражение лица (атопическое лицо), проявляющееся гиперпигментацией, шелушением кожи век, вычесыванием бровей, явлениями хейлита.
Подростковая стадия АД у детей старше 13 лет характеризуется резко выраженной лихенизацией, сухостью и шелушением, преимущественными поражениями кожи лица, верхней части туловища и непрерывно рецидивирующим течением [10].
По распространенности различают: ограниченный АД — с локализацией преимущественно на лице и площадью поражения кожи не более 5%; распространенный АД — с площадью поражения 5–50%; диффузный АД — с обширным поражением кожи более 50% [10].
По степени тяжести АД выделяются следующие варианты течения:
Выделяют также три фазы течения АД: острое, подострое и хроническое течение.
Лечение АД у детей является одной из сложных задач для врача-педиатра, терапия должна быть патогенетической, комплексной и направленной на ограничение и уменьшение воспалительного процесса в коже [1, 9].
Основными направлениями лечения АД являются:
В острый период АД у детей, особенно при его осложненном течении, при быстрой манифестации процесса и раннем поступлении больного ребенка в клинику, рекомендуются мероприятия по выведению аллергенов и продуктов аллергической реакции из организма. Среди них важнейшим является проведение энтеросорбции.
Энтеросорбция является неинвазивным методом связывания и выведения из организма аллергенов, медиаторов, продуктов аллергической реакции, метаболитов, токсинов, активных перекисных соединений, условно-патогенной флоры и вирусов. Энтеросорбция осуществляется введением в полость кишечной трубки различных твердых или жидких соединений естественного или искусственного происхождения, обеспечивающих поглощение, связывание и удаление экзогенных и эндогенных токсинов, и направлена на детоксикацию организма и восстановление его реактивности. При этом используются как прямые (непосредственные), так и опосредованные эффекты энтеросорбции.
Прямые эффекты энтеросорбции обеспечиваются различными физико-химическими механизмами (адсорбции, абсорбции и хемосорбции, ионообмена и комплексирования), протекающими на активной поверхности различных пористых систем при движении энтеросорбента в просвете кишки. При этом молекулы небольшого размера сорбируются преимущественно в микропорах с радиусом менее 1,5 нм, молекулы средней и высокой массы поглощаются мезопорами с радиусом от 1,5 до 200 нм, а субклеточные надмолекулярные структуры и клетки сорбируются в макропорах с радиусом более 200 нм.
Опосредованные эффекты энтеросорбентов обеспечивают ослабление и предотвращение аллергического воспаления, профилактику эндо- и экзотоксикозов, уменьшение метаболической нагрузки на выделительную систему, коррекцию обменных процессов и иммунного статуса больного ребенка, восстановление целостности и проницаемости слизистых оболочек, улучшение функционального состояния кишечника.
Энтеросорбенты классифицируются по следующим параметрам [1, 10]:
Неселективные энтеросорбенты являются универсальными, поскольку они обладают способностью связывать различные по свойствам вещества. Основной их недостаток заключается в том, что эти сорбенты могут влиять и на жизненно необходимые для организма процессы — обмен микроэлементов и витаминов.
Особенностью селективных энтеросорбентов является их способность эффективно осуществлять детоксикацию организма, т. е. извлекать из химуса и содержимого желудочно-кишечного тракта токсичные или потенциально опасные соединения и метаболиты — бактериальные токсины, аллергены, биологически активные вещества и не сорбировать микроэлементы и электролиты.
Процессы сорбции осуществляются четырьмя основными путями. Первый из них — это адсорбция, представляющая собой взаимодействие между сорбентом и сорбатом на границе раздела сред. Адсорбенты имеют пористую основу, которая способствует накоплению и фиксации в порах веществ за счет их физико-химических свойств. Это приводит к снижению концентрации сорбируемых веществ в окружающей среде, т. е. в просвете желудочно-кишечного тракта. Второй путь — это абсорбция, которая состоит в поглощении сорбата всем объемом сорбента, т. е. имеет место растворение вещества. Третий путь — ионообмен, когда происходит замещение ионов на поверхности сорбента ионами сорбата (ионообменные смолы). Четвертый путь сорбции — комплексообразование, являющееся сложным комбинированным процессом нейтрализации, транспорта и выведения из организма антигенов, продуктов метаболизма (билирубин) и др.
Сравнительная характеристика современных энтеросорбентов, использующихся в клинической практике, представлена в таблице. Представленные данные свидетельствуют, что Энтеросгель является единственным высокоселективным энтеросорбентом, имеет широкий диапазон и наиболее высокий коэффициент избирательности сорбции.
При выборе препарата врачу необходимо учитывать следующие требования к имеющимся энтеросорбентам: высокая эффективность сорбции при полной безвредности и нетоксичности; хорошая биосовместимость с тканями; высокая сорбционная емкость по отношению к удаляемым компонентам; селективная сорбция среднемолекулярных токсических метаболитов; отсутствие повреждающего действия на слизистые оболочки желудка и кишечника; отсутствие воздействия или позитивное влияние на процессы секреции и микробиоценоз кишечника; удобная фармацевтическая форма.
Как показано в таблице, этим требованиям в полной мере соответствует единственный селективный энтеросорбент — Энтеросгель, обладающий следующими свойствами:
Основными показаниями к назначению энтеросорбентов у детей, страдающих АД, являются обострение течения основного заболевания, наличие сопутствующей патологии органов ЖКТ, тяжелое течение АД с выраженной интоксикацией, осложненные инфекцией формы АД, а также формирование АД у детей, проживающих в экологически неблагополучных регионах.
В ходе клинических исследований нами было установлено, что наиболее эффективным при лечении АД у детей является использование Энтеросгеля как активного селективного сорбента с выраженным цитопротективным действием. Механизм терапевтического воздействия этого препарата при АД непосредственно определяется сорбцией пищевых аллергенов, гистамина, серотонина, эндотоксинов различной природы, циркулирующих иммунных комплексов, бактериальных антигенов, адгезией патогенной флоры и нормализацией микробиоценоза кишечника у детей.
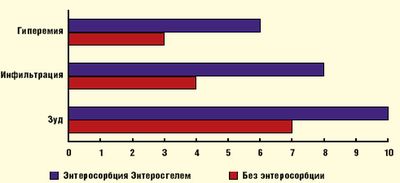
По нашим данным высокоэффективно использование Энтеросгеля у детей, страдающих АД, при сочетанном поражении кожи и гастроинтестинального тракта, а также при осложненном различными инфекциями течении АД. При этом купирование симптомов со стороны кожи происходит значительно быстрее, чем при обычных методах терапии: гиперемия и инфильтрация кожи значимо уменьшаются на 3–4 сутки курсового лечения Энтеросгелем, зуд кожи существенно ослабляется к 7 дню терапии (рис. 1).
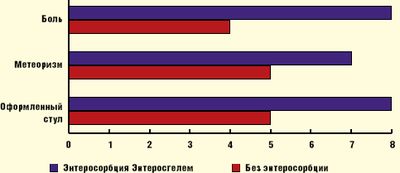
Собственный опыт применения Энтеросгеля в комплексном лечении АД у детей выявил также его существенное позитивное влияние на функциональное состояние желудочно-кишечного тракта: болевой синдром, метеоризм и стул нормализовались на 4–5 сутки курсового лечения, что указывает на высокую эффективность этого энтеросорбента (рис. 2).
Способ применения и рекомендуемые дозы Энтеросгеля представлены на рис. 3. Принимать Энтеросгель следует внутрь 2 раза в сутки за 1,5–2 часа до еды (утром натощак) и/или через 2 часа после ужина и приема лекарств. Способ приготовления Энтеросгеля для маленьких детей — разведение в теплой кипяченой воде в соотношении 1:10. Продолжительность приема Энтеросгеля при АД у детей — до 2–4 недель.
Таким образом, энтеросорбция является эффективным и безопасным методом комплексной терапии АД у детей. Она позволяет в более короткие сроки купировать обострение аллергического процесса, существенно улучшить течение основного заболевания, сопутствующей патологии и предупредить формирование осложнений. Применение Энтеросгеля у детей, страдающих АД, показало его выраженную клиническую эффективность, обусловленную высокой селективностью, нетоксичностью, значимым цитопротективным действием и, что особенно важно в педиатрической практике, удобной фармацевтической формой препарата, позволяющей использовать его в течение длительного времени при отсутствии отрицательных органолептических свойств.
Очевидно, что энтеросорбция, как и другие способы лечения аллергической патологии у детей, будет совершенствоваться по различным направлениям. На современном этапе эволюции технологических возможностей создания энтеросорбентов Энтеросгель, несомненно, занимает ведущее место среди конкурирующих неинвазивных средств детоксикации и метаболической коррекции функционального состояния детей и подростков.
Литература
Г. И. Смирнова, доктор медицинских наук, профессор ММА имени И. М. Сеченова, Москва
.jpg)
.jpg)