Что лучше лидаза или лонгидаза при пневмонии
От лидазы к лонгидазе
Российские ученые нашли эффективный и безопасный способ лечить многие, мучающие человечество, болезни.
Речь идет о лечении болезней, связанных с гиперплазией соединительной ткани (увеличением объема ткани в результате новообразования клеток). Гиперплазия опасна тем, что вызывает осложнения при заболеваниях бронхов и легких, почек и мочевыводящих путей, простаты, женских половых органов, желудочно-кишечного тракта и рубцовой деформации кожи.
Обычно гиперплазию лечат ферментными препаратами, наиболее распространенный из которых – Лидаза (действующее вещество гиалуронидаза). Гиалуронидаза, воздействуя на гиалуроновую кислоту – субстрат соединительной ткани – увеличивает проницаемость тканевых барьеров, облегчает движение жидкости в межклеточном пространстве, в результате чего уменьшается отечность тканей, рассасывается воспалительный экссудат, повышается эластичность ткани.
Однако эти ферментные препараты обладают низкой эффективностью из-за своей неустойчивости после попадания в организм, требуют ежедневного введения, часто вызывают аллергические реакции вплоть до анафилактического шока.
Исследователи из Института иммунологии РАМН и российской компании Петровакс Фарм разработали оригинальный новый препарат, лишенный этих недостатков. Оригинальность разработки заключается в том, что исходными компонентами нового препарата Лонгидазы являются все тот же фермент гиалуронидаза и синтетический биополимер полиоксидоний, также ранее разработанный в Институте иммунологии. Полиоксидоний является эффективным иммуномодулятором и выполняет роль матрицы (с химической точки зрения) или носителя для других биомолекул – физиологически-активных веществ.
Именно на основе полиоксидония была разработана российская вакцина от гриппа Гриппол. Теперь же его химически соединили с ферментом гиалуронидазой, так что получился принципиально новый препарат – физиологически активный комплекс, эффективность лечения которым врачи-клиницисты оценивают как прорыв в борьбе с заболеваниями, связанными с гиперплазией соединительной ткани.
Новый препарат является рецептурным и его применение возможно только под строгим врачебным контролем.
Автор: Татьяна Зимина
Источник: «Наука и Жизнь»
Выбор читателей
Почему женщины стареют хуже мужчин
Гены, сохраняющие здоровье пожилым мужчинам, вредят пожилым женщинам.
7 чудеса света: семь и другие
Когда кто-то, увидев нечто его поразившее, привычно произносит: «Это же восьмое чудо света!», — окружающие прекрасно понимают: в смысле, что замечательно и потрясающе.
«Однако» в запятых или без
«Но, однако, меня ужасно мучит шведская спичка» (А. П. Чехов).
Гиалуронидаза и Лонгидаза ® : в чём отличия?
Гиалуронидаза — общее название для группы ферментов, расщепляющих кислые мукополисахариды.
Гиалуронидазой называют целую группу ферментов, поэтому у нее нет единого химического состава. К этой группе относят все вещества, способные расщеплять кислые мукополисахариды, и тем самым увеличивающие проницаемость соединительных тканей.
Лонгидаза ® — оригинальный препарат, основное действующее вещество которого — фермент гиалуронидаза, связанный с высокомолекулярным носителем. Поэтому лекарство действует эффективнее чистого фермента с меньшим количеством нежелательных реакций и при этом долго сохраняет свою активность.
Историческая справка о гиалуронидазе
Впервые о свойстве некоторых ферментов расщеплять мукополисахариды заговорили в 1928 году. Тогда Ф. Дюран-Рейналь выяснил, что экстракт из семенников быка может увеличивать проницаемость тканей. Впоследствии это открытие вызвало интерес, и тема ферментов продолжила активно развиваться:
В 1931 году
фактор распространения — первичное название группы ферментов — был выделен из сперматозоидов;
В 1936–37 годах
Карл Мейер с сотрудниками доказали способность ферментов разрушать полисахаридные кислоты, и показали, что их действие аналогично воздействию автолитического фермента бактерий рода Стрептококки;
В 1949 году
Карл Мейер ввел термин гиалуронидаза для обозначения группы ферментов, способных расщеплять кислые мукополисахариды.
В дальнейшем действие фермента активно изучали многие специалисты. Появились препараты, которые увеличивают биодоступность лекарственных средств за счет улучшения проницаемости тканей.
Препараты с гиалуронидазой
Положительные свойства группы ферментов послужили отправной точкой для создания целого ряда препаратов. Самый распространенный из них — чистый фермент с международным наименованием hyaluronidase.
Некоторые из них используют в косметологии, некоторые — в медицине. Большая часть препаратов предыдущего поколения предназначена для ликвидации посттравматических рубцов, послеоперационных швов, уменьшения воспаления и увеличения биодоступности других лекарств в виде инъекций или капельниц.
Применение гиалуронидазы
В косметологии
Основное применение гиалуронидазы в косметологии — устранение дефектов, вызванных инъекциями гиалуроновой кислоты. Ее используют для коррекции овала лица — например, увеличивают губы или корректируют носогубный треугольник. Гиалуроновая кислота также стимулирует естественные процессы омоложения и замедляет старение. Раньше, до выявления целебных свойств фермента, недовольные результатами «уколов красоты» ждали 6–12 месяцев: в течение этого времени наполнитель рассасывается сам. Теперь ждать не надо — в место, откуда нужно вывести гиалуроновую кислоту, делают инъекции фермента гиалуронидазы. Она стимулирует активный распад и выведение вещества. Если не вдаваться в описание сложных химических процессов, фермент приводит к разрушению молекулярных связей гиалуроновой кислоты — ее длинные отрезки распадаются на более короткие и безболезненно выходят из организма. Весь процесс занимает около 48 часов — через двое суток можно оценить видимый эффект.
В медицине
Применение фермента в медицине более разнообразно. Его используют для лечения различных заболеваний, сопровождающихся активным ростом соединительной ткани и воспалением. Например, с помощью фермента гиалуронидазы лечат спайки в маточных трубах, воздействуют на очаг воспаления при воспалительных заболеваниях органов малого таза у мужчин и женщин, эндометриозе, вторичном бесплодии, усиливают действие антибиотиков при многих заболеваниях и др. В числе показаний к применению — контрактуры суставов, склеродермия, гематомы и другие заболевания и патологии. Гиалуронидаза улучшает трофику тканей и их проницаемость, повышает эластичность рубцовоизмененных участков, увеличивает подвижность суставов и облегчает движение жидкости в межтканевом пространстве, поэтому способствует снижению отеков.
Показания к применению гиалуронидазы
Противопоказания к применению гиалуронидазы
Возможные побочные эффекты от приема гиалуронидазы
Медицинская практика показывает, что ферменты гиалуронидазы могут вызывать побочные эффекты. Часто пациенты сталкиваются с разнообразными аллергическими реакциями, включая анафилактоидные. В большей части случаев возникает местная аллергическая реакция от инъекций — например, покраснение или выраженные очаговые эритематозные пятна.
Историческая справка о препарате Лонгидаза ®
Лонгидаза ® — инновационный ферментный препарат, не имеющий аналогов в мире. Его выпускает фармацевтическая компания НПО «Петровакс Фарм». Сейчас у компании есть 20 мировых патентов на молекулы, технологию производства и изобретения.
Что такое Лонгидаза ® и в чем его отличие от «чистого» фермента
Препарат нового поколения также отличается высокой биодоступностью — она достигает 90% при ректальном введении. Активное вещество достигает максимальной концентрации в крови через 20–25 минут после внутримышечного введения, а позднее выводится преимущественно с помощью почек. При этом препарат проникает абсолютно во все ткани, в том числе через гематоофтальмический барьер и ГЭБ.
Лекарство выпускают в удобной форме: в виде инъекций и суппозиториев. Последние применяют вагинально или ректально, в зависимости от назначения лечащего врача. Благодаря своему пролонгированному действию, в отличие от обычного фермента, Лонгидаза применяется 1 раз в 2–3 дня.
Препарат Лонгидаза ® : фармакологическое действие
Препарат обладает ферментативной активностью пролонгированного действия. Вещество также обладает антиоксидантным, хелатирующим, противовоспалительным и имунномодулирующим действием. Фермент деполимеризует матрикс соединительной ткани в фиброзно-гранулематозных образованиях, поэтому способствует их быстрому устранению. Кроме того, он подавляет обратную регуляторную реакцию, которая направлена на синтез компонентов соединительной ткани. Поэтому Лонгидаза ® не только изменяет структуру сформированных соединительно-тканных образований (рубцов, спаек, фиброзной ткани), но и способствует снижению интенсивности их формирования.
Множество исследований доказывают, что препарат не повреждает нормальную соединительную ткань, а воздействует только на измененную по составу и структуре ткань в области фиброза. Препарат не оказывает мутагенного, тератогенного, эмбриотоксического, канцерогенного действия. Его можно применять после операций или в при текущем инфекционном процессе, потому, что лекарственное средство не нарушает процесса заживления послеоперационных ран или течения воспаления.
Показания к применению препарата Лонгидаза ®
Противопоказания к применению препарата Лонгидаза ®
С осторожностью
С осторожностью препарат назначают детям младше 12 лет, потому что клинические исследования по применению препарата Лонгидаза ® у детей не проводились.
По этой же причине — отсутствие клинических испытаний — в число противопоказаний внесли беременность и период грудного вскармливания.
Не чаще одного раза в неделю препарат нужно применять пациентам с легочными кровотечениями в анамнезе и хронической почечной недостаточностью, потому что почки участвуют в выведении лекарства.
Побочные эффекты от применения препарата Лонгидаза ®
Большинство пациентов не отмечают никаких побочных эффектов после приема препарата. Очень редко — менее, чем в 0.001% случаев — возникают местные аллергические реакции в виде покраснения, зуда, отека, вагинального зуда в зависимости от формы выпуска препарата.
При передозировке пациенты могут испытывать озноб, головокружение, повышение температуры тела. Поэтому применять препарат нужно строго по рекомендованной специалистом схеме. Самолечение недопустимо.
Преимущества препарата Лонгидаза ®
Оригинальность молекулы
В 2015 году ВОЗ — Всемирная организация здравоохранения — присвоила препарату международное непатентованное наименование: бовгиалуронидаза азоксимер.
Совместимость с другими лекарствами
Гиалуронидазу азоксимер можно сочетать с антибиотиками, противовирусными, противогрибковыми и многими другими препаратами. Лонгидаза ® усиливает действие и повышает биодоступность введенных препаратов.
Комплексное воздействие
Основное назначение препарата — противофиброзное, воздействие на структурные компоненты соединительной ткани, профилактика и лечение рубцов, спаек, синехий, фиброза. Препарат также обеспечивает увеличение проницаемости тканей для повышения биодоступности антибиотиков и других лекарств, применяемых в комплексной терапии. Лонгидаза ® также уменьшает отеки за счет воздействия на мукополисахариды и оказывает противовоспалительное действие благодаря конъюгации с биологически активным носителем.
Доказанная эффективность
Многолетний опыт применения препарата и обширное количество научных работ, клинических исследований (которые проводятся до сих пор в разных направлениях) доказали, что терапия препаратом Лонгидаза проходит эффективно и без каких-либо серьезных побочных эффектов. Включение препарата Лонгидаза в комплексную терапию различных заболеваний (наиболее часто в урологии и гинекологии) позволяет значительно повысить эффективность проводимой терапии, ускорить выздоровление и продлить ремиссию.
Эффективность при остром воспалении
«Чистый» фермент не назначают в острой фазе воспаления — она служит противопоказанием. Это связано с тем, что он распадается в условиях очага воспаления с образованием провоспалительных компонентов. Противовоспалительные свойства препарата Лонгидаза позволяют применять это средство совместно с антибактериальными средствами даже при воспалительном процессе. Препарат Лонгидаза ® не теряет своей ферментной активности в течение 20 суток. Совместно с противовоспалительными лекарствами он начинает воздействовать на очаг уже в первые сутки лечения.
Минимальные побочные эффекты
У препарата нового поколения максимально снижены токсические, раздражающие, аллергизирующие свойства. Частота появления аллергической реакции в виде побочного эффекта составляет всего 1 раз на 1 000 случаев применения лекарственного средства. При этом «чистый» фермент может вызывать фибрилляцию желудочков, инфильтраты и другие осложнения. Все они связаны с высокой чувствительностью к компонентам группы ферментов.
Высокая биодоступность
Высокая устойчивость к ингибиторам
Устойчивость препарата Лонгидаза ® к различным негативным факторам в 50 раз выше по сравнению с препаратами предыдущего поколения и гиалуронидазой. Он долго сохраняет свою эффективность при высокой температуре, наличии в организме большого количества протеазы и других негативных воздействиях.
Удобная форма выпуска
Лекарство пригодно для домашнего применения, потому что его выпускают в виде ректальных или вагинальных суппозиториев. Еще одна форма выпуска — инъекции: при необходимости внутримышечные инъекции также можно делать дома.
Проверенное действие
Лонгидаза ® — самый назначаемый в РФ врачами препарат для профилактики и лечения спаечных процессов. Лонгидаза находится в арсенале врачей уже более 10 лет.
Схема лечения препаратом Лонгидаза ®
Подробное описание схем назначения препарата и продолжительности лечения приводится в инструкции по медицинскому применению. Однако в каждом конкретном случае доктор подбирает оптимальную схему для конкретной клинической ситуации.
Новые подходы к лечению фиброзирующих интерстициальных заболеваний легких
Фиброзирующие варианты поражения легких, приводящие к развитию дыхательной недостаточности, относятся к числу наиболее тяжелых интерстициальных заболеваний легких. Помимо идиопатического легочного фиброза, они включают в себя хронический гиперсенситивный пневмонит, неспецифическую интерстициальную пневмонию, поражение легких в рамках системных заболеваний соединительной ткани, неблагоприятные варианты течения легочного саркоидоза и некоторые другие. Применяющаяся для лечения этих заболеваний иммуносупрессивная терапия у части пациентов оказывается неэффективной и сопряжена с высоким риском тяжелых нежелательных явлений. Изучение новых лекарственных препаратов с антифиброзным действием, в частности нинтеданиба, открывает новые возможности для лечения этой непростой группы больных.
С.В. Моисеев. Среди хронических интерстициальных заболеваний легких (ИЗЛ) наиболее тяжелыми являются варианты поражения легких, протекающие с формированием выраженного фиброза и, следовательно, дыхательной недостаточности. Хотя механизмы образования соединительной ткани при этих заболеваниях были достаточно хорошо изучены, терапевтические подходы к торможению фиброгенеза до недавнего времени оставались мало эффективными, а широко назначавшаяся ранее при всех вариантах ИЗЛ иммуносупрессивная терапия оказалась неоправданной при многих заболеваниях. Действительно, при хроническом гиперсенситивном пневмоните, фибротическом варианте неспецифической интерстициальной пневмонии (в том числе в рамках системных заболеваний соединительной ткани), продвинутых стадиях легочного саркоидоза применение преднизолона и иммуносупрессивных препаратов не приводит к торможению фиброзного ремоделирования легочной ткани и значительно повышает риск респираторных инфекций и других нежелательных явлений [1].
М.Ю. Бровко. В начале XXI века для лечения идиопатического легочного фиброза, характеризующегося рентгенологической и гистологической картиной обычной интерстициальной пневмонии, были зарегистрированы два препарата с доказанным антифиброзным действием – нинтеданиб и пирфенидон [2,3]. Общность механизмов развития легочного фиброза при обычной интерстициальной пневмонии и других вариантах фиброзирующих ИЗЛ позволили предположить, что эти препараты могут найти применение и при других заболевания [4].
Нинтеданиб является низкомолекулярным ингибитором тирозинкиназ, блокирующим важнейшие сигнальные пути фиброгенеза в легочной ткани, в которых участвуют фактор роста тромбоцитов (PDGF), фактор роста эндотелия сосудов (VEGF) и фактор роста фибробластов (FGF) [5]. Первоначально этот препарат изучали при онкологических заболеваниях и применяли для лечения немелкоклеточного рака легкого, однако в 2014 году были завершены 52-недельные двойные слепые плацебоконтролируемые исследования INPULSIS-1 и INPULSIS-2, которые доказали способность препарата замедлять прогрессирование идиопатического легочного фиброза [2]. В целом в эти исследования были включены 1066 пациентов с идиопатическим легочным фиброзом, которых рандомизировали на группы нинтеданиба в дозе 150 мг два раза в день или плацебо. Первичной конечной точкой была ежегодная скорость снижения форсированной жизненной емкости легких (ФЖЕЛ). В обоих исследованиях в группе нинтеданиба она была примерно в два раза ниже, чем в группе плацебо (в исследовании INPULSIS-1 разница ежегодной скорости снижения ФЖЕЛ между группами составила 125,3 мл; p 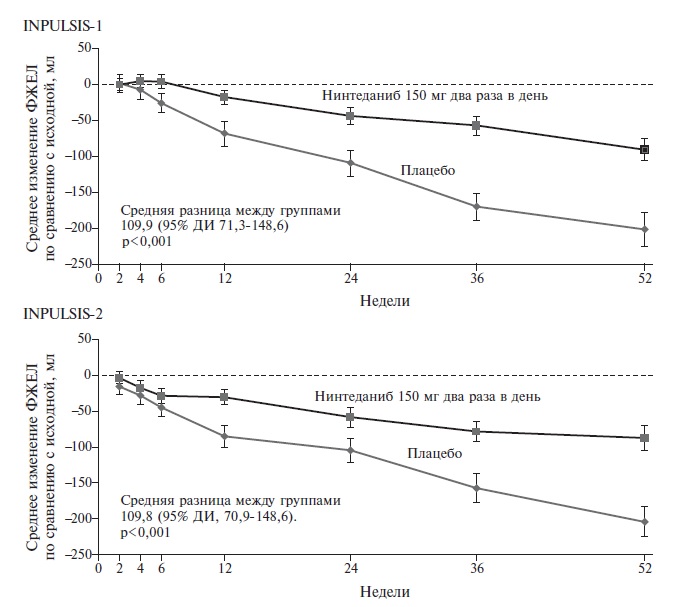
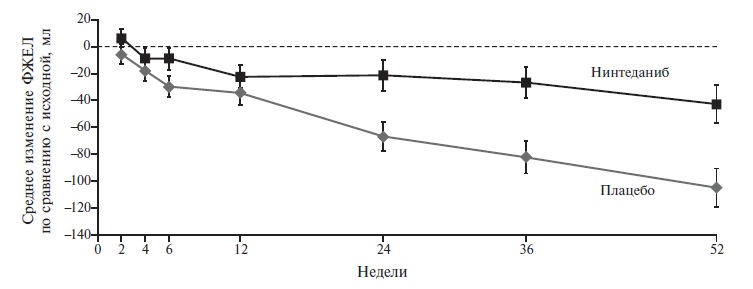
В 2018 г. после завершения двойного слепого, плацебо-контролируемого исследования SENCSIS была подтверждена эффективность назначения нинтеданиба при прогрессирующем поражении легких в рамках системной склеродермии (ССД) [6]. В исследование были включены 576 больных, которых рандомизировали на группы нинтеданиба в дозе 150 мг два раза в день внутрь или плацебо. Первичная конечная точка была такой же, как в исследованиях INPULSIS. Лечение нинтеданибом достоверно задерживало развитие фиброза у больных ССД, а разница ежегодной скорости снижения ФЖЕЛ между двумя группами составила 41,0 мл в пользу нинтеданиба (р=0,04; рис. 2).
П.И. Новиков. ССД – это аутоиммунное заболевание, в основе которого лежат генерализованная микроангиопатия и активация процессов фиброгенеза. На ранних стадиях заболевание проявляется кожными изменениями в виде плотного отека пальцев и синдромом Рейно, которые могут не сопровождаться ухудшением общего состояния или признаками поражения внутренних органов (в том числе одышкой), поэтому пациенты зачастую не сразу обращаются за медицинской помощью. В связи с этим ССД нередко диагностируют поздно, когда патологические изменения в органах необратимы, а лечение менее эффективно. По данным канадского регистра, у 408 пациентов диагноз ССД был установлен в среднем через 6,0 лет после развития феномена Рейно и через 2,7 года после появления первых «внекожных» проявлений [7]. В России ССД диагностировали через 2,0–2,7 года после появления феномена Рейно при диффузной форме заболевания [8]. При этом результаты крупного исследования (n=5860) показали, что смертность пациентов с ССД достигает 68 на 1000 человек в год [9]. Таким образом, своевременная диагностика ССД представляет собой сложную, но очень важную задачу для врача. Примерно у 75% больных уже в первые годы заболевания выяв ляют интерстициальное поражение легких, характеризующееся медленным прогрессирующим течением с исходом в фиброз разной степени тяжести [10]. Л.В. Теплова и соавт. с помощью компьютерной томографии высокого разрешения выявили признаки поражения интерстиция легких у 82% из 138 пациентов с ССД [11].
Лечение ИЗЛ в рамках ССД обычно начинают с иммуносупрессивных препаратов, в частности циклофосфамида [12]. В многоцентровом, проспективном, рандомизированном, двойном слепом, плацебо-контролируемом исследовании лечение цифлофосфамидом внутривенно в течение 6 мес с последующей заменой на азатиоприн привело к увеличению ФЖЕЛ на 4,2% по сравнению с контролем [13], что указывало на способность препарата замедлять прогрессирование поражения легких при этом заболевании. Тем не менее, через 2 года после начала 12-месячной иммуносупрессивной терапии было выявлено ухудшение ФЖЕЛ и рентгенологической картины [14].
В рандомизированном, двойном слепом 24-месячном исследовании микофенолат мофетил в дозе 3000 мг/сут у больных ССД с поражением легких не отличался от циклофосфамида в дозе 2 мг/кг/сут внутрь по эффективности, но имел преимущества по переносимости [15]. Результаты небольших неконтролируемых исследований свидетельствуют о том, что ритуксимаб может улучшить течение ИЗЛ у больных ССД [16]. Недавно эффективность и безопасность ритуксимаба были изучены у 254 больных ССД (у 58% из них имелось ИЗЛ), получавших лечение в центрах, которые входят в программу EUSTAR (в Российской Федерации – НИИ ревматологии им. В.А. Насоновой и клиника им. Е.М. Тареева). Контрольную группу составили 9575 подобранных пациентов с ССД, которым проводилось лечение другими препаратами. Хотя ритуксимаб вызывал улучшение фиброза кожи, он не оказывал существенного влияния на динамику ФЖЕЛ или диффузионной способности по оксиду углерода (DLCO).
В целом приведенные данные свидетельствуют о том, что иммуносупрессивные препараты, в том числе циклофосфамид, микофенолат мофетил и ритуксимаб, позволяют стабилизировать течение ИЗЛ у части, но далеко не у всех больных ССД, что определяет необходимость применения других подходов к лечению, прежде всего с использованием препаратов, обладающих антифиброзной активностью.
С.В. Моисеев. Особенно трудным является ведение пациентов с поражением легких в рамках ССД, у которых легочный фиброз прогрессирует несмотря на адекватную иммуносупрессивную терапию. Приводим клиническое наблюдение:
Л.А. Акулкина. Пациентка А., 50 лет. С 35 лет отмечает онемение и посинение пальцев рук на холоде. Диагностирован синдром Рейно. В 2010 г. в возрасте 40 лет появились малопродуктивный кашель и одышка при физической нагрузке. По месту жительства респираторная симптоматика трактовалась как проявление инфекционного процесса, в связи с чем периодически проводились антибактериальная терапия, инфузии эуфиллина без существенного эффекта. В 2014 г. при мультиспиральной компьютерной томография органов грудной клетки (МСКТ) выявлены признаки интерстициальной пневмонии, однако какая-либо терапия назначена не была, а дыхательная недостаточность постепенно нарастала. При контрольной МСКТ через полтора года в обоих легких, преимущественно в нижних долях, определялись участки фиброза и «сотового легкого» на фоне значительных интерстициальных изменений по типу «матового стекла» с утолщением и уплотнением легочного интерстиция и междольковых перегородок (более выражено в периферических отделах), а также внутригрудная лимфаденопатия верхней паравазальной, ретрокавальной, трахеобронхиальных и бифуркационной групп до 13 мм. Обратилась к фтизиатру, который исключил туберкулез органов дыхания. В 2016 г. в возрасте 46 лет впервые госпитализирована в клинику им. Е.М. Тареева. При осмотре обращали на себя внимание изменения кожи с формированием «кисетного рта», плотный отек пальцев рук, синдром Рейно с дигитальными язвами. При обследовании выявлены антинуклеарный фактор (АНФ) в титре 1:1280, положительные антитела к цитоплазматическому антигену SS-A (Ro), резкоположительные антитела к топоизомеразе I Scl-70. ФЖЕЛ была снижена до 74%, а DLСО – до 58%. При эхокардиографии выявлены умеренные признаки легочной гипертензии с повышением систолического давления в легочной артерии до 45 мм рт. ст. Сочетание характерных кожных изменений, синдрома Рейно, изменений в легких по типу прогрессирующего фиброзирующего заболевания легких (утолщение, деформация внутридолькового и междолькового легочного интерстиция, участки кистозной трансформации легочной ткани, уменьшение нижних долей легких в размерах, наличие тракционных бронхоэктазов, уплотнение легочной ткани по типу «матового стекла» в субплевральных и базальных отделах обоих легких) и серологических маркеров позволило диагностировать ССД с поражением легких. Начата комбинированная иммуносупрессивная терапия циклофосфамидом в дозе 800 мг внутривенно ежемесячно в течение 5 месяцев, пероральный прием преднизолона 10 мг/сут и гидроксихлорохина 200 мг/сут. В результате терапии отмечены уменьшение одышки и кашля, повышение толерантности к физическим нагрузкам, однако каждая инфузия циклофосфамида сопровождалась инфекционными осложнениями. Тем не менее, при МСКТ через 6 мес наблюдалась умеренная отрицательная динамика в виде нарастания интерстициальных фиброзных изменений в легких. Циклофосфамид был заменен на микофенолат мофетил, а терапия преднизолоном продолжена в прежней дозе. Увеличить дозу микофенолата мофетила до целевой не удалось в связи с развитием стойкой диареи, поэтому препарат был отменен. В декабре 2016 г. начаты инфузии ритуксимаба. В результате лечения наблюдался некоторый положительный клинический эффект в виде уменьшения одышки и выраженности синдрома Рейно, повышения толерантности к физическим нагрузкам. В мае 2017 г. лабораторные признаки активности заболевания отсутствовали, а при МСКТ выявлено уменьшение выраженности изменений по типу «матового стекла» в обоих легких, однако площадь фиброзных изменений несколько увеличилась. С учетом полной деплеции CD19+ B-лимфоцитов в периферической крови повторное введение ритуксимаба было решено отложить. В апреле 2018 г. рентгенологическая картина и функциональные легочные показатели без динамики. Отмечено нарастание числа CD19+ В-лимфоцитов до 0,8%, в связи с чем проведена очередная инфузия ритуксимаба 1 г. В мае 2019 года функция легких оставалась относительной стабильной (ФЖЕЛ 67%, DLCO 46%), однако при МСКТ отмечено нарастание уплотнения легочной ткани по типу «матового стекла». Выполнено очередное введение ритуксимаба 1 г. При обследовании в декабре того же года клиническое состояние пациентки стабильно, признаков активности ССД нет, однако выявлено нарастание фиброзных изменений легочной ткани при отсутствии существенной динамики ФЖЕЛ и DLCO. В настоящее время обсуждается возможность назначения нинтеданиба.
М.Ю. Бровко. История заболевания пациентки де монстрирует недостаточную эффективность применявшихся иммуносупрессивных лекарственных препаратов – несмотря на лечение в течение 3 лет отмечено снижение показателей легочной вентиляции, в том числе ФЖЕЛ на 10% и DLCO на 12%. В этом случае оправдано применение антифибротической терапии, так как в исследовании SENCSIS лечение нинтеданибом у таких больных позволило замедлить нарастание респираторного дефицита у пациентов с ССД практически вдвое [6].
В.И. Шоломова. Опубликованные в 2019 г. результаты 52-недельного двойного слепого, плацебо-контролируемого исследования INBUILD подтвердили эффективность терапии нинтеданибом при практически полном спектре фиброзирующих ИЗЛ, не относящихся к ИЛФ. В исследовании приняли участие 663 пациента из 15 стран, включая Российскую Федерацию. Критериями включения были признаки интерстициального фиброза с вовлечением более 10% легочной паренхимы по данным МСКТ органов грудной клетки в сочетании с признаками прогрессирования заболевания за предыдущие 24 мес (нарастание рентгенологических изменений, снижение ФЖЕЛ, усугубление респираторной симптоматики) несмотря на иммуносупрессивную терапию. Лечение нинтеданибом 150 мг два раза в сутки и плацебо получали пациенты с гиперсенситивным пневмонитом, идиопатической неспецифической интерстициальной пневмонией, неклассифицируемой интерстициальной пневмонией, поражениями легких, ассоциированными с различными системными заболеваниями соединительной ткани (в том числе ССД, ревматоидным артритом), профессиональными заболеваниями и саркоидозом. У большей части пациентов (62,1%) имелись рентгенологические изменения, соответствующие паттерну обычной интерстициальной пнев монии.
А.Ш. Янакаева. Больная К., 65 лет. В 2014 г. в возрасте 60 лет появился постоянный сухой кашель, однако к врачу не обращалась. В январе 2016 г. при диспансеризации впервые выявлены патологические признаки на рентгенограммах легких. При МСКТ обнаружены изменения по типу «матового стекла» в базальных отделах обоих легких, увеличение внутригрудных лимфатических узлов до 14 мм. Признаков дыхательной недостаточности не выявлено. ФЖЕЛ составила 110%, однако исследование диффузионной способности не проводилось. При эхокардиографии без существенных отклонений. Диагностирована идиопатическая интерстициальная пневмония. Проводилась терапия преднизолоном 25 мг/сут и ацетилцистеином 600 мг/сут. При контрольной МСКТ через 6 мес положительной динамики не наблюдалось, сохранялся сухой кашель. Рекомендовано продолжить прием преднизолона в дозе 15 мг/сут.
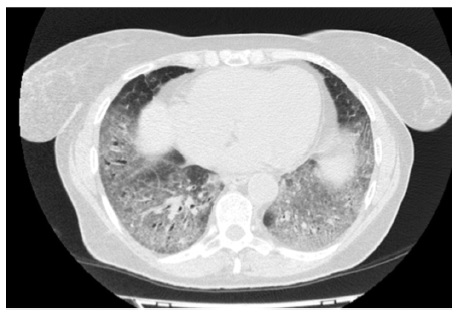
В апреле 2017 г. госпитализирована в Клинику им. Е.М. Тареева с жалобами на мучительный сухой кашель, слабость, умеренную одышку. В базальных отделах обоих легких выслушивалась крепитация. ФЖЕЛ – 91%, DLСО – 67%. Рентгенологически определялась картина неспецифической интерстициальной пневмонии. По сравнению с предыдущим исследованием отмечено нарастание фиброзных изменений, в то время как выраженность зон «матового стекла» существенно не изменилась (рис. 4). При иммунологическом исследовании обнаружено повышение титра АНФ до 1:320, слабоположительный титр SS-A. Неоднократно осматривалась ревматологом, данных за какое-либо системное заболевание соединительной ткани не было. Диагностирована интерстициальная пневмония с аутоиммунными признаками [18]. Продолжена терапия преднизолоном в дозе 20 мг/сут, к которому был добавлен микофенолат мофетил в дозе 2000 мг/сут. В ноябре 2017 г. отмечено уменьшение площади интерстициальных изменений по типу «матового стекла» при усилении выраженности тракционных бронхоэктазов. Несмотря на проводимую иммуносупресивную терапию вентиляционная функция продолжала снижаться, в том числе ФЖЕЛ до 82% и DLСО до 61%. С учетом неэффективности иммуносупрессивной терапии и соответствия пациенки критериям отбора в исследование INBUILD в декабре 2017 г. начато лечение нинтеданибом в дозе 150 мг два раза в сутки в сочетании с преднизолоном в дозе 10 мг/сут. На фоне 2-летней терапии нинтеданибом впервые отмечена стабилизация показателей функции внешнего дыхания: в сентябре 2019 г. ФЖЕЛ составила 81%, а DLСО – 59%. При МСКТ выраженность фиброзных изменений не изменилась, в связи с чем терапию антифиброзным препаратом решено продолжить.
С.В. Моисеев. Представленные истории болезни демонстрируют варианты неблагоприятного фиброзирующего течения ИЗЛ, отличных от идиопатического легочного фиброза. Обеим пациенткам показана длительная терапия антифиброзным лекарственным препаратом – нинтеданибом в дозе 150 мг два раза в сутки. Результаты плацебо-контролируемых клинических исследований свидетельствуют о том, что лечение этим препаратом оказывает благоприятное влияние на различные фиброзирующие заболевания легких. Очевидно, что лучших результаты терапии можно ожидать у второй пациентки, учитывая отсутствие системного заболевания. Однако и первой больной назначение нинтеданиба также показано, так как неблагоприятный прогноз в первую очередь определяется поражением легких и прогрессирующей дыхательной недостаточности.
Необходимость лечения нинтеданибом должна быть подтверждена в лечебном учреждении, занимающемся изучением ИЗЛ и имеющем опыт ведения таких пациентов. Нинтеданиб переносится удовлетворительно и обычно не вызывает тяжелые нежелательные реакции, поэтому препарат может применяться под наблюдением врача поликлиники. Био химические показатели целесообразно контролировать ежемесячно в течение первых трех месяцев после начала лечения, а затем ежеквартально.
