Что лучше пиаскледин или артра для суставов
Лучшие хондропротекторы для суставов
Хондропротекторы – эффективная защита для ваших суставов
Что такое хондропротекторы?
При каких болезнях применяются хондропротекторы
Хондропротекторы станут незаменимыми помощниками в борьбе с болезнями суставов
Препараты этой группы рекомендованы при врожденных и приобретенных патологиях костной ткани (например, деформация костей), грыжах и протрузиях. Хондроитин сульфат хорошо зарекомендовал себя в качестве вспомогательного вещества при лечении кератитов (воспаление глазной роговицы). Хондропротекторы при артрозе назначают на 1-2 стадии заболевания.
Действие хондропротекторов для суставов
Действие хондропротекторов при артрозе разделяют на:
Механизм действия хондропротективных препаратов основан на том, что они стимулируют рост хондроцитов, повышают их стойкость перед окислением, и подавляют активность ферментов, которые разрушают хрящевую ткань. Благодаря этому вместо дефектной хрящевой ткани начинает нарастать устойчивая, т.е., достаточно прочная, чтобы хрящ мог снова выполнять свои функции в суставе. Также протективные средства обладают слабым противовоспалительным эффектом, уменьшают отеки.
Показания и противопоказания к приему хондропротекторов
Кому нужны хондропротекторы для суставов?
Начинать курс глюкозамина и хондроитина нужно:
Кому нельзя принимать хондропротекторы?
Классификация хондропротекторов
В медицинских источниках хондропротекторы для суставов разделяют по поколениям:
Хондропротекторы нового поколения облегчают самочувствие больного гораздо быстрее, имеют меньше побочных эффектов.
Хондопротекторы выпускаются в различных формах Выберите то, что подходит именно вам.
Таблетки
Мази-хондропротекторы
Местные хондропротекторы (мази и гели) используются при артрозах межпозвоночных, мелких и средних суставов. Наружные препараты обладают минимальной биодоступностью (менее 5%) и практически не влияют на структуру хряща, в особенности, если он залегает глубоко под кожей. Зато мази-хондропротекторы благотворно воздействуют на околосуставные ткани, снимают боль и отек, уменьшают воспаление. При отсутствии аллергической реакции их можно использовать постоянно.
Порошки для лечения суставов
Хондропротекторы в уколах
Внутримышечный укол хондропротектора можно сделать самостоятельно или при помощи близких, а вот инъекция в сустав должна проводиться только опытным медицинским работником.
Натуральные хондропротекторы в еде
Людям с больными суставами полезны и растительные коллагеноподобные соединения, которые содержатся в ростках пшеницы, грибах, орехах, брокколи, морских водорослях. В рационе стоит увеличить содержание цитрусовых, листовой зелени.
Даже ежедневное употребление хондропротективных продуктов не гарантирует здоровье хряща при:
К числу лучших хондропротекторов относятся глюкозамин, хондроитин, метилсульфонилметан, гиалуроновая кислота, коллаген II типа, а также ряд вспомогательных средств. Лучше всех, по отзывам пациентов, себя зарекомендовали следующие препараты-хондропротекторы:
Артрадол. Хондроитина сульфат в виде порошка для приготовления внутримышечных инъекций.
Артракам.Глюкозамина гидрохлорид в форме саше (порошок для приема внутрь раствором). Стимулирует восстановление хряща.
Артра.Обладает обезболивающими свойствами, помогает восстановить сустав. Производится в США.
Дона. Глюкозамина сульфат. Выпускается в виде таблеток, саше и раствора для внутримышечного введения. Курс применения:
Румалон. Препарат 1-го поколения в виде раствора для внутримышечных инъекций. Содержит экстракт хрящей и костного мозга крупного рогатого скота.
Курс: 5-6 недель, 3 раза в неделю по 1 мл.
Хондрогард. Выпускается в виде раствора хондроитинсульфата для внутримышечных и внутрисуставных инъекций.
Курс хондропротектора в уколах:
Хондроксид. Хондроитина сульфат в виде таблеток, геля или мази 5%.
Перед применением хондропротекторов из списка желательно посоветоваться c врачом.
Надеемся, что смогли Вам помочь! Здоровья Вам и Вашим близким!
Результаты многоцентрового исследования по оценке эффективности и переносимости Пиаскледина
Опубликовано в журнале:
« Ревматология. Травматология. Ортопедия. » №3, 2011г. Д. м. н., проф. В.В.Бадокин
ГОУ ДПО «Российская медицинская академия последипломного образования» (РМАПО) Росздрава, Москва
В статье рассматриваются общие подходы к лечению остеоартроза (ОА) и основные группы препаратов, используемые в терапии этого заболевания. Обсуждаются особенности симптом-модифицирующих и структурно-модифицирующих лекарственных средств. К числу препаратов с хондропротективными и структурно-модифицирующими свойствами относится Пиаскледин, действие которого направлено на коррекцию ряда процессов, лежащих в основе нарушенного метаболизма хряща при ОА. Симптом-модифицирующий эффект Пиаскледина при ОА, выражающийся в уменьшении болей в суставах и улучшении их функциональной способности, доказан результатами многочисленных контролируемых исследований.
Остеоартроз – группа патогенетически близких заболеваний различной этиологии, характеризующихся однотипными морфологическими и клиническими проявлениями и исходами. в основе заболевания лежит прогрессивная потеря гиалинового хряща и ремоделирование субхондральной кости. несмотря на то, что основными признаками ОА являются дегенеративные изменения хрящевой ткани, для данного заболевания характерно воспаление в тканях сустава, которое приводит к развитию рецидивирующего вторичного (реактивного) синовита, хондрита, остеита и периартрита. Персистирующий воспалительный процесс, в свою очередь, способствует прогрессированию морфологических изменений, в том числе деградации гиалинового хряща.
Реальные показатели распространенности ОА трудно оценить. При этом заболевании выраженность клинической симптоматики не всегда соответствует структурным изменениям суставов по данным рентгенографии, магнитно-резонансной томографии, ультразвуковых методов, а также с макро- и микроскопическими морфологическими показателями, полученными при изучении биоптатов синовиальной оболочки или артроскопии. так, хорошо известно, что многие рентгенопозитивные больные не имеют клинических симптомов.
При этом следует отметить, что ОА, безусловно, лидирует по своей распространенности среди других ревматических болезней [1]. B целом он встречается у 10% населения, при этом 50% населения старше 50 лет имеют клинические и/или рентгенологические симптомы этого заболевания. в возрасте старше 70 лет рентгенологические признаки ОА находят у 90% женщин. При остеоартрозе прежде всего поражаются «нагрузочные» (коленные и тазобедренные) суставы, что значительно ухудшает качество жизни больных и представляет серьезную медико-социальную проблему. Хотя ОА непосредственно не влияет на жизненный прогноз, он является одной из основных причин преждевременной потери трудоспособности и инвалидности, уступая в этом отношении только ишемической болезни сердца [2].
По данным ВОЗ, только ОА коленных суставов находится на четвертом месте среди основных причин нетрудоспособности у женщин и на восьмом – у мужчин. Существует точка зрения, согласно которой у женщин наблюдается снижение продолжительности жизни по мере увеличения числа пораженных суставов, хотя эти данные требуют дальнейшего детального изучения.
Кроме того, этот цитокин непосредственно влияет на темпы хрящевой деструкции, ингибируя синтез компонентов матрикса (аггрекана и коллагена II типа) и стимулируя продукцию провоспалительных цитокинов (ИЛ-6, ИЛ-8). в сложном многоступенчатом каскаде различных изменений задействованы также простагландин Е2, оксид азота и другие биологически активные вещества. вышеприведенные нарушения способствуют недостаточному синтезу хондроцитами протеогликанов и фрагментации протеогликановых агрегатов, которые являются основными патологическими изменениями при ОА.
Раскрытие молекулярных механизмов деградации хряща и уточнение причин, ведущих к персистирующему воспалению непосредственно в тканях сустава, послужили основанием для разработки не только симптом-модифицирующих (быстродействующих), но и структурно-модифицирующих (медленнодействующих) препаратов, активно воздействующих на течение и темпы дальнейшего прогрессирования заболевания.
Целесообразность такого подхода обусловлена тем, что даже у больных с далеко зашедшей стадией ОА хондроциты способны синтезировать межклеточный матрикс [3]. Эффективная медленнодействующая симптоматическая терапия направлена на стимуляцию хондробластами и хондроцитами синтеза макромолекул межуточного вещества гиалинового хряща, в частности протеогликанов, снижение активности МП и провоспалительных цитокинов, активацию анаболических процессов в матриксе хряща и создание условий для формирования устойчивого хряща. Кроме того, она увеличивает резистентность хондроцитов к негативному воздействию как провоспалительных цитокинов, так и большинства нестероидных противовоспалительных препаратов (НПВП), обладающих хондронегативными свойствами. Для уменьшения темпов прогрессирования ОА предложено большое количество различных препаратов.
Наиболее широкое применение нашли структурные аналоги хряща, к которым относятся, прежде всего, глюкозамин сульфат и хондроитин сульфат. В долгосрочных контролируемых рандомизированных исследованиях доказано их структурно-модифицирующее действие. Bсе большее применение находят комбинированные препараты, в состав которых входит хондроитин сульфат в комбинации с глюкозамин сульфатом или глюкозамин гидрохлоридом. Положительное действие этих препаратов у больных ОА также не вызывает сомнений. интересным препаратом является диацериин – ингибитор интерлейкина-1. Препараты гиалуроновой кислоты (Гиалган, Остенил и др.) не только улучшают механическую функцию пораженных суставов, но и тормозят дальнейшее их прогрессирование. Согласно рекомендациям ЕULAR (2003, 2006 г.), только 5 препаратов обладают структурно-модифицирующими свойствами: глюкозамин сульфат, хондроитин сульфат, диацериин, гиалуроновая кислота, а также неомыляемые соединения масел авокадо и бобов сои [5]. Что же касается других препаратов, ранее относящихся к хондропротекторам, то они обладают анальгетической и противовоспалительной активностью, но их влияние на темпы прогрессиро-вания ОА остается спорным. Одним из основных структурно-модифицирующих препаратов является Пиаскледин 300. Он представляет собой неомылямые соединения масел авокадо и бобов сои в соотношении 1/3:2/3, полученные из экстрактов этих продуктов после молекулярной дистилляции [6].
В состав Пиаскледина 300 входит также комплекс активных фитостеролов (γ-токоферол и β-ситостерол). Препарат выпускается только Laboratories Expanscience (франция) и не имеет аналогов.
Одним из основных механизмов действия Пиаскледина 300 является его влияние на экспрессию цитокинов [3, 6, 7, 8]. Пиаскледин ингибирует ИЛ-1, предотвращая его повреждающее действие на хондроциты и синовиоциты, стимулирует синтез коллагена и протеогликанов. Он угнетает ИЛ-1β-cтимулированный синтез МП (коллагеназы и стромелизина) хондроцитами, экспрессию ИЛ-6 и ИЛ-8, а также простагландина E2, что обусловливает как антикатаболическое действие на матрикс хряща, так и ингибицию «вторичного» воспаления в тканях сустава, а именно: в синовиальной оболочке, энтезах, субхондральной кости и непосредственно в гиалиновом хряще. B эксперименте было отмечено, что неомыляемые соединения масел авокадо и бобов сои обладают превентивным действием на развитие посттравматического ОА и могут стимулировать процесс восстановления хряща.
Биологические эффекты Пиаскледина 300:
Симптом-модифицирующий эффект Пиаскледина доказан результатами многочисленных контролируемых исследований [9–11]. в рандомизированном двойном слепом плацебоконтролированном мультицентровом исследовании, включавшем 164 больных с ОА коленных и тазобедренных суставов, назначалась стандартная доза препарата (300 мг/сут) [7]. длительность терапии составляла 6 месяцев, затем больных наблюдали еще в течение двух месяцев. на фоне проводимой терапии отмечалось достоверное снижение интенсивности боли в суставах и функционального индекса (в 1,58 и 1,42 раза соответственно), а также достоверное улучшение глобальной оценки пациентом своего состояния. 57% больных основной группы смогли отказаться от приема НПВП в связи со значительным уменьшением интенсивности болей в суставах или их полным прекращением. в этом исследовании более значимый положительный эффект терапии наблюдался у больных с коксартрозом, чем у пациентов с гонартрозом. достигнутая положительная динамика основных клинических показателей заболевания сохранялась в течение изучаемого 2-месячного периода наблюдения, что подтверждает наличие у Пиаскледина 300 последействия и кумулятивных свойств.
Основным критерием включения являлось сужение щели тазобедренных суставов по данным рентгенографии. все больные были разделены на две группы. Больные первой группы, которая включала 85 человек, принимали 300 мг/сут Пиаскледина на протяжении всего периода исследования, а остальные (78 человек) составили контрольную группу и принимали плацебо.
Больные как основной, так и контрольной групп могли использовать НПВП по собственному усмотрению при наличии болей в суставах. исследуемые группы были сопоставимы по возрасту, полу, весу, росту, стадии ОА, длительности заболевания, индексу Лекена, выраженности спонтанной боли. в обеих группах в целом не было выявлено существенного различия в динамике сужения суставной щели – наиболее важного показателя структурно-модифицирующей активности изучаемого препарата.
Однако у больных с исходной шириной суставной щели менее 2 мм на фоне лечения Пиаскледином наблюдалось в 2 раза менее выраженное дальнейшее ее сужение по сравнению с группой контроля (0,24 мм и 0,47 мм соответственно). таким образом, по данным литературы, Пиаскледин 300 обладает достоверной симптом-модифицирующей и структурно-модифицирующей активностью у больных ОА коленных и тазобедренных суставов. нами также проведено изучение эффективности и переносимости Пиаскледина 300.
На первом этапе в открытом пилотном исследовании проводилась клиническая оценка этого препарата в 8 центрах, расположенных в различных регионах России. в исследование были включены амбулаторные или стационарные больные любого возраста с первичным ОА коленного или тазобедренного сустава, а также с полиостеоартрозом. У всех больных наблюдались клинически значимые проявления заболевания, при этом интенсивность боли в суставах составляла не менее 30 мм по визуальной аналоговой шкале (ВАШ), а индекс тяжести гонартроза или коксартроза соответствовал 5 и более баллам по Лекену. Кроме того, все больные нуждались в применении НПВП на протяжении последнего месяца. критерием включения также являлось прекращение приема любых препаратов с хондропротективной активностью за 3 месяца до начала исследования. критерии исключения: вторичный ОА и клинически латентное течение заболевания, наличие обострения язвенной болезни желудка или 12-перстной кишки, гепатоцеллюлярной и почечной недостаточности, а также тяжелое течение других острых и хронических заболеваний. всего в исследование вошли 440 больных, из них 302 – с гонартрозом, 84 – с коксартрозом и 54 – с полиостеоартрозом. У 47 больных наблюдалась симптоматика вторичного (реактивного) артрита коленных суставов. возраст больных колебался от 39 до 82 лет (средний возраст составил 59,8 года). Длительность заболевания составляла от 2 до 40 лет.
Рентгенологическая стадия ОА по Kellgren – Lawrence у 15,3% соответствовала I, у 65,1% – II и у 19,6% – III. У всех больных наблюдались умеренные и интенсивные боли в суставах (не менее 30 мм ВАШ) и все они нуждались в приеме НПВП. длительность терапии у 410 больных составила 6 месяцев и у 30 – 3 месяца.
Суточная доза Пиаскледина составляла 300 мг (1 капсула). контроль основных параметров терапии осуществлялся через 1 и 3 месяца непрерывной терапии, а при 6-месячном курсе приема препарата – через 1, 3 и 6 месяцев. Эффективность терапии оценивалась по динамике интенсивности боли в покое и при движении (BАШ), длительности утренней скованности (минуты) и ее интенсивности (BАШ), динамике суммарного индекса Лекена и функциональной недостаточности (WOMAC), суточной потребности в НПВП, общей оценке эффективности лечения пациентом и врачом. Переносимость и безопасность Пиаскледина 300 оценивали с учетом возникновения и выраженности возможных нежелательных явлений препарата. Положительная динамика основных субъективных симптомов ОА наблюдалась уже к концу первого месяца лечения.
Одним из основных структурно-модифицирующих препаратов является Пиаскледин 300. Он представляет собой неомыляемые соединения масел авокадо и бобов сои в соотношении 1/3:2/3, полученные из экстрактов этих продуктов после молекулярной дистилляции. В состав Пиаскледина 300 входит также комплекс активных фитостеролов (γ-токоферол и β-ситостерол). Препарат выпускается только Laboratories Expanscience (Франция) и не имеет аналогов.
Так, боль при ходьбе по ровной поверхности уменьшилась в среднем в 0,9 раза и боль в покое – в 1,3 раза. Tакже была отмечена существенная динамика функционального индекса WOMAC. Однако не было выявлено достоверной динамики таких показателей, как интенсивность боли при ходьбе по лестнице вниз и вверх или интенсивности боли в ночные часы. У преобладающего большинства больных спустя 14–19 дней от начала терапии разрешились явления вторичного (реактивного) артрита. К концу третьего месяца непрерывной терапии положительная динамика основных показателей ОА стала еще более выраженной, включая интенсивность суставной боли при ходьбе по лестнице и интенсивность «стартовой» боли.
Таблица 1. Клиническая характеристика больных
I (основную) группу составили больные, которые наряду со стандартной дозой Пиаскледина (300 мг/сут – 1 капсула во время еды) принимали НПВП. Больных II (контрольной) группы лечили только НПВП. длительность терапии составила 6 месяцев. По условиям испытания больные I и II групп могли принимать любые НПВП в дозировке, эквивалентной 100 мг диклофенака. чаще всего применялся диклофенак, реже – ибупрофен, нимесулид, мелоксикам (Мовалис) и еще реже – другие препараты.
Больные обеих групп были рандомизированы по основным параметрам заболевания, в частности по полу, возрасту, длительности заболевания, локализации процесса, рентгенологической стадии ОА. Однако по некоторым показателям полной рандомизации не было.
Так, в I группе оказалось больше больных с генерализованным ОА и с явлениями синовита, в то время как во II группе преобладали больные с гонартрозом и с более длительным периодом последнего обострения. наличие вторичного (реактивного) синовита позволяло более адекватно оценить противовоспалительный эффект Пиаскледина. Помимо ОА у пациентов наблюдались и другие заболевания. в основной группе наиболее часто встречался хронический гастрит или язвенная болезнь вне обострения (9 больных), реже – гипертоническая болезнь (7) и ишемическая болезнь сердца (6) и еще реже – другие хронические заболевания органов пищеварения (колит, холецистит).
У одной больной имел место хронический пиелонефрит. На фоне лечения Пиаскледином у больных ОА наблюдалось уменьшение выраженности боли в покое, нарастающее по мере увеличения длительности приема препарата (рис. 1). K третьему месяцу непрерывной терапии уменьшение интенсивности боли было статистически значимым только у больных основной группы, которые принимали изучаемый препарат в комбинации с НПВП. K концу шестого месяца терапии интенсивность боли в покое в основной группе уменьшилась в 3,5 раза, а в контрольной – только в 1,9 раза. Более отчетливая положительная динамика боли отмечена при движении (рис. 2).
Рис. 1. Динамика боли в покое (по ВАШ)
Рис. 2. Динамика боли при движении (по ВАШ)
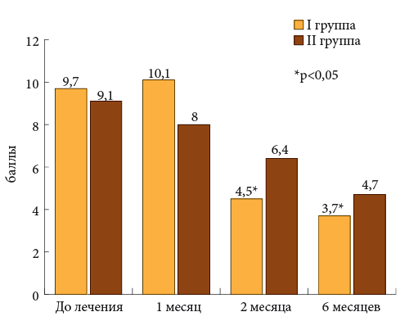
Уже к концу первого месяца получено достоверное снижение интенсивности боли у больных, которые принимали Пиаскледин 300 и НПВП, в то время как у пациентов, получавших только НПВП, достоверных различий не было выявлено в течение всего шестимесячного периода лечения. к концу шестого месяца в I группе интенсивность боли при движении снизилась с 63,7 до 23,4 мм ВАШ, а во II – с 57,3 до 35,8. к концу третьего месяца терапии интенсивность утренней скованности заметно снизилась по сравнению с исходным уровнем, причем в большей степени в контрольной группе, чем основной. Однако к концу лечения интенсивность утренней скованности увеличилась как в I, так и во II группах, причем этот показатель не коррелировал с динамикой других основных показателей ОА. Это позволяет предполагать, что ригидность у лиц пожилого и старческого возраста далеко не всегда обусловлена имеющимся дегенеративным заболеванием суставов. в ходе исследования получены интересные данные о влиянии проводимой терапии на функциональный индекс Лекена (рис. 3).
Рис. 3. Функциональный индекс Лекена
К третьему и шестому месяцам терапии этот показатель претерпел достоверную положительную динамику (9,7, 4,5 и 3,7). Уже к третьему месяцу у больных основной группы индекс тяжести ОА, как коленного, так и тазобедренного сустава, снизился более чем в 2 раза по сравнению с исходным уровнем, а к концу шестого месяца почти в 3 раза. Менее отчетливая положительная динамика наблюдалась в контрольной группе, где она оказалась статистически недостоверной.