Что лучше структум или инъектран
Лучшие хондропротекторы для суставов
Хондропротекторы – эффективная защита для ваших суставов
Что такое хондропротекторы?
При каких болезнях применяются хондропротекторы
Хондропротекторы станут незаменимыми помощниками в борьбе с болезнями суставов
Препараты этой группы рекомендованы при врожденных и приобретенных патологиях костной ткани (например, деформация костей), грыжах и протрузиях. Хондроитин сульфат хорошо зарекомендовал себя в качестве вспомогательного вещества при лечении кератитов (воспаление глазной роговицы). Хондропротекторы при артрозе назначают на 1-2 стадии заболевания.
Действие хондропротекторов для суставов
Действие хондропротекторов при артрозе разделяют на:
Механизм действия хондропротективных препаратов основан на том, что они стимулируют рост хондроцитов, повышают их стойкость перед окислением, и подавляют активность ферментов, которые разрушают хрящевую ткань. Благодаря этому вместо дефектной хрящевой ткани начинает нарастать устойчивая, т.е., достаточно прочная, чтобы хрящ мог снова выполнять свои функции в суставе. Также протективные средства обладают слабым противовоспалительным эффектом, уменьшают отеки.
Показания и противопоказания к приему хондропротекторов
Кому нужны хондропротекторы для суставов?
Начинать курс глюкозамина и хондроитина нужно:
Кому нельзя принимать хондропротекторы?
Классификация хондропротекторов
В медицинских источниках хондропротекторы для суставов разделяют по поколениям:
Хондропротекторы нового поколения облегчают самочувствие больного гораздо быстрее, имеют меньше побочных эффектов.
Хондопротекторы выпускаются в различных формах Выберите то, что подходит именно вам.
Таблетки
Мази-хондропротекторы
Местные хондропротекторы (мази и гели) используются при артрозах межпозвоночных, мелких и средних суставов. Наружные препараты обладают минимальной биодоступностью (менее 5%) и практически не влияют на структуру хряща, в особенности, если он залегает глубоко под кожей. Зато мази-хондропротекторы благотворно воздействуют на околосуставные ткани, снимают боль и отек, уменьшают воспаление. При отсутствии аллергической реакции их можно использовать постоянно.
Порошки для лечения суставов
Хондропротекторы в уколах
Внутримышечный укол хондропротектора можно сделать самостоятельно или при помощи близких, а вот инъекция в сустав должна проводиться только опытным медицинским работником.
Натуральные хондропротекторы в еде
Людям с больными суставами полезны и растительные коллагеноподобные соединения, которые содержатся в ростках пшеницы, грибах, орехах, брокколи, морских водорослях. В рационе стоит увеличить содержание цитрусовых, листовой зелени.
Даже ежедневное употребление хондропротективных продуктов не гарантирует здоровье хряща при:
К числу лучших хондропротекторов относятся глюкозамин, хондроитин, метилсульфонилметан, гиалуроновая кислота, коллаген II типа, а также ряд вспомогательных средств. Лучше всех, по отзывам пациентов, себя зарекомендовали следующие препараты-хондропротекторы:
Артрадол. Хондроитина сульфат в виде порошка для приготовления внутримышечных инъекций.
Артракам.Глюкозамина гидрохлорид в форме саше (порошок для приема внутрь раствором). Стимулирует восстановление хряща.
Артра.Обладает обезболивающими свойствами, помогает восстановить сустав. Производится в США.
Дона. Глюкозамина сульфат. Выпускается в виде таблеток, саше и раствора для внутримышечного введения. Курс применения:
Румалон. Препарат 1-го поколения в виде раствора для внутримышечных инъекций. Содержит экстракт хрящей и костного мозга крупного рогатого скота.
Курс: 5-6 недель, 3 раза в неделю по 1 мл.
Хондрогард. Выпускается в виде раствора хондроитинсульфата для внутримышечных и внутрисуставных инъекций.
Курс хондропротектора в уколах:
Хондроксид. Хондроитина сульфат в виде таблеток, геля или мази 5%.
Перед применением хондропротекторов из списка желательно посоветоваться c врачом.
Надеемся, что смогли Вам помочь! Здоровья Вам и Вашим близким!
Хондроитин сульфат (Структум) в лечении остеоартроза: патогенетическое действие и клиническая эффективность
Опубликовано в журнале:
Ревматология РМЖ ТОМ 17, № 3, 2009
Чичасова Н.В.
ММА имени И.М. Сеченова
Лечение остеоартроза (ОА) является весьма актуальной проблемой. Связано это со многими факторами. Во–первых, ОА – самое частое заболевание суставов, клинические симптомы которого в целом наблюдаются более чем у 10–20% населения земного шара [1]. Рентгенологические признаки ОА обнаруживаются значительно чаще, чем клинические, частота и тех и других нарастает с возрастом. Например, в США до 70% населения в возрасте старше 65 лет имеют определенные радиологические признаки заболевания [2]. Но развиваться ОА может в любом возрасте. Широкомасштабное исследование в 7 городах бывшего СССР лиц старше 15 лет (41348 человек) выявило клинические проявления ОА у 6,43% [3]. Кроме того, ОА является одной из основных причин преждевременной потери трудоспособности, уступая в этом только ишемической болезни сердца. Известно, что развитие ОА у женщин приводит к уменьшению продолжительности жизни в среднем на 10–15 лет. Показано, что уменьшение продолжительности жизни у пожилого контингента в большей степени зависит от интенсивности боли (рис. 1), чем от наличия или отсутствия жизнеугрожающих заболеваний (например, ИБС, артериальной гипертензии и др.) [4]. При оценке выживаемости 1525 больных, из которых 370 страдали OA (24%), 246 – сердечно–сосудистыми болезнями (16%), а 109 имели сочетание OA и сердечно–сосудистых заболеваний, оказалось, что относительный риск (95% CI) 5–летней смерти больных OA, имевших интенсивность боли >40 мм, по сравнению с больными, имевшими боль Таблица 1. Сравнительная стоимость ОА по отношению ко всей группе скелетно– мышечных заболеваний (СМЗ) [Clocci, 1996; млн. лир]
Хотя ОА может развиваться в различных возрастных группах, но отчетливое нарастание его частоты именно у лиц пожилого возраста также сопряжено с трудностями терапевтических подходов: ухудшение переносимости многих обезболивающих средств, наличие сопутствующих заболеваний и необходимость в использовании лекарств для их лечения. Трудности лечения ОА заключаются также не только в пожилом возрасте большинства пациентов, но и в необходимости длительного многолетнего лечения при трудности оценки эффекта терапии.
Многие годы считалось, что ОА является следствием возрастного «изнашивания » хряща. Однако патогенез ОА намного сложнее (рис. 2). Данная патология рассматривается, как гетерогенная группа заболеваний суставов, патоморфологически характеризующихся фокальным разрушением суставного хряща, изменениями в субхондральной кости (включая микропереломы и образование кист) и образованием остеофитов, а также сопутствующим поражением других компонентов сустава (синовиальная оболочка, связки, капсула и периартикулярные мышцы) [5]. Рентгенологически ОА характеризуется сужением суставной щели, остеофитозом. субхондральным склерозом, образованием кист и неровными костными контурами.
| Рис. 2. Патофизиологическая диаграмма ОА |
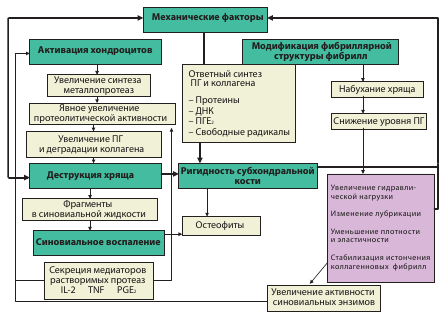 |
Основными звеньями патогенеза ОА являются дегенеративные процессы в хрящевой ткани, развитие воспаления в синовиальной оболочке и патологические процессы в субхондральной кости. Нормальный метаболизм хрящевой ткани изменяется с превалированием катаболических процессов над анаболическими [6]. Одним из самых важных компонентов матрикса хряща являются протеогликаны (макромолекулы, в которых стержневой белок связан с одной или несколькими цепями гликозаминогликанов – ГАГ). ГАГ разделяют на 2 группы: несульфатированные (гиалуроновая кислота, хондроитин) и сульфатированные (хондроитин–сульфат и кератан–сульфат). Совместно с коллагеновыми волокнами ГАГ обеспечивают устойчивость хряща к внешним воздействиям. При ОА синтез хондроцитами ГАГ снижается (табл. 2) [7]. Снижается синтез коллагена II типа с повышением синтеза коллагена I, III, X типов. Активация хондроцитов приводит не только к ухудшению синтеза полноценных компонентов матрикса хряща, но и к повышенной экспрессии провоспалительных цитокинов (интелейкина–1, интелейкина–6, фактора некроза опухоли–a), циклооксигеназы II типа (ЦОГ–2), оксида азота [8]. Важная роль в деградации хряща отводится матриксным металлопротеазам (ММП) [9], основными мишенями которых становятся структурные компоненты экстрацеллюлярного матрикса (протеогликаны и коллаген II типа). Кроме того, коллагенолитические ММП влияют и на функциональную активность клеток субходральной кости, усугубляя остеоклаcтическую резорбцию [10].
| Ткань | Головка бедра | Кондиллус бедра | ||
| Число больных | Синтез ГАГ (М±σ) | Число больных | Синтез ГАГ (М±σ) | |
| Без ОА | 185 | 3,63±0,30 | 15 | 6,02±0,41 |
| ОА легкий | 101 | 2,45±0,15 | 12 | 3,76±0,16 |
| ОА умеренный | 74 | 2,01±0,14 | 15 | 2,39±0,14 |
| ОА тяжелый | 66 | 1,31±0,14 | 5 | 1,95±0,1 |
| Весь ОА | 486 | 1,88±0,38 | 60 | 3,73±0,36 |
При развитии дегенеративных процессов в хрящевой ткани вторично страдают и все остальные структуры сустава: в синовиальной оболочке развивается воспаление (синовит), в подлежащей кости увеличиваются деструктивные процессы (субхондральные кисты) и параллельно с ними идет компенсационное разрастание костной ткани (остеофиты), ослабевает сухожильно–связочный аппарат, что приводит к нестабильности сустава.
Все эти факторы приводят к развитию основного клинического проявления ОА – болевого синдрома, поэтому в первую очередь больным назначается анальгетическая терапия. Рекомендации ВОЗ по лечению ОА динамически изменялись с 1995 г. по 2003 г., отражая получение новых данных об эффективности или недостаточной эффективности различных лечебных мероприятий (табл. 3). На современном этапе считается, что обезболивание при ОА надо начинать с симптом–модифицирующих средств – назначения ацетаминофена (парацетамола), проведения ортопедических мероприятий и назначения нестероидных противовоспалительных препаратов (НПВП) из группы ЦОГ–2 селективных ингибиторов. Далее назначаются структурно–модифицирующие препараты, и только при необходимости назначают неселективные НПВП. К сожалению, в реальной практике НПВП используются очень широко. И врачей, и пациентов привлекает быстрота анальгетического эффекта. Однако следует учитывать, что НПВП наиболее эффективны при выраженных явлениях воспаления в синовиальной оболочке, но дают либо очень кратковременный эффект, либо вообще не эффективны при других причинах болевого синдрома (в частности, при нейропатическом или сосудистом характере болей). Ранее считалось, что подавление образования провоспалительных простагландинов, цитокинов, свободных кислородных радикалов, протеаз (то есть подавление синовита) при назначении НПВП может иметь и некоторое «хондропротективное » действие [11,12]. Позднее появились новые данные, которые освещают негативное влияние неселективных НПВП на синтез матрикса хряща. Некоторые НПВП (ибупрофен, салицилаты, индометацин) при систематическом применении в течение 4–6 мес. ускоряют деструкцию хряща, угнетая синтез простагландинов, пролиферацию хондроцитов, ингибируя ферменты, необходимые для синтеза гликозаминогликанов (ГАГ) [13,14]. Известно, что ГАГ играют центральную роль в супрамолекулярной организации агрегатов простагландинов, и вследствие этого – в биомеханической функции хряща. Применение неселективных НПВП приводит к выраженному снижению содержания гиалуронана в хряще при экспериментальном ОА [15] и в хряще человека [16], не зависящее от возраста пациентов [17,18]. Для некоторых неселективных НПВП показано зависящее от дозы различие воздействия на катаболические и анаболические процессы в хряще. Введение низких доз НПВП (5 мг/кг тиапрофеновой кислоты) в эксперименте in vitro приводило к снижению деградации протеогликановых агрегатов и повышению синтетической активности хондроцитов, а введение более высоких (терапевтических) доз вызывало ускорение катаболических процессов и потерю протеогликанов из хрящевой ткани [19]. Аналогичные данные были получены для диклофенака и индометацина. Кроме того, было показано, что при длительном лечении диклофенаком и тиапрофеновой кислотой происходит гибель остеоцитов в субхондральной кости [20]. Все это свидетельствует, что НПВП при ОА следует использовать короткими курсами и в низких дозах. Однако такой подход не всегда приводит к удовлетворительному обезболиванию больных ОА.
| 1995 г. | 2000 г. | 2003 г. |
| 1. в/с введение ГК (только в коленный сустав) | 1. Неопиоидные анальгетики (ацетаминофен) | 1. Неопиоидные анальгетики (ацетаминофен) |
| 2. Неопиоидные анальгетики (ацетаминофен) | 2. ЦОГ–2 селективные НПВП | 2. Ортопедические мероприятия |
| 3. Локальные анальгетики (мази, кремы, гели) | 3. Неселективные НПВП + мизопростол или ингибиторы протонной помпы (при риске гастропатии) | 3. ЦОГ–2 селективные НПВП |
| 4. НПВП | 4. Другие анальгетики (трамадол, кодеин) | 4. Структурно–модифицирующие препараты (хондроитин сульфат,соли глюкозамина и др.) |
| 5. Опиоидные анальгетики (кодеин, трамадол) | 5. в/с ГК (только в коленный сустав) | 5. в/с гиалуронан |
| — | 6. в/с гиалуронан | 6. авокадо/соя |
| — | 7. Локальные анальгетики (мази, кремы, гели) | 7. неселективные НПВП |
| — | — | 8. Хирургическое лечение |
Следует ясно представлять, что основным патогенетическим механизмом, приводящим к развитию болевого синдрома, является постепенная деградация и снижение синтеза матрикса хряща, потеря им своих амортизационных свойств, изменение свойств синовиальной жидкости (снижение вязкости и эластичности), увеличение нагрузки на субхондральную кость с нарушением баланса костного обмена, отеком костной ткани в подлежащей кости, развитием остеита и остеофитов. Изменения субхондральной кости, видные на рентгенограммах у больных с установленным ОА, скорее, позволяют предполагать их важную роль в развитии этого заболевания, чем рассматривать их как следствие повреждения хряща. Известно, например, что целостность хряща зависит от механических свойств подлежащей кости. Так, изменение субхондральной кости (возможно после повторных микропереломов) вызывает отсутствие абсорбции давления. Роль обмена субхондральной кости при ОА подтверждается в исследованиях in vivo на моделях морских свинок, где отчетливо появлялись изменения в ней раньше, чем развивались изменения в хряще; проспективными исследованиями, в которых костные изменения, определяемые сцинтиграфически, предсказали рентгенографическое прогрессирование в коленных суставах и суставах кистей; увеличенной экспрессией в кости металлопротеиназ матрикса и щелочной фосфатазы при ОА тазобедренных суставов у человека [21].
Хондроитин сульфат является естественным компонентом элементов хряща, играет биологически активную роль во многих процессах метаболизма различных структур сустава. Препарат Структум (хондроитин сульфат) уже давно используется в клинической практике, в том числе и в нашей стране. Фармакокинетические исследования показали, что при приеме внутрь дозы 800–1000 мг/сут. он хорошо абсорбируется и обнаруживается в высоких концентрациях в синовиальной жидкости [22] (прием 500 мг/сут. ХС не сопровождается таким эффектом). Механизм действия ХС многогранен. Очевидно, что его клиническая эффективность определяется влиянием на различные механизмы развития и прогрессирования ОА.
Нарушения обмена и активности хондроцитов при ОА приводит к повреждению матрикса хряща с уменьшением содержания хондроитин сульфата и протеогликанов (рис. 3). С этими процессами неразрывно связана гиперэкспрессия провоспалительных медиаторов, приводящая к воспалительно–дегенеративным процессам в различных структурах сустава и апоптозу хондроцитов. Среди провоспалительных цитокинов при ОА ведущая роль принадлежит интерлейкину 1 (IL–1). Прием Структума в терапевтической дозе 1000 мг/сут. в течение первых 3 месяцев приводит не только к восполнению синтеза ГАГ, но и к отмене IL–1–зависимых патологических эффектов (рис. 4). Это приводит к восстановлению синтетических процессов, уменьшению воспаления и купированию боли, связанной с воздействием агрессивных цитокинов, свободных радикалов, фрагментов фибронектина и металлопротеаз (ММР) на обнаженные болевые рецепторы при дефиците гиалуроновой кислоты. Структум способен подавлять синтез агрессивных ММР и активировать синтез ингибиторов ММР, что также способствует восстановлению равновесия между анаболическими и катаболическими процессами в матриксе хряща. Особая роль в патогенезе ОА принадлежит оксиду азота (NO), который способен ингибировать синтез макромолекул хряща, увеличивать активность ММР матрикса, увеличивать количество простагландинов и лейкотриенов, уменьшать выработку антивоспалительных цитокинов, способствовать апоптозу хондроцитов [23]. Показано, что хондроитин сульфат подавляет NО–индуцированный апоптоз хондроцитов [24]. Кроме того, использование хондроитин сульфата улучшает микроцируляцию субхондральной кости за счет ингибиции синтеза липидов, связывания Е–селектина, мобилизации фибрина, липидов и холестерина в кровеносных сосудах субхондральной кости.
| Рис. 3. Содержание хондроитин сульфата (ХС) в интактном хряще и в хряще при ОА | |
| Высокое содержание ХС в интактном суставном хряще (ув. 200) | Неравномерное уменьшение содержания ХС в хряще при ОА (ув. 200) |
| Рис. 4. Хондроитин сульфат модифицирует деятельность цитокинов/факторов роста [Habara et al., 2002] |
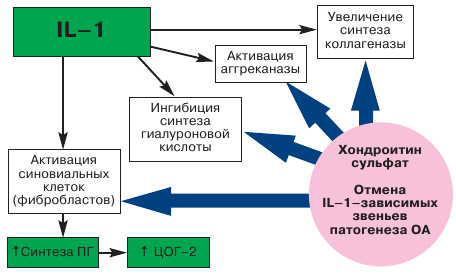 |
Таким образом, хондроитин сульфат воздействует практически на все основные ключевые патогенетические механизмы развития ОА (рис. 5).
| Рис. 5. Структум: механизм действия |
 |
Оценка эффективности медленнодействующих препаратов, к каковым относится Структум (хондроитин сульфат), весьма сложна и кропотлива. Основной целью лечения больного ОА является улучшение качества его жизни за счет уменьшения боли (симптом–модифицирующий эффект) и улучшения функциональных возможностей. В соответствии с современными рекомендациями эти параметры регистрируются с использованием стандартных методов. Оценка боли проводится с использованием визуальных аналоговых шкал (ВАШ) в мм или в баллах, а функциональные возможности пациента оцениваются по индексам Леккена или WOMAC. Следует отметить, что эти методы основаны на субъективных ощущениях больного, что может влиять на статистически обрабатываемые данные. Степень симптоматического эффекта медленнодействующих препаратов можно оценить по изменению потребности больного в приеме обезболивающих средств. Для оценки структурно–модифицирующего действия необходимо проведение строго контролируемых длительных (многолетних) исследований рентгенологических параметров, отражающих прогрессирование ОА: изменение величины суставной щели (отражает степень деградации хряща), состояние субхондральной кости, наличие и величина остеофитов.
Симптом–модифицирующий эффект Структума. Еще в начале 90–х годов прошлого столетия в двойном слепом плацебо–контролируемом исследовании [25] с использованием хондроитина сульфата курсом в 3 месяца, с последующим 2–месячным периодом без лечения, было показано снижение потребления НПВП среди пациентов с гонартрозом, как во время курса терапии, так и в период после ее окончания. Первый опыт применения Структума в нашей стране в лечении гонартроза в течение 6 месяцев (и 3 месяца наблюдения после отмены препарата) показал, что прием суточной дозы 1,0 г Структума уменьшает боль и потребность в НПВП, улучшает функциональное состоянии суставов, повышает качество жизни. Важным оказалось сохранение эффекта Структума в течение 3–х месяцев наблюдения по окончанию его приема [26]. В отечественном многоцентровом (11 центров в различных городах РФ) открытом 6–месячном рандомизированном исследовании [27] было решено оценить эффект и переносимость Структума у больных ОА коленных и тазобедренных суставов. Дизайн исследования представлен на рисунке 6. Все больные в течение 6 месяцев получали либо только назначенную ранее суточную дозу НПВП, либо НПВП и Структум в первые 3 недели 1,5 г и далее по 1,0 г/сут. до 6 месяцев лечения. Затем больные наблюдались длительный период времени (как видно из рисунка 6, весь период исследования занял 540 дней). Основные результаты этого исследования:
| Рис. 7. Итоги многоцентрового исследования препарата Структум в России. Клиническое улучшение у 90,2% пациентов |
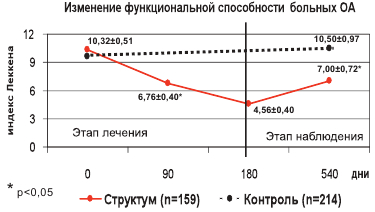 |
| Продолжительность эффекта после отмены Структума составила 4,1 месяца при коксартрозе и 4,6 месяца при гонартрозе |
Кроме того, у больных ОА коленных и тазобедренных суставов, включенных в Российское многоцентровое исследование Л.И. Алексеевой и соавт. [28], было проведено фармакоэкономическое исследование: насколько оправдано с экономической точки зрения использование препаратов с медленным развитием эффекта, требующих непрерывного использования в течения многих месяцев. Оценивались прямые расходы на лекарственную терапию ОА (стоимость Структума и НПВП), расходы на лечение побочных эффектов; стоимость медикаментов и госпитализаций, медицинских услуг оценивали по медико–экономическим стандартам. Прямые расходы на лекарственную терапию ОА увеличиваются больше при назначении Структума, чем при монотерапии НПВП. Однако при использовании Структума значительно снижаются расходы и на приобретение НПВП, и на лечение связанных с ними побочных реакций, кроме того, уменьшилось число госпитализаций и амбулаторных посещений (табл. 5). Так что эффективность на единицу затрат (для расчета использован специальный программный комплекс ПРИНН) значительно возрастала при использовании Структума.
| Параметр | Группа, получавшая Структум (n=159) | Контрольная группа (n=214) | p |
| Число обострений ОА | 1,75±0,17 | 3,7±0,22 | |
| Число госпитализаций | 0,23±0,04 | 0,7±0,06 | |
| Число койко–дней | 25,32±2,57 | 24,04±0,97 | >0,05 |
| Количество амбулаторных обращений | 0,4±0,18 | 2,83±0,18 | |
| Число дней нетрудоспособности | 3,9±0,88 | 8,4±0,89 |
Симптом–модифицирующий эффект Структума зарегистрирован во многих зарубежных рандомизированных контролируемых исследованиях: достоверное уменьшение боли по сравнению с монотерапией НПВП [29,30], улучшение функциональной способности суставов, хорошая переносимость, в связи с чем было проведено 2 мета–анализа (напомним, что мета–анализ контролируемых клинических исследований обладает наибольшей степенью доказательности), объединивших данные по изучению клинической эффективности и переносимости Структума у 776 больных ОА коленных и тазобедренных суставов, включенных в двойные слепые контролируемые исследования [31,32]. Все полученные данные свидетельствуют о наличии у Структума собственного анальгетического и противовоспалительного действия, что проявляется в уменьшении клинических признаков ОА (боль, скованность, ограничение движений) на фоне уменьшения суточной дозы или отмены НПВП и других анальгетиков, а также о хорошей переносимости препарата. Эти данные нашли отражение в рекомендациях EULAR 2003, 2005 и 2007 гг. [33–35].