Что лучше тримедат или необутин при синдроме раздраженного
Что лучше тримедат или необутин при синдроме раздраженного
Е.В. Бородулина, И.В. Мареев, М.Ю. Колокольцова, И.А. Самыкина, В.В. Удут
Научно-исследовательский институт фармакологии и регенеративной медицины им. Е.Д. Гольдберга ФГБНУ «Томский национальный исследовательский медицинский центр» Российской академии наук, Томск
Введение
Синдром раздраженного кишечника (СРК) – дизрегуляторное состояние сложного генеза, при котором нарушения регуляции функциональной активности кишечника, вегетативный дисбаланс, изменения в нейрогуморальной системе, снижение выработки эндогенных опиатов реализуются с участием психосоматических наслоений. Значимую роль в становлении патологии играют нарушения кишечного микробиома и воспалительные изменения стенки кишки с цитокиновым дисбалансом. Совокупность обозначенных факторов приводит к висцеральной гиперчувствительности, нарушению моторики кишечника и замедлению транзита газов по нему, что проявляется такими симптомами, как боль, метеоризм, нарушения частоты и консистенции стула.
Принимая во внимание, что в желудочно-кишечном тракте (ЖКТ) присутствуют три основных типа опиоидных рецепторов (µ, δ и κ), а основным клиническим проявлением СРК является боль, во многом определяющаяся состоянием опиоидных рецепторов в центральных и периферических структурах, патогенетически оправдано применение при этом заболевании тримебутина, механизм действия которого заключается в стимуляции периферических энкефалиновых рецепторов, при этом связывание с κ-рецепторами приводит к снижению мышечной активности, а взаимодействие с µ- и δ-рецепторами вызывает ее активацию [1–4]. Благодаря этим эффектам тримебутин купирует дискоординацию моторики всех отделов ЖКТ, а его эффекты в отношении снижения висцеральной гиперчувствительности позитивно сказываются на проявлениях ведущего симптома СРК – боли.
Результаты значительного числа клинических исследований и богатый опыт применения препарата при нарушениях ЖКТ демонстрируют высокую эффективность тримебутина в моно- и комбинированной терапии СРК при курсе лечения от 4 до 12 недель. При этом, если и обозначаются варианты однократной дозы (от 100 до 200 мг), дискретность назначения постоянна (3 раза в сутки). То есть клинический опыт доказывает достаточность суточной дозировки в 600 мг. Вместе с тем, согласно современным данным о фармакокинетике тримебутина, а на отечественном рынке присутствуют его генерики (Необутин и Тримедат), время достижения которыми Сmax составляет 2 часа, а Т1/2 – 12 часов, повышение комплаенса без ущерба эффективности возможно реализовать двукратным приемом препарата при соблюдении суточной дозировки в 600 мг.
В соответствии с этим целью исследования стало сравнение эффективности и безопасности применения препаратов Необутин® Ретард (таблетки пролонгированного действия, покрытые пленочной оболочкой, 300 мг производства АО ФП «Оболенское», Россия) и Тримедат® (таблетки 200 мг производства ОАО «Валента Фармацевтика», Россия) больными СРК в острый период и в период ремиссии (Разрешение № 482 на проведение клинических исследований от 31.10.2012 МЗ РФ).
Материал и методы
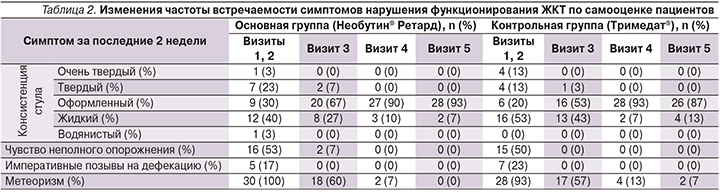
В исследование были включены пациенты с верифицированным диагнозом «синдром раздраженного кишечника». Диагноз подтверждался наличием соответствующей клинической картины, а также результатами лабораторно-инструментального обследования. Для исключения органической патологии ЖКТ и вторичного характера функционального расстройства кишечника анализировались данные полной колоно- или сигмоидоскопии, проведенных после возникновения симптомов СРК и в течение последних 5 лет до визита рандомизации. До начала терапии клиническая картина СРК у включенных в исследование пациентов характеризовалась наличием симптомов нарушения функциональной активности ЖКТ различной степени выраженности. При первичном осмотре пациенты предъявляли жалобы на боль в животе, измененную консистенцию стула, чувство неполного опорожнения кишечника, императивные позывы на дефекацию, запоры, диарею, метеоризм.
Для равномерного распределения прогностических факторов, обеспечения надежной статистической основы оценки различий между пациентами исследуемых групп и минимизации вклада личностного фактора исследователя была предусмотрена рандомизация методом конвертов. Основная группа включала 30 человек, получавших Необутин® Ретард, таблетки пролонгированного действия, покрытые пленочной оболочкой, 300 мг (АО ФП «Оболенское», Россия) 2 раза в сутки; контрольная группа – 30 пациентов, которым назначался Тримедат®, таблетки 200 мг (ОАО «Валента Фармацевтика», Россия) 3 раза в сутки. Таким образом, суммарная суточная доза составила 600 мг для пациентов обеих групп. Исследование проведено на базе двух клинических центров. В соответствии с принципами Хельсинкской декларации на этапе скрининга получено информированное согласие пациентов. С целью верификации причин, препятствующих с медицинской точки зрения участию в исследовании, собиралась исходная информация о пациенте (демографические данные, анамнез, наследственность, перенесенные заболевания, физикальный осмотр, лабораторные данные).
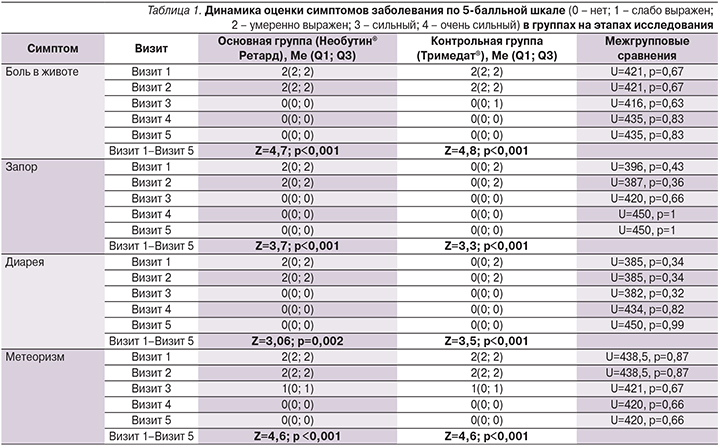
Исходно основные популяционные параметры характеризовались межгрупповой однородностью. Так, средний возраст пациентов, получавших Необутин® Ретард, составил 49±12 лет, пациентов, получавших Тримедат, – 47±11 лет, группы по данному показателю были сопоставимыми (t=0,88, p=0,38). По полу межгрупповые различия также были статистически не значимыми (χ²=0,42, p=0,519). До начала терапии интенсивность симптомов нарушения функционирования ЖКТ практически не различалась в сравниваемых группах (табл. 1).
На каждом из пяти предусмотренных протоколом визитов проведен физикальный осмотр (измерение артериального давления, частоты сердечных сокращений, температуры тела; пальпация органов брюшной полости); фиксировались и оценивались по 5-балльной шкале симптомы нарушения функционирования ЖКТ; оценивалось качество жизни по опроснику SF-36; оценивались терапия сопутствующих заболеваний, а также наличие и выраженность нежелательных явлений. Процедуры скрининга реализованы на 1-м визите. Рандомизация по группам лечения осуществлена на 1-м визите, а исследуемый препарат выдан после проведения всех требуемых по протоколу процедур на визитах 2 и 3. В отсутствие критериев невключения в исследование визит 1 (скрининг) был совмещен с визитом 2 (рандомизация). На 3-м и 4-м визитах, соответствовавших 14 и 28 дням приема препарата, также проведена оценка комплаентности лечению. Длительность терапии составила 28 дней. Заключительный визит 5 был осуществлен через 4 недели после завершения лечения.
Для обработки результатов использованы методы описательной статистики. Значения качественных показателей представлены в виде абсолютных величин, долей (N, %), в виде M±SD для количественных данных, подчиняющихся нормальному закону распределения, где M – среднее значение, SD – стандартная девиация; в виде Me (Q1; Q3) для порядковых данных и количественных данных, не подчиняющихся нормальному закону распределения, где Me – медиана, Q1 – нижний квартиль, Q3 – верхний квартиль. Сравнения количественных нормально распределенных данных произведены с использованием параметрического t-критерия Стьюдента для связанных групп. Для сравнения порядковых и количественных данных, не соответствовавших нормальному закону распределения, использованы метод знаков (Z-критерий), парный тест Вилкоксона (Wilcoxon signed-rank test). Для сравнения связанных групп данных, не подчинявшихся нормальному закону распределения, порядковых данных применен критерий Манна–Уитни (Mann-Whitney test), для бинарных качественных признаков – критерий хи-квадрат (Сhi-square test) [6].
Результаты исследования и их обсуждение
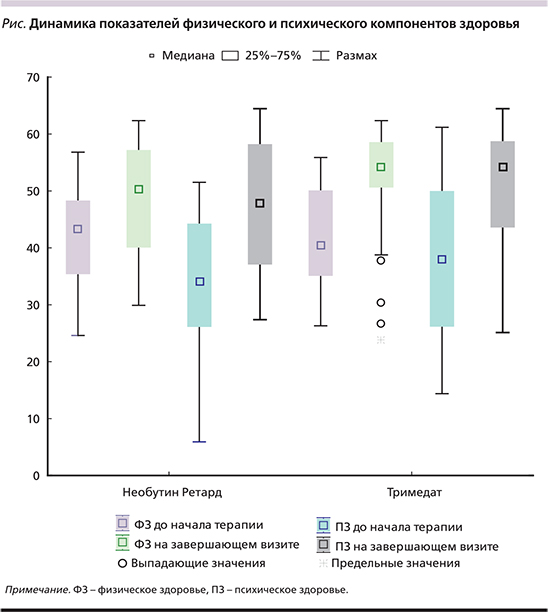
Клиническая эффективность терапии оценивалась комплексно: как по субъективным характеристикам наличия, выраженности и частоты отдельных симптомов, ощущений пациентом психического и физического компонентов здоровья, так и по клинико-лабораторным результатам динамики состояния, а также приверженности назначенному варианту терапии.
Полученные данные демонстрируют факт купирования основных симптомов СРК к окончанию срока проведения терапии: улучшение состояния отмечали все пациенты независимо от назначенного препарата (табл. 1). При этом уже через 14 дней после начала лечения проявилось значимое снижение интенсивности болевых ощущений (Z1=4,5, p
1. Белоусова Е.А. Идиопатический медленнотранзитный запор: механизмы развития и возможности лечения. Фарматека. 2010;15:18–23.
2. Нolzer P. Opioid receptors in gastrointestinal tract. Regulatory peptides. 2009;155(1–3):11–3.
3. Ивашкин В.Т., Драпкина О.М. Современные возможности применения тримебутина в лечении хронической абдоминальной боли. РЖГГК. 2008;5:12–6.
4. Тропская Н.С., Попова Т.С. Механизм действия тримебутина в коррекции функциональных расстройств желудочно-кишечного тракта. Кл. гастроэнтерология и гепатология. Русское издание. 2008;1(4):294–97.
5. Брюшинина О.С., Гурто Р.В., Соловьев М.А., Бородулина Е.В., Трифонова О.Ю., Гриднева Т.Д., Удут В.В. Проблемные вопросы изучения фармакокинетики тримебутина. Бюллетень физиологии и патологии дыхания. 2014;54:82–6.
6. Гланц С. Медико-биологическая статистика. Пер. с англ. М., 1998. С. 459.
7. Минушкин О.Н., Елизаветина Г.А. Патофизиология абдоминальной боли. Современные подходы к терапии моторных нарушений. Эффективная фармакотерапия/Гастроэнтерология. 2012;3:52–60.
8. Трухан Д.И., Гришечкина И.А., Быховцев Н.А. Тримебутин в лечении синдрома раздраженного кишечника и других функциональных гастроинтестинальных расстройств. Медицинский совет/Гастроэнтерология. 2016;19:82–6.
Что лучше тримедат или необутин при синдроме раздраженного
Функциональные гастроинтестинальные расстройства (ФГИР) в настоящее время рассматриваются как наиболее распространенная патология желудочно-кишечного тракта (ЖКТ), в основе которой лежат комбинированные морфологические и физиологические отклонения, связанные с висцеральной гиперчувствительностью, нарушениями моторики ЖКТ, защитного слизистого барьера, иммунной функции и состава кишечной микробиоты, а также расстройствами со стороны центральной нервной системы (ЦНС).
Изучением патофизиологии ФГИР, разработкой, совершенствованием и внедрением их классификации, диагностических критериев и практических алгоритмов ведения пациентов занимается международная группа экспертов. В мае 2016 года состоялась официальная презентация «Римских критериев- IV», которые определяют ФГИР как «расстройства взаимодействия «кишка–головной мозг» («ЖКТ-ЦНС») (disorders of gut-brain interaction) [1].
В последней редакции «Римских критериев» официальное признание получил синдром перекреста функциональных нарушений (overlap syndrome), т.е. возможность наличия у пациента одновременно нескольких функциональных нарушений и переход их из одной формы в другую, например сочетание СРК и ФД [1].
Практикующему врачу, с учетом многообразия клинической картины функциональных нарушений, приходится часто корректировать лечение в связи с меняющейся клинической картиной, в том числе при сочетанных функциональных нарушениях, например СРК+ФД, СРК + билиарная дисфункция, ФД + билиарная дисфункция, а также при смене клинического варианта СРК. Все это требует пересмотра подхода к терапии и заставляет врача постоянно изменять тактику лечения.
Соответственно актуальным является оптимизация лекарственной терапии, подразумевающая в лечебной тактике ФГИР приоритет применения препаратов, обладающих мультитаргетным эффектом, влияющим одновременно на несколько патогенетических звеньев этих заболеваний или же оказывающим благоприятное действие при наличии коморбидной патологии. К патогенетическим факторам ФГИР, которые можно считать доказанными в настоящее время, относятся нарушения моторики ЖКТ и висцеральная гиперчувствительность [2, 3].
Одним из широко применяемых и хорошо изученных регуляторов моторики является тримебутин – универсальный регулятор моторики ЖКТ, который является полным агонистом всех трех типов периферических опиоидных рецепторов. Тримебутин – 2–(диметиламино)–2–фенилбутилэфир 3,4,5–триметоксибензойной кислоты – синтезирован Laboratoires Jouveinal (Франция) в 1969 г. По фармакологическому указателю тримебутин относится к группам «Спазмолитики миотропные» и «Стимуляторы моторики ЖКТ, в том числе рвотные средства». По АТХ – к группе «Препараты для лечения функциональных расстройств кишечника» и имеет код A03AA05.
Механизм действия тримебутина заключается в стимуляции периферических опиоидных (энкефалиновых) рецепторов (μ-, k-, δ-) на протяжении всего желудочно-кишечного тракта (ЖКТ). Связывание с k-рецепторами приводит к снижению мышечной активности, а связывание с μ- и δ-рецепторами вызывает ее стимуляцию. При этом препарат не оказывает влияние на другие рецепторы. Тримебутин оказывает прямое действие на гладкомышечные клетки через рецепторы на миоцитах и в ганглиях энтеральной нервной системы, имитируя действие энкефалинов [4, 5]. Описано воздействие Тримебутина на Na+ каналы, обуславливающие анестезирующее действие препарата и прямой спазмолитический эффект [6]. Тримебутин воздействует на антиноцицептивную систему организма с повышением порога болевой чувствительности, модификацией оценки боли, снижением чувствительности рецепторов к медиаторам воспаления. Более того, тримебутин обладает местным обезболивающим действием, которое в 17 раз превышает действие лидокаина [7]. Отмечено и влияние тримебутина на потенциал-зависимые Ca каналы: L-тип Ca++ каналов / BKca каналы, что объясняет его физиологичность: тримебутин поддерживает гомеостаз мышечной клетки в ЖКТ, за счет того, что ограничивает выход К+ из клетки [8].
Тримебутин стимулирует эвакуаторную функцию желудка, нормализует моторику кишечника, способствует купированию ощущения вздутия и дискомфорта, благоприятно действует как при гиперкинетических, так и при гипокинетических формах нарушений моторной деятельности ЖКТ [7, 8]. Действие тримебутина на висцеральные сенсорные афферентные нервы дополняет его благоприятный эффект при лечении функциональных заболеваний ЖКТ. Кроме того, тримебутин оказывает влияние и на гуморальную регуляцию моторики ЖКТ, активируя энтеральную нервную систему, способствуя высвобождению желудочно-кишечных гормонов – мотилина, вазоактивного интестинального пептида (ВИП), гастрина и глюкагона, обладающих прокинетическим потенциалом [4, 9, 10].
Таким образом, тримебутин является селективным желудочно-кишечным спазмолитиком с выраженной анастезирующей и прокинетической активностью. На протяжении многих лет тримебутин применяется в различных странах мира для лечения функциональных нарушений ЖКТ у взрослых и детей.
Эффективность тримебутина при лечении синдрома раздраженного кишечника (СРК) продемонстрирована в ряде мета-анализов [11–14] и обзоров [9, 15]. Тримебутин благоприятно действует как при гипокинетических, так и при гиперкинетических формах нарушений моторной деятельности кишечника. Тримебутин назначают по 100 – 200 мг 3 раза в сутки, перед едой (на курс 3–4 недели). У больных с СРК с преобладанием кишечной гипотонии исключительно эффективен тримебутин по 300 мг/сут, через 7 дней дозу увеличивают до 600 мг/сут. [9]. Модулирующий эффект тримебутина на моторику кишечника у больных СРК продемонстрирован в российском исследовании [10], в котором через 4 недели терапии препаратом тримебутином в суточной дозе 600 мг у пациентов с СРК с запорами частота стула увеличилась у 94 % больных, а у пациентов с СРК с диареей уменьшилась у 75 % больных. В рандомизированном исследовании, проведенном в Китае, включавшем пациентов с функциональной диспепсией и СРК с диареей, показана высокая эффективность тримебутина в коррекции диареи [16].
При проведении клинических исследований разные авторы относили тримебутин к различным фармакологическим группам, в зависимости от механизма влияния на ЖКТ. При изучении действия тримебутина на гиперкинетические расстройства моторики и выраженность абдоминальной боли исследователи относили препарат к группе спазмолитиков [12], а при изучении его влияния при гипокинетических расстройствах ЖКТ препарат расценивался как прокинетик [17]. Ретроспективное наблюдение в течение 4 лет за пациентами с СРК свидетельствует о наибольшей эффективности в лечении СРК тримебутина в комбинации с анксиолитиками и пробиотиками [18]. Эффективность тримебутина в лечении пациентов с хроническим запором: увеличение толстокишечного транзита и частоты стула – отмечена и в ряде других исследований [19–21].
В сравнительных исследованиях отмечена сравнимая клиническая эффективность тримебутина с другими спазмолитиками: пинаверия бромидом [22], мебеверином [23, 24] и феноверином [25] в лечении пациентов с СРК.
Тримебутин представляется препаратом выбора при сочетанной патологии – ФД и СРК как наиболее частой ассоциации нарушений моторики (желудок, двенадцатиперстная кишка, кишечник). Эффект тримебутина связан с восстановлением разных форм расстройств моторики желудочно-кишечного тракта (как верхних – желудок, двенадцатиперстная кишка, так и толстого кишечника) [26–29]. Ускорение опорожнения желудка в сочетании со снижением висцеральной гиперчувствительности позволяет тримебутину эффективно воздействовать и на симптомы ГЭРБ, что было продемонстрировано в греческом исследовании при лечении тримебутином пациентов с СРК и сопутствующей ГЭРБ [30]. В исследовании прокинетических эффектов тримебутина было показано ускорение эвакуации жидкости из желудка на 19 % и модулирующее действие тримебутина на электрическую активность ЖКТ [31].
В одном из первых исследований применения тримебутина при патологии билиарного тракта была отмечена его эффективность регуляции моторики и тонуса сфинктера Одди после холецистэктомии [32]. Дальнейшее исследование применения тримебутина в терапии пациентов с функциональными расстройствами билиарной системы подтвердило, что тримебутин эффективно купирует симптомы функциональных и диспепсических расстройств у большинства пациентов с дисфункциями желчного пузыря и сфинктера Одди [4, 33]. Четырехнедельный курс терапии тримебутином 200 мг 3 раза в день приводит к нормализации сократительной функции желчного пузыря у больных с функциональными расстройствами как гипомоторного, так и гипермоторного типа. Тримебутин оказывает спазмолитическое действие на сфинктер Одди у больных желчнокаменной болезнью, перенесших холецистэтомию, что подтверждается существенным уменьшением диаметра холедоха к завершению курсовой терапии у большинства пациентов. При этом тримебутин хорошо переносится больными, не оказывает побочных эффектов и не влияет на показатели клинического и биохимического анализа крови, что подтверждает его безопасность [4]. Исследование на здоровых пациентах показало отсутствие влияния на ЧСС и показатели автономной нервной системы [34].
Еще одним свидетельством безопасности тримебутина является и опыт его применения в педиатрической практике. Тримебутин в форме суспензии разрешен к применению с младенческого возраста, в таблетированной форме с 3-летнего возраста.
Согласно многочисленным обзорам [35, 36], применение тримебутина у детей с СРК высокоэффективно (имеет уровень доказательности В) и безопасно. В исследовании C. Dupont и соавт. [8] был показан достоверный положительный эффект применения тримебутина у детей с функциональными нарушениями моторики желудочно-кишечного тракта. В турецком исследовании [37] у 345 детей (4–18 лет) с СРК терапия тримебутином была эффективна у 94,9 % группы тримебутина по сравнению с 20,5 % группы сравнения, в которой использовались немедикаментозные методы (р
Клиническая эффективность и безопасность схем лечения синдрома раздраженного кишечника
(результаты сравнительного исследования)
И.В.Маев, А.А.Самсонов, А.В.Яшина, Д.Н.Андреев, В.А.Шестаков, С.А.Караулов
ГБОУ ВПО Московский государственный медико-стоматологический университет им. А.И.Евдокимова Минздрава России. 127473, Россия, Москва, ул. Делегатская, д. 20, стр. 1
Приведены результаты сравнительного неинтервенционного наблюдательного исследования по оценке эффективности и безопасности применения препарата Колофорт в лечении синдрома раздраженного кишечника в сравнении с препаратом тримебутина.
Ключевые слова: синдром раздраженного кишечника, Колофорт, тримебутин.
aleksey.samsonov@gmail.com
Для цитирования: И.В.Маев, Самсонов А.А., Яшина А.В. и др. Клиническая эффективность и безопасность схем лечения синдрома раздраженного кишечника (результаты сравнительного исследования). Consilium Medicum. 2016; 18 (8): 19–26.
Clinical efficacy and safety of treatment regimens for irritable bowel syndrome (a comparative study)
A.I.Evdokimov Moscow State University of Medicine and Dentistry of the Ministry of Health of the Russian Federation. 127473, Russian Federation, Moscow, ul. Delegatskaia, d. 20, str. 1
The results of the comparative non-interventional observational study held to evaluate the efficacy and safety of Kolofort in the treatment of irritable bowel syndrome in comparison with trimebutine are given below.Key words: irritable bowel syndrome, Kolofort, trimebutine.
For citation: I.V.Maev, Samsonov A.A., Yashina A.V. et al. Clinical efficacy and safety of treatment regimens for irritable bowel syndrome (a comparative study). Consilium Medicum. 2016; 18 (8): 19–26.
aleksey.samsonov@gmail.com
Синдром раздраженного кишечника (СРК) – наиболее распространенная и изученная патология среди функциональных расстройств желудочно-кишечного тракта (ЖКТ), затрагивающая до 25% популяции [1]. Доля пациентов с СРК, обращающихся за амбулаторной медицинской помощью, составляет 12% и на сегодняшний день является самой большой подгруппой больных в гастроэнтерологических клиниках [2]. Одна из причин пристального внимания к проблеме СРК – несоответствие тяжести состояния пациента и благоприятного прогноза течения заболевания предъявляемым жалобам и субъективной тяжести симптоматики, существенно снижающим качество жизни пациентов и их трудоспособность [3].
Согласно недавно опубликованным Римским критериям IV пересмотра, СРК определяется как функциональное расстройство, при котором периодические боли в животе наблюдаются в среднем по крайней мере 1 день в неделю за последние 3 мес и связаны с 2 или более критериями:
1) дефекацией;
2) изменением частоты стула;
3) изменением формы стула на протяжении последних
3 мес при общей продолжительности жалоб не менее 6 мес.
Римские критерии IV не противоречат Римским критериям III, но исключают термин «дискомфорт» и еще более уточняют временные рамки наличия симптомов [4].
Клинические проявления СРК характеризуются наличием болевого синдрома, что отличает СРК от других функциональных расстройств, и нарушением стула разного характера – запор, диарея и их сочетание.
В зависимости от типа стула выделяют 4 вида (типа) СРК – с преобладанием запоров (СРК-З), с преобладанием диареи (СРК-Д), смешанный (СРК-С) и неспецифический (СРК-Н). Однако в практике часто наблюдается гетерогенность симптомов и «перемещение» одного и того же пациента из одного вида СРК в другой [4].

К факторам, вызывающим или провоцирующим развитие симптомов, относят феномен висцеральной гиперчувствительности, перенесенную острую кишечную инфекцию или не связанное с ней нарушение микрофлоры кишечника, наследственную предрасположенность, средовые факторы и стрессовые воздействия [5, 6]. Также к факторам риска СРК относят молодой возраст и женский пол [3]. Данные компоненты этиопатогенеза СРК отдельно или в совокупности ведут к нарушению по оси «мозг–кишечник» – регуляции между центральной нервной системой (ЦНС) и энтеральной нервной системой (ЭНС) [7]. Ключевая задача последней – регуляция основных функций кишечника, в частности ритмической моторной активности тонкой и толстой кишки. В настоящее время большое значение в патогенезе уделяется процессам воспаления в кишечнике, дисбалансу иммунных процессов в кишечнике [8, 9]. В частности, установлена роль мастоцитов, энтероэндокринных клеток в кишечнике и дисбаланса ряда цитокинов, включая фактор некроза опухоли a (ФНО-a), гистамин, серотонин, интерлейкины (ИЛ-1b, 6, 10), что проявляется персистирующим субклиническим воспалением [10]. 
Терапия пациентов с СРК является трудной задачей, несмотря на обилие лекарственных препаратов. В настоящее время используются спазмолитики, слабительные средства, препараты для купирования диареи, ветрогонные, комбинированные препараты, про- и пребиотики, антибиотики, антидепрессанты и нейролептики [11, 12]. Эффективность препаратов указанных групп показана во множестве клинических исследований с разным уровнем доказательности. Тем не менее до настоящего времени не существует универсальной схемы терапии СРК, которая одинаково хорошо подходила бы ко всем его типам. Гетерогенность клинических проявлений, «перемещение» пациентов из одного типа в другой обусловливают необходимость приема нескольких препаратов, что существенно снижает приверженность пациентов лечению, эффективность терапии и, следовательно, качество жизни [13, 14]. В связи с этим представляются важным поиск и применение препаратов для лечения СРК, не только обладающих симптоматическим действием, но и влияющих на его патогенетические механизмы, что позволило бы обеспечить высокую терапевтическую эффективность вне зависимости от типа СРК.
Недавно в арсенале врача появился новый отечественный комбинированный лекарственный препарат для лечения СРК – Колофорт, созданный на основе антител к мозгоспецифическому белку S-100, ФНО-a и гистамину, прошедших технологическую обработку в процессе производства. В результате в состав Колофорта входят релиз-активные антитела, которые оказывают воздействие на молекулы-мишени – не блокируют, а модифицируют активность белка S-100, рецепторов к гистамину и ФНО-a. Сочетание трех активных компонентов позволяет осуществлять комплексное воздействие на центральные и периферические звенья патогенеза функциональных нарушений кишечника и, в частности, СРК [15].
Полученные в ходе экспериментальных и клинических исследований данные о влиянии Колофорта на функциональное состояние ЖКТ показали, что благодаря нормализующему действию на его моторику, противовоспалительному и успокаивающему эффектам препарат обладает достоверной терапевтической эффективностью при СРК. Колофорт уменьшает боль и висцеральную гиперчувствительность, нормализует паттерн стула, улучшает качество жизни пациентов, положительно влияет на эмоциональные нарушения [16, 17].
Наиболее часто при СРК для купирования болевого синдрома используются спазмолитики. Их применение терапевтически оправдано как в отношении боли в животе, поскольку одна из ее причин – аномальное сокращение гладких мышц в ЖКТ, так и спазма как причины нарушенного кишечного транзита. Широко применяемый спазмолитик при СРК – синтетический холиноблокатор тримебутин (торговое название Тримедат), относящийся к эфирам с третичной аминогруппой и фармакодинамически оказывающий агонистическое действие на энкефалиновую систему кишечника – периферические опиатные рецепторы. Согласно данным официальной инструкции по применению, тримебутин регулирует моторику ЖКТ без влияния на ЦНС, восстанавливая нормальную физиологическую активность мускулатуры кишечника [18]. Нормализуя висцеральную чувствительность, он обеспечивает анальгетический эффект при абдоминальном болевом синдроме. Клинические исследования и лечебная практика демонстрируют успешное применение тримебутина в лечении пациентов с СРК [19].
С учетом изложенного представляется интересным клиническое изучение сравнительной эффективности и безопасности терапии СРК препаратами Колофорт и Тримедат в рутинной практике.
Целью исследования явилась оценка эффективности и безопасности применения препарата Колофорт в терапии СРК в сравнении с Тримедатом.
Неинтервенционное сравнительное клиническое исследование в параллельных группах проводилось с октября 2014 г. по июнь 2016 г. на базе клиники кафедры пропедевтики внутренних болезней и гастроэнтерологии ГБОУ ВПО «МГМСУ им. А.И.Евдокимова».
В исследование включались амбулаторные пациенты обоего пола в возрасте от 18 до 60 лет с установленным диагнозом СРК всех подтипов, который соответствовал Римским критериям III (2006 г.), согласно которым СРК – функциональное расстройство, при котором боль или дискомфорт в животе уменьшается после дефекации, связаны с изменением частоты и консистенции стула, возникают не менее 3 дней в месяц на протяжении последних 3 мес при общей продолжительности жалоб не менее 6 мес [20].
Поскольку исследование носило неинтервенционный характер, до включения в исследование лечащим врачом была назначена терапия препаратом Колофорт или Тримедат. В зависимости от этого пациенты были распределены в одну из двух групп – 1-я группа (основная, группа Колофорта) и 2-я группа (сравнения, группа Тримедата). Колофорт был назначен врачом по схеме: первые 2 нед приема 2 таблетки 3 раза в сутки, начиная с 15-го дня – по 2 таблетки 2 раза в сутки. Тримедат был назначен по 1 таблетке (200 мг) 3 раза в день. Длительность лечения – 12 нед.
Помимо объективного обследования в данном исследовании для оценки клинической динамики симптомов СРК использовались визуальная аналоговая шкала (ВАШ) при СРК, Бристольская шкала формы стула, расчет суммарного индекса висцеральной чувствительности по шкале VSI (Visceral Sensitivity Index) и опросник для оценки качества жизни при СРК (IBS-QoL).
После подписания пациентом информированного согласия на визите 1 подтверждалась возможность его участия в исследовании в соответствии с критериями включения/невключения (табл. 1). В течение последующего периода лечения (12 нед) пациенты совершали еще 4 визита в медицинский центр, в ходе которых проводились объективное обследование, тестирование по указанным опросникам и шкалам, регистрировались сопутствующая терапия (если такая применялась), а также возможные нежелательные явления.
Для оценки эффективности лечения использовались следующие критерии:
• Первичные:
1. Доли пациентов, у которых отмечается снижение выраженности боли/дискомфорта по ВАШ на 30% и более от исходного значения на визитах 3 и 5.
2. Доли пациентов, у которых отмечается снижение выраженности боли/дискомфорта по ВАШ на 90% и более от исходного значения на визитах 3 и 5.
• Вторичные:
1. Доля пациентов в подгруппе СРК-Д с изменением типа стула по Бристольской шкале формы стула до 5 и менее (в среднем за 1 нед).
2. Динамика изменения типа стула по Бристольской шкале.
3. Доля пациентов в подгруппе СРК-З, у которых число актов дефекации увеличилось в среднем на 1 раз в неделю по сравнению с исходным уровнем.
4. Динамика количества актов дефекации у пациентов с СРК-З.
5. Динамика результатов оценки по ВАШ.
6. Динамика значений суммарного балла индекса висцеральной чувствительности по опроснику VSI.
7. Динамика значений суммарного балла опросника качества жизни IBS-QоL.
В процессе исследования выполнялись 5 визитов пациента к врачу: визит 1 (день 0), визит 2 (день 14±3), визит 3 (день 28±3), визит 4 (день 56±3), визит 5 (день 84±3). На каждом визите проводились объективное обследование пациента, включающее измерение массы тела, артериального давления, частоты сердечных сокращений, температуры тела, и оценка безопасности, заполнение опросников ВАШ, VSI, IBS-QoL и определение типа стула по Бристольской шкале. Кроме этого, на визите 1 пациенты подписывали форму информированного согласия, а также проводилась проверка соответствия критериям включения/невключения. Определение критериев безопасности было связано с наличием, характером и продолжительностью нежелательных явлений, их связью с приемом препарата, выраженностью и другими характеристиками, в связи с чем проводилось заполнение соответствующей формы для оповещения отдела клинической безопасности компании-производителя. Для обработки полученных данных использовались стандартные методы описательной статистики, включая дисперсионный анализ, метод Generalized estimating equations (GEE), расчет t-критерия Стъюдента, точного критерия Фишера, критерий χ2, критерий Кохрана–Мантеля–Хенсзеля (модификация критерия χ2 для множественных сравнений), критерий Фаррингтона–Мэннинга.
Результаты исследования
Таким образом, по возрастному, половому составу и исходным клиническим характеристикам исследуемые группы были сопоставимы.
Влияние сравниваемой терапии на болевой синдром
В качестве первичных критериев в данном исследовании оценивалось влияние терапии на болевой синдром, поскольку боль при СРК – один из ключевых симптомов, традиционно рассматриваемый в качестве терапевтической мишени в клинических исследованиях [20]. Также динамика болевого синдрома по ВАШ оценивалась в целом в качестве вторичного критерия.
В соответствии с выбранными первичными критериями эффективности оценивалась доля пациентов со снижением выраженности боли/дискомфорта по ВАШ на 30% и более от исходного значения на визитах 3 и 5. Выбор данного значения был сделан в соответствии с существующими подходами к проведению клинических исследований при СРК – снижение боли в животе на 30% по сравнению с исходным уровнем считается клинически значимым [20].
Через 4 нед терапии, к визиту 3, доля пациентов со снижением боли по ВАШ на 30% и более была сопоставима в обеих группах: 62% пациентов в группе Колофорта и 60% – в группе Тримедата [критерий χ2: χ2=0,07; p=0,7867; критерий Фаррингтона–Мэннинга (nonferiority test): z=1,53; p=0,0633]; рис. 2.
Однако к визиту 5, окончанию курса наблюдения и терапии сравниваемыми препаратами, продемонстрировано статистически значимое превосходство терапии Колофортом по сравнению с Тримедатом: уменьшение выраженности боли на 30% и более отмечено у 95% пациентов основной группы против 84% пациентов в группе сравнения [критерий χ2: χ2=4,4; p=0,0368; критерий Фаррингтона–Мэннинга (nonferiority test): z=3,7; p=0,0001]; рис. 2, 3.
При оценке доли пациентов, у которых отмечено снижение выраженности боли/дискомфорта по ВАШ на 90% и более от исходного значения на визитах 3 и 5, получены сопоставимые данные в сравниваемых группах с тенденцией к лучшим показателям в группе Колофорта, что может говорить о необходимости более длительной терапии СРК (рис. 4).
В целом под действием обоих препаратов в течение всего периода наблюдения отмечалась отчетливая сопоставимая положительная динамика в отношении купирования болевого синдрома с тенденцией к несколько большей эффективности в группе Колофорта (дисперсионный анализ: фактор «Группа» F1/145=0,7, p=0,4122; фактор «Визит» F3/435=2,2, p=0,1115; фактор «Группа*Визит» F3/435=3,7, p=0,0229; ковариата «Визит 1» F1/145=100, p=0,0001); рис. 5.
Выявленная тенденция к большей выраженности купирования боли в животе демонстрировала нарастание до конца исследования.
Таким образом, к окончанию 3-месячного курса Колофорт продемонстрировал более выраженное влияние на уменьшение болевого синдрома.
Влияние сравниваемой терапии на паттерн стула
Стоит отметить, что, несмотря на одинаковую долю пациентов с типом стула 1, 2 (87%) на визите 1 и 2 в группе Колофорта, выраженность запора между двумя визитами в течение 2 нед терапии существенно уменьшилась. Так, к визиту 2 по сравнению с визитом 1 доля пациентов с типом стула 2 увеличилась более чем в 2 раза, а доля пациентов с типом стула 1 уменьшилась в 5,5 раза. В дальнейшем к визиту 3 доля пациентов с нормальным типом стула увеличилась в 7 раз, продемонстрировав нормализацию стула у 100% пациентов с СРК-З через 3 мес (рис. 9).
Полученные результаты позволяют сделать вывод о достоверном превосходстве Колофорта по сравнению с Тримедатом в отношении нормализации типа стула у пациентов с СРК-З. Превосходство заключалось в более быстром наступлении эффекта и большей его выраженности. Очевидно, выявленные различия в терапевтической эффективности связаны с особенностями действия Колофорта – его регуляторным влиянием как на центральные, так и на периферические звенья патогенеза заболевания [15–17].
При оценке динамики частоты дефекаций в подгруппе СРК-З определялась доля пациентов, у которых число актов дефекации увеличилось в среднем на 1 раз в неделю по сравнению с исходным уровнем. Было установлено, что результаты, полученные в группе Колофорта, значимо превосходят таковые в группе Тримедата, начиная уже с визита 2, 3-й недели терапии, достигнув максимума к 8-й неделе (метод Generalized estimating equations – GEE): Z=4,8; p=0,0001); рис. 10.
В группе Тримедата увеличение частоты стула происходило значительно медленнее, начавшись только с визита 3, через 4 нед лечения. На визите 4 улучшения по данному критерию достигли на 1/3 меньше пациентов, чем в группе Колофорта, а к окончанию исследования – 90% пациентов, тогда как в группе Колофорта уже на визите 4 отмечалась его нормализация у 100% пациентов.
Средняя динамика количества актов дефекации у пациентов с СРК-З также свидетельствовала в пользу большей эффективности Колофорта, достигнув к окончанию наблюдения в среднем 4,6±0,9 раза в неделю против 3,2±0,6 раза в неделю в группе сравнения. Под действием Колофорта улучшение отмечалось уже с визита 2, тогда как на фоне приема Тримедата первые результаты получены на 4 нед позже, к визиту 3 (рис. 11).
Данные, полученные при оценке влияния сравниваемой терапии на паттерн стула, позволяют сделать вывод о достоверно более быстром наступлении эффекта Колофорта, его большей выраженности и стабильности по сравнению с Тримедатом у пациентов с СРК.
Влияние сравниваемой терапии на висцеральную гиперчувствительность
В ходе данного исследования проводилась оценка влияния проводимой терапии на первичный патофизиологический механизм СРК, который обусловливает возникновение и интенсивность боли, выраженность моторных расстройств – висцеральную гиперчувствительность.
При анализе динамики значений данного критерия эффективности по шкале VSI в ходе исследования установлена статистически значимая тенденция к превосходству терапии Колофортом по сравнению с Тримедатом согласно результатам дисперсионного анализа (фактор «Группа» F1/146=4,3, p=0,0411; фактор «Визит» F3/438=306, p=0,0001; фактор «Группа*Визит» F3/438=2.8, p=0,0725; ковариата «Визит 1» F1/146=263, p=0,0001); табл. 4.
Несмотря на очевидно прослеживаемую в течение всего периода наблюдения тенденцию к преимуществу Колофорта по сравнению с Тримедатом, оценка изменений суммарного балла VSI относительно исходного значения на фоне сравниваемой терапии в целом свидетельствует о сопоставимой эффективности сравниваемых препаратов (дисперсионный анализ: фактор «Группа» F1/147=2,5, p=0,1147; фактор «Визит» F3/441=317, p=0,0001; фактор «Группа*Визит» F3/441=1,9, p=0,1701); рис. 12.
Полученные результаты позволяют сделать вывод о способности как Колофорта, так и Тримедата нормализовывать висцеральную гиперчувствительность, что подтверждают ранее описанные данные о влиянии препаратов на основные клинические проявления СРК. Прослеживаемая на протяжении всего периода наблюдения устойчивая тенденция к несколько большему, хотя и статистически незначимому влиянию Колофорта на изменение висцеральной чувствительности относительно исходного значения, что согласуется с продемонстрированной в данном исследовании его более выраженной терапевтической эффективностью в отношении клинической симптоматики.
Полученные в исследовании положительные результаты по влиянию проводимой терапии на клиническую симптоматику, висцеральную гиперчувствительность нашли свое отражение и в динамике значений суммарного балла опросника качества жизни IBS-QoL. Влияние изучаемой терапии СРК на качество жизни пациентов было сопоставимым в обеих группах при более выраженном его улучшении по сравнению с исходным уровнем в группе пациентов, получавших Колофорт.
В ходе данного исследования какого-либо неблагоприятного влияния на витальные функции и параметры, включая частоту сердечных сокращений, артериальное давление, а также нежелательных явлений в обеих группах зарегистрировано не было.
Исследуемые препараты характеризовались хорошей переносимостью, что наряду с продемонстрированной эффективностью обеспечило высокий уровень приверженности пациентов назначенной им терапии.
Выводы
Проведенное неинтервенционное сравнительное клиническое исследование в параллельных группах для оценки эффективности и безопасности применения препарата Колофорт в терапии СРК в сравнении с Тримедатом продемонстрировало соответствие применяемых препаратов основным клиническим задачам, решаемым при терапии данного заболевания, и в первую очередь – необходимости купирования его ведущих проявлений. При сопоставимой в целом эффективности рассматриваемых препаратов полученные в ходе исследования результаты позволяют сделать следующие выводы:
1. Колофорт более выраженно влияет на уменьшение болевого синдрома – к окончанию исследования установлено статистически значимое превосходство по первичному критерию исследования с уменьшением выраженности боли на 30% и более у 95% пациентов основной группы против 84% пациентов в группе сравнения.
2. Колофорт достоверно более быстро, выраженно и стабильно способствует нормализации паттерна стула при СРК по сравнению с Тримедатом.
3. Колофорт достоверно превосходит Тримедат в эффективности нормализации типа стула по Бристольской шкале у пациентов с СРК, это заключается в более быстром наступлении эффекта и большей его выраженности.
4. Колофорт способствует нормализации висцеральной гиперчувствительности с устойчивой тенденцией на протяжении всего периода наблюдения к несколько большему по сравнению с Тримедатом, хотя и статистически незначимому, влиянию на ее изменение относительно исходного значения.
5. Влияние изучаемой терапии СРК на качество жизни пациентов было сопоставимым в обеих группах при более выраженном его улучшении по сравнению с исходным уровнем в группе пациентов, получавших Колофорт.
6. При сопоставимо высоком уровне безопасности применения сравниваемых препаратов также подтверждена высокая безопасность длительного использования Колофорта в терапии СРК, что иллюстрируют отсутствие зарегистрированных в ходе исследования нежелательных явлений и результаты мониторинга витальных функций пациентов.
Совокупность хорошей переносимости и продемонстрированной эффективности обеспечила высокий уровень приверженности пациентов назначенной терапии.
Таким образом, полученные данные позволяют рекомендовать препарат к широкому применению в терапии СРК вне зависимости от его подтипа и тяжести течения.