Что лучше визанна или бусерелин при эндометриозе
Дифференциальный подход к выбору метода лечения больных эндометриозом яичников
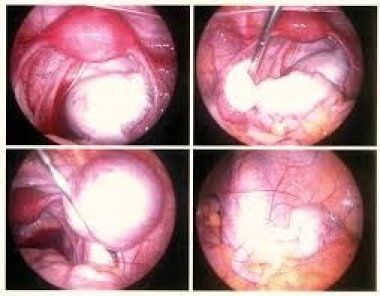
Изучены эффективность и отдаленные результаты склерозирующей терапии эндометриом яичников и обоснованы условия и показания к минимально инвазивному вмешательству.
Efficiency and long-term results of sclerotherapy of ovary endometriosis were studied; conditions and indications for minimal invasive intervention were grounded.
Эндометриоз по праву считается одной из главных причин женского бесплодия и в силу особенностей морфогенеза тяжело поддается медикаментозной терапии. Онкологическая настороженность при эндометриозе остается малоизученной, вызывая много споров и дискуссий. Каждая локализация эндометриоза имеет не только свои клинические, но и патофизиологические и гистологические отличия. Эндометриозу яичников отводится особая роль, для подтверждения которой существует ряд фактов:
1) в структуре всех локализаций эндометриоидных гетеротопий эндометриоз яичников занимает первое место;
2) эндометриоз яичников неблагоприятно воздействует на фолликулогенез в целом и функцию желтого тела в частности;
3) эндометриоз яичников угнетает овариальный резерв, разрушая функциональную ткань яичников;
4) считается, что изначально именно эндометриоз яичников приводит к развитию тяжелого осложнения — глубоко инфильтративного эндометриоза, вовлекая в патологический процесс экстрагенитальные органы и структуры — мочевыводящие пути, кишечник, окружающую брюшину;
5) эндометриоз яичников, в отличие от других локализаций нозологии, представляет наибольшую потенциальную угрозу для озлокачествления.
Эндометриомы (эндометриоидные кисты) яичников занимают лидирующие позиции не только в структуре всех поражений эндометриозом, но и среди причин женского бесплодия, ассоциированного с эндометриозом. Более того, особенности гистогенеза эндометриом (способность к инфильтрации в окружающие ткани) обуславливают снижение объема функционирующей ткани яичника независимо от размеров новообразования [2]. В отношении тактики лечения пациенток с эндометриомами в репродуктивном периоде существуют две точки зрения: одни авторы считают, что при средних размерах эндометриоидных кист до 30 мм целесообразно проведение медикаментозной терапии, другие — придерживаются мнения о необходимости цистэктомии при таких новообразованиях.
Недопустимо медикаментозное лечение эндометриоидных кист яичников без верификации диагноза, так как предполагаемая «эндометриоидная киста» на самом деле может быть опухолью яичника или «переродиться» в нее в процессе лечения». Действительно, с одной стороны, пассивное наблюдение или медикаментозная терапия эндометриом связаны с высоким риском различных осложнений (снижение функции яичников, экспансивный рост новообразования, угроза его озлокачествления), с другой — хорошо известно, что классическая цистэктомия при эндометриоидных кистах яичников сопряжена с потенциальной потерей фолликулярного запаса. Следовательно, для решения данной проблемы необходим некий компромисс, который позволил бы не только избежать повреждения функциональной ткани яичников, но и снизить риски, обусловленные онкологической настороженностью. Сегодня роль «золотой середины» лечения пациенток с эндометриоидными кистами яичников играет аспирационная (склерозирующая) терапия. В литературе последних лет появилось сравнительно большое количество публикаций на эту тему. В частности, García-Tejedor et al. из университетского госпиталя Барселоны (Bellvitge University Hospital-IDIBELL, Испания) опубликовали результаты предварительного анализа 27 случаев склеротерапии эндометриом яичников, выполненных в период 2010–2014 гг. При этом указали частоту рецидивов новообразования всего лишь 12% в течение 17 мес наблюдения [5]. Профессор А. И. Давыдов и соавт. первое подобное вмешательство осуществили в 1999 г. у пациентки 32 лет с единственным яичником, в котором диагностирован рецидив эндометриоидной кисты после предшествующих цистэктомий [6]. Первый опыт оказался удачным: после 2 лет бесплодия у женщины наступила беременность, закончившаяся срочными родами. С того периода были произведены 124 подобные манипуляции, ретроспективный анализ которых позволил обосновать четкую позицию по данному вопросу.
Целью данной работы было изучить эффективность и отдаленные результаты склерозирующей терапии эндометриом яичников и обосновать условия и показания к минимально инвазивному вмешательству.
Пациенты и методы исследования
За период 1999–2017 гг. выполнены 124 вмешательства по методике аспирационной (склерозирующей) терапии эндометриоидных кист яичников. Возраст пациенток варьировал от 18 до 42 лет, составив в среднем 26,4 ± 4,2 года. Средний возраст менархе составил 13,3 ± 1,2 года. Продолжительность менструального цикла у большинства больных (68%) находилась в пределах 25–29 дней. У 92% пациенток длительность менструального кровотечения была 4 и более дней, жалобы на обильные менструации предъявляли 26% больных, а у 36 менструации сопровождались болями различной интенсивности. Одну и более беременностей имели 24 (19%) пациентки; соответственно, не было беременностей у 100 (81%) женщин. Первичное бесплодие диагностировано у 42 (34%) пациенток, вторичное бесплодие — у 9 (7%). Роды в анамнезе имели 26 (20%) больных, у 16% — беременность закончилась самопроизвольным прерыванием в сроки 3–11 нед гестации, причем у 10% женщин — после экстракорпорального оплодотворения. При анализе перенесенных заболеваний обращает на себя внимание высокий инфекционный индекс в детстве. Оперативные вмешательства на придатках матки в связи с новообразованиями яичников различного генеза в прошлом выполнены у 38 (31%) пациенток, в том числе по поводу эндометриоидных кист — у 26 (21%). Следует уточнить, что у 22 из 38 (18%) больных в ходе предшествующих хирургических вмешательств были удалены придатки матки.
Длительность основного заболевания колебалась от нескольких месяцев до 4 лет (в среднем — 1,6 ± 0,6 года). Его ведущими симптомами были: тазовые боли различной интенсивности — 74%, дисменорея — 22%, диспареуния — 14%, меноррагии — 5% (перечисленные симптомы сочетались в различных отношениях). Лишь 15 (12%) пациенток не предъявляли жалоб, у них образования яичников были выявлены гинекологом и/или врачом ультразвуковой диагностики при профилактическом осмотре. При гинекологическом исследовании патологические образования в проекции придатков матки обнаружены у 38% женщин, у 12% — высказано предположение об их наличии. Соответственно в 50% наблюдений новообразования яичников диагностированы только с помощью эхографии.
Методика аспирационной (склерозирующей) терапии эндометриом яичников хорошо известна и описана ранее [6]. Следует акцентировать внимание на необходимости полной санации полости кисты и экспозиции 70% раствора этанола не менее чем на 40 с (в зависимости от исходного объема эндометриомы).
Результаты исследования и их обсуждение
Средний диаметр эндометриом яичников в наших исследованиях варьировал от 25 до 65 мм. В 84 (67,7%) наблюдениях патологический процесс был односторонним, в 72,3% — двусторонним. У 43 (34,6%) женщин имел место рецидив заболевания после предшествующей цистэктомии, у 28 (22,6%) — эндометриоидные кисты локализовались в единственном яичнике и еще у 7 (5,6%) пациенток при ультрасонографии яичник, контрлатеральный от эндометриодного образования, был резко уменьшен в размерах, а в его срезах отсутствовали признаки антральных фолликулов (после предшествующей цистэктомии по поводу эндометриоидных кист). То есть фактически у 35 (28,2%) пациенток эндометриома диагностирована в единственном яичнике. Ультразвуковая характеристика эндометриоидных кист хорошо изучена и не требует обсуждения. Следует уточнить, что их главным акустическим критерием считается констатация внутри патологического образования мелкоточечной эхо-позитивной взвеси на фоне повышенного уровня звукопроводимости. Обнаружение подобной картины позволяет почти в 100% наблюдений установить точный диагноз до хирургического вмешательства.
Для выявления локусов неоангиогенеза — одного из основных маркеров злокачественной опухоли — использовали цветное допплеровское картирование в режиме энергетического допплера. В этом режиме у больных с эндометриомами кровоток регистрировали в области ворот яичника, а также по периферии новообразования в сохранной ткани яичника. Объем содержимого эндометриоидной кисты, эвакуированного в ходе аспирационной терапии, варьировал от 2 до 12 мл. Однако истинный объем содержимого этих кист было сложно оценить вследствие высокой плотности «шоколадной» жидкости, что практически всегда требовало предварительного лизиса с помощью 0,9% раствора NaCl. Важным этапом склерозирующей терапии эндометриом является экспозиция 70% раствора этанола на завершающем этапе вмешательства. Ее длительность зависит от объема полости новообразования и составляет 60–90 с. Суть данного этапа аспирационной терапии — вызвать легкий ожог (химическая деструкция) и в последующем — склероз эндометриоидной выстилки кисты. Склерозирующую терапию пациенток с эндометриоидными кистами яичников необходимо рассматривать только в комплексе с послеоперационным гормональным лечением. Вопрос о роли послеоперационной гормональной терапии больных эндометриозом яичников до настоящего времени остается поводом для дискуссий. Существует точка зрения, что после полного удаления капсулы эндометриоидных кист, других очагов эндометриоза нет необходимости в применении гормональных средств. В то же время никто не отрицает сравнительно высокую частоту рецидивов эндометриом после цистэктомии, что можно объяснить наличием микроскопических и/или непигментированных гетеротопий, рост которых в последующем обуславливает рецидивы патологических образований. В любом случае, аспирационная терапия предусматривает обязательное назначение гормональных препаратов.
Применение в послеоперационном периоде экзогенных гормонов (антигормонов) преследует следующие цели:
1) дополнить склерозирующий эффект этанола;
2) подавить пиковые выбросы гормонов аденогипофиза, способствующие рецидиву заболевания.
Традиционно препаратами первой линии лечения пациенток с эндометриозом после хирургического вмешательства считаются комбинированные оральные контрацептивы (КОК) — эстроген-гестагенные средства [4]. При выборе последних особое внимание уделяют типу прогестагена, так как именно эти соединения оказывают антипролиферативное действие на очаги эндометриоза.
Эффективность результатов комплексной (склерозирующей + медикаментозной) терапии эндометриом оценивали по следующим параметрам:
1) частота рецидивов новообразования;
2) длительность периода, в течение которого произошел рецидив эндометриомы;
3) частота наступления беременности.
Ретроспективный анализ полученных результатов показал, что частота рецидивов заболевания в течение первых 12 мес наблюдения составила 38,7% (48 из 124 наблюдений). В то же время в течение первых 3 мес наблюдения этот показатель не превысил 9,7% (12 из 124 наблюдений). В период 7–12 мес после вмешательства самопроизвольная беременность наступила у 36,3% (46) женщин, которая во всех наблюдениях закончилась родами. Причем часть пациенток (20,1%) по разным причинам не планировали беременности.
Сегодня главная дилемма в отношении эндометриом яичников — оперировать или не оперировать. Справедливо отметить, что по данному вопросу мнения ученых всего мира разделились. Действительно, некоторые авторы ратуют в пользу нехирургического подхода при эндометриомах яичников диаметром до 3 см, аргументируя свою позицию резким снижением, а иногда потерей фолликулярного запаса после хирургических вмешательств на яичниках по поводу эндометриоидных образований. Нельзя не признать, что данный факт имеет высокий уровень достоверности. Механизмы снижения/утраты фолликулярного запаса после хирургического лечения больных эндометриомами яичников различны. Однако главная причина тесным образом связана непосредственно с морфогенезом эндометриом. Хорошо известно, что эндометриоидные кисты в отличие от других доброкачественных новообразований яичников характеризуются наличием плотных подэпителиальных сращений между капсулой кисты и воротами яичников — места прохождения основных кровеносных и лимфатических сосудов, питающих яичник. Поэтому цистэктомия при эндометриоидных кистах — это уже большая травма для яичника, а необходимость лигирования (коагуляции) яичника в области его ворот вызывает дополнительные нарушения в системе кровоснабжения яичника. «Агрессивность» цистэктомии при эндометриомах — это одна сторона медали. Другая — напрямую связана с онкологической настороженностью. Сегодня не является поводом для дискуссий риск озлокачествления эндометриоза. Однако в обсуждении данной проблемы «ускользает» важное уточнение: способностью к малигнизации обладает, как правило, эндометриоз яичников. Именно для этой локализации эндометриоза характерны атипические формы, которые принято рассматривать как фазу перехода доброкачественного процесса в злокачественный [8]. Проведенные по данной проблеме клинико-статистические исследования установили, что в отдаленном периоде наблюдения (11,4 года) риск развития рака яичников у пациенток с эндометриомами яичников в 2 раза выше, чем в популяции [9].
Анализ данных литературы и опыт собственных наблюдений по данной проблеме позволяют обосновать ряд положений:
1) эндометриоз — гистологический диагноз, характеризующийся специфическими морфоструктурными особенностями; до хирургического вмешательства «эндометриодная киста яичника» — лишь предположительное заключение методов инструментальной диагностики (УЗИ, КТ, МРТ);
2) нецелесообразно проводить медикаментозное лечение при эндометриоидных кистах яичников без их гистологической верификации вследствие погрешности диагностики даже при использовании ультрасовременных методов нехирургической визуализации;
3) учитывая высокие риски повреждения фолликулярного запаса после хирургического лечения эндометриом, особенно при их рецидивах, необходимо ставить вопрос о применении аспирационной (склерозирующей) терапии;
4) склерозирующую терапию пациенток с эндометриоидными кистами яичников необходимо рассматривать только в комплексе с послеоперационным гормональным лечением.
Важно подчеркнуть, что от комплаентности экзогенных гормонов зависит исход микроинвазивного (максимально щадящего для функции яичников) хирургического вмешательства, коим является склеротерапия. Сегодня КОК вполне справедливо причисляют к препаратам первой линии выбора, которые используют для купирования тазовой боли у пациенток с эндометриозом. Их потенциальными преимуществами являются сравнительно низкая цена, небольшая частота побочных эффектов, возможность длительного лечения. Последний аспект имеет особое значение у женщин, не планирующих беременность. При выборе КОК для послеоперационного лечения пациенток с эндометриоидными кистами яичников необходимо учитывать фармакодинамику прогестагена, входящего в состав КОК. Данные литературы свидетельствуют, что эффективность диеногеста при эндометриозе сопоставима с таковой агонистов гонадотропин-рилизинг-гормона [10]. Однако в отличие от последних прогестагены не модулируют развитие эстроген-дефицитных состояний, тяжело переносимых пациентами. В литературе последних лет сведения об эффективности склерозирующей терапии эндометриом имеют разноречивый характер. В метаанализе Cohen et al., основанном на изучении мировых источников (Pubmed, Embase, Ovid Medline, Google Scholar, Clinicaltrials. gov, Cochrane Central Register of Controlled Trials), частота рецидивов эндометриом после склерозирующей терапии варьирует от 0% до 62,5% (соответственно эффективность — от 37,5% до 100%) [11]. В наших исследованиях частота рецидивов составила 38,7%, что коррелирует с «нижней границей» эффективности данного метода. В то же время мы считаем это достаточно высоким результатом, основанным на многолетнем опыте. Различия в эффективности склерозирующей терапии, представленные в литературе, по-видимому, объясняются длительностью периода наблюдения за этими пациентками. В частности, в наших исследованиях в течение первых 3 мес наблюдения этот показатель не превысил 9,7%, что в итоге способствовало наступлению беременности у 46 из 124 женщин. С учетом того, что 25 (20,1%) женщин, вошедших в настоящее исследование, не планировали беременность и использовали гормональную контрацепцию (диеногест + этинилэстрадиол), частота наступления беременности в данной группе достигла 46,4%.
Необходимо подчеркнуть, что склеротерапия эндометриом яичников не должна рассматриваться в качестве панацеи в лечении таких пациенток. Ее популяризация не означает отказ от применения других методов хирургического вмешательства. Безусловно, данный метод обеспечивает максимально бережное отношение к фолликулярному запасу. Однако он имеет и свои ограничения, такие как невозможность выполнения овариолизиса, отсутствие визуального контроля над деструкцией капсулы кисты, отсутствие информации о распространенности эндометриоза. Более того, благоприятный исход аспирационной терапии эндометриоидных кист яичников во многом зависит от соблюдения условий и показаний к подобному вмешательству:
Заключение
Склеротерапия эндометриом яичников с ультразвуковым мониторингом вмешательства — минимально инвазивный метод лечения пациенток репродуктивного возраста, обеспечивающий сохранность фолликулярного запаса. Также данный метод можно рассматривать в качестве выбора в сложных клинических ситуациях: рецидив эндометриоидной кисты единственного яичника; предшествующие многократные оперативные вмешательства на единственном яичнике; высокий риск осложнений абдоминального хирургического вмешательства и др. Аспирационная терапия эндометриом не должна рассматриваться в качестве основного метода лечения таких пациенток, для ее применения разработаны определенные условия и показания. Склерозирование капсулы эндометриом яичников не является монотерапией, ее исход во многом определяется адекватностью послеоперационного гормонального лечения.
Литература
М. Б. Таирова 1
А. И. Давыдов, доктор медицинских наук, профессор
ФГАОУ ВО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Дифференциальный подход к выбору метода лечения больных эндометриозом яичников/ М. Б. Таирова, А. И. Давыдов
Для цитирования: Лечащий врач № 12/2018; Номера страниц в выпуске: 20-23
Теги: тазовая боль, эндометриома, склерозирующая терапия
Клиника «Центр ЭКО»
Бесплодным считается брак, в котором отсутствует беременность у женщины при регулярной половой жизни партнеров без использования каких-либо противозачаточных средств. Ошибочно полагается, что бесплодие относится только к женщинам. В 45 процентах случаев это патология со стороны женщин, а в 40 процентах – у мужчин. Еще в 5-10 процентах случаев нарушения обнаруживаются сразу у обоих партнеров.
Клиническое бесплодие бывает:
Наиболее распространены следующие формы бесплодия:
В клинике бесплодия первой жалобой пациентов является отсутствие беременности либо выкидыши с невозможностью выносить и родить малыша. Также выявляются жалобы, связанные с первичной или сопутствующей патологией. Анамнез также подтверждает нарушения менструального цикла, перенесенные операции и аборты, воспалительные заболевания, или заболевания щитовидной железы, надпочечников, либо травму головного мозга. При физикальном обследовании могут выявиться ожирение, клиника синдрома Иценко-Кушинга, который также провоцирует бесплодие, признаки гиперандрогении (повышение андрогенов – мужских половых гормонов), либо нервная анорексия, клинически также приводящая к бесплодию.
Почему стоит выбрать клинику «Центр ЭКО»?
Преимущества клиники «Центр ЭКО»:
Комфорт и удобство клиники «Центр ЭКО»
Подробно узнать о ВРТ-программах клиники «Центр ЭКО» вы можете в разделе «Наши услуги».
Мы поможем вам осуществить вашу мечту о детях!
Онкологические аспекты эндометриоза гениталий
Статья посвящена проблеме малигнизации эндометриоза, приведены особенности эндометриоза, сближающие его с опухолевым процессом, патогенетические факторы злокачественной трансформации эндометриоза. Отмечается, что при эндометриозе, особенно при эндометриои
The article is dedicated to the issue of endometriosis malignization, the features of endometriosis which bring it together with tumor process, were given, as well as pathogenic factors of malignant transformation of endometriosis. It was highlighted that, in endometriosis, especially, in endometrioid ovarian cysts, oncologic prudency is necessary. Approaches to endometriosis treatment were considered.
Эндометриоз — болезнь-загадка XX века, которая и по сей день вызывает множество вопросов и затруднений в диагностике и лечении. Разнообразие клинических признаков и топографии этого заболевания (от бессимптомных форм до весьма выраженных и тяжелых состояний) предопределяет широкий диапазон терапевтических алгоритмов у российской и зарубежных гинекологических школ и практическую значимость поиска общего, максимально эффективного подхода к ведению пациенток.
Эндометриоз в настоящее время рассматривают как доброкачественное гормонозависимое состояние, при котором за пределами границ нормального расположения слизистой оболочки матки происходит разрастание ткани, по морфологическим и функциональным свойствам идентичной эндометрию («эндометриоидные очаги», «эндометриоидные гетеротопии»), что индуцирует хроническую воспалительную реакцию и приводит к появлению клинических симптомов, которые могут оказывать влияние на физическое состояние, психологический статус и социальное благополучие пациенток [1].
Если заболевание обнаружено в молодом возрасте, то есть основания для прогнозирования его тяжелого течения в последующем [2].
Малигнизация эндометриоза остается нерешенной научной и клинической проблемой. По данным различных специалистов, это явление встречается в 0,6–11,4% случаев у пациенток с генитальной формой эндометриоза, и этот показатель превышает распространенность злокачественных опухолей внутренних половых органов у женщин в среднем в популяции [3–7]. Гистологически злокачественные опухоли, происходящие из генитального эндометриоза, отличаются от эпителиальных раков, формирующихся de novo, и выделяются в отдельную группу. С позиции гистологии такие опухоли соответствуют светлоклеточным (14,8%) и эндометриоидным (66,7%) карциномам [8]. При этом 75% опухолей происходит из эндометриоидных кист яичников и только 25% — из экстраовариальных локализаций процесса [9, 10].
Начало изучению вопроса малигнизации эндометриоза положил Sampson (1925), определив патологические критерии злокачественного процесса в эндометриоидном очаге: наличие раковой и доброкачественной эндометриоидной ткани в одном и том же органе, возникновение опухоли в эндометриоидной ткани, полное окружение клеток опухоли эндометриоидными клетками [11]. По его мнению, эктопический эндометрий должен рассматриваться как предрасположенность к злокачественным новообразованиям, так как периодически проявляющиеся цитолитические свойства стромы и кровоизлияния в эктопическом эндометрии на протяжении многих лет не могут оставаться безразличными для окружающих тканей. Поскольку очаги эндометриоза состоят из двух компонентов (железистый эпителий и строма), то злокачественное перерождение может происходить из железистого эпителия в карциному, из стромы — в саркому.
Концепция этиопатогенеза злокачественного перерождения эндометриоза до сих пор не ясна. В качестве основного провоцирующего фактора рассматривают гиперэстрогению, поэтому пристальному наблюдению должны подвергаться женщины репродуктивного возраста [12, 13].
Пик злокачественной трансформации эндометриоидных кист яичников приходится на возраст 35–55 лет, что на 10–20 лет меньше, чем у пострадавших от рака яичников без сопутствующего эндометриоза, и чаще соответствует репродуктивному периоду [3–5, 14].
По данным мировой литературы, прогноз при опухолях из эндометриоидных кист и очагов наружного генитального эндометриоза лучше, чем при обычных эпителиальных злокачественных опухолях яичников [9, 15, 16]. Пятилетняя выживаемость при недиссеминированных формах составляет 65%, при диссеминированных — 10%. При распространенном эндометриозе даже после удаления матки и придатков сохраняется риск гиперплазии эндометриоидной ткани и малигнизации экстраовариального эндометриоза [17].
Очевидно, что онкологические аспекты эндометриоза — одна из наиболее значимых, но, к сожалению, наименее изученных и дискутабельных проблем. По частоте малигнизации первое место занимает эндометриоидная киста яичника, второе — ретроцервикальный эндометриоз, третье принадлежит аденомиозу [18], однако онкологический аспект эндометриоза — «камень преткновения» и одновременно «гнездо раздора» многих исследователей [19]!
Причина разногласий в расхождении данных о частоте злокачественной трансформации эндометриоза, которые существенно противоречивы (от 0,4% до 11–24%) [20]. Я. В. Бохман (1989) высказывается категорично: частота малигнизации эндометриоза значительно превосходит представленные в литературе сведения в связи со сложностью диагностики поэтапных изменений малигнизированных очагов эндометриоза вследствие «поглощения» злокачественной опухолью предшествующих эндометриоидных тканевых структур [21].
Особенности эндометриоза, сближающие его с опухолевым процессом:
1) способность к инфильтративному росту в окружающие ткани и органы с деструкцией последних (в связи с отсутствием соединительнотканной капсулы и способностью эндометриодных очагов выделять липолитические и триполитические ферменты);
2) возможность paспространяться по кровеносным и лимфатическим сосудам, а также диссеминировать в результате нарушения целостности кистозных форм [22 [;
3) повышение уровня онкомаркера СА-125;
4) рак яичника и эндометриоз имеют общие законы наследования: повышение риска развития у близнецов и родственников первой линии [23].
Но в отличие от истинной опухоли для эндометриоза не специфична клеточная атипия и прогрессивный автономный рост.
В отличие от истинной опухоли при эндометриозе имеется связь с менструальной функцией и «содружественные» взаимоотношения с беременностью (физиологическое течение беременности является благоприятном фактором для эндометриоза).
Что касается раковой опухоли, то беременность стимулирует ее экспансивный рост [19].
При истинной опухоли яичника выражены катаболические нарушения (кахексия, анемия, нарушение основного обмена), не характерные для эндометриоза. Эндометриозу присущи тазовые боли, бесплодие, что ухудшает качество жизни [22].
Среди всех эндометриодных нарушений эндометриоз яичников имеет особое значение в связи с тем, что:
1) в числе всех эндометриодных гетеротопий эндометриоз яичников занимает стабильное первое место;
2) эндометриоз яичников играет ведущую роль в генерализации патологического процесса: очаги, расположенные в яичнике, распространяются на соседние органы и брюшину, способствуя развитию глубокого инфильтративного эндометриоза и спаечного процесса в малом тазу;
3) с позиций онкологической настороженности эндометриоз яичников представляет наибольшую потенциальную угрозу для малигнизации.
Сведения о частоте злокачественных трансформаций эндометриоидных кист чрезвычайно противоречивы. Существуют мнения известных исследователей о достаточно высоком риске малигнизации этих образований (3–4-кратное увеличение риска, на 37% чаще, чем в популяции, особенно если они были выявлены в молодом возрасте и имели длительное течение). Критической можно считать длительность заболевания 10–15 лет [24].
Существует проблема ложноположительного диагностирования рака яичника при эндометриозе, а F. E. van Lecumen считает, что наличие эндометриоза яичника является существенно менее опасным, чем процедура экстракорпорального оплодотворения с последующим переносом эмбриона, которая связана с увеличением риска агрессивного рака яичника в 3 раза [25].
В последние годы интенсивно изучаются патогенетические факторы, способствующие злокачественной трансформации эндометриоза в целом и эндометриоидных кист яичников в частности:
По-видимому, изучение экспрессии определенных генов поможет выявить факторы, объясняющие возможность прогрессирования и малигнизации эндометриоза у отдельных пациенток [29, 30].
В 60–80% эндометриоз-ассоциированный рак яичников (РЯ) возникает при наличии атипичного эндометриоза [22], который следует относить к предраковому состоянию. Гистохимически наличие атипичного эндометриоза подтверждается повышением экспрессии маркеров пролиферации.
Эндометриоз яичников коррелирует с определенными гистологическими типами РЯ, а именно эндометриоидными и светлоклеточными карциномами [31]. Эндометриомы, а также эндометриоидный и светлоклеточный РЯ чаще встречаются в левом яичнике, однако этот факт не нашел объяснения [8].
Профилактика злокачественной трансформации эндометриоидных кист:
1. Адекватная диагностика:
2. Рациональная лечебная тактика — оперативное вмешательство (основной этап в лечении эндометриодных кист).
К мерам профилактики эндометриоза и РЯ относят перевязку маточных труб, что снижает развитие как эндометриоза, так эндометриоидного и светлоклеточного РЯ [22].
Есть наблюдения, что консервативная хирургия, даже сопровождающаяся полным удалением эндометриоидных поражений, не предотвращает риска РЯ. Поэтому у пациенток с реализованной репродуктивной функцией есть основание рассмотреть вопрос о сальпингоовариэктомии ± гистерэктомии [32].
При полном удалении гистологически верифицированных эндометриоидных кист яичника можно ограничиться только хирургическим лечением, однако следует помнить о высокой частоте развития рецидивов и персистенции заболевания (через 1–2 года — 15–21%, спустя 5 лет — 36–47%, через 5–7 лет — 50–55%) [33].
Лечение эндометриоза гормональными препаратами также является одним из мощных факторов профилактики развития канцерогенеза. В большинстве случаев терапия эндометриоза осуществляется комплексно (хирургическое вмешательство и гормональная терапия в послеоперационном периоде).
Гормональная терапия осуществляется дифференцированно — с учетом репродуктивных планов пациентки, сопутствующей генитальной и экстрагенитальной патологии, наличия противопоказаний. При планировании беременности в ближайшее время препаратами выбора должны быть агонисты гонадотропин-релизинг-гормона (аГнРГ), в частности отечественный препарат Бусерелин-лонг (уровень доказательности А (литература в статье)).
Механизм действия аГнРГ связан с восстановлением нарушенных взаимосвязей в гипоталамо-гипофизарной системе у больных эндометриозом. В результате продолжительного воздействия аГнРГ на гипофиз происходят десенситизация клеток гипофиза и быстрое снижение интенсивности секреции и биосинтеза гонадотропинов [34]. Угнетение стероидогенеза, вызываемое аГнРГ, индуцирует атрофию как самого эндометрия, так и эктопических эндометриальных желез и стромы. Этот феномен называют медикаментозной кастрацией. Блокада обратима, и после отмены аГнРГ у женщин репродуктивного возраста восстанавливается чувствительность аденогипофиза к гипоталамической стимуляции [35].
Бусерелин-лонг при внутримышечном введении один раз в 28 дней в дозе 3,75 мг обеспечивает стойкий терапевтический эффект. Рекомендованная длительность лечения — до шести месяцев [20].
Активное вещество препарата Бусерелин-лонг заключено в микросферы размером от 30 до 150 мкм с разным временем рассасывания. Основу микросфер составляет биорастворимый сополимер DL молочной и гликолевой кислот. Микросферы в виде водной суспензии вводятся глубоко внутримышечно. После инъекции пролонгированной формы препарата начинается постепенное высвобождение аГнРГ с поверхности микросфер, что сначала — в течение первых суток — приводит к стимуляции синтеза гонадотропинов, а затем к десенситизации гипофиза и блокаде гипофизарно-гонадной оси. Впоследствии микросферы, подвергаясь биодеградации в тканях, медленно высвобождают содержащийся в них аГнРГ, длительно (до 28 дней) поддерживая необходимую для десенситизации гипофиза концентрацию препарата в крови. Сам сополимер метаболизируется в организме до мономеров молочной и гликолевой кислот. В репродуктивном возрасте нормальный менструальный цикл восстанавливается спустя два-три месяца после отмены препарата [34, 35].
Данные клинического исследования, проведенного на базе Московского областного научно-исследовательского института акушерства и гинекологии (С. Н. Буянова и соавт., 2014), показали высокую эффективность применения Бусерелина-лонг у группы пациенток, страдающих эндометриозом (n = 50), среди которых риск развития онкогинекологических заболеваний был выше, чем в популяции (возраст старше 35 лет, наличие сопутствующих заболеваний матки: миома, гиперплазия эндометрия; доброкачественные заболевания яичников и др.).
ФГБОУ ВО НижГМА МЗ РФ, Нижний Новгород