Что может быть твердым жидким и газообразным
Введение: агрегатное состояние вещества
Агрегатное состояние — состояние какого-либо вещества, имеющее определенные свойства: способность сохранять форму и объем, иметь дальний или ближний порядок и другие. При изменении агрегатного состояния вещества происходит изменение физических свойств, а также плотности, энтропии и свободной энергии.
Выделяют четыре типа агрегатных веществ:
Кажется, что химия открывает нам свои тайны в этих удивительных превращениях. Однако это не так. Переход из одного агрегатного состояния в другое, а также броуновское движение или диффузия относятся к физическим явлениям, поскольку в этих превращениях не происходит изменений молекул вещества и сохраняется их химический состав.
Газообразное состояние
На молекулярном уровне газ представляет собой хаотически движущиеся, сталкивающиеся со стенками сосуда и между собой молекулы, которые друг с другом практически не взаимодействуют. Поскольку молекулы газа между собой не связаны, то газ заполняет весь предоставленный ему объем, взаимодействуя и изменяя направление только при ударах друг о друга.
К сожалению, невооруженным глазом и даже с помощью светового микроскопа увидеть молекулы газа невозможно. Однако газ можно потрогать. Конечно, если вы просто попробуете ловить молекулы газов, летающие вокруг, в ладони, то у вас ничего не получится. Но наверняка все видели (или делали это сами), как кто-то накачивал воздухом шину автомобиля или велосипеда, и из мягкой и сморщенной она становилась накачанной и упругой. А кажущуюся «невесомость» газов опровергнет опыт, описанный на странице 39 учебника «Химия 7 класс» под редакцией О.С. Габриеляна.
Это происходит потому, что в замкнутый ограниченный объем шины попадает большое количество молекул, которым становится тесно, и они начинают чаще ударяться друг о друга и о стенки шины, а в результате суммарное воздействие миллионов молекул на стенки воспринимается нами как давление.
Но если газ занимает весь предоставленный ему объем, почему тогда он не улетает в космос и не распространяется по всей вселенной, заполняя межзвездное пространство? Значит, что-то все-таки удерживает и ограничивает газы атмосферой планеты?
Совершенно верно. И это — сила земного тяготения. Для того чтобы оторваться от планеты и улететь, молекулам нужно развить скорость, превышающую «скорость убегания» или вторую космическую скорость, а подавляющее большинство молекул движутся значительно медленнее.
Тогда возникает следующий вопрос: почему молекулы газов не падают на землю, а продолжают летать? Оказывается, благодаря солнечной энергии молекулы воздуха имеют солидный запас кинетической энергии, который позволяет им двигаться против сил земного притяжения.
Жидкое состояние
При повышении давления и/или снижении температуры газы можно перевести в жидкое состояние. Еще на заре ХIХ века английскому физику и химику Майклу Фарадею удалось перевести в жидкое состояние хлор и углекислый газ, сжимая их при очень низких температурах. Однако некоторые из газов не поддались ученым в то время, и, как оказалось, дело было не в недостаточном давлении, а в неспособности снизить температуру до необходимого минимума.
Жидкость, в отличие от газа, занимает определенный объем, однако она также принимает форму заполняемого сосуда ниже уровня поверхности. Наглядно жидкость можно представить как круглые бусины или крупу в банке. Молекулы жидкости находятся в тесном взаимодействии друг с другом, однако свободно перемещаются относительно друг друга.
Если на поверхности останется капля воды, через какое-то время она исчезнет. Но мы же помним, что благодаря закону сохранения массы-энергии, ничто не пропадает и не исчезает бесследно. Жидкость испарится, т.е. изменит свое агрегатное состояние на газообразное.
Испарение — это процесс преобразования агрегатного состояния вещества, при котором молекулы, чья кинетическая энергия превышает потенциальную энергию межмолекулярного взаимодействия, поднимаются с поверхности жидкости или твердого тела.
Испарение с поверхности твердых тел называется сублимацией или возгонкой. Наиболее простым способом наблюдать возгонку является использование нафталина для борьбы с молью. Если вы ощущаете запах жидкости или твердого тела, значит происходит испарение. Ведь нос как раз и улавливает ароматные молекулы вещества.
Жидкости окружают человека повсеместно. Свойства жидкостей также знакомы всем — это вязкость, текучесть. Когда заходит разговор о форме жидкости, то многие говорят, что жидкость не имеет определенной формы. Но так происходит только на Земле. Благодаря силе земного притяжения капля воды деформируется.
Однако многие видели как космонавты в условиях невесомости ловят водяные шарики разного размера. В условиях отсутствия гравитации жидкость принимает форму шара. А обеспечивает жидкости шарообразную форму сила поверхностного натяжения. Мыльные пузыри – отличный способ познакомиться с силой поверхностного натяжения на Земле.
Еще одно свойство жидкости — вязкость. Вязкость зависит от давления, химического состава и температуры. Большинство жидкостей подчиняются закону вязкости Ньютона, открытому в ХIХ веке. Однако есть ряд жидкостей с высокой вязкостью, которые при определенных условиях начинают вести себя как твердые тела и не подчиняются закону вязкости Ньютона. Такие растворы называются неньютоновскими жидкостями. Самый простой пример неньютоновской жидкости — взвесь крахмала в воде. Если воздействовать на неньютоновскую жидкость механическими усилиями, жидкость начнет принимать свойства твердых тел и вести себя как твердое тело.
Твёрдое состояние
Если у жидкости, в отличие от газа, молекулы движутся уже не хаотически, а вокруг определенных центров, то в твёрдом агрегатном состоянии вещества атомы и молекулы имеют четкую структуру и похожи на построенных солдат на параде. И благодаря кристаллической решетке твердые вещества занимают определенный объем и имеют постоянную форму.
Между твердыми и жидкими телами существует промежуточная группа аморфных веществ, представители которой с одной стороны за счет высокой вязкости долго сохраняют свою форму, а с другой – частицы в нем строго не упорядочены и находятся в особом конденсированном состоянии. К аморфным веществам относится целый ряд веществ: смола, стекло, янтарь, каучук, полиэтилен, поливинилхлорид, полимеры, сургуч, различные клеи, эбонит и пластмассы. Про аморфные тела подробно можно прочитать на странице 40 учебника «Химия 7 класс» под редакцией О.С. Габриеляна.
При определенных условиях вещества, находящиеся в агрегатном состоянии жидкости, могут переходить в твердое, а твердые тела, наоборот, при нагревании плавиться и переходить в жидкое.
Это происходит потому, что при нагревании увеличивается внутренняя энергия, соответственно молекулы начинают двигаться быстрее, а при достижении температуры плавления кристаллическая решетка начинает разрушаться и изменяется агрегатное состояние вещества. У большинства кристаллических тел объем увеличивается при плавлении, но есть исключения, например – лед, чугун.
В зависимости от вида частиц, образующих кристаллическую решетку твердого тела, выделяют следующую структуру:
У одних веществ изменение агрегатных состояний происходит легко, как, например, у воды, для других веществ нужны особые условия (давление, температура). Но в современной физике ученые выделяют еще одно независимое состояние вещества — плазма.
Плазма — ионизированный газ с одинаковой плотностью как положительных, так и отрицательных зарядов. В живой природе плазма есть на солнце, или при вспышке молнии. Северное сияние и даже привычный нам костер, согревающий своим теплом во время вылазки на природу, также относится к плазме.
Искусственно созданная плазма добавляет яркости любому городу. Огни неоновой рекламы — это всего лишь низкотемпературная плазма в стеклянных трубках. Привычные нам лампы дневного света тоже заполнены плазмой.
Плазму делят на низкотемпературную — со степенью ионизации около 1% и температурой до 100 тысяч градусов, и высокотемпературную — ионизация около 100% и температурой в 100 млн градусов (именно в таком состоянии находится плазма в звездах).
Низкотемпературная плазма в привычных нам лампах дневного света широко применяется в быту.
Для проверки усвоения материала предлагаем небольшой тест.
1. Что не относится к агрегатным состояниям:
Агрегатные состояния вещества
Агрегатное состояние — это состояние вещества, которое зависит от температуры и давления. В природе вещества встречаются в трёх агрегатных состояниях: твёрдом, жидком и газообразном.
Вещество, находящееся при стандартных условиях в твёрдом состоянии, называется твёрдым веществом, в жидком состоянии — жидким веществом или жидкостью, в газообразном — газообразным веществом или газом.
При одинаковых условиях (температуре и давлении) различные вещества могут находиться в разных агрегатных состояниях.
Пример. В стандартных условиях:
Переходы между агрегатными состояниями
Многие вещества при изменении условий могут переходить из одного агрегатного состояния в другое.
Пример. При температуре ниже 0 °C вода превращается в лёд, т. е. переходит из жидкого состояния в твёрдое.
Переход вещества из газообразного состояния в жидкое называется конденсацией. Переход вещества из жидкого состояния в газообразное называется испарением.
При увеличении температуры вещества испарение становится интенсивнее. И, наконец, при определённой температуре испарение становится настолько интенсивным, что жидкость закипает. Такая температура называется температурой кипения вещества. Испарение и кипение — это два способа перехода жидкости в газообразное состояние.
Испарение происходит с поверхности жидкости, а при кипении жидкость переходит в газообразное состояние, как с поверхности, так и внутри неё.
Когда говорят о веществах в газообразном состоянии, иногда помимо термина газ используется и слово пар. Газ и пар очень похожи между собой. Они представляют собой разновидности газообразного состояния вещества.
Разница между газом и паром в том, что газ имеет температуру выше критической или равную ей, а пар — ниже.
В быту под словом пар обычно подразумевают именно водяной пар.
Переход вещества из жидкого состояния в твёрдое называется кристаллизацией. Переход вещества из твёрдого состояния в жидкое называется плавлением.
Переход вещества из твёрдого состояния сразу в газообразное называется возгонкой или сублимацией. Переход из газообразного состояния в твёрдое называется десублимацией.
При всех этих явлениях частицы вещества не разрушаются. Таким образом, вещество, изменяя агрегатное состояние, не превращается в другое вещество.
Одни вещества могут иметь любое из трёх агрегатных состояний, другие — нет.
Пример. Вода может находиться в твёрдом состоянии (лёд), жидком (вода) и газообразном (водяной пар). Для сахара известны только два агрегатных состояния: твёрдое и жидкое.
При нагревании сахар плавится, затем его расплав темнеет, и появляется неприятный запах. Это свидетельствует о превращении сахара в другие вещества. Значит, газообразного состояния для сахара не существует.
Взаимные переходы веществ из одного агрегатного состояния в другое в виде схемы:
Основные агрегатные состояния вещества
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений.
Заполняем нашу табличку
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.
Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
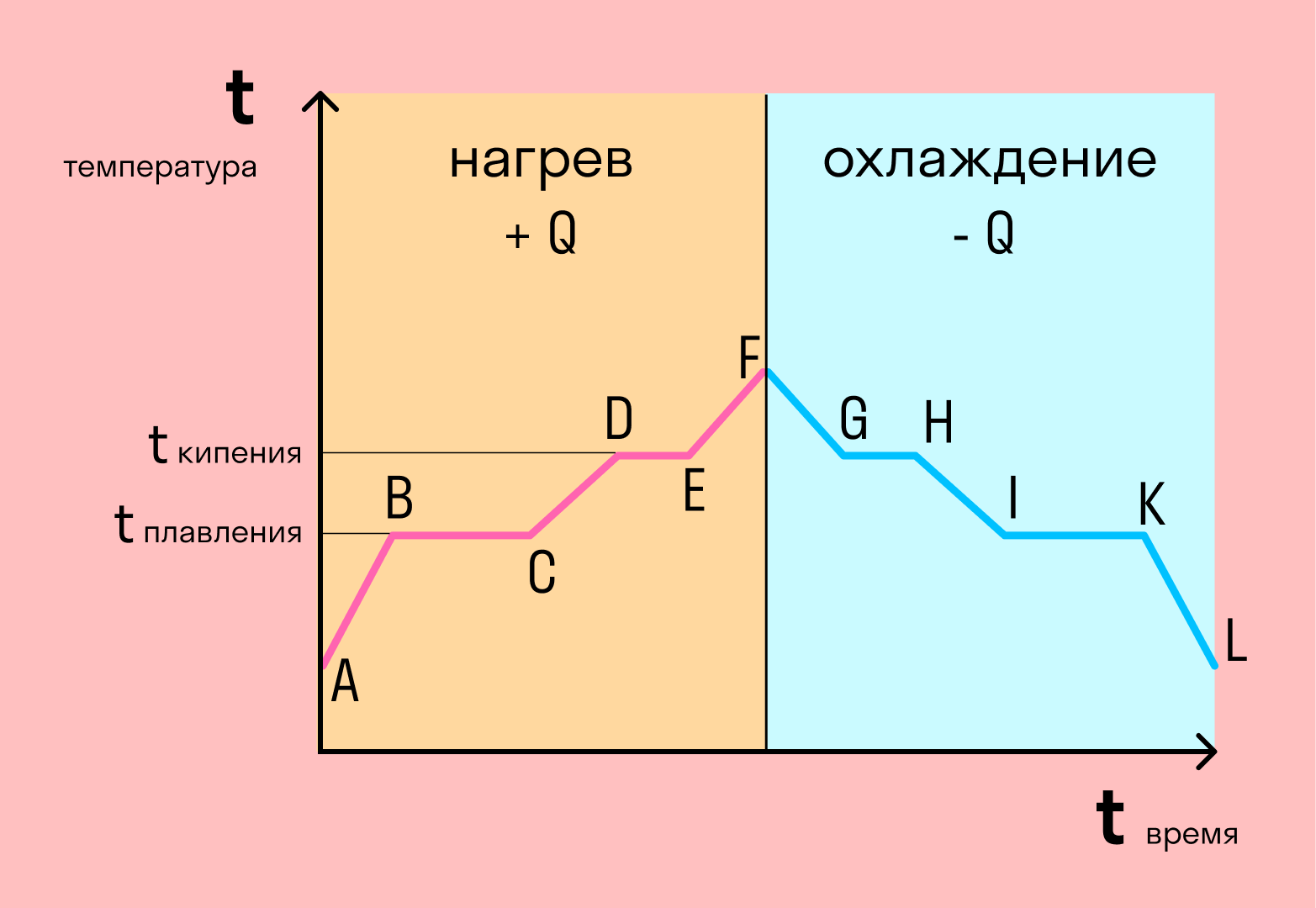
График фазовых переходов
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
Разбираемся по шагам. Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов).
После того, как лед нагрелся до температуры плавления, он начинает плавиться. Плавление происходит при постоянной температуре тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
Расправившись вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс аналогично плавлению происходит при постоянной температуре. Данный процесс нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
Первый шаг в обратную сторону — охлаждение до температуры кипения.
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Плавление
Кристаллизация
Q — количество теплоты [Дж]
λ — удельная теплота плавления вещества [Дж/кг]
m — масса [кг]
Парообразование
Конденсация
Q — количество теплоты [Дж]
L — удельная теплота парообразования вещества [Дж/кг]
m — масса [кг]
Онлайн-уроки физики в Skysmart не менее увлекательны, чем наши статьи!
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг умножить на °С)
Q = 380 * 0,1*(60-20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ=80кДж/кг. Теплопотерями пренебречь.
80 кДж/кг = 80000 Дж/кг
Q = 80000*2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
Примерчики из жизни🤓
Про принтеры. Цветные принтеры (только не лазерные) печатают путем сублимации. Вот как это работает: частицы краски быстро переходят из твердого состояния в газообразное и оседают на бумаге — так получается цветная картинка.
Рисуночки на окнах. Если вы решите проехаться на автобусе в холодную погоду — увидете на стеклах чудесные узоры. Из-за огромной разницы температур между улицей и автобусом, мы можем наблюдать процесс десублимации в виде красивых рисунков на стеклах. Иней образуется похожим способом — резкое похолодание приводит к десублимации воздуха.
Влажность воздуха: испарение и конденсация
Такие процессы, как испарение и конденсация, становятся более логичными и простыми, если их рассмотреть на примере влажности воздуха.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Любое количество пара в воздух не запихнешь, поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Как влажность влияет на человека
Для человека влажность очень важна, потому что мы состоим из воды на 90%. Если окружающей среде нечего испарять, она будет испарять нас. Поэтому при низкой влажности мы чувствуем сухость во рту, а при высокой — волосы впитывают влагу, разбухают и начинают виться. На этом принципе построены некоторые гигрометры — приборы для измерения влажности. Они так и называются — волосяные гигрометры. Только внутри не человеческий волос, а конский, но принцип от этого не меняется.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой, но при высокой влажности пот не может испариться. При испарении пота мы теряем избыточное тепло, а в данном случае этого не происходит.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно, а при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.
Влажностью можно управлять. Существуют мешочки с шариками адсорбентами, которые кладут в коробки с обувью, чтобы впитать лишнюю влагу. Чтобы окна не запотевали, можно насыпать в рамы соль, которая также впитает влагу. А если вам наоборот нужно больше влаги — берем увлажнитель воздуха (классная вещь!): он добавляет в воздух водяной пар.
Может ли металл быть газом?
Да, металлы могут быть газами, в зависимости от того, насколько высока их температура кипения. Но действительно ли газообразные металлы считаются металлами?
Закройте на мгновение глаза и позвольте слову «металл» всплыть в вашей голове. А теперь ответьте: какой первый образ приходит вам на ум, когда вы думаете о «металле»?
Может ли металл быть газом?
Да, конечно! Хотя металлы обычно находятся в твердом состоянии при комнатной температуре (вероятно, поэтому мы ассоциируем слово «металл» с твердыми объектами), металлы также могут быть газами.
Дело в том, что состояния вещества универсальны: металл может быть твердым, жидким или газообразным. Но это состояние определяется на основе правильных условий температуры и давления.
Например, металл, скажем, свинец, имеет температуру кипения 1740 градусов по Цельсию. Теперь вы знаете, что свинец в своем «естественном состоянии» представляет собой твердое вещество. Но когда вы начнете его нагревать, он сначала превратится в жидкость при 327 градусах Цельсия, а если вы продолжите подавать больше тепла, он превратится в газ при 1740 градусах Цельсия.
Свинец превращается в пар при 1740 градусах Цельсия.
Но учтите, что пары ртути очень вредны. По данным Всемирной организации здравоохранения, «вдыхание паров ртути может оказывать вредное воздействие на нервную, пищеварительную и иммунную системы, легкие и почки и может быть фатальным. Неорганические соли ртути разъедают кожу, глаза и желудочно-кишечный тракт, а при попадании внутрь могут вызывать токсическое воздействие на почки«.
А теперь давайте обсудим еще один аспект этой саги о превращении металла в газ.
Остается ли металл металлом, когда он превращается в газ?
Мы установили, что металлы могут превращаться в газы, если их нагреть до точки кипения. Но если металл нагревается до точки кипения и становится газом, остается ли он металлом? Другими словами, может ли металл находиться в газообразном состоянии и при этом оставаться металлом?
Но почему металлы твердые? Что в них такого особенного, что делает их твердыми?
Почему металлы вообще твердые?
Металлы твердые при комнатной температуре из-за того, как их последовательные атомы упаковываются внутри.
Видите ли, вся материя состоит из атомов. Состояние вещества зависит от того, насколько близко или далеко друг от друга находятся эти атомы.
Если составляющие атомы вещества находятся далеко друг от друга, то это вещество будет существовать в виде газа при комнатной температуре. Атомы в жидком состоянии относительно ближе друг к другу, но в твердых телах атомы упакованы вместе в плотные кристаллы.
Из-за сильных сил, которые удерживают эти атомы близко друг к другу, твердые тела жесткие и имеют определенную форму и размер (в отличие от жидкости и газа).
Металлы твердые при комнатной температуре, потому что входящие в их состав атомы металлов упаковываются близко друг к другу, придавая им жесткий или «затвердевший» внешний вид. Это также является причиной того, что металлы имеют высокую температуру плавления и не существуют в жидком состоянии при комнатной температуре.
В целом, металлы могут превращаться в газ, но как только они превращаются в газ, они не сохраняют своих металлических свойств.