Что может набухать в природе
набухание семян
Смотреть что такое «набухание семян» в других словарях:
НАБУХАНИЕ СЕМЯН — поглощение воды семенами растений, сопровождающееся увеличением их объема. Наблюдается не только при намачивания жизнеспособных семян, но и заведомо невсхожих … Словарь ботанических терминов
набухание семян — поглощение семенами воды, сопровождающееся увеличением их объема … Сельскохозяйственный словарь
Набухание — увеличение объёма твёрдого тела вследствие поглощения им из окружающей среды жидкости или пара. Способность к Н. характерная особенность тел, образованных высокомолекулярными веществами (полимерами (См. Полимеры)). Н. обусловлено… … Большая советская энциклопедия
ПЕРЕТИРАНИЕ СЕМЯН — обработка семян нек рых культурных раст., трудно отделимых друг от друга из за наличия цепляющихся волосков и дающих поэтому неравномерный высев. П. с. производится руками или на специальных терках. Волоски при этом обламываются, и семена легко… … Сельскохозяйственный словарь-справочник
набуха́ние — я, ср. Действие по знач. глаг. набухать. Набухание семян. Набухание почек … Малый академический словарь
Абсорбция — У этого термина существуют и другие значения, см. Абсорбция (значения). Не следует путать с Адсорбцией. Абсорбция (лат. absorptio от absorbere поглощать) поглощение сорбата всем объёмом сорбента. Является частным случаем сорбции … Википедия
Биологическое действие ионизирующих излучений — изменения, вызываемые в жизнедеятельности и структуре живых организмов при воздействии коротковолновых электромагнитных волн (рентгеновского излучения и гамма излучения (См. Гамма излучение)) или потоков заряженных частиц (альфа частиц… … Большая советская энциклопедия
РАСТЕНИЯ, ВЫЗЫВАЮЩИЕ ПРЕИМУЩЕСТВЕННО СИМПТОМЫ ПОРАЖЕНИЯ ОРГАНОВ ДЫХАНИЯ И ПИЩЕВАРИТЕЛЬНОГО ТРАКТА (РАСТЕНИЯ, ОБРАЗУЮЩИЕ ГОРЧИЧНЫЕ МАСЛА) — Глава III РАСТЕНИЯ, ВЫЗЫВАЮЩИЕ ПРЕИМУЩЕСТВЕННО СИМПТОМЫ ПОРАЖЕНИЯ ОРГАНОВ ДЫХАНИЯ И ПИЩЕВАРИТЕЛЬНОГО ТРАКТА (РАСТЕНИЯ, ОБРАЗУЮЩИЕ ГОРЧИЧНЫЕ МАСЛА) Общие сведения. К растениям, вызывающим преимущественно симптомы поражения органов дыхания и… … Токсикология ядовитых растений
КОЛЛОИДЫ — КОЛЛОИДЫ, КОЛЛОИДНАЯ ХИМИЯ. Коллоиды (от греч. ко 11а клей, желатина), название, данное Грэмом (Graham) группе веществ, типичными представителями которых являются желатина или гум ми арабик. Коллоидная химия является наиболее молодой хим.… … Большая медицинская энциклопедия
Хитиназы — Хитиназа из семян ячменя Хитиназы (КФ 3.2.1.14) это ферменты, катализирующие деградацию … Википедия
Лекция №16.
План лекции:
РАСТВОРЕНИЕ ВМС
Растворение высокомолекулярных веществ принято рассматривать как процесс, аналогичный смешению двух жидкостей, в котором имеет значение как энергетическое взаимодействие между молекулами растворяемого вещества и растворителя (энергетический фактор), так и действие фактора, обусловливающего равномерное распределение молекул растворенного вещества в растворе (энтропийный фактор).
Самопроизвольное растворение ВМС, равно как и всяких других веществ, должно сопровождаться уменьшением изобарного термодинамического потенциала. Согласно химической термодинамике
Очевидно, чтобы уменьшился термодинамический потенциал и произошло самопроизвольное растворение высокополимера, изобарно-изотермический потенциал должен иметь отрицательное значение. Это возможно в двух случаях: а) Н S > 0. Первое условие (Н
Второе условие ( S > 0) при растворении выполняется всегда, так как энтропия смешения, как правило, положительна. Исследования, произведенные в последние годы, показали, что при растворении высокополимеров энтропия смешения обычно значительно превышает идеальную энтропию. Это объясняется тем, что при растворении высокополимеров возрастает возможность движения в растворе отдельных участков (сегментов) гибких цепных молекул, причем, каждая может осуществлять большое число конфигураций. В предельно разбавленном растворе, когда макромолекулы будут находиться на значительном расстояниях друг от друга, они могут практически принимать любые конфигурации. Таким образом, при растворении ВМС система переходит из менее вероятного в более вероятное состояние и соответственно вероятностная функция, характеризующая процесс (энтропия), должна возрастать.
Благодаря аномально большим значениям энтропии, при растворении многих высокополимеров энтропийный фактор играет решающую роль, особенно при растворении полимеров с неполярными молекулами, когда растворение сопровождается поглощением тепла (Н > 0).
С набуханием не следует смешивать процесс капиллярного поглощения растворителя, при котором жидкость заполняет микропустоты, имеющиеся в твердом теле. Размеры твердого тела при этом обычно не увеличиваются.
Например, такие вещества с жесткой пространственной структурой, пронизанные большим числом капилляров, как силикагели (туф, пемза, искусственные пермутиты и т.п.) поглощают большое количество воды, но этот процесс называют не набуханием, а оводнением. Механизм этого явления ничего общего с набуханием не имеет.
Причиной набухания является диффузия молекул растворяемого вещества и, наоборот, молекул растворителя в высокомолекулярное вещество. Последнее связано с тем, что молекулы аморфных ВМС обычно упакованы неплотно, расстояния между ними в результате теплового движения увеличиваются и в пустоты могут проникнуть маленькие молекулы растворителя. Так как последние более подвижны, то сначала происходит, главным образом, диффузия молекул растворителя в высокополимер; это сопровождается увеличением объема последнего и когда связь между макромолекулами будет ослаблена, они также начинают диффундировать в среду и образуется однородный истинный раствор. Так набухают каучуки в бензоле, нитроцеллюлоза в ацетоне, белок в воде. Чем больше молекулярный вес ВМС, тем медленнее идет процесс набухания и растворения. Имеет значение форма и размеры молекулы. Например, высокополимеры со сферическими молекулами при растворении не набухают или набухают очень слабо. Это указывает, что диффузия не может рассматриваться как единственный фактор, управляющий набуханием. В данном случае малая когезионная энергия ВМС со сферическими частицами облегчает их растворение.
Описанная картина набухания ВМС с линейными макромолекулами имеет место тогда, когда энергетическое взаимодействие между молекулами растворяемого вещества и растворителя незначительно или практически равно нулю, т.е. когда растворение и набухание носит чисто энтропийный характер (например при растворении каучуков в углеводах). Если же молекулы растворителя энергетически взаимодействуют с молекулами ВМС, как, например при растворении желатина в воде, то механизм растворения усложняется. В этом случае первой стадией является сольватация макромолекул в результате диффузии в ВМС растворителя. Эта стадия характеризуется выделением тепла и упорядоченным расположением молекул растворителя около макромолекул. В результате упорядоченного расположения молекул растворителя в первой стадии растворения энтропия системы обычно даже понижается. Значение этой стадии растворения сводится к разрушению связей между отдельными макромолекулами, вследствие чего цепи становятся свободными и способными совершать тепловое движение в целом.
Второй стадией является набухание или растворение, обусловленное чисто энтропийными причинами.
Набухание не всегда завершается растворением. Во многих случаях после достижения известной степени набухания процесс прекращается. Причина такого явления заключается в том, что ВМС и растворитель способны смешиваться ограниченно. В результате после установления равновесия система будет состоять из двух фаз: насыщенного раствора высокополимера в растворителе (собственно раствор) и насыщенного раствора растворителя в (гель, студень). Этот случай ограниченного набухания имеет много общего с ограниченным растворением двух низкомолекулярных жидкостей. Примером ограниченного набухания является набухание при комнатной температуре поливинилхлорида а ацетоне, желатина и целлюлозы в воде.
Ограниченное набухание при изменении условий опыта часто переходит в неограниченное. Так, например, желатина и агар-агар, набухающие ограниченно в холодной воде, в теплой воде набухают неограниченно.
Набухание характеризуется степенью набухания, величина которой определяется количеством жидкости в граммах поглощаемой на данной стадии набухания и при данной температуре одним граммом высокополимера:
ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ НАБУХАНИЕ
Степень и скорость набухания полимеров зависит от ряда факторов: температуры, давления, величины pH среды, присутствия веществ, в особенности электролитов, степени измельченности полимера и «возраста» полимера.
Скорость набухания с повышением температуры растет, а степень предельного набухания уменьшается, если процесс набухания сопровождается выделением тепла.
С ростом внешнего давления степень набухания всегда повышается, что вытекает из принципа Ле-Шателье, если учитывать, что суммарный объем системы из растворителя и растворяемого вещества при набухании уменьшается.
Влияние pH среды на набухание хорошо изучено для белков и целлюлозы: минимум набухания лежит в области изоэлектрической точки (например для желатины при pH =4,7), по ту и другую сторону, от которой степень набухания возрастает и, достигнув максимумов, вновь начинает уменьшаться.
Такое влияние pH на набухание связано с тем, что в изоэлектрической точке заряд макромолекул белков минимален, а вместе с этим минимальна и степень гидратации белковых ионов.
Роданид > иодид > бромид > нитрат > хлорат.
Хлорид > ацетат > цитрат > тартрат > сульфат.
Такое действие анионов на набухание в полной мере проявляется только тогда, когда растворы электролитов достаточно концентрированы, а среда является нейтральной или слабощелочной. В кислой среде все анионы уменьшают набухание.
Измельчение высокополимера, приводящее к увеличению его общей поверхности, увеличивает скорость набухания.
Набухание является процессом экзотермическим. Тепловой эффект процесса получил название теплоты набухания. Определение теплоты набухания имеет большое значение характеристики степени сольватации высокополимеров.
Набухание играет исключительно важную роль как в повседневной жизни человека, так и во многих технологических процессах. Например, перевод пищевых продуктов в усвояемое организмом состояние сводится в основном к процессам набухания.
В физиологических процессах, протекающих в растительных и животных организмах, набухание так же имеет большое значение. Зерно, прежде чем взойдет, должно набухнуть. Благодаря набуханию поддерживается определенное состояние клеток в организме.
Нельзя себе представить без набухания производство клеящих веществ, обуви и кожгалантереи, процесс изготовления пироксилиновых порохов, затвердевание (схватывание) цемента и т.д.
НАРУШЕНИЕ УСТОЙЧИВОСТИ В РАСТВОРАХ ВЫСОКОМОЛЕКУЛЯРНЫХ ВЕЩЕСТВ
Растворы высокомолекулярных веществ, если они находятся в термодинамически равновесном состоянии, обладают, как и истинные растворы, абсолютной агрегативной устойчивостью. Поэтому теории устойчивости лиофильных коллоидных систем (растворов высокополимеров), например, теория Кройта, в которой агрегативную устойчивость желатина, агар-агара и некоторых других веществ объясняли либо электрическим зарядом, либо сольватацией, или, наконец, действием того и другого фактора одновременно, имеет в данное время только историческое значение.
Коагуляция лиофобных систем обычно происходит в результате сжатия двойного электрического слоя и уменьшения или полного исчезновения электрического заряда, являющегося для данных систем основным фактором устойчивости. Выделение из раствора высокополимера при добавлении большого количества электролита объясняется уменьшением растворимости высокомолекулярного вещества в концентрированном растворе электролита.
Подобные явления имеют место и в растворах низкомолекулярных веществ. Ранее было отмечено, что при введении в водноспиртовой раствор поташа гомогенная система разделяется на два жидких слоя. Это явление называется высаливанием. По аналогии выделение из раствора ВМВ под действием электролитов следует называть не коагуляцией, а высаливанием.
Высаливающее действие соответствует тому положению иона, которое он занимает в лиотропном ряду. Так, катионы и анионы по мере уменьшения их высаливающего действия могут быть расположены в следующие ряды:
Ряд катионов Li + > Na + > K + > Rb + > Cs +
Положение ионов в рядах обратно тому, которое они занимают в лиотропных рядах для набухания. Чем больше ион способен связывать растворитель, тем больше он будет уменьшать способность среды растворять высокомолекулярное вещество, т. е. лучше высаливать.
Электролиты обычно способствуют процессам ассоциации макромолекул и структурообразования в растворах высокополимеров. За счет слипания макромолекул в отдельных местах могут образоваться сетки, превращающие раствор в студень. Этот вопрос будет рассмотрен в дальнейшем.
Если мельчайшие капельки коацерватов не обладают достаточной агрегативной устойчивостью, то они могут соединяться друг с другом, образуя флокулы, способные всплывать или опускаться на дно в виде рыхлого осадка. Флокуляция имеет большое значение в биологии и медицине.
Аналогично действовать на вязкость растворов высокомолекулярных соединений способны и некоторые другие примеси.
НАБУХАНИЕ
Набухание — увеличение объема твердого тела вследствие поглощения им из окружающей среды жидкости или пара. В медицине под Набуханием понимают увеличение объема клеток или стромы внутренних органов.
Способность к Набуханию является характерной особенностью тел, образованных высокомолекулярными веществами (полимерами). Набухание обусловлено диффузионными процессами, которые обычно сопровождаются сольватацией (см.). Различают Набухание ограниченное и неограниченное. В первом случае макромолекулы соединены достаточно прочно и Набухание прекращается, достигнув определенного предела; при этом набухшее тело сохраняет форму и четкую границу раздела с жидкой средой. Во втором случае взаимная диффузия растворителя и полимерного тела постепенно приводит к исчезновению границы раздела между набухающим телом и жидкостью; Набухание завершается полным растворением полимера.
Н. клеток может возникнуть в результате нарушения водно-солевого обмена и избыточного связывания воды клеткой (гипергидратация клеточного водного сектора), что наблюдается, напр., в результате задержки в организме натрия при снижении функции почек. Аналогичный патогенез имеет гидропическое Н. эпителия извитых канальцев почек при использовании осмотически активных веществ типа маннитола, мочевины, гипертонических р-ров глюкозы и др. Задержка жидкости в нефротелии объясняется при этом повышением осмолярности цитоплазмы за счет фиксации в ней мочегонных веществ. Такое Н. клеток является по существу функциональным и быстро ликвидируется при выравнивании водно-солевого баланса организма или отмене мочегонных средств. Более сложные механизмы лежат в основе Н. вещества головного мозга, возникающего при тяжелых эндо- и экзотоксикозах различной этиологии. Однако и здесь происходит избыточное связывание воды коллоидами цитоплазмы нейроцитов, глиальными клетками и нервными волокнами белого вещества.
Макроскопическая картина набухания органа наиболее ярко выражена при набухании головного мозга. Мозг при этом увеличен в объеме, дряблый, поверхность разрезов сухая, в сосудах видна сгустившаяся кровь. Исходом подобного Н. может быть прогрессирующая гипоксического характера деструкция нейроцитов и нервных волокон, чему способствует и нередко осложняющее этот процесс вклинение ствола мозга в большое затылочное отверстие. Несколько иной характер имеет Н. клеток и волокнистых веществ при паренхиматозных и мезенхимальных белковых дистрофиях — диспротеинозах (см. Белковая дистрофия). Так, при зернистой дистрофии, чаще всего развивающейся в печени, миокарде и почках, отмечается увеличение органа в размерах, дряблость, тусклость паренхимы на разрезе. Поэтому в таких случаях говорят о мутном Н. органов.
Особая разновидность Н. межклеточного вещества наблюдается при коллагеновых болезнях (см.). При этом различают Мукоидное и фибриноидное Н. соединительной ткани, обусловленное различной глубиной ее дезорганизации. При мукоидном Н. (см. Слизистая дистрофия), развивающемся чаще всего в стенках артерий, клапанах сердца, эндокарде и эпикарде, микроскопически определяется повышенная базофилии и метахромазия основного вещества соединительной ткани за счет накопления хромотропных веществ. При прогрессировании процесса может наступить необратимая дезорганизация соединительной ткани — фибриноидное Н., заканчивающееся фибриноидным некрозом (см. Фибриноидное превращение). Процесс сопровождается гомогенизацией коллагеновых волокон вследствие пропитывания их белками плазмы и фибрином; волокна интенсивно окрашиваются кислыми красителями, резко ШИК-положительны, пиронинофильны и аргентофильны.
Клинические проявления Набухания зависят от органа, в к-ром оно развивается. Н. головного мозга проявляется коматозным состоянием. Мутное Н. паренхиматозных органов выражается в снижении их функции. В одних случаях Н. клеток и тканей — процесс обратимый, не требующий специальных методов терапии, в других — ведет к гибели клеток и тканей.
Библиография: Воюцкий С.С. Курс коллоидной химии, с. 442, М., 1975; Пасынский А. Г. Коллоидная химия, с. 179, М., 1968; Пермяков Н. К. Основы реанимационной патологии, М., 1979; Струков А. И. и Серов В.В. Патологическая анатомия, с. 27, М., 1979.
Н. К. Пермяков; В. О. Шпикитер (биохим.).
ГК «Униконс»
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
«Антисептики Септоцил»
Септоцил. Бытовая химия, антисептики.
«Петритест»
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
«АльтерСтарт»
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
5.4. ДИСПЕРСНЫЕ И КОЛЛОИДНЫЕ СИСТЕМЫ
Важная роль в пищевой технологии принадлежит дисперсным и коллоидным системам и их свойствам.
Дисперсные системы гетерогенны и состоят из двух фаз. Одна из них — сплошная, называется дисперсионной средой. Другая — раздробленная и распределенная в первой, называется дисперсной фазой.
Дисперсными системами являются большинство продуктов питания, сырье и полуфабрикаты: хлеб, мука, шоколад, сыры, творог, сухое молоко, соки, шампанское, пиво, конфеты и т. п.
5.4.1. Классификация дисперсных систем
Все дисперсные системы классифицируют по степени дисперсности.
Дисперсные системы с частицами, размер которых превышает 10
3 см, относятся к грубодисперсным системам. Эти частицы при распределении в жидкости или газе, где они постепенно оседают или всплывают, наблюдаются визуально.
Дисперсные системы классифицируются не только по размерам частиц, но и по агрегатному состоянию дисперсной фазы и дисперсионнойсреды.
Сочетание трех агрегатных состояний (твердое, жидкое и газообразное) дает 9 типов дисперсных систем (см. табл. 3). Условно их обозначают дробью, числитель которой указывает на агрегатное состояние дисперсной фазы, а знаменатель— дисперсионной среды. Например, обозначение Г/Ж показывает, что система состоит из газообразной дисперсной фазы и жидкой дисперсионной среды (газообразное вещество в жидкости).
Типы дисперсных систем
5.4.2. Коллоидные системы
Дисперсные системы с частицами коллоидных размеров принято называть золями (от лат. solutio — раствор).
Системы с газовой дисперсионной средой независимо от природы газа называют аэрозолями. Системы с жидкой дисперсионной средой — лиозолями (от греч. lios — жидкость).
По размеру частиц золи занимают промежуточное положение между истинными растворами и грубодисперсными системами — порошками, суспензиями и эмульсиями.
Коллоидные системы образуются двумя путями.
При этом необходимыми условиями образования коллоидных систем являются нерастворимость вещества дисперсной фазы в дисперсионной среде; достижение частицами дисперсной фазы коллоидной дисперсности; наличие стабилизатора, сообщающего коллоидной системе агрегативную устойчивость.
Стабилизаторами могут быть вещества, специально вводимые в дисперсионную среду, например, поверхностно-активные вещества или продукты взаимодействия дисперсной фазы с дисперсионной средой. Стабилизаторы создают вокруг коллоидных частиц адсорбционный защитный слой, препятствующий их агрегатированию.
В производстве различных пищевых продуктов диспергирование и конденсация занимают одно из ведущих мест. Это обусловлено особенностями вещества в дисперсном состоянии, которые обеспечивают удобства фасования, транспортирования, дозирования, способствуют увеличению скоростей химических и биохимических реакций и процессов растворения, сорбции, экстракции и других процессов.
Диспергирование используют при дроблении и измельчении зерна в муку, какао-бобов в какао тертое и какао-порошок, сахара в сахарную пудру, в консервной промышленности при гомогенизации плодово-ягодных пюре и т. п.
Конденсация возникает в ректификационных аппаратах при получении спирта, кристаллизации сахара, выпаривании растворов, оклейке вин и т. д.
Коллоидные системы обладают молекулярно-кинетическими свойствами, обусловленными самопроизвольным движением частиц. Это такие свойства, как диффузия, осмотическое давление и распределение частиц по высоте.
На коллоидные частицы, распределенные в дисперсионной среде, действуют две противоположно направленные силы: сила тяжести и сила диффузии. Под действием силы тяжести частицы стремятся осесть на дно — седиментировать (от латинского слова sedimentum — осадок). Силы диффузии же стремятся распределить частицы равномерно по всему объему системы. Таким образом, дисперсные системы способны сохранять определенное распределение частиц по объему. Эта способность называется седиментационной или кинетической устойчивостью.
Грубодисперсные системы кинетически неустойчивы, их частицы велики и поэтому под действием силы тяжести оседают на дно. Молекулярные системы (газы, растворы) обладают очень высокой кинетической устойчивостью. Кинетическая устойчивость коллоидных систем зависит от размеров их частиц: чем меньше размер частиц, тем более кинетически устойчива коллоидная система.
5.4.3. Микрогетерогенные системы
СУСПЕНЗИИ
Суспензии представляют собой дисперсные системы с твердой дисперсной фазой и жидкой дисперсионной средой. К ним относятся фруктовые и овощные пасты, помадные конфетные массы, какао тертое и др.
ЭМУЛЬСИИ
Дисперсные системы, состоящие из жидкой дисперсной фазы и жидкой дисперсионной среды, называются эмульсиями. Обязательное условие образования эмульсии — нерастворимость вещества дисперсной фазы в дисперсионной среде.
Обычно эмульсии получают методом механического диспергирования. Для этого используют различные мешалки, смесители, гомогенизаторы, коллоидные мельницы и ультразвук.
Жидкости, из которых получают эмульсии, нерастворимы друг в друге и, следовательно, отличаются по своим свойствам. Практически одной из жидкостей всегда является вода, а другой — какая-либо неполярная, нерастворимая в воде жидкость, например, масло.
Эмульсии — неустойчивые системы. Неустойчивость этой системы проявляется в самопроизвольном слиянии капелек дисперсной фазы — коалесценции, что приводит к разрушению эмульсии и разделению ее на два слоя.
Устойчивость эмульсиям может придать только третий компонент — стабилизатор или эмульгатор. Роль эмульгатора в образовании устойчивой эмульсии заключается, во-первых, в том, что он адсорбируется на границе раздела фаз масло — вода (М/В) и снижает межфазное поверхностное натяжение, т. е. является поверхностно- активным веществом, а во-вторых, концентрируясь на поверхности капелек дисперсной фазы, эмульгатор образует механически прочный слой (пленку). Наличие такой защитной пленки на поверхности частиц дисперсной фазы препятствуют их слиянию, т. е. предохраняет эмульсию от коалесценции.
Природа эмульгатора определяет не только устойчивость, но и тип эмульсии. Эмульгаторы, растворимые в воде, способствуют образованию прямых эмульсий (М/В); эмульгаторы, растворимые в неполярных жидкостях, дают обратные эмульсии (В/М).
К представителям эмульсий относится ряд важнейших жиросодержащих продуктов, например, молоко, сливки, сливочное масло, сметана и майонез. Все это — эмульсии.
АЭРОЗОЛИ И ПОРОШКИ
Аэрозоли и порошки — это дисперсные системы, дисперсионной средой которых является газ (воздух), а дисперсной фазой могут быть твердые частицы или капельки жидкости.
Аэрозоли имеют большое практическое значение в ряде отраслей пищевой промышленности. К типичным аэрозолям относятся водяной туман, топочный дым, мучная и сахарная пыль. В ряде случаев в промышленности прибегают к искусственному получению аэрозолей. Так, для высушивания соки, пюре, молоко распыляют до мельчайших капелек в сухом горячем воздухе. Из образующегося аэрозоля благодаря его большой удельной поверхности испарение влаги идет очень интенсивно, и сушка заканчивается за 15-20 с.
Образование аэрозолей может привести к нежелательным и опасным последствиям. Так, пыль многих веществ — муки, сахара, крахмала, угля — образует с воздухом взрывоопасные смеси.
Порошки можно рассматривать как осажденные аэрозоли с твердыми частицами. Однако частицы в них могут быть более крупными и достигать в диаметре 1-2 мм. Размер частиц промышленных порошков определяется их целевым назначением и часто является одним из основных показателей качества продукта. Например, дисперсность и распределение частиц по размерам в какао-порошке влияют на вкусовые качества и пищевую ценность этого продукта. Степень помола зерна оказывает влияние на качество муки.
ПЕНЫ
Высококонцентрированные дисперсные системы, в которых дисперсионная среда — жидкость, а дисперсная фаза — газ, называются пенами.
Пузырьки газа в пенах имеют большие размеры, форму многогранников и отделены друг от друга очень тонкими слоями дисперсионной среды.
Для получения пен применяют диспергационные методы: интенсивное встряхивание или перемешивание жидкости.
Устойчивую пену можно получить только в присутствии стабилизатора — пенообразователя. Это связано с тем, что поверхность жидкости, соприкасающаяся с газообразной средой, находится в особых условиях по сравнению с основной массой жидкости. Эти условия возникают потому, что молекулы поверхностного слоя жидкости в отличие от молекул, находящихся в глубине, подвергаются неодинаковому притяжению молекул жидкости и газа. Каждая молекула внутри жидкости со всех сторон притягивается соседними молекулами, расположенными на расстоянии радиуса сферы действия межмолекулярных сил. В результате силы притяжения компенсируются, и равнодействующая этих сил равна нулю. У молекул поверхностного слоя часть сферы действия межмолекулярных сил находится в газовой фазе, плотность которой меньше плотности жидкости, поэтому равнодействующая всех сил притяжения будет направлена внутрь жидкости перпендикулярно к ее поверхности. Вследствие этого поверхностные молекулы жидкости всегда находятся под действием силы, стремящейся втянуть их внутрь. Это приводит к тому, что поверхность жидкости всегда стремится сократиться. Этим объясняются и шарообразная форма капли жидкости (шар имеет минимальную поверхность), и идеально гладкая поверхность жидкости в широком сосуде. При увеличении поверхности некоторое число молекул из глубины жидкости переходит на поверхность. Процесс переноса молекул из равновесного состояния в особое состояние молекул поверхностного слоя требует затраты внешней работы. Работа по увеличению площади поверхности жидкости переходит в потенциальную энергию молекул поверхностного слоя— поверхностную энергию. Последняя, в свою очередь, отнесенная к единице поверхности, называется поверхностным натяжением.
Пенообразующие вещества с длинной молекулярной цепью уменьшают поверхностное натяжение, облегчают образование пены и придают ей стабильность, так как они адсорбируются на границе вода-воздух и образуют высоковязкую структурированную пленку, препятствующую стеканию жидкости. В этом случае толщина слоя жидкости между пузырьками воздуха уменьшается медленно, и пена может существовать длительное время.
Пенообразование имеет важное практическое значение. В частности, многие продукты, такие как хлеб, ряд кондитерских изделий, имеют структуру пены, что определяет их вкусовые свойства и пищевую ценность.
5.4.4. Молекулярные коллоиды (растворы высокомолекулярных соединений)
Вещества, имеющие молекулярную массу от 10000 до нескольких миллионов, называются высокомолекулярными соединениями (ВМС). Размеры макромолекул этих соединений в вытянутом состоянии могут достигать 1000 нм и более, т. е. они соизмеримы с размерами частиц ультрамикрогетерогенных (коллоидных) дисперсных систем.
Вследствие большой молекулярной массы и гибкости цепей макромолекул ВМС га растворы обладают специфическими свойствами: способностью образовывать волокна и пленки, эластичностью, набухаемостью, структурообразованием.
К важнейшим природным полимерам относятся белки и полисахариды.
По химической структуре белки являются полиамидами, исходными мономерами для их синтеза служат а-аминокислоты.
Полисахариды представляют собой соединения, состоящие из многих сотен и даже тысяч моносахаридных звёньев. К наиболее важным полисахаридам относятся крахмал, целлюлоза, пектин и др.
Растворы ВМС по своим свойствам аналогичны коллоидным системам. Так же, как и у коллоидных растворов, у них сравнительно невелика скорость диффузии, небольшое осмотическое давление, они не проходят через полунепроницаемые мембраны.
В отличие от золей растворы ВМС образуются самопроизвольно и не нуждаются в стабилизаторе.
Растворению ВМС предшествует его набухание.
Набухание — это самопроизвольный процесс поглощения низкомолекулярного растворителя высокомолекулярным веществом, сопровождающийся увеличением массы и объема последнего. Набухание часто является начальным этапом растворения высокомолекулярных веществ.
Существует ограниченное и неограниченное набухание. При ограниченном набухании объем и масса полимера достигают определенных значений, и дальнейший контакт полимера с растворителем не приводит к каким-либо изменениям. Ограниченно набухший полимер называется студнем. У неограниченного набухания отсутствует предел набухания; с течением времени полимер поглощает все большее количество жидкости и набухание переходит в растворение.
Причиной набухания является диффузия молекул низкомолекулярного растворителя в высокомолекулярное вещество. Между макромолекулами полимера обычно имеются небольшие промежутки, размер которых соизмерим с размером молекул растворителя. Благодаря этому молекулы низкомолекулярной жидкости достаточно быстро проникают между макромолекулами, раздвигая молекулярные цепи.
Набухание включает не только простую диффузию, но и сольватацию макромолекул, т. е. взаимодействие молекул растворителя с молекулами полимера.
При взаимодействии высокомолекулярного вещества с полимером сольватируется не вся макромолекула. Если растворитель полярен, то сольватируются полярные группы, если неполярен — то сольватируются неполярные группы. В зависимости от того, каких групп в полимере больше, он будет быстрее набухать в полярном или неполярном растворителе. Обычно набухание — избирательное явление, так как полимер набухает в жидкостях, близких к нему по химическому строению. Так, углеводородные полимеры типа каучук набухают в неполярных жидкостях — бензине, бензоле. Полимеры, в состав молекул которых входят полярные группы, набухают в воде и спиртах.
Чаще всего жидкой дисперсионной средой в пищевых производствах служит вода. При этом следует учитывать, что часть воды находится в свободном состоянии, а часть — в связанном.
В системах, в состав которых входят биополимеры (высокомолекулярные природные соединения — белки, полисахариды), часть воды, прочно связанная с поверхностью этих макромолекул, образует гидратную оболочку. Например, 1 г яичного альбумина связывает 0,25 г воды, образуя гидратный слой толщиной 0,25 нм.
Свободная же вода служит реакционной средой и растворителем веществ. При участии гидролитических ферментов она вступает во множество реакций, в результате которых образуются новые вещества. Таким образом, свободная вода является и активным участником биохимических реакций.
Мука, состоящая главным образом из сухих протеиновых гелей и крахмальных зерен, при замешивании теста (при взаимодействии с водой) проявляет коллоидные свойства.
Крахмал муки, смоченный водой при комнатной температуре, может адсорбционно связать 35-40% влаги. При более высокой температуре и достаточном количестве воды связывание крахмала с водой увеличивается, и при температуре 60°С и избытке воды происходит процесс клейстеризации крахмала, т. е. нарушение структуры крахмальных зерен и образование коллоидного раствора.
Крахмал, смоченный водой в любом соотношении и в любых условиях, не образует связного теста.
Ведущая роль в образовании теста принадлежит белкам пшеничной муки.
Белки способны набухать в холодной воде и удерживать воду в количестве в 2-2,5 раза больше своей массы. При замешивании теста из пшеничной муки белки при достаточном количестве воды легко и сравнительно быстро (через 3-5 мин) образуют тончайшие нити и пленки, связывающие и склеивающие между собой зерна увлажненного крахмала. Благодаря этому пшеничное тесто приобретает упруговязкопластичные свойства, какими не обладает тесто из других злаков.
Крахмал муки состоит из двух основных фракций — амилозы и амилопектина. Амилоза содержится внутри крахмальных зерен, а амилопектин образует их наружную оболочку. Амилоза отличается меньшей величиной частиц и меньшей молекулярной массой (около 80000), а амилопектин — большей величиной частиц и большей молекулярной массой (115000). Это позволяет рассматривать зерно крахмала как осмотическую ячейку, внутри которой находится растворимая низкомолекулярная фракция — амилоза, обусловливающая избыточное осмотическое давление и приток воды внутрь ячейки.
Гидратация муки при разных температурах зависит от поведения белков и крахмала. В температурном интервале 25-40°С гидратация муки происходит преимущественно за счет белков клейковины. Повышение температуры до 60°С приводит к резкому усилению этого процесса в результате значительного увеличения гидратации крахмала при понижении этой способности у белков клейковины.
Таким образом, набухание пшеничной муки при низкой температуре (25-40°С) в основном протекает вследствие осмотического набухания бежов, а при более высокой температуре (60°С) — в результате осмотического связывания воды крахмалом.
В связи с этим схему образования теста можно представить в следующем виде.
Белки, содержание которых в пшеничной муке составляет 10- 20%, при температуре замеса около 30°С поглощают незначительное количество воды путем взаимодействия гидрофильных групп белка с водой, а значительное количество воды диффундирует внутрь белка в результате наличия в нем избыточного осмотического давления.
Крахмал, содержание которого в пшеничной муке достигает 70%, при той же температуре теста поглощает до 30% воды благодаря активности гидрофильных групп. Так как крахмал количественно преобладает в муке, то содержание влаги, связанное крахмалом и белками клейковины, приблизительно одинаково.
При неограниченном оводнении коллоидов муки часть воды находится в свободном состоянии в капиллярах теста. Незначительная часть растворимых белков, а также сахара и неорганические соли находятся в растворе.
Набухшие белки во время замеса плотно соприкасаются друг с другом и образуют сплошную белковую сетку с адсорбционно связанными с ними, слабо набухшими крахмальными зернами. В белковую сетку, кроме того, входят другие нерастворимые вещества. Это приводит к образованию массы (теста), обладающей упруговязкопластичными свойствами.
Недостаточное количество воды при замесе теста приводит к получению несвязной массы увлажненного сырья. При избыточном количестве воды, добавляемой к муке, не образуется связного теста, а получается мучная болтушка, в которой частицы набухшего белка разделены водными оболочками, препятствующими соприкосновению их и образованию клейковинных нитей.
Тесто, используемое для мучных кондитерских изделий, — более сложный комплекс, так как в состав его кроме муки и воды входят и другие виды сырья, в первую очередь сахар и жир, влияющие на набухаемость коллоидов муки.
Сахар, присутствующий в кондитерском тесте в виде водного раствора, оказывает влияние на степень набухания белков клейковины. С увеличением концентрации сахара степень набухания белков снижается.
Жир, адсорбируясь на поверхности белков, образует пленки, препятствующие проникновению воды внутрь макромолекул белков, что ослабляет связь между ними, при этом уменьшается упругость и увеличивается пластичность теста.
Таким образом, регулируя количество сахара и жира, добавляемых при замесе теста, можно получать тесто с определенными физическими свойствами.
5.4.5. Структурообразование в дисперсных системах
Одно из важных свойств дисперсных систем и растворов ВМС — способность их к структурообразованию.
Коллоидные системы, частицы которых удалены друг от друга на достаточно большое расстояние и практически не взаимодействующие между собой, называются свободнодисперсными системами. Такие коллоидные системы по своим свойствам похожи на обычные жидкости. Их вязкость очень мало отличается от вязкости дисперсионной среды.
Дисперсные системы, в которых частицы связаны между собой и не способны к взаимному перемещению, называются связнодис- персными системами. В таких системах частицы дисперсной фазы образуют пространственную сетку или структуру.
Рассмотрим процесс структурообразования на примере пектина при производстве фруктового желе.
Желеобразная консистенция фруктовых консервов достигается благодаря присутствию в сырье пектина, который образует в сахарокислотном растворе пространственную сетку. Пектин при нагревании образует коллоидные растворы. На поверхности молекул пектина адсорбированы молекулы воды, которые создают сольватную (водную) оболочку вокруг частиц пектина. Это препятствует соединению пектиновых молекул для образования пространственной сетки. Для формирования желе необходимо присутствие наряду с пектином Сахаров и кислот.
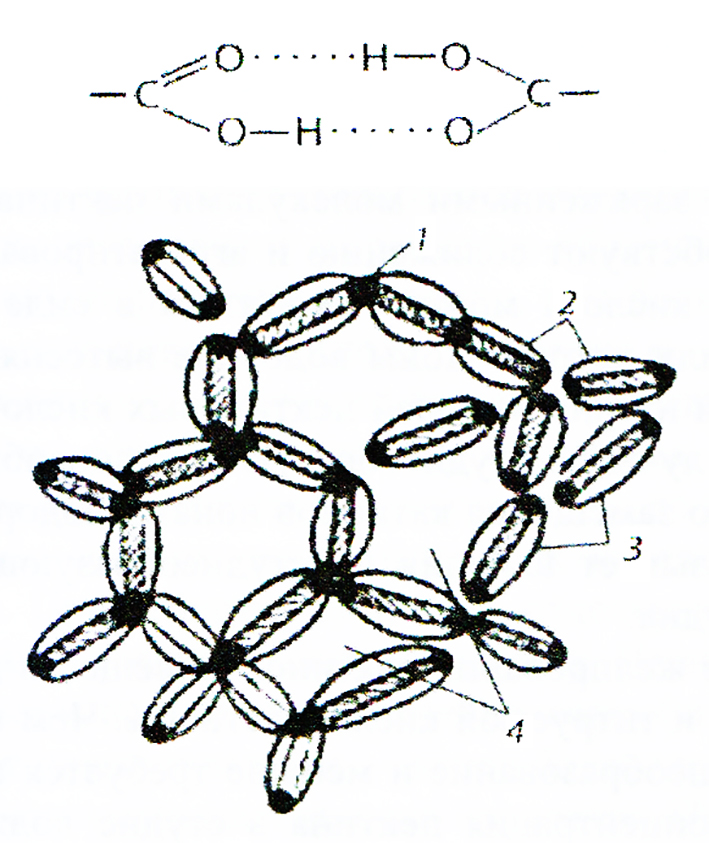
Сила притяжения частиц пектина сосредоточена по краям молекулы. Соединение частиц концами приводит к образованию пространственной сетки, которая охватывает весь объем продукта и служит каркасом студня (см. рис. 25). Укрепление сетки происходит за счет водородных мостиков, которые образуются между карбоксильными и гидроксильными группами соседних пектиновых молекул.
Образовавшиеся ячейки внутри заполнены жидким сахарокислотным раствором. По мере остывания студня тепловое движение замедляется и продолжается процесс укрупнения студня, т. е. сближение молекул и образование цепей. Чем выше концентрация пектина, тем легче сближение молекул и прочнее их сцепление и тем быстрее идет застудневание.
Механическое воздействие на студень при его остывании ослабляет его прочность. Но при нагревании структура студня может быть восстановлена. Это свойство пектиновых студней называется тиксотропией.
Пектино-сахаро-кислотный студень — упруго-эластичная система, в которой каждый компонент выполняет свои функции.
Схема сцепления частиц пектина в желе:
1 — концевые участки, свободные от зарядов; 2 — частицы пектина; 3 — соль- ватные оболочки;
4 — петли пектиновой сетки с дисперсионной средой.
Каркас студня составляет пектин, поэтому прочность студня будет зависеть от вида и качества пектина. Лучше и прочнее студень образуется в присутствии высокометоксилированного пектина, который имеет длинную цепочку с числом метоксильных групп более 70%. Значение имеет также общее содержание пектина в сырье и его природа. Наилучшей желирующей способностью обладает пектин яблок, крыжовника, черной смородины, кожуры цитрусовых. Концентрация пектина должна быть около 1%.
Количество сахара, которое требуется для образования студня, зависит от свойств и количества применяемого пектина. Чем больше пектина и выше его желирующие свойства, тем больше требуется сахара для студнеобразования. Максимальное количество сахара, которое может быть использовано для образования студня, — показатель «сахароемкости» пектина. Он определяет студнеобразующую способность и измеряется в градусах. Это масса сахара, приходящаяся на единицу массы пектина. Для пектина средней студнеобразующей способности содержание сахара должно быть близким к насыщенному раствору при комнатной температуре, т. е. 65%.
Еще один компонент пектинового студня — кислота. Она определяет рН студня. Чем больше диссоциирована кислота, тем более она способствует образованию агрегатов пектиновых молекул, так как при диссоциации кислоты в растворе появляются свободные положительно заряженные ионы водорода (Н + ). Они взаимодействуют с отрицательно заряженными молекулами пектина, нейтрализуют их заряд и способствуют сближению и агрегатированию. Полиметилга-лактуроновая кислота может находиться в виде слаборастворимых солей калия или натрия. Ионы водорода вытесняют и замещают катионы калия и натрия из солей пектиновых кислот, а пектиновые кислоты имеют лучшую студнеобразующую способность, чем их соли. После полного замещения катионов ионами водорода добавление кислоты не оказывает влияния на студнеобразующую способность и прочность студня.
Хорошее желирование пектиновых веществ достигается при рН среды 3,0-3,4 и титруемой кислотности 1%. Чем ниже рН, тем быстрее идет студнеобразование и меньше требуется пектина. Например, при рН 3,1 концентрация пектина в студне должна быть не менее 0,7%, при рН 3,-0,8%, при рН 3,-0,9%. При рН более 3,5 студень образуется непрочный.
Используя способность ВМС к образованию студней, можно получить более сложные дисперсные системы, например, пенообразные кондитерские массы (пастилу). Эти изделия являются в основном агаровым студнем. Он имеет пористую структуру с ячейками микроскопических размеров (до 20 мкм).
В пастильном студне распределены мелкие воздушные пузырьки, и готовая сухая пастила напоминает по своей структуре твердый крем. В производстве пастилы процесс обычного студнеобразования мармелада сочетается с процессом пенообразования (сбивания) яблочно-сахарной смеси.
При сбивании пастилы путем продолжительного встряхивания яблочно-сахарной смеси происходит вспенивание ее, т. е. масса насыщается воздухом; при этом воздух захватывается яблочно-сахарной массой и дробится на мелкие частички. По мере увеличения скорости механического взбалтывания степень раздробленности воздуха увеличивается, размеры пузырьков воздуха уменьшаются, а вязкость массы повышается. Постепенно образуется густая пена, состоящая из мелких пузырьков воздуха, затянутых в тонкую пленку из окружающей полужидкой яблочно-сахарной смеси.
В физико-химическом смысле пена представляет собой двухфазную систему газ-жидкость. В данном случае дисперсной фазой является газ-воздух, а дисперсионной средой — полужидкий раствор сахара, кислоты и пектина. Этот раствор образует оболочку дисперсных частиц газа (воздуха), которая несет на себе поверхностный пограничный слой, отделяющий одну фазу от другой.
В процессе образования пены происходит сильное развитие поверхности раздела на границах газообразной и жидкой фаз. Увеличение поверхности раздела зависит от размеров образующихся воздушных ячеек. Чем меньше размеры последних, тем больше эта поверхность, тем больше сила поверхностного натяжения o.
Сила поверхностного натяжения всегда стремится сократить до минимума общую поверхность раздела всей системы, сделать ее наименьшей. В данном случае она стремится сократить до возможных пределов общую сумму поверхностей отдельных капелек, образующих пенную эмульсию. При действии этой силы отдельные пузырьки воздуха в пене стремятся соединиться в одну массу. Пленка капелек прорывается, отдельные капельки, постепенно сливаясь (агрегируясь) друг с другом, образуют новые пузырьки — капли более крупных размеров, степень дисперсности уменьшается, пена «опадает». Процесс самопроизвольного разрушения пены и эмульсии называется коалесценцией.
В пенах процесс коалесценции идет весьма интенсивно благодаря близкому расположению капелек по отношению друг к другу.
Чтобы сделать пену более устойчивой, стабилизировать ее, в качестве пенообразующего средства (ПАВ) при сбивании пастилы обычно используют белок куриного яйца, который, располагаясь в поверхностном слое пленки пузырьков пены, увеличивает механическую прочность этого слоя и тем самым препятствует прорыванию пленки пузырьков и агрегированию последних.
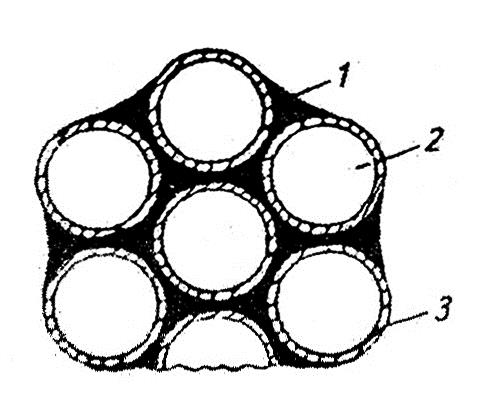
Механизм совмещения студневой и пенной структур при смешивании сбитой массы с агаровой (или мармеладной) можно представить так: при смешивании с холодной сбитой массой горячая масса агарового сиропа или мармелада заполняет воздушные пространства между пузырьками сбитой массы, вытесняя оттуда воздух (см. рис. 26).
При этом прочность пленки структурных элементов массы значительно увеличивается. Последняя возрастает благодаря тому, что температура всей массы поднимается до 50°С и адсорбированный альбуминовый гель пленки при указанной температуре, близкой к свертыванию альбумина, фиксируется в ней в виде плотного коагулята. Одновременно же по мере остывания массы в пространстве между пузырьками происходит формирование прочного агарового (или пектинового) студня. Смешивание сбитой массы с горячей желейной (или мармеладной) массой создает, таким образом, необходимые условия для образования структуры пастилы.
Схема совмещения пенной и студневой структур пастилы:
1 — агаро-сахаро-водный студень; 2 — воздух; 3 — пектино-белково-сахаро- водная пленка.
После остывания массы получается характерный пастельный студень, который отличается от мармеладного только пористой структурой благодаря мельчайшим воздушным включениям, равномерно распределенным в его массе.