Что можно наблюдать в химии
Наблюдение и эксперимент как методы изучения естествознания и химии
Урок 2. Химия. Вводный курс. 7 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Наблюдение и эксперимент как методы изучения естествознания и химии»
Знания о природе человек получает с помощью наблюдения.
Наблюдение – это концентрация внимания на познаваемых объектах с целью их изучения.
С помощью наблюдения человек накапливает информацию об окружающем мире, систематизирует её, выявляя при этом определённые закономерности.
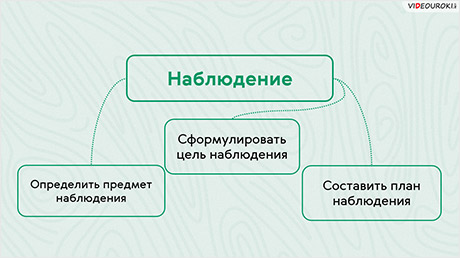
Для того, чтобы наблюдение было эффективным, следует выполнять ряд условий. Во-первых, нужно определить предмет наблюдения. Предметом наблюдения выступает вещество, его свойство или превращения веществ. То есть это то, на что обращено внимание наблюдателя. Во-вторых, нужно сформулировать цель наблюдения, то есть для чего это наблюдение нужно. В-третьих, необходимо составить план наблюдения, чтобы достичь нужной цели.
В основе составления плана лежит гипотеза. Термин «гипотеза» происходит от греческого слова hypothesis, что означает «основание, предположение». Гипотеза может быть выдвинута в конце, когда уже получен результат наблюдения.
Естественно то, что научное наблюдение отличается от житейского. Как правило, научное наблюдение проводится в определённых условиях и в специальном помещении, например, в лаборатории.
Эксперимент представляет собой научное воспроизведение какого-либо явления с целью его исследования, испытания в определённых условиях.
Само название «эксперимент» происходит от латинского experimentum, что означает «опыт, проба». Эксперимент позволяет опровергнуть гипотезу, возникшую при наблюдении, и сформулировать вывод.
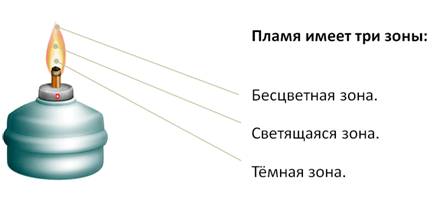
Проведём небольшой эксперимент по изучению строения пламени. Если зажечь свечу и посмотреть на пламя, то можно заметить, что оно неоднородно по цвету и имеет три зоны. Первая – это тёмная зона – находится в нижней части пламени. Эта зона самая холодная. За тёмной зоной следует яркая часть пламени, температура которой выше, чем в тёмной зоне. В верхней части пламени, которая является бесцветной, самая высокая температура. Если поместить спичку в пламя так, чтобы она пересекала все зоны, то можно заметить, что спичка обугливается в верхней и средней зонах. Это означает, что температура в этих зонах наиболее высокая.
Как вы думаете, а будет ли пламя спиртовки иметь такое же строение, как и пламя свечи? Для этого используем следующие гипотезы. Первая: предположим, что пламя будет иметь одинаковое строение, так как в основе этого лежит одинаковый процесс – горение. Второе предположение: строение пламени будет отличаться, так как возникает в результате горения различных веществ.
Чтобы доказать или опровергнуть одну из гипотез, нужно провести эксперимент. Зажжём спиртовку. Пламя, как и в случае со свечой, имеет три зоны: внутреннюю (тёмную) самую холодную, среднюю светящуюся (горячую) и внешнюю бесцветную (самую горячую).
Таким образом, можно сделать вывод, что строение любого пламени одинаково. Поэтому, чтобы нагреть в пламени какой-либо предмет, его нужно внести в верхнюю часть пламени, потому что она самая горячая.
Все экспериментальные данные принято записывать в специальном лабораторном журнале или тетради. Записывают дату проведения эксперимента, его название и ход опыта в виде таблицы. Например, в первой колонке, что делал, во второй – что наблюдал и в третьей – выводы.
Таким образом, объект наблюдения в нашем случае – пламя свечи. Цель наблюдения – определить строение пламени и температуру в разных частях пламени. План – зажечь свечу, рассмотреть пламя, проверить температуру пламени.
Ещё великий Леонардо да Винчи говорил, что науки, которые не родились из эксперимента, – основы всех познаний – бесполезны и полны заблуждений.
Все естественные науки – это экспериментальные науки. Для постановки любого эксперимента требуется специальное оборудование. Так, в биологии часто используют оптические приборы, которые позволяют увеличивать изображение наблюдаемого объекта. К таким оптическим приборам относят лупу и микроскоп. Физики применяют приборы для измерения напряжения, силы тока и электрического сопротивления. У географов имеются такие приборы, как компас, метеорологические зонды, а также огромные научно-исследовательские суда, уникальные космические орбитальные станции.
Химики также используют специальное оборудование, например, спиртовку, химическую посуду и так далее.
Самые красивые химические реакции в мире — описание, особенности и интересные факты
Нежные чувства к науке могут испытывать не только те, кто любит учится, но и ценители прекрасного и удивительного. Химия — точная наука, через которую человек познает мир. Она многогранна и достаточно интересна, особенно если опустить долгие изыскания и сразу увидеть результат.
В статье кратко описаны самые невероятные химические реакции и приведена информация о них.
Реакция первая: натрий и H2O, газообразный хлор
Инструкция проста: к натрию и газу необходимо добавить одну каплю воды, и начнется спектакль. Что должен увидеть человек, производящий реакцию, что почувствовать? С этим все достаточно просто: во-первых, будет выделяться очень много тепла, а значит, в колбе поднимется температура. Во-вторых, раствор будет излучать ровный желтый свет. Именно этот эксперимент относится к одним из самых необычных химических реакций.
Почему так происходит? Главным элементом реакции является натрий. Благодаря его природной горючести он часто используется в освещении улиц. Сама реакция безвредна потому, что при соединении хлора и натрия возникает хлорид, более известный простым обывателям как простая поваренная соль, которую можно найти на любой кухне.
Реакция вторая: сухой лед и магний

Что представляет собой сухой лед? Это замороженный углекислый газ. Его очень часто используют в различных экспериментах в домашних условиях, при съемках кино и клипов со звездами. При попадании в теплую среду или воду вещество начинает дымиться и дает своеобразный эффект тумана, что само по себе уже является красивой химической реакцией.
Вторым компонентом является магний, по своей природе очень горючее вещество. Первоначально, после открытия этого свойства, использовался в качестве вспышки для фотоаппаратов, но уже позднее его стали применять в качестве отвечающего за воспламенение состава.
Сама реакция происходит так: магний заключают в своего рода клетку из углекислого газа, а поскольку он способен гореть как в нем, так и в азоте, то начинается процесс. Внешних спецэффектов немного, но выглядит все так, как будто горит лед изнутри, к тому же от сухого льда идет испарение в виде тумана.
Реакция третья: сладости и соль бертолетовая
Реакция четвертая: Эффект Мейснера
Этот опыт проводится достаточно часто не только в высших учебных заведениях, но даже в средних школах, если, конечно, позволяет оборудование и запасы. Для проведения эксперимента нужен сверхпроводник, охладитель и магнит. При остывании до температуры, которая будет ниже переходной, сверхпроводник начнет активно отталкиваться от любого магнитного поля. Внешне это будет выглядеть, как объект, парящий над магнитом.
Такие реакции используются в транспорте нового поколения, полностью избавленном от трения колес об рельсы. Это открытие послужило началом нового витка развития транспортных технологий.
Реакция четвертая: суперабсорбирующие полимеры
Несмотря на то что именно эта вещь сейчас известна каждому, все же стоит уделить ей немного внимания. Суперабсорбирующие полимеры (в народе просто гидрогель) способны поглощать просто гигантское количество воды по сравнению с собственной массой.
Сегодня эту красивую химическую реакцию можно провести и дома, поскольку гранулы гидрогеля продаются чуть ли не на каждом шагу. Многим взрослым и детям очень интересно наблюдать за тем, как растут в размерах гранулы.
В производстве подобное вещество используется при изготовлении подгузников для детей или в тех областях, где требуется качественная защита от воды, связанная с ее поглощением.
Реакция номер пять: гексафторид серы
По своей сути это вещество является газом, который намного тяжелее воздуха. Его можно налить в емкость и отправить какой-либо легкий предмет в плаванье. Стоит отметить, что газ нетоксичен, не горит и абсолютно не имеет цвета и запаха, что создает иллюзию того, что предметы парят в воздухе.
Кроме всех прочих свойств, этот газ имеет одну особенность: при его вдыхании тембр голоса человека становится ниже, что прямо противоположно влиянию гелия.
Реакция шесть: охлаждение гелия
Реакция семь: Бриггса-Раушера
Что ни говори, именно она занимает лидирующее место в номинации «Самая красивая химическая реакция». Вся ее красота заключается в визуальных цветовых эффектах. По завершении приготовления раствора, изначально бесцветного, начинают происходить феноменальные изменения цвета. Сначала жидкость приобретает красивый янтарный оттенок, потом в ускоренном темпе становится темно-синей, после чего возвращается в исходное состояние, затем повторяет все изменения по кругу несколько раз, до момента полного затухания реакции. Причиной круговой смены цвета является то, что при первоначальной реакции выделяются вещества, провоцирующие следующую, и так по кругу.
30 химических реакций повседневной жизни
химические реакции Мы можем найти их в повседневной жизни в целом. Это ответ, который химик мог бы дать вам без ошибок, чтобы преувеличивать.
И это то, что кто-то стремится в этом вопросе будет пытаться увидеть вещи с молекулярной или атомной точки зрения, будет пытаться увидеть реакции повсюду, и молекулы постоянно превращаются.
Люди, разбирающиеся в химии, не могут не видеть вещи с этой точки зрения, точно так же, как физик мог видеть вещи с ядерной точки зрения или биолог с клеточной точки зрения..
Для обоснования комментария ниже я привожу 30 примеров химии, присутствующей в повседневной жизни..
Химические реакции, которые остаются незамеченными дома, на кухне, в саду, на улице или даже внутри нашего тела. Я надеюсь, что это поможет осветить обычную и рутинную химию в повседневной жизни..
30 химических реакций, которые вы видите каждый день в своей жизни
Химия на кухне
1- сольватационные реакции: когда соль растворяется в воде, ионные связи разрушаются, что приводит к сольватации катионов и анионов.
Технически готовят раствор хлорида натрия в воде..
2- Фазовые изменения: При кипячении воды во время приготовления или приготовления кофе или чая происходит фазовое изменение между жидкой водой и газированной водой.
3- реакции горения: Газовые плиты используют пропан для производства пламени.
4- ХлорХлор, используемый в качестве моющего средства, на самом деле представляет собой хлорит натрия, который является восстановителем. Пятна от одежды называются хромофорами и имеют ненасыщенность. Хлор атакует эту ненасыщенность, удаляя цвет пятен. Технически это не удаляет пятно, но делает его невидимым.
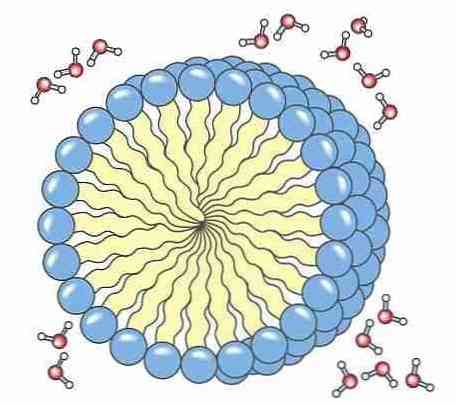
5- мылоМыла и моющие средства имеют полярную часть, обычно карбоновую кислоту, присоединенную к неполярной алифатической цепи, которая дает ей способность образовывать мицеллы. Эти мицеллы обладают способностью окружать грязь, поэтому ее можно удалить с одежды, посуды и нашего тела..
6- Пищевая сода: это слабое основание, которое при взаимодействии с кислотой, такой как уксус или вода (которая является слегка кислой), выделяет углекислый газ.
Это соединение является активным ингредиентом многих антацидов (C., 2015).
Жар кулинарии может денатурировать белки, стимулировать химические реакции между ингредиентами, карамелизовать сахар и т. Д. (Helmenstine A.M., 10 примеров химических реакций в повседневной жизни, 2017).
8- Искусственный вкус и цвет: многие обработанные пищевые продукты содержат химические вещества, которые придают особый вкус или цвет и способствуют их сохранению.
9- Плачь о луке: лук содержит аминокислотные молекулы сульфоксидов. При разрезании луковых клеточных стенок происходит разрушение, выделяя эти сульфоксиды вместе с ферментами, которые разлагают его до сульфеновых кислот, сероорганического соединения формулы R-SOH, которое раздражает глаза (Reactions, 2016).
Химия в доме
10- АккумуляторыОни используют электродохимические или окислительно-восстановительные реакции для преобразования химической энергии в электрическую. Спонтанные окислительно-восстановительные реакции происходят в гальванических элементах, тогда как не спонтанные химические реакции происходят в электролитических ячейках (Helmenstine, 2017).
11- ЖК-экраны: ЖК-телевизоры содержат спиральные кристаллические молекулы, которые имеют свойство ориентироваться в соответствии с электрическим сигналом и путем изменения тона или цвета, обеспечиваемого светодиодной лампой. Каждая кристаллическая молекула представляет собой пиксель на телевизоре, и чем больше молекул, тем выше разрешение.
12- Старые книги, которые хорошо пахнут: разложение целлюлозы из бумаги книг, придает листьям желтоватый цвет и запах ванили. Если у вас есть старые книги, которые хорошо пахнут в вашей библиотеке, это происходит из-за молекул лигнина или ванилина в нем.
13- Наркотики и наркотикиНекоторые лекарственные средства представляют собой молекулы, которые частично блокируют гормональную активность, вызываемую определенным раздражителем (например, лекарственные средства для снятия напряжения или противоэпилектические средства), в то время как другие являются ферментативными ингибиторами, такими как, например, анальгетики..
14- ШампуньКак шампуни и мыло, шампуни удаляют жир с кожи головы, образуя мицеллы. Ингредиентом, который заботится об этом, обычно являются сульфаты, такие как додецилсульфат или лауриловый эфир сульфата натрия или аммония.
15- Дезодоранты и антиперспиранты: плохой запах подмышек, ног и дыхания вырабатывается бактериями, которые питаются белками и жирами в поте, который выделяет апокринные железы.
У дезодорантов есть химическое соединение, названное триклозаном, который является сильным антибактериальным и фунгицидным средством. С другой стороны, антиперспиранты содержат соли алюминия, которые проникают в поры и предотвращают потоотделение..
16- Косметика и макияжЭто химические вещества и пигменты, которые прилипают к коже. Обычно это неполярные соединения, такие как воски и масла..
Химия в саду
17- Фотосинтез: это процесс, при котором зеленые растения производят свою еду. Это происходит в присутствии солнечного света и другого сырья, а именно углекислого газа и воды. Пигмент хлорофилла собирает световую энергию солнечного света, которая превращается в глюкозу (Crystal, 2017).
18- реакции окисления: на неокрашенных железных поверхностях часто наблюдается оксидное покрытие, которое постепенно приводит к разрушению железа. Это химическое явление, называемое окислением.
В этом случае железо соединяется с кислородом в присутствии воды, что приводит к образованию оксидов железа (химические реакции в повседневной жизни, 2016 г.).
20- Удобрения: калий, нитраты, фосфаты и сульфаты используются в почвах для обеспечения растений питательными веществами и могут расти.
21- ПестицидыЭто химические вещества, используемые для окуривания сельскохозяйственных культур или садов. Обычно это нейротоксины, которые поражают бактерии или насекомых, которые потребляют зерновые культуры..
Химия на улице
22- Сжигание бензина: автомобили используют бензин в качестве топлива за счет контролируемых взрывов, которые приводят в движение поршни двигателей.
23- Дым машин: вырабатывает свободные радикалы, которые являются очень реактивными соединениями и атакуют кожу или волосы, делая их сухими и ломкими, не говоря уже о том, что они канцерогенные.
24- кислотный дождь: избыток серы и оксидов азота в атмосфере, производимых заводами и автомобилями, растворяется в воде облаков с образованием серной, серной и азотной кислоты, которая выпадает в осадок в виде кислотных дождей.
25- Конструкции: цемент и другие материалы, используемые при строительстве домов, такие как картины, штукатурка и многие другие, являются продуктами химии. В частности, цемент сделан из молекул гидроксида кальция, также называемых негашеной известью.
Химия в вашем теле
26- Пищеварение: пищеварение основано на химических реакциях между пищевыми продуктами и кислотами и ферментами, которые расщепляют молекулы на питательные вещества, которые организм может усваивать и использовать.
27- Аэробное дыхание: основным процессом, который производит энергию в организме, является аэробный гликолиз. Здесь дыхание помогает расщеплять глюкозу (источник энергии) в воде, углекислый газ и энергию в форме АТФ. С6H12О6 + 6O2 → 6CO2 + 6H2O + Энергия (36 АТП)
28- Анаэробное дыхание: из-за перенапряжения, иногда клетки нашего организма истощаются и дышат анаэробно. Это вызывает синтез молочной кислоты. Анаэробное дыхание наблюдается у некоторых бактерий, дрожжей и других организмов. Уравнение анаэробного дыхания:
29- Мускульное движение: напряжение или расслабление мышц происходит из-за конформационных изменений белков скелетных мышц. Эти изменения происходят благодаря фосфокреатину, который при потере фосфата высвобождает энергию для процесса.
30- Мысль: это сложный биохимический процесс, в котором разность ионного потенциала создает электрические импульсы нейронов (Али, 2013).