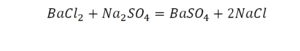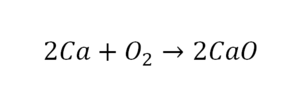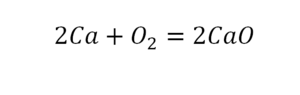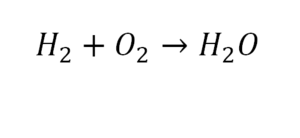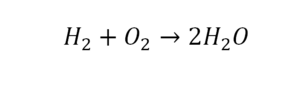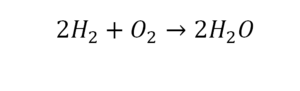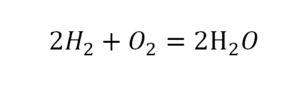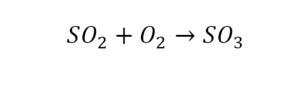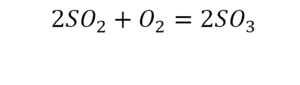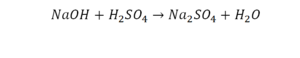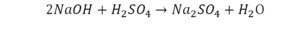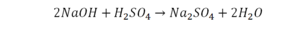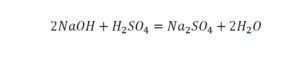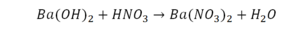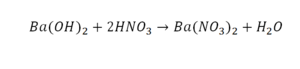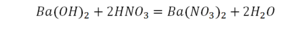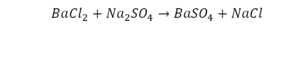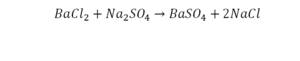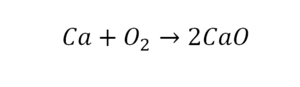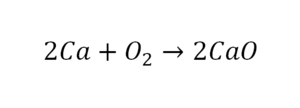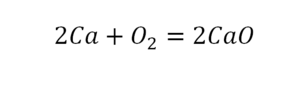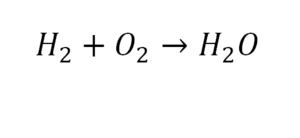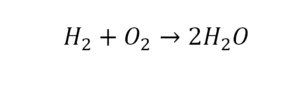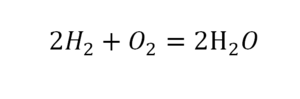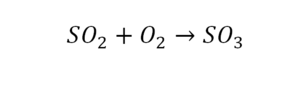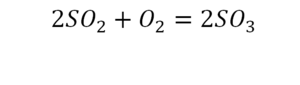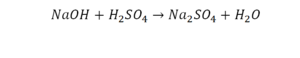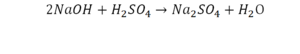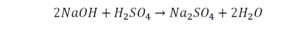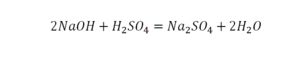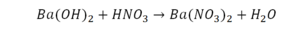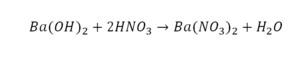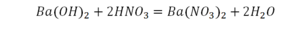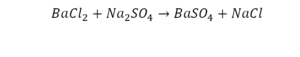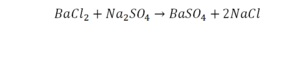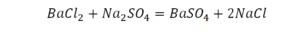Что такое расставить коэффициенты в химии
Что такое расставить коэффициенты в химии
Когда химические вещества вступают во взаимодействие, химические связи между их атомами разрушаются и образуются новые, уже в других сочетаниях. В результате одни вещества превращаются в другие.
Рассмотрим реакцию горения метана, происходящую в конфорке газовой плиты:
Молекула метана (CH₄) и две молекулы кислорода (2O₂) вступают в реакцию, образуя молекулу углекислого газа (CO₂) и две молекулы воды (2H₂O). Связи между атомами углерода (С) и водорода (H) в метане, а также между атомами кислорода (O) разрываются, и образуются новые связи между атомами углерода и кислорода в молекуле углекислого газа (CO₂) и между атомами водорода и кислорода в молекуле воды (H₂O).
Картинка даёт наглядное представление о том, что произошло в ходе реакции. Но зарисовывать сложные химические процессы такими схемами неудобно. Вместо этого учёные используют уравнения химических реакций.
Химическое уравнение — это условная запись химической реакции с помощью формул и символов.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
Виды химических реакций
Вещества вступают в реакции по-разному, можно выделить четыре наиболее частых варианта:
Сложное вещество негашёная известь соединяется с водой, и образуется новое сложное вещество — гашёная известь:
Стрелка вверх означает, что образовался газ. Он улетучивается и больше не участвует в реакции.
В примере атомы цинка замещают атомы водорода в составе хлороводорода, и образуется хлорид цинка:
Стрелка вниз означает, что вещество выпало в осадок, поскольку оно нерастворимо.
Коэффициенты в уравнениях химических реакций
Чтобы составить уравнение химической реакции, важно правильно подобрать коэффициенты перед формулами веществ.
Коэффициент в химических уравнениях означает число молекул (формульных единиц) вещества, необходимое для реакции. Он обозначается числом перед формулой (например, 2NaCl в последнем примере).
Коэффициент не следует путать с индексом (числом под символом химического элемента, например, О₂). Индекс обозначает количество атомов этого элемента в молекуле (формульной единице).
Чтобы узнать общее число атомов элемента в формуле, нужно умножить его индекс на коэффициент вещества. В примере на картинке (2H₂O) — четыре атома водорода и два кислорода.
Подобрать коэффициент — значит определить, сколько молекул данного вещества должно участвовать в реакции, чтобы она произошла. Далее мы расскажем, как это сделать.
Алгоритм составления уравнений химических реакций
Для начала составим схему химической реакции. Например, образование оксида магния (MgO) в процессе горения магния (Mg) в кислороде (O₂). Обозначим реагенты и продукт реакции:
Чтобы схема стала уравнением, нужно расставить коэффициенты. В левой части схемы два атома кислорода, а в правой — один. Уравняем их, увеличив число молекул продукта:
Теперь число атомов кислорода до и после реакции одинаковое, а число атомов магния — нет. Чтобы уравнять их, добавим ещё одну молекулу магния. Когда количество атомов каждого из химических элементов в составе веществ уравнено, вместо стрелки можно ставить равно:
Уравнение химической реакции составлено.
Рассмотрим реакцию разложения. Нитрат калия (KNO₃) разлагается на нитрит калия (KNO₂) и кислород (О₂):
В обеих частях схемы по одному атому калия и азота, а атомов кислорода до реакции 3, а после — 4. Необходимо их уравнять.
Для начала удвоим коэффициент перед реагентом:
Теперь в левой части схемы шесть атомов кислорода, два атома калия и два атома азота. В левой по-прежнему по одному атому калия и азота и четыре атома кислорода. Чтобы уравнять их, в правой части схемы нужно удвоить коэффициент перед нитритом калия.
Снова посчитаем число атомов каждого химического элемента в составе веществ до и после реакции: два атома калия, два атома азота и шесть атомов кислорода. Равенство достигнуто.
Химические уравнения не только позволяют предсказать, что произойдёт при взаимодействии тех или иных веществ, но и помогают рассчитать их количественное соотношение, необходимое для реакции.
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.

Интересное по рубрике
Найдите необходимую статью по тегам
Подпишитесь на нашу рассылку
Мы в инстаграм
Домашняя онлайн-школа
Помогаем ученикам 5–11 классов получать качественные знания в любой точке мира, совмещать учёбу со спортом и творчеством

Как расставлять коэффициенты в химических уравнениях
Содержание:
Все химические реакции, проходящие в окружающем мире можно описать при помощи специальных уравнений, представляющих собой химические формулы и математические знаки с коэффициентами. И от правильно расставленных коэффициентов в химических уравнениях порой зависит не много не мало, а то какой собственно и будет химическая реакция и будет ли она вообще. В нашей статье мы расскажем о том, как правильно расставлять коэффициенты в химии, чтобы химические уравнения были записаны верно.
Пример разбора простых реакций
Главное правило, которым следует руководствоваться при составлении химических уравнений – принцип сохранения энергии вещества, то есть, сколько есть атомов каждого химического элемента в левой части уравнения, столько должно быть и в правой части того же уравнения.
Для примера возьмем химическую реакцию взаимодействия кальция (Ca) с кислородом (O2). Но для начала объясним, почему вообще кислород (как и некоторые другие химических элементы) в химических уравнениях записывается с индексом «2». Дело в том, что одна молекула кислорода имеет 2 атома, поэтому его записывают как O2. В свою очередь, к примеру, одна молекула воды, состоящая из кислорода и водорода, имеет всем известную формулу H2O. Это означает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Заметьте, что по своему усмотрению индексы в химических уравнениях и формулах менять нельзя, так как они изначально должны быть написаны правильно.
Теперь вернемся к нашему простому примеру реакции взаимодействия кальция и кислорода. Ее можно записать следующим образом:
О чем говорит эта запись? О том, что в результате химической реакции взаимодействия кальция с кислородом образуется оксид кальция, который записан формулой CaO. Но также обратите внимание, что в правой части оксид кальция мы записали с коэффициентом 2 – 2CaO. Это значит, что каждый из двух атомов кислорода сцепился со своим атомом кальция, но тогда происходит несоответствие – в правой стороне у нас два атома кальция, в то время как в левой только лишь один. А значит, чтобы запись была правильной в левой части мы должны перед кальцием поставить коэффициент 2:
Теперь мы можем проверить наше уравнение – с левой стороны у нас два атома кальция и с правой тоже два, а значит между обеими частями можно вполне справедливо поставить знак равенства:
Разберем еще один простой пример, из взаимодействия кислорода и водорода как мы знаем, рождается одно из самых ценным и необычных веществ во Вселенной (и это без преувеличения) – вода, основа жизни на нашей планете. Образование воды можно записать следующим уравнением:
Но где же здесь закралась ошибка? Давайте разберем: в левой части у нас два атома кислорода, а в правой только один. Значит перед формулой воды необходимо поставить коэффициент 2:
Умножение 2 молекул воды на 2 атома водорода даст нам 4 атома водорода с правой стороны, но ведь с левой стороны атомов водорода лишь два! Значить перед водородом в уравнении мы также должны поставить коэффициент 2 и теперь получим правильное химическое уравнение, где вместо стрелочки → можно уже смело поставить знак равенства.
Пример разбора сложной реакции
Теперь давайте разберем то, как проставлять коэффициенты в более сложных химических уравнениях:
Перед вами запись так званой реакции нейтрализации – взаимодействие кислоты и основания, в результате которого образуются соли и вода.
Что же мы имеем тут: с левой стороны у нас один атом натрия (Na), а с правой индекс говорит, что атомов натрия уже стало два. Значит логично, что химическую формулу основания гидроксида натрия NaOH надо умножить на 2. Или другими словами поставить перед ней коэффициент 2:
Количество серы в серной кислоте (H2SO4) и соли сульфате натрия (Na2SO4) у нас одинаковое, тут все хорошо, а вот с количеством кислорода и водорода опять несоответствие, с левой стороны кислорода 6, а с правой 5. Водорода с правой стороны 4, а с левой только 2, непорядок. Чтобы правильно записать это химическое уравнение надо сравнять количество кислорода и водорода в левой и правой части уравнения, к счастью тут сделать это просто, надо перед H2O поставить коэффициент 2.
Таким образом, количество всех химических элементов в правой и левой части уравнения у нас сравнялись, а значит, мы неспроста поставили знак равенства.
Для закрепления материала разберем еще один пример сложного уравнения.
Это уравнение отображает химическую реакцию гидроксида бария (Ba(OH)2) с азотной кислотой (HNO3) в результате которой образуется нитрат бария (Ba(NO3)2) и вода.
Пример этот нам интересен тем, что тут используются скобки. Они означают, что если множитель стоит за скобками, то каждый элемент умножается на него. Начнем же разбирать это уравнение, первое, что бросается в глаза, несоответствие азота N, слева он один, а вот справа, если принимать во внимание скобки, его уже два. Получим следующее:
Теперь у нас слева стало 4 атома водорода, а справа только 2. Значит, перед формулой воды также ставим коэффициент 2.
Теперь все элементы уравнены, и мы справедливо поставили знак равенства.
Видео
И чтобы окончательно закрепить материал, рекомендуем посмотреть это образовательное видео.
Коэффициенты и индексы в химических уравнениях
По коэффициенту можно узнать, сколько всего молекул или атомов принимают участие в реакции. Индекс показывает, сколько атомов входит в молекулу. Уравнением реакции называется запись химического процесса с помощью химических формул и математических знаков.
В такой науке, как химия, такая запись называется схемой реакции. Если возникает знак «=», то называется «уравнение». Давайте расставлять коэффициенты. В Са одна частица, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. Справа уравнения Са тоже один. По Са нам не надо работать. Смотрим следующий элемент. Это кислород.
Индекс говорит о том, что здесь две частицы кислорода, а справа без индексов. То есть слева 2 молекулы, а с правой одна молекула. Что делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты
Коэффициенты – это то, что написано перед молекулами. Они уже имеют право меняться. Для удобства саму формулу не переписываем. Справа 1 умножаем на 2, чтобы получить и там 2 частицы кислорода.
После того как мы поставили коэффициент, получилось две частицы кальция. Слева же только одна. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество молекул элементов равно с обеих сторон, то можем поставить знак «равно».
Следующий пример.
2 водорода слева, и после стрелочки у нас тоже 2 водорода. Смотрим дальше. Два кислорода до стрелочки, а после стрелочки индексов нет, значит, 1 атом. Слева больше, а справа меньше. Выходим из положения и ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось две частицы водорода. Вот чтобы получить 4, мы должны водород умножить на 2.
Проверяем. Если везде одинаково, то ставим «равно».
Последний пример в элементарных реакциях.
Реакция нейтрализации
Второй пример более сложный, так как здесь больше элементов вещества.
Эта реакция называется реакцией нейтрализации. Что здесь надо уравнивать в первую очередь?
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь дальше смотрим, сколько есть серы. С левой и правой стороны по 1 атому серы. Дальше смотрим на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем два.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны тоже 6. Кислород уравнен. Проверяем водород. Два водорода и еще два водорода будет 4 водорода с левой стороны. Смотрим с другой стороны. Здесь также 4 водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример:
Он интересен тем, что появились скобки. Скобки говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на этот множитель. Здесь надо начать с азота, так как его меньше, чем кислорода и водорода. Слева азот 1, а справа, с учетом скобок, его два.
Справа же 2 атома водорода, а нужно 4. Мы просто выходим из положения и умножаем воду на 2, в результате чего получили 4 водорода. Отлично, водород уравняли. Если все элементы не уравнены, нельзя сказать что-то однозначно. Остался не уравненным кислород. До реакции присутствует 8 атомов кислорода, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Теперь за счет коэффициента, который только что поставили, после реакции два натрия, до реакции его тоже 2. Отлично, все остальное уравнено.
Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
Коэффициенты и как правильно их расставлять в химической формуле
Содержание:
Химическое уравнение – отражение взаимодействия соединений формулами. Согласно закону сохранения массы в обеих сторонах уравнения должно быть равное количество атомов. Этот закон соблюдается с помощью расстановки коэффициентов.
Алгоритм расстановки коэффициентов
Примеры расстановки коэффициентов в уравнениях
В реакции участвуют углерод С, водород Н и кислород О. При подсчете атомов можно получить следующие результаты:
Количество атомов углерода совпадает, поэтому соединения углерода не нуждаются в коэффициентах.
Чтобы поставить коэффициент перед водородом, необходимо найти наименьшее общее кратное – 2. Поэтому вода Н2О нуждается в коэффициенте 2.
Стоит обратить внимание на то, что из-за постановки коэффициента перед водой количество кислорода увеличивается. В данном варианте уравнения слева находится два кислорода, а справа – четыре. Перед кислородом нужен коэффициент 2.
Как расставить коэффициенты в окислительно-восстановительных реакциях (ОВР)
1. В уравнении нужно найти восстановитель и окислитель. Для этого следует расставить степени окисления у каждого атома.
Теперь можно определить восстановитель и окислитель.
Mn +7 +5ē→Mn +2 (окислитель)
2. Затем необходимо найти наименьшее общее кратное принятых и отданных электронов. В данной реакции оно равно 10. Таким образом, у соединений марганца должен стоять коэффициент 2, а коэффициент 5 должен стоять только у газа хлора в правой части уравнения. Перед соляной кислотой в левой части уравнения коэффициент ставить рано, т. к. водород не изменил степень окисления.
3. Необходимо уравнять металлы. Слева два атома калия, а справа один, поэтому перед хлоридом калия необходимо поставить коэффициент 2.
4. Нужно уравнять количество хлора. Справа 16 атомов хлора, а слева только один. Перед соляной кислотой ставят коэффициент 16.
5. Затем необходимо посчитать количество водорода. Слева 16 атомов водорода, а справа 2, поэтому перед водой нужен коэффициент 8.
6. В обеих частях уравнения по 8 атомов кислорода.
Как расставить коэффициенты в окислительно-восстановительных реакциях с органическими веществами
Чтобы расставить степени окисления в органическом соединении, необходимо расписать полную формулу вещества.
Исходя из метода электронного баланса, в уравнении стоят следующие коэффициенты.
Как расставлять коэффициенты в химических уравнениях
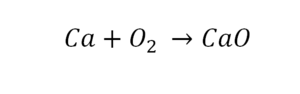
Такая запись является схемой химической реакции. Когда возникает знак «=», то это называется «уравнение». Попробуем его решить.
Пример разбора простых реакций
В кальции один атом, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. С правой стороны уравнения Са тоже один. По кальцию нам не надо работать.
Видео: Коэффициенты в уравнениях химических реакций.
Смотрим следующий элемент — кислород. Индекс 2 говорит о том, что здесь 2 иона кислорода. С правой стороны нет индексов, то есть одна частица кислорода, а с левой — 2 частицы. Что мы делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты — это то, что написано перед наименьшей частью. Они имеют право меняться. Для удобства саму формулу не переписываем. С правой части один умножаем на 2, чтобы получить и там 2 иона кислорода.
После того как мы поставили коэффициент, получилось 2 атома кальция. С левой стороны только один. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество атомов элементов равно с обеих сторон, то можем поставить знак «равно».
Другой наглядный пример: два водорода слева, и после стрелочки у нас тоже два водорода.
Смотрим дальше:
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось два атома водорода. И чтобы получить 4, мы должны водород умножить на два.
Видео: Расстановка коэффициентов в химическом уравнении
Вот тот случай, когда элемент в одной и в другой формуле с одной стороны, до стрелочки.
Один ион серы слева, и один ион — справа. Две частицы кислорода, плюс еще две частицы кислорода. Значит, что с левой стороны 4 кислорода. Справа же находится 3 кислорода. То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. Для этого умножаем на два всю формулу после стрелочки. После умножения получаем шесть ионов кислорода, да еще и 2 атома серы. Слева же имеем одну микрочастицу серы. Теперь уравняем ее. Ставим слева уравнения перед серой 2.
Уравняли.
Сложные реакции
Этот пример более сложный, так как здесь больше элементов вещества.
Это называется реакцией нейтрализации. Что здесь нужно уравнивать в первую очередь:
Напрашивается вывод, что надо умножить всю формулу на два.
Видео: Составление уравнений химических реакций
Теперь смотрим, сколько серы. С левой и правой стороны по одной. Обращаем внимание на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем 2.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны также 6 атомов. Проверяем водород. Два атома водорода и еще 2 атома водорода. То есть будет четыре атома водорода с левой стороны. И с другой стороны также четыре атома водорода. Все элементы уравнены. Ставим знак «равно».
Видео: Химические уравнения. Как составлять химические уравнения.
Здесь пример интересен тем, что появились скобки. Они говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на него. Начать необходимо с азота, так как его меньше, чем кислорода и водорода. Слева азот один, а справа, с учетом скобок, его два.
Справа два атома водорода, а нужно четыре. Мы выходим из положения, просто умножая воду на два, в результате чего получили четыре водорода. Отлично, водород уравняли. Остался кислород. До реакции присутствует 8 атомов, после — тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Последний пример.
На очереди у нас барий. Он уравнен, его трогать не нужно. До реакции присутствует два хлора, после нее — всего один. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Видео: Балансирование химических уравнений.
Теперь за счет коэффициента, который только что поставлен, после реакции получилось два натрия, и до реакции тоже два. Отлично, все остальное уравнено.
Также уравнивать реакции можно методом электронного баланса. Этот метод имеет ряд правил, по которым его можно осуществлять. Следующим действием мы должны расставить степени окисления всех элементов в каждом веществе для того, чтобы понять где произошло окисление, а где восстановление.
.jpg)
.jpg)
.jpg)
.jpg)


.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)