Что такое раствор серной кислоты
Раствор серной кислоты и его свойства
Серная кислота очень гигроскопична, легко поглощает водяные пары. Хорошо смешивается с водой, образуя растворы любой концентрации. Серная кислота – одно из важнейших химических соединений, находящее самое широкое применение в разных отраслях производства.
Серная кислота – «кровь химии»
Эта кислота известна со времен Средневековья. По имеющимся сведениям, впервые ее получил арабский алхимик Ар-Рази в IX веке, который прокаливал смесь железного и медного купороса.
С XIX века получили широкое распространение два основных способа получения серной кислоты: камерный и контактный. Объемы производства этого вещества непрерывно росли. Серная кислота широко используется при получении различных синтетических материалов, минеральных удобрений, красителей, лекарственных средств, взрывчатых веществ. Без нее невозможно представить современное текстильное, кожевенное, металлообрабатывающее производство. Поэтому серную кислоту по праву называют «кровью химии».
Свойства раствора серной кислоты
Концентрированная серная кислота практически не содержащая воды, имеет плотность около 2 грамм/см3. Она может смешиваться с водой в любых соотношениях. Легко понять, что чем менее концентрированный раствор, тем ближе будет его плотность к плотности воды, то есть к 1 грамму/см3.
При смешивании кислоты с водой необходимо лить кислоту в воду тонкой струйкой, постоянно перемешивая. Ни в коем случае нельзя лить воду в кислоту!
Раствор серной кислоты реагирует с металлами, находящимися в электрохимическом ряду напряжений слева от водорода. При этом образуется соль (сульфат) и выделяется водород. Например: 2К + H2SO4 = K2SO4 + H2.
При взаимодействии раствора серной кислоты с раствором щелочи происходит реакция нейтрализации, с образованием соли (сульфата) и воды. Например: Ca(OH)2 + H2SO4 = CaSO4 + 2H2O.
Раствор серной кислоты реагирует с солями, образованными более слабыми кислотами. Например, если воздействовать серной кислотой на кусочки мела или известняка, тут же пойдет реакция с бурным образованием мелких пузырьков. Она протекает по такой формуле: H2SO4 + CaCO3 = H2CO3 + CaSO4.
Образовавшаяся угольная кислота очень нестойкая и практически мгновенно разлагается на воду и углекислый газ. Выделение углекислого газа и приводит к образованию пузырьков.
Раствор серной кислоты также широко используется в свинцовых аккумуляторах. Раствор также применяют при лечении рака. Эффективна кислота и против геморроя. Однако лечение следует проводить только после консультации со специалистом. Серную кислоту можно найти в продаже.
Серная кислота
Содержание
Физические и физико-химические свойства [ ]
Олеум [ ]
Температура кипения водных растворов cерной кислоты повышается с ростом ее концентрации и достигает максимума при содержании 98,3 % H2SO4.
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов cерной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3, в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
С повышением температуры усиливается диссоциация H₂SO₄ ↔ H₂O + SO₃ — Q, уравнение температурной зависимости константы равновесия lnKp = 14,74965 − 6,71464ln(298/T) — 8,10161·10⁴T² — 9643,04/T — 9,4577·10⁻³T + 2,19062·10⁻⁶T². При нормальном давлении степень диссоциации: 10⁻⁵ (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К). Плотность 100%-ной cерной кислоты можно определить по уравнению: d = 1,8517 − 1,1·10⁻³t + 2·10⁻⁶t² г/см³. С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO³ увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается: λ = 0,518 + 0,0016t — (0,25 + t/1293)·С/100, где С-концентрация серной кислоты, в %. Максимальнаую вязкость имеет олеум H₂SO₄·SO₃, с повышением температуры η снижается. Электрическое сопротивление серной кислоты минимально при концентрации 30 и 92 % H2SO4 и максимально при концентрации 84 и 99,8 % H₂SO₄. Для олеума минимальное ρ при концентрации 10 % SO₃. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10⁻⁵T 3/2 см²/с.
Химические свойства [ ]
Применение [ ]
Серную кислоту применяют:
Самый крупный потребитель серной кислоты — производство минеральных удобрений. На 1 т P₂O₅ фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH₄)₂SO₄ — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Токсическое действие [ ]
Дополнительные сведения [ ]
Получение серной кислоты [ ]
Стандарты [ ]
Примечания [ ]
Литература [ ]
ar:حمض الكبريتيك bg:Сярна киселина br:Trenkenn sulfurek bs:Sumporna kiselina ca:Àcid sulfúric cs:Kyselina sírová cy:Asid swlffwrig da:Svovlsyre de:Schwefelsäure el:Θειικό οξύ en:Sulfuric acid eo:Sulfata acido es:Ácido sulfúrico et:Väävelhape fa:اسید سولفوریک fi:Rikkihappo fr:Acide sulfurique gl:Ácido sulfúrico he:חומצה גופרתית hu:Kénsav id:Asam sulfat is:Brennisteinssýra it:Acido solforico ja:硫酸 ko:황산 la:Acidum sulphuricum lmo:Acid sulforich lt:Sieros rūgštis lv:Sērskābe ms:Asid sulfurik nds:Swevelsüür nl:Zwavelzuur nn:Svovelsyre no:Svovelsyre pl:Kwas siarkowy(VI) pt:Ácido sulfúrico ro:Acid sulfuric sh:Sumporna kiselina simple:Sulfuric acid sk:Kyselina sírová sl:Žveplova kislina sr:Сумпорна киселина sv:Svavelsyra th:กรดกำมะถัน tr:Sülfürik asit uk:Сульфатна кислота ur:ترشۂ گندھک vec:Àsido solfòrico vi:Axít sulfuric zh:硫酸
Серная кислота
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Получение
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:
Химические свойства
В водном растворе диссоциирует ступенчато.
С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Серная кислота. Свойства серной кислоты.
Серная кислота H2SO4 – нелетучая тяжелая жидкость, хорошо растворима в воде (при нагревании). tпл. = 10,3°C, tкип. = 296°С,
Отлично впитывает влагу, поэтому часто выступает в качестве осушителя.
Производство серной кислоты представляет собой контактный процесс. Его можно разделить на 3 этапа:
1. Получение SO2 путем сжигания серы или обжигом сульфидов.
3. Поглощение SO3 серной кислотой, в результате чего образуется 100% серная кислота (олеум):
Воду использовать нельзя из-за образования тумана.
Химические свойства серной кислоты.
Серная кислота H2SO4 – двухосновная кислота, которая обладает большой силой. В воде она диссоциирует ступенчато:
Разбавленная серная кислота реагирует только с металлами, стоящими в ряду напряжения до водорода:
В реакциях с щелочами или основными оксидами образует сульфаты или гидрофильфаты:
Необходимо отметить, что сульфат бария является нерастворимым сульфатом, поэтому его используют в качестве индикатора на присутствие сульфат-ионов.
Концентрированная H2SO4 окисляет медь, серебро, углерод и фосфор:
Концентрированная H2SO4 при обычных условиях не взаимодействует с Al, Cr, Fe, но при нагревании вступает в реакцию.
Концентрированная H2SO4 быстро вступает в реакцию с водой, выделяя пр этом огромное количество тепла.
Серная кислота
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
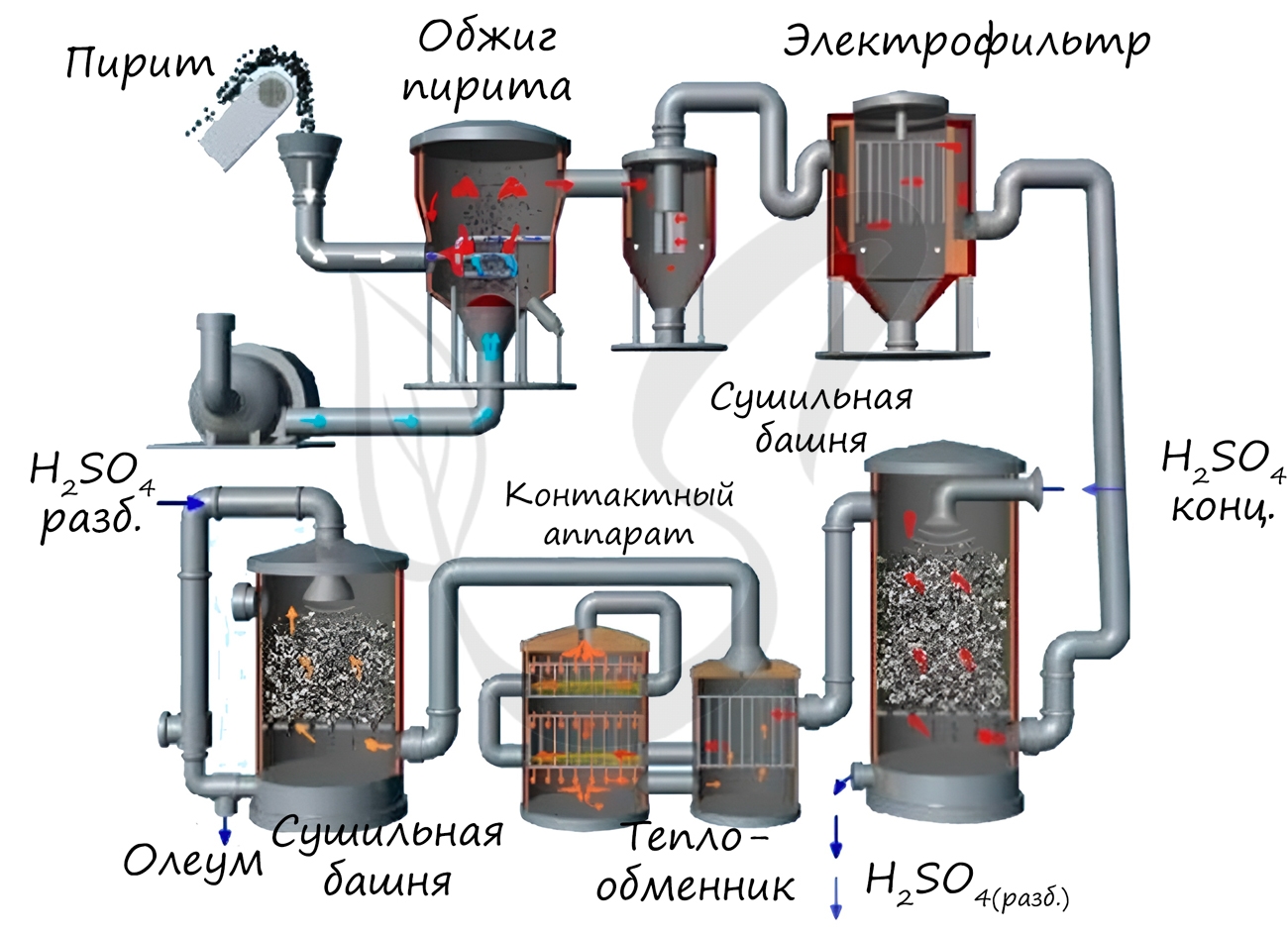
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800 о С |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3): Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
Химические свойства
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
4. Т акже серная кислота вступает в обменные реакции с солями.
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород: