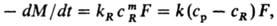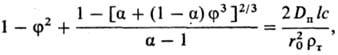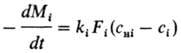Что такое растворение в химии
Растворение
Раство́р — гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии химического равновесия
Содержание
Твердые, жидкие, газообразные растворы
Чаще под раствором подразумевается жидкое вещество, например раствор соли или спирта в воде (или даже раствор золота в ртути — амальгама).
Существуют также растворы газов в жидкостях, газов в газах и жидкостей в жидкостях, в последнем случае растворителем считается вода, или же компонент, которого больше.
В химической практике обычно под растворами понимают гомогенные системы, растворитель может быть жидким, твердым (твёрдый раствор), газообразным. Однако нередко допускается и микрогетерогенность — см. «Золи».
Раствором именуют и смесь цемента с водой, песком и т.д. Хотя это и не является раствором в химическом смысле этого слова.
Истинные и коллоидные растворы
Коллоидные и истинные растворы (изучением коллоидных систем занимается коллоидная химия) отличаются главным образом размерами частиц.
В истинных растворах размер частиц менее 1·10 −9 м, частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах размер частиц 1·10 −9 м — 5·10 −7 м, частицы в таких растворах можно обнаружить при помощи ультрамикроскопа (см. эффект Тиндаля).
Растворение
См. также
Растворы электролитов и неэлектролитов
Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов).
См. также
Растворы полимеров
Растворы высокомолекулярных веществ ВМС — белков, углеводов и др. обладают одновременно многими свойствами истинных и коллоидных растворов. Средняя молекулярная масса растворенного
Концентрация растворов
В зависимости от цели для выражения концентрации растворов используются разные единицы измерения — весовой и объёмный процент, молярность, моляльность, г/л, мольная доля и др.
Мнемонические правила
В случаях приготовления растворов сильных кислот согласно правилам техники безопасности кислоту нужно лить в воду, но ни в коем случае не наоборот. Для запоминания этого лабораторного приема существует несколько мнемонических правил:
Сначала вода,
Потом кислота,
Иначе случится
Большая беда
См. также
Полезное
Смотреть что такое «Растворение» в других словарях:
РАСТВОРЕНИЕ — РАСТВОРЕНИЕ, в геологии форма химического ВЫВЕТРИВАНИЯ. Растворение особенно активно в известняковых зонах, где в результате этого мелкие трещинки могут превратится в крупные ТРЕЩИНЫ, ВОРОНКИ и ГРАЙКИ. Растворение также может происходить в… … Научно-технический энциклопедический словарь
растворение — разжижение, лизис, травление, открытие, размешивание, распускание, распахивание, солюбилизация, открывание, разведение, диссолюция, отворение Словарь русских синонимов. растворение сущ. 1. • открывание • отворение • раскрывание • распахивание … Словарь синонимов
РАСТВОРЕНИЕ — уменьшение долевого участия акционеров в распределении чистого дохода в результате увеличения акционерного капитала. Экономический словарь. 2010 … Экономический словарь
Растворение — уменьшение долевого участия акционеров в распределении чистого дохода в результате увеличения акционерного капитала. Словарь бизнес терминов. Академик.ру. 2001 … Словарь бизнес-терминов
РАСТВОРЕНИЕ — РАСТВОРЕНИЕ, растворения, мн. нет, ср. (спец.). Действие по гл. растворить2 растворять2. При растворении тел иногда происходит заметное выделение тепла. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
растворение — РАСТВОРИТЬ 2, рю, ришь; рённый ( ён, ена); сов., что. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
«РАСТВОРЕНИЕ» — уменьшение долевого участия акционеров в распределении чистого дохода в результате увеличения акционерного капитала. Райзберг Б.А., Лозовский Л.Ш., Стародубцева Е.Б.. Современный экономический словарь. 2 е изд., испр. М.: ИНФРА М. 479 с.. 1999 … Экономический словарь
«РАСТВОРЕНИЕ» — уменьшение долевого участия акционеров в распределении чистого дохода в результате увеличения акционерного капитала. Словарь бизнес терминов. Академик.ру. 2001 … Словарь бизнес-терминов
растворение — разведение — [Англо русский глоссарий основных терминов по вакцинологии и иммунизации. Всемирная организация здравоохранения, 2009 г.] Тематики вакцинология, иммунизация Синонимы разведение EN dilution … Справочник технического переводчика
растворение — Процесс, при котором жидкость, обычно вода, растворяет твердые частицы горных пород, как, например, это имеет место при химическом выветривании … Словарь по географии
Понятие о растворах. Растворимость веществ
Растворы — гомогенные (однородные) системы переменного состава, которые содержат два или несколько компонентов.
Наиболее распространены жидкие растворы. Они состоят из растворителя (жидкости) и растворенных веществ (газообразных, жидких, твердых):
Жидкие растворы могут быть водные и неводные. Водные растворы — это растворы, в которых растворителем является вода. Неводные растворы — это растворы, в которых растворителями являются другие жидкости (бензол, спирт, эфир и т. д.). На практике чаще применяются водные растворы.
Растворение веществ
Растворение — сложный физико-химический процесс. Разрушение структуры растворяемого вещества и распределение его частиц между молекулами растворителя — это физический процесс. Одновременно происходит взаимодействие молекул растворителя с частицами растворенного вещества, т.е. химический процесс. В результате этого взаимодействия образуются сольваты.
Сольваты — продукты переменного состава, которые образуются при химическом взаимодействии частиц растворенного вещества с молекулами растворителя.
Если растворителем является вода, то образующиеся сольваты называются гидратами. Процесс образования сольватов называется сольватацией. Процесс образования гидратов называется гидратацией. Гидраты некоторых веществ можно выделить в кристаллическом виде при выпаривании растворов. Например:
Что представляет собой и как образуется кристаллическое вещество синего цвета? При растворении в воде сульфата меди (II) происходит его диссоциация на ионы:
Образующиеся ионы взаимодействуют с молекулами воды:
При выпаривании раствора образуется кристаллогидрат сульфата меди (II) — CuSО4 • 5Н2О.
Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами. Вода, входящая в их состав, называется кристаллизационной водой. Примеры кристаллогидратов:
Впервые идею о химическом характере процесса растворения высказал Д. И. Менделеев в разработанной им химической (гидратной) теории растворов (1887 г.). Доказательством физико-химического характера процесса растворения являются тепловые эффекты при растворении, т. е. выделение или поглощение теплоты.
Тепловой эффект растворения равен сумме тепловых эффектов физического и химического процессов. Физический процесс протекает с поглощением теплоты, химический — с выделением.
Если в результате гидратации (сольватации) выделяется больше теплоты, чем ее поглощается при разрушении структуры вещества, то растворение — экзотермический процесс. Выделение теплоты наблюдается, например, при растворении в воде таких веществ, как NaOH, AgNО3, H2SО4, ZnSО4 и др.
Если для разрушения структуры вещества необходимо больше теплоты, чем ее образуется при гидратации, то растворение — эндотермический процесс. Это происходит, например, при растворении в воде NaNО3, KCl, K2SO4, KNO2, NH4Cl и др.
Растворимость веществ
Мы знаем, что одни вещества хорошо растворяются, другие — плохо. При растворении веществ образуются насыщенные и ненасыщенные растворы.
Насыщенный раствор — это раствор, который содержит максимальное количество растворяемого вещества при данной температуре.
Ненасыщенный раствор — это раствор, который содержит меньше растворяемого вещества, чем насыщенный при данной температуре.
Количественной характеристикой растворимости является коэффициент растворимости. Коэффициент растворимости показывает, какая максимальная масса вещества может раствориться в 1000 мл растворителя при данной температуре.
Растворимость выражают в граммах на литр (г/л).
По растворимости в воде вещества делят на 3 группы:
Таблица растворимости солей, кислот и оснований в воде:
Растворимость веществ зависит от природы растворителя, от природы растворенного вещества, температуры, давления (для газов). Растворимость газов при повышении температуры уменьшается, при повышении давления — увеличивается.
Зависимость растворимости твердых веществ от температуры показывают кривые растворимости. Растворимость многих твердых веществ увеличивается при повышении температуры.
По кривым растворимости можно определить: 1) коэффициент растворимости веществ при различных температурах; 2) массу растворенного вещества, которое выпадает в осадок при охлаждении раствора от t1 o C до t2 o C.
Процесс выделения вещества путем испарения или охлаждения его насыщенного раствора называется перекристаллизацией. Перекристаллизация используется для очистки веществ.
Растворение: что такое в химии, как характеризуется, описывается
Содержание:
Растворение — это процесс, при котором частицы взаимодействуют между собой. Раствор – это гомогенная смесь, состоящая из мелких частиц вещества и растворителя. В растворах частицы не видны. До XIX века растворы рассматривали только с физической точки зрения, и считалось, что растворение – это результат процесса диффузии. В 1906 году была высказана теория Дмитрия Ивановича Менделеева, объединяющая химические и физические процессы в растворах. Доказана эта теория была значительно позже.
Растворимость – это максимально возможное число граммов вещества, которое растворяется в 100 г воды или другого растворителя при определенной температуре. Понятие растворимости используется при приготовлении насыщенных и ненасыщенных растворов. Она зависит от:
Например, в 100 мл воды Н2О растворяется 200 г пищевого сахара С12Н22О11 или 35,9 г пищевой соли NaCl. При нагревании растворимость газов понижается, а твердых веществ повышается.
Растворимость у всех веществ различна. Растворяемое вещество можно классифицировать на несколько групп в зависимости от растворимости:
Растворение в формулах
Также в задачах на растворы встречается понятие массовой доли, которую можно рассчитать по следующей формуле:
В первом случае массовая доля – безразмерная величина, а во втором случае массовая доля выражается в процентах %.
Также растворы можно выразить с помощью молярной концентрации (молярности). Единица измерения – моль/л.
Задачи на растворение веществ
Задача №1. В насыщенной гомогенной смеси 33 % соли. Найдите коэффициент растворимости.
Дано:
Решение:
Ответ: kS=49,25 г/100 г воды
Задача №2. Массовая доля нитрата серебра AgNO3 в насыщенном растворе равна 69,5 %. Найдите массу соли, растворяемой в 100 г воды Н2О.
Дано:
Решение:
х+100 – масса раствора
Ответ: m(AgNO3)=227,9 г
Задача №3. В 100 г воды Н2О растворяется 36 г хлорида натрия NaCl. Определите массовую долю соли в насыщенном растворе.
Дано:
Решение:
w(NaCl)=36 г/136 г=0,265 или 26,5 %
Ответ: w(NaCl)=0,265 или 26,5 %
Найти: w(NaCl)-?
Задача №4. В 100 г воды Н2О растворяется 36 г хлорида натрия NaCl. Найдите молярную массу раствора поваренной соли, если плотность раствора 1,2 г/мл.
РАСТВОРЕНИЕ
РАСТВОРЕНИЕ твердых тел, гетерогенное физ.-хим. взаимод. твердого тела и жидкости, сопровождающееся переходом твердой фазы в р-р; один из осн. процессов хим. технологии. Растворение следует отличать от экстрагирования, при к-ром контактирующие с р-ром твердые частицы состоят из двух или более р-римых и инертных твердых фаз, а растворение носит избират. характер (см. также Выщелачивание).
Различают физическое, химическое и электрохимическое растворение. При физическом растворении переход в р-р в-ва не сопровождается изменением его хим. состава; в-во можно выделить в твердом состоянии с помощью выпаривания и кристаллизации. При химическом растворении переход в-ва в р-р сопровождается хим. р-цией; исходное в-во нельзя выделить из р-ра в твердом состоянии физ. методами (примеры-растворение металлов или их оксидов в к-тах, растворение фосфоритов либо апатитов в сернокислотном р-ре с получением Н 3 РО 4 и др.). Электрохимическое растворение протекает в условиях, когда процессу сопутствует перенос электрич. зарядов. Наиб. изучены закономерности и практика растворения твердых в-в с ионной кристаллич. решеткой (гл. обр. соли), к-рым в осн. посвящена данная статья.
Физико-химические основы процесса
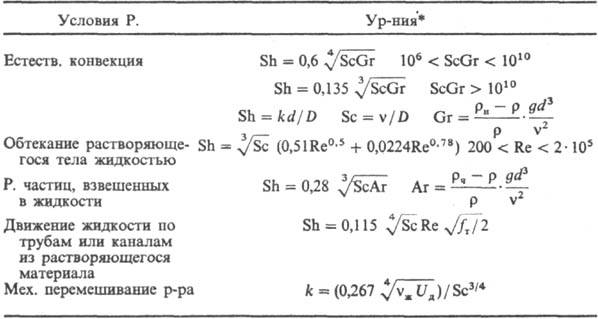
Физическое растворение может протекать по диффузионному, кине-тич. или смешанному механизму (см. Массообмен). Рассмотрим наиб. распространенный диффузионный механизм. При растворении на пов-сти растворяющегося тела возникает диффузионный пограничный слой, в пределах к-рого концентрация изменяется от с н на пов-сти тела до концентрации с в осн. массе р-ра. При погружении тела в неподвижную жидкость в пределах диффузионного слоя возникает движение жидкости, побуждаемое разностью плотностей ее и тела в слое и вне его (естеств. конвекция). При погружении тела в движущуюся жидкость в пределах диффузионного слоя также возникает движение, скорость к-рого снижается по мере приближения к пов-сти тела (вынужденная конвекция, ускоряемая перемешиванием). При этом толщина слоя зависит от его диффузионных и гидродинамич. параметров и уменьшается с увеличением числа Рейнольдса Re = ud/v (u-скорость обтекания жидкостью объекта растворения, d-eгo размер, v-кинематич. вязкость жидкости).
Химическое растворение может протекать без образования или с образованием новой фазы.
Р астворение без образования новой фазы (продукты р-ции растворены в жидкости). Скорость процесса находят из выражения:
-dM/dt = Fc p /(1/k R +1/k).
Аналогично физическому растворению в данном случае также различают диффузионный, кинетич. и смешанный механизмы.
Р астворение с образованием новой твердой фазы. Возможно неск. вариантов процесса.
1) Твердый продукт р-ции немедленно удаляется с пов-сти растворения; при этом скорость процесса остается постоянной (при F = const и с = const).
2) Твердый продукт образует пленку с постоянной по толщине пористостью, плотно связанную с исходным твердым материалом. По мере протекания процесса толщина пленки возрастает, а скорость процесса снижается. Анализ кинетики растворения сферич. частиц (наиб. распространенный случай) в описанных условиях приводит к выражению:
3) Образующаяся твердая фаза кристаллизуется в р-ре, что обусловлено его пересыщением, и осаждается на пов-сти растворения. Ее экранирование тем значительнее, чем выше концентрация твердых частиц в р-ре.
Опытные данные по кинетике растворения ряда объектов обобщены критериальными ур-ниями, к-рые применимы к концентрациям, не превышающим критические:
Sh* = (k R d)/D R Sc* = (lq R d)/( r r u ж )
Закономерности растворения техн. металлов и их сплавов связаны с электрохим. явлениями (см. Коррозия металлов, Электрохимическая кинетика).
Способы организации и аппаратурное оформление
Схемы процесса. Пром. реализация растворения, проводимого в аппаратах-растворителях, связана с определенной схемой взаимод. твердой и жидкой фаз: замкнутый периодич. процесс (напр., в аппарате с мешалкой); прямоточное или противоточное растворение, при к-ром фазы движутся соотв. в одном направлении либо в противоположных направлениях; периодич. растворение в слое растворяющихся частиц (жидкость фильтруется через неподвижный стационарный слой). В крупнотоннажных произ-вах наиб. распространены прямоточная и противоточная схемы. При прямотоке пов-сть растворения и движущая сила (с н — с) одновременно уменьшаются, что приводит к замедлению процесса. При противотоке уменьшение пов-сти растворения сопровождается увеличением разности концентраций, а скорость растворения более постоянна. Выбор схемы растворения зависит также и от др. факторов, напр. от размера частиц растворяющегося в-ва. Так, при растворении полидисперсной смеси частиц в противоточном аппарате трудно избежать выноса за его пределы мелкой фракции вместе с жидкостью.
В практике растворения широко применяют комбинир. схемы, комплектуемые из ряда аппаратов. Так, каждый аппарат в отдельности работает по принципу прямотока, а вместе соединены в противоточную схему. Растворению обычно предшествует измельчение твердого материала, что способствует ускорению процесса, но требует больших энергетич. затрат и затрудняет фильтрац. очистку полученного р-ра. Размер частиц, поступающих на растворение, находят оптимизацией его самого и всей совокупности сопутствующих процессов.
При галургич. переработке минер., сырья важную роль играет растворение многокомпонентных солевых систем. Напр., в основе получения КС1 из сильвинита лежит частичное растворение NaCl и почти полное растворение KCl в горячих щелоках с последующим выделением из р-ра готового продукта при охлаждении. Кинетика растворения смеси из п компонентов определяется совместным решением (обычно на ЭВМ) системы ур-ний:
F i =f F (M i ) i=1,2. n
и ур-ния материального баланса типа
Аппаратура. При периодич. процессе в одном и том же аппарате выполняют ряд последоват. операций: дозировку компонентов р-ра, заполнение рабочего объема, подогрев жидкости до заданной т-ры, собственно растворение, отделение р-ра от нерастворимого остатка, их выгрузку, подготовку к след. циклу. К оборудованию периодич. действия, используемому в малотоннажных произ-вах и при большом ассортименте растворяемых в-в, относятся аппараты с мех. перемешиванием и со стационарным слоем растворяющихся твердых частиц. В первом случае применяют перемешивающие приспособления разл. типов, частота вращения к-рых должна быть достаточна для создания гидродинамич. силы, способной привести частицы во взвешенное состояние (см. также Перемешивание). Во втором случае р-р фильтруется сквозь слой растворяющихся и инертных частиц, а скорость фильтрования определяет кинетику растворения.
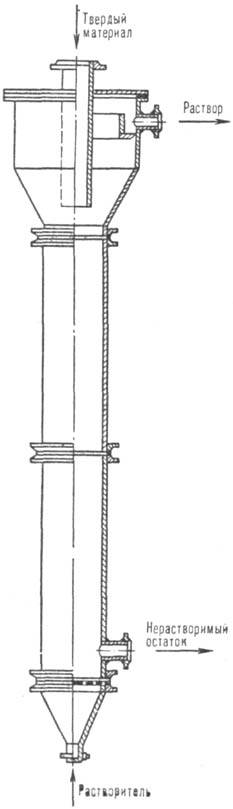
Рис. 1. Колонный аппарат для растворе- ния в псевдоожиженном слое.
Аппараты непрерывного действия используют для растворения больших масс материала. Каждая стадия осуществляется в отдельном аппарате. Пром. значение имеют аппараты: с псевдоожиженным слоем растворяющихся частиц; сочетающие растворение с гидравлич. транспортом целевых продуктов; с транспортирующими и перемешивающимися устройствами; с движущимся слоем твердой фазы.
На рис. 1 представлен аппарат с псевдоожиженным слоем, предназначенный для растворения, напр., галитовых отходов (размер частиц 0,5-5,0 мм) калийных предприятий. Скорость движения растворяющего рассола должна превышать скорость псевдоожижения крупных частиц.
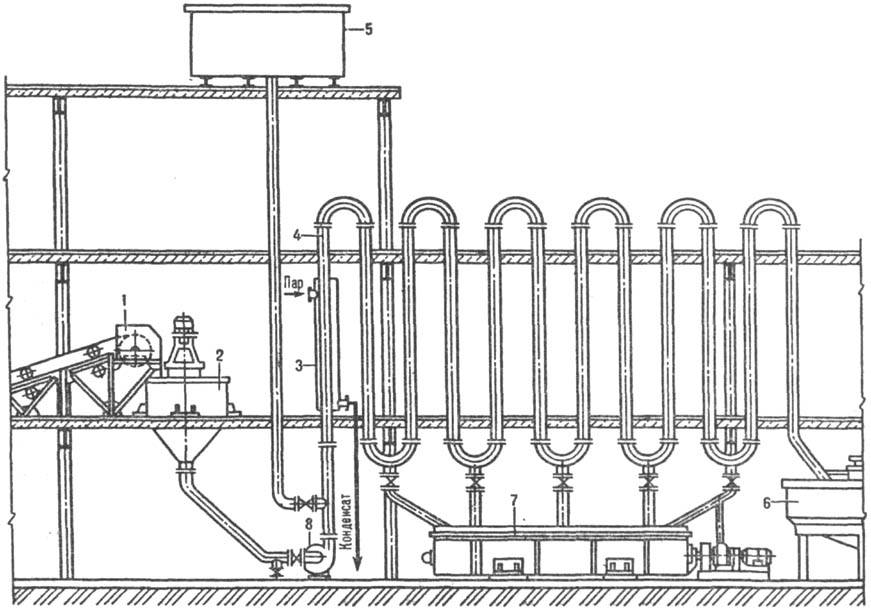
Трубчатый растворитель (рис. 2) состоит из ряда последовательно соединенных вертикальных труб, через к-рые насосом перекачивается суспензия, предварительно подготовленная в аппарате с мешалкой 2. Скорость движения жидкости должна превышать скорость осаждения самых крупных частиц во избежание закупорки труб. В случае аварийной остановки насоса жидкость, содержащая и твердую фазу, спускается в горизонтальный корытный аппарат с мешалкой 7.
К числу аппаратов с транспортирующими и перемешивающими устройствами относится шнековый растворитель (рис. 3). Сварной корпус корытообразной формы снабжен шнеком для перемешивания твердого материала и наклонным ковшовым элеватором для выгрузки нерастворившегося остатка. Уменьшение продольного перемешивания достигается секционированием аппарата спец. перегородками. Растворяющий реагент движется к элеватору (прямоток) или в противоположном направлении (противоток). В перспективе предполагается использование вертикальных противоточных колонных аппаратов с движущимся слоем р-римого в-ва.
Интенсификация процесса. Скорость растворения, как правило, возрастает с увеличением т-ры, однако р-р можно нагревать до определенного предела, обусловленного пределом кипения жидкости и стоимостью тепловой энергии. В практике растворения используют методы, основанные на обтекании твердых частиц жидкостью, а также на систематич. обновлении пов-сти растворения: интенсивное перемешивание мех. мешалками и др. устройствами; наложение поля колебаний (от низкочастотных до ультразвуковых); сочетание растворения и измельчения в одном аппарате; применение электрич. разрядов в жидкости. Два последних метода обеспечивают высокую степень интенсификации растворения и, кроме того, эффективны, если твердые частицы первоначально покрыты экранирующими инертными пленками или примесями.
Р астворение широко используют в хим. и смежных отраслях промети для получения р-ров с последующей их переработкой (см. Галургия), отделения р-римых в-в от сопутствующих инертных примесей (напр., в произ-вах минер. солей и удобрений), обработки р-римых материалов, в т.ч. металлов, с целью придания им определенных размера и формы (т. наз. химическое фрезерование), создания полостей большого объема в соляных толщах с целью хранения в них газов и жидкостей.
Лит.: Здановский А.Б., Кинетика растворения природных солей в условиях вынужденной конвекции, Л., 1956; Аксельруд Г. А., Мол чанов А. Д., Растворение твердых веществ, М., 1977; Галургия, под ред. И. Д. Соколова, Л., 1983; Аксельруд Г. А., Гумницкий Я. М., Дубинин А. И., «Теоретич. основы хим. технологии», 1989, т. 23, № 1, с. 28-33; К а раж ан о в Н. А., Основы кинетики растворения солей, А.-А., 1989. Г. А. Аксельруд.