Что такое равновесная и неравновесная системы
Равновесные и неравновесные системы
Равновесным является такое состояние изолированной системы, в которое она переходит по истечении, строго говоря, бесконечно большого промежутка времени. Практически равновесие достигается за конечное время (время релаксации), которое зависит от природы тел, их взаимодействий, а также и от характера исходного неравновесного состояния. Если система находится в состоянии равновесия, то в равновесии находятся и отдельные её макроскопические части. При неизменных внешних условиях такое состояние не меняется со временем. Следует подчеркнуть, что неизменность во времени не является достаточным признаком равновесности состояния. Например, помещенный в термостат участок электрической цепи, по которому течёт постоянный ток, находится в неизменном (стационарном) состоянии практически неограниченное время. Однако это состояние неравновесно: протекание тока сопровождается необратимым превращением энергии электрического тока в теплоту, отводимую в термостат, в системе имеется градиент температуры. В стационарном неравновесном состоянии могут находиться и все так называемые открытые системы.
Равновесное состояние полностью характеризуется небольшим числом физических параметров. Прежде всего, это температура, равенство значений которой для всех частей системы является необходимым условием термодинамического равновесия. (Существование температуры — параметра, единого для всех частей системы, находящейся в равновесии, часто называется нулевым началом Т.) Состояние однородных жидкости или газа полностью фиксируется заданием любых двух из трёх величин: температуры Т, объёма V и давления р. Связь между р, V и Т характерна для каждой данной жидкости (газа) и называется уравнением состояния (например, Клапейрона уравнение для идеального газа или Ван-дер-Ваальса уравнение). В более сложных случаях для полной характеристики равновесного состояния могут понадобиться и др. параметры (например, концентрации отдельных составляющих смеси газов, напряжённость электрического поля, магнитная индукция).
Совокупность тел любой физической природы и любого химического состава, характеризуемая некоторым числом макроскопических параметров, называется термодинамической системой. Для описания состояния простейшей термодинамической системы необходимо знать ее температуру t, объем V и давление р, так называемые термодинамические (макроскопические) параметры.
Опыт показывает, что система, предоставленная самой себе, по прошествии некоторого промежутка времени приходит в состояние, в котором каждый параметр имеет одинаковое значение во всех точках системы и остается неизменным с течением времени. Такое состояние называется равновесным или состоянием термодинамического равновесия.
Возможны и такие состояния системы, в которых какой-либо из параметров имеет неодинаковые значения в ее различных точках, т.е. не существует единого значения данного параметра для всей системы. В этом случае равновесие еще не установилось, и такое состояние называется неравновесным.
При переходе термодинамической системы из одного равновесного состояния в другое ее параметры изменяются. Изменение параметров состояния системы с течением времени называется процессом. Процесс установления в термодинамической системе равновесного состояния называется релаксацией, а соответствующее время — временем релаксации.
Таким образом, термодинамика — раздел физики, изучающий наиболее общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
Пусть систему, находящуюся в равновесном состоянии А, нужно перевести в равновесное состояние В, например, нагреть газ в колбе от одной температуры до другой. Если процесс происходит с такой скоростью, что значения параметров системы будут успевать выравниваться по всему объему, то его называют равновесным (квазистатическим). Иными словами, равновесный процесс должен идти настолько медленно, чтобы все промежуточные состояния системы были равновесными.
Термодинамический процесс называется обратимым, если систему можно вернуть из состояния В в состояние А через те же промежуточные равновесные состояния, но только в обратном порядке.
Параметры, описывающие состояние системы, являются взаимозависимыми. Например, если при постоянной температуре увеличивать давление газа, то его объем будет уменьшаться. Следовательно, между параметрами системы (р, V, t) существует определенная связь, которая задается уравнением состояния.
Для определения термодинамического равновесия необходим параметр, не встречавшийся в механике,— температура.
Температура — скалярная физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. Она определяет не только степень нагретости, но и способность системы находиться в термодинамическом равновесии с другими системами.
Для нахождения температуры используют легко измеряемые физические параметры, зависящие от степени нагретости тела — термометрические параметры. Такими параметрами являются, например, давление газа в сосуде с неизменным объемом, высота столбика жидкости в стеклянной трубке, сопротивление проводника. Измерение любого такого параметра может использоваться для создания термометра. В силу различных физических причин каждый термометр имеет ограниченную область применения. Например, работа газового термометра ограничена температурой конденсации газа, работа ртутного термометра — температурой затвердевания (—39 °С) и кипения (357 °С) ртути. Подчеркнем, что внутри рабочего диапазона ртуть является хорошим термометрическим веществом, так как ее объем линейно увеличивается при увеличении температуры.
В настоящее время на практике используются температурные шкалы Цельсия и Фаренгейта. В СИ используется абсолютная термодинамическая шкала температур, которую в 1848 г. предложил английский физик Уильям Томсон. Поскольку за работы в области физики он был удостоен титула лорда Кельвина, то эту шкалу называют шкалой Кельвина.
Отметим, что температура определяется только для системы, находящейся в состоянии термодинамического равновесия.
Понятие термодинамического равновесия. Равновесные и неравновесные системы.
Термодинамическое равновесие – это полностью стабильное состояние, в котором система может находиться в течение неограниченного периода времени. При выведении изолированной системы из равновесия, она стремится возвратиться к этому состоянию самопроизвольно (термос с горячей водой и кусочек льда).
В состоянии термодинамического равновесия в системе не только все параметры постоянны во времени, но и нет никаких стационарных потоков за счет действия каких-либо внешних источников.
Для открытых и закрытых систем характерное стационарное состояние (параметры системы с течением времени не изменяются).
Равновесная система – параметры в разных частях системы одинаковы. Движущие силы отсутствуют. Если такая система изолирована, то она может находиться в состоянии равновесия неограниченно долго.
Неравновесная система– их параметры различны в разных точках объема, что приводит к наличию постоянных градиентов и сил, и создаваемых ими потоков вещества и энергии за счет поступления энергии из внешней среды. Если такая система изолирована, то она необратимо эволюционирует к состоянию ТД равновесия.
7. Первый закон термодинамики. История открытия. Формулировка, физический и биологический смысл.
Открытие первого закона термодинамики исторически связано с установлением эквивалентности теплоты и механической работы. Это открытие связано с имена Р. Майера и Д. Джоуля. Основная работа Майера, в которой он подробно и систематически развил свои идеи, была опубликована в 1845 г. и называлась «Органическое движение в его связи с обменом веществ». Майер сразу же сформулировал первое начало термодинамики как принцип, которому подчиняются любые формы движения в природе. Он указывал, что источником механических и тепловых эффектов в живом организме является не жизненная сила, как утверждали виталисты, а те химические процессы, которые протекают в нем в результате поглощения кислорода и пищи.
Джоуль пришел к установлению эквивалентности тепла и механической работы индуктивным путем, т.е. непосредственно экспериментальным измерением превращения механического движения в теплоту.
Первый закон термодинамики формулируется следующим образом: «Общая энергия в изолированной системе – величина постоянная и не изменяется во времени, а лишь переходит из одной формы в другую.
Теплота σQ, поглощенная системой из внешней среды идет на увеличение внутренней энергии dU системы и совершение работы σА против внешних сил.
Если теплота передается в систему, то ΔQ > 0.
а – количество клеток,
b – площадь поверхности,
М – масса тела животного.
(Удельная теплопродукция уменьшается с увеличением массы животного).
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Равновесные и неравновесные состояния
Классификация и характеристики термодинамических систем
Под термодинамической системой подразумевается макроскопическое тело, заключенное в некотором ограниченном пространстве и способное обмениваться с внешней средой и между внутренними частями веществом и энергией.
Термодинамические системы по характеру обмена с окружающей средой подразделяются на изолированные, закрытые и открытые.
Изолированными называют системы, которые не обмениваются с внешней средой ни массой, ни энергией. Таких систем вприроде не существует, поэтому под изолированными подразумевают системы, обменом которых с окружающей средой веществом и энергией можно пренебречь в рамках данной задачи.
Закрытыми называют системы, обменивающиеся внешней средой энергией, но не массой.
Открытые системы обмениваются с внешней средой и энергией и массой.
Классическая термодинамика занимается описанием изолированных и закрытых систем. Теория открытых систем (неравновесная термодинамика) начала разрабатываться с 30-х годов прошлого века.
Параметры термодинамических систем
Для того чтобы дать термодинамическое описание системы используются параметры системы. Параметры системы – это физические величины, которые служат для характеристики состояния системы. Параметры делятся на категории. Одни из них являются экстенсивными, другие интенсивными. Экстенсивные параметры характеризуют систему как целое, например, масса и объем. Далее мы встретимся другими экстенсивными характеристиками. Основное свойство экстенсивных параметров — их аддитивность. Например, масса системы равна сумме масс ее отдельных частей. Интенсивные параметры носят силовой характер (давление, температура, концентрация, внутренняя энергия, энтропия и др.) и могут приобретать разные значения в различных точках системы. Любой вид затрачиваемой на совершение работы энергии выражается через произведение интенсивного (силового) параметра на экстенсивный.
Равновесные и неравновесные состояния
Равновесным является такое состояние изолированной темы, в которое она приходит по истечении достаточно большого промежутка времени. Это время, называемое временем релаксации, зависит от природы тела, от характера взаимодействия частиц в системе, а также от исходного неравновесного состояния. После истечения времени релаксации параметры изолированной системы принимают постоянные значения и в дальнейшем не изменяются. Интенсивные параметры принимают одинаковые значения во всех частях системы. Поэтому равновесное состояние полностью описывается определенным набором параметров системы, экстенсивных и интенсивных. Связь между параметрами состояния называется уравнением состояния. Например, уравнение равновесного состояния идеального газа связывает между собой температуру, давление (интенсивные характеристики), объем и массу (экстенсивные характеристики).
Неравновесным называется такое состояние изолированной системы, при котором интенсивные параметры системы имеют различные значения в ее различных частях, вследствие чего в ней протекают процессы, направленные на выравнивание значений этих параметров во всех точках системы и на установление равновесного состояния.
Стационарное состояние – состояние системы, при котором значения параметров системы изменяются с постоянной скоростью. Отличие стационарного состояния от равновесного заключается в том, что в этом состоянии макроскопические процессы не прекращаются, как в случае равновесного состояния, а идут с постоянной скоростью. Входной поток энергии и вещества равен выходному потоку.
Дата добавления: 2016-02-02 ; просмотров: 3782 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Термодинамическая система. Параметры состояния системы. Равновесное и неравновесное состояние



ОПРЕДЕЛЕНИЕ: Термодинамической системой называется совокупность тел, обменивающихся энергией, как друг с другом, так и с окружающими телами.
Примером системы может служить жидкость и находящийся в равновесии с ней пар. Система может состоять и из одного тела: жидкость, газ, твердое тело.
Всякая система может находиться в различных состояниях, отличающихся температурой, давлением, объемом и т.д.
ОПРЕДЕЛЕНИЕ: Совокупность физических величин, однозначно определяющих состояние системы, называется параметрами системы.
Не всегда какой-либо параметр имеет определенное значение. Если, например, температура в разных точках тела неодинакова, то телу нельзя приписать определенное значение параметра “T”. В этом случае состояние называется неравновесным. Если такое тело изолировать от других тел и предоставить самому себе, то температура выровняется и примет одинаковое для всех точек значение “T” – тело перейдет в равновесное состояние. Это значение температуры не изменится до тех пор, пока тело не будет выведено из равновесного состояния воздействием извне.
То же самое может иметь место и для других параметров системы, например для давления “p”.
А что же будем называть равновесным состоянием?
ОПРЕДЕЛЕНИЕ: Равновесным состоянием системы будем называть такое состояние, при котором все параметры системы имеют определенные значения, остающиеся при неизменных внешних условиях постоянными сколь угодно долго.
Если по координатным осям откладывать значения каких-либо 2 х параметров, то любое равновесное состояние может быть изображено точкой на этом графике (например, точкой 1). Неравновесное состояние не может быть изображено таким способом, т.к. в неравновесном состоянии хотя бы один из параметров не имеет определенного значения.
Процесс перехода системы из неравновесного состояния в равновесное называется процессом релаксации. Время, затрачиваемое на такой переход, называют временем релаксации. В качестве времени релаксации принимается время, за которое первоначальное отклонение какой-либо величины от равновесного значения уменьшается в “e” раз. Для каждого параметра имеется свое время релаксации. Наибольшее из этих времен играет роль времени релаксации системы.
Всякий процесс, т.е. переход системы из одного состояния в другое связан с нарушением равновесия системы. Следовательно, при протекании в системе какого-либо процесса она проходит через последовательность неравновесных состояний. В предельном случае бесконечно медленный процесс будет состоять из последовательности равновесных состояний.
ОПРЕДЕЛЕНИЕ: Процесс, состоящий из последовательности равновесных состояний, будет называться равновесным (равновесный процесс – абстракция).
Равновесный процесс может быть изображен на графике соответствующей сплошной кривой. Неравновесные процессы будем условно изображать пунктирными линиями.
Равновесный процесс может быть проведен в обратном направлении, причем система будет проходить через те же состояния, что и при прямом ходе, но в обратной последовательности. Поэтому равновесные процессы также называются обратимыми.
Понятия равновесного состояния и обратимого процесса играют большую роль в термодинамике. Все количественные выводы термодинамики строго применимы только к равновесным состояниям и обратимым процессам.
Равновесные и неравновесные процессы.



В химической термодинамике большое значение имеют понятия о равновесном и неравновесном процессе.
Равновесным, или квазистатическим, называется процесс, в котором система под влиянием бесконечно малых воздействий со стороны внешней среды или вследствие наличия внутренней бесконечно малой разности в величинах интенсивных параметров бесконечно медленно проходит непрерывный ряд состояний, как угодно мало отличающихся от равновесных.
Упрощая, можно сказать, что в равновесном процессе силы, действующие на систему, почти точно уравновешиваются другими силами со стороны системы. Отсюда ясно, что если снять движущие воздействия, процесс прекратится. Если же изменить знак воздействий, начнется обратный процесс. Таким образом, равновесному процессу присуща двусторонность.
Другая особенность равновесного процесса — отсутствие потерь энергии на преодоление трения, завихрений потоков в газах и жидкостях. Следовательно, работа, совершаемая системой против внешней среды в равновесном процессе, максимально возможная. Энергия же, рассеянная в виде теплоты, минимальна.
Неравновесный процесс происходит с конечной скоростью, обусловленной конечной разностью в давлениях и температурах между системой и внешней средой или большой неравномерностью температурных, концентрационных и иных полей внутри системы. В этом случае исключение внешних воздействий не приводит к прекращению процесса. Первоначальное возмущение, например нагревание, само собой распространяется вглубь системы до тех пор, пока не наступит состояние равновесия, например, пока не выравнивается температура. Следовательно, неравновесный процесс является односторонним.
Работа, совершаемая системой в этом процессе, меньше, чем в равновесном, так как часть энергии тратится на преодоление различного рода сопротивлений и превращается в бесполезную теплоту. Количество последней равно разности между максимальной работой в равновесном процессе и соответствующей работой в неравновесном процессе.
Таким образом, протекание неравновесного процесса сопровождается потерей работоспособности системы.
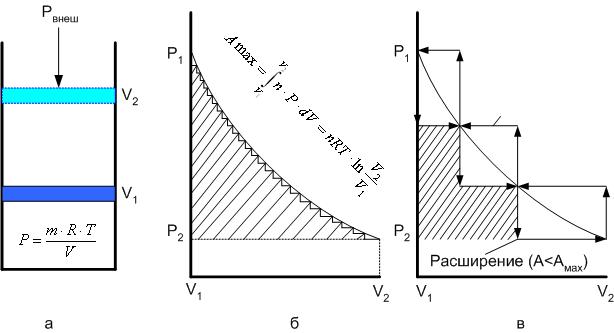
Расширение газа в цилиндре с поршнем хорошо иллюстрирует различие между равновесным и неравновесным процессами.
Рис. 1 Различие между равновесным и неравновесным процессами.
Поршень в цилиндре (рис. 1, а) не движется, если давление п молей газа в объеме V1 уравновешено внешним давлением Р (например, Р — это вес поршня и набора гирь с разным весом). Пусть вся система погружена в термостат, обеспечивающий постоянство температуры Т. Чтобы вызвать медленное расширение газа до конечного объема V2, надо поочередно снимать самые маленькие гирьки, например, весом 1 г. Каждый раз после снятия гирьки давление газа будет слегка превышать внешнее давление; расширение газа прекращается, когда внешнее давление уравновешивается внутренним давлением, которое для идеального газа равно
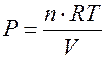
На рис. 1, б этот процесс изображен ступеньками (вертикальная черточка — снятие груза, горизонтальная — расширение до равновесного объема). В данном случае процесс еще не является вполне равновесным, так как изменение уравновешивающего давления происходит, хотя и с малой, но конечной скоростью. Если же снимать груз бесконечно малыми порциями, давление газ каждый раз будет бесконечно мало превышать внешнее давление, и расширение станет вполне равновесным. В таком случае на графике P-Vнадо вместо ступеньки изображать ее бесконечно малую форму, т. е точку, а весь процесс представить непрерывным рядом точек, т. е кривой (изотерма расширения, рис. 1, б).
Расширение будет быстрым и неравновесным, если снимать крупные гири. Графически процесс представится совокупностью больших ступенек (рис. 1, в). При каждом подъеме поршня в газе возникают сложные макроскопические движения, которые потом затухают под влиянием сил трения. В результате не вся первоначальная кинетическая энергия, переданная поршню, превращается в теплоту, поглощаемую термостатом. Работа, совершаемая против внешнего давления в неравновесном процессе (заштрихованная площадь под ломаной линией на рис. 1, б, в), оказывается меньшей, чем в равновесном процессе (площадь под изотермой).
Аналогичное неравенство работ свойственно любым другим процессам. К разновидностям равновесных процессов относятся термодинамически обратимые процессы, которые могут идти как в прямом, так и в обратном направлениях при бесконечно малом изменении действующих на систему сил без изменения работоспособности системы в обоих направлениях. Таким образом, обратимые процессы должны протекать бесконечно медленно, через одну и ту же непрерывную последовательность состояний равновесия в обоих направлениях (точки на кривой ab, рис. 1) и так, чтобы после возвращения системы в первоначальное состояние ни в окружающей среде, ни в самой системе не осталось никаких изменений.
Неравновесные процессы всегда в какой-то мере необратимы, так как возвращение системы в исходное состояние связано с изменением состояния внешней среды вследствие большей затраты работы по сравнению с той, которая получается в прямом процессе (на рис. 1, в видно, что работа неравновесного расширения газа меньше работы неравновесного сжатия).
Поскольку любой вполне равновесный процесс практически неосуществим, то обратимый процесс есть идеальный процесс. Однако понятием обратимого процесса пользуются широко, и это оправдывается рядом соображений.
1. работа в обратимом (равновесном) процессе максимальна, и, сравнивая реальный процесс с обратимым, можно судить об его эффективности в прямом и обратном направлениях.
2. выбирая границы системы так, чтобы не было больших перепадов температур, давлений и концентраций, реальный процесс (например, химическую реакцию) можно представить протекающим бесконечно медленно и обратимо. Это позволяет наиболее просто и однозначно рассчитать изменения термодинамических свойств системы.
Для процессов, рассматриваемых в изучаемом курсе, обратимость и равновесность совпадают, то есть всякий обратимый процесс является процессом равновесным. Отсюда вытекает одно практическое правило:
так как всякий равновесный процесс протекает бесконечно медленно, то всякий практический процесс всегда имеет отклонение от равновесного.