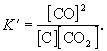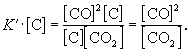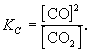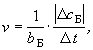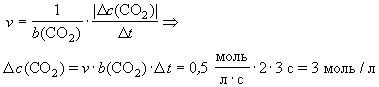Что такое равновесная концентрация в химии
Химическое равновесие
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.
Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое» место, которые мы создали. Наглядно демонстрирую на примере:
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:
Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химическое равновесие. Принцип Ле Шателье
Материалы портала onx.distant.ru
Понятие химического равновесия
Признаки химического равновесия
Принцип Ле Шателье
Влияние температуры на химическое равновесие
Влияние давления на химическое равновесие
Влияние концентрации на химическое равновесие
Константа химического равновесия
Примеры решения задач
Задачи для самостоятельного решения
Понятие химического равновесия
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Признаки химического равновесия
Принцип Ле Шателье
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
Влияние температуры на химическое равновесие
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Влияние концентрации на химическое равновесие
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Константа химического равновесия
Для химической реакции:
константа химической реакции Кс есть отношение:
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGT о = – RTlnK (2)
Примеры решения задач
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
Вещество
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
Решение.
Задача 3. Определите равновесную концентрацию HI в системе
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | 0 |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х) 2 /((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Задача 4. Используя справочные данные, определите температуру, при которой константа равновесия процесса: H2(г) + HCOH(г) →CH3OH(г) становится равной 1. Принять, что ΔН о Т » ΔН о 298, а ΔS о T » ΔS о 298.
Решение.
Если К = 1, то ΔG о T = — RTlnK = 0;
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
Задачи для самостоятельного решения
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества
газообразных веществ, то равновесие сместится вправо в реакции 3.
2. При некоторой температуре равновесные концентрации в системе:
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
К = 4; исходная концентрация HBr составляет 1,5 моль/л.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
[H2] = 0,5 моль/л; [S] = 1,5 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
становится равной 1. Примите, что ΔН о Т≈ΔН о 298, а ΔS о T≈ΔS о 298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
6. Для реакции 2С3Н8(г) → н-С5Н12(г)+СН4(г) при температуре 1000 К константа равновесия равна 4. Определите равновесную концентрацию н-пентана, если исходная концентрация пропана равна 5 моль/л.
7. При температуре 500 К константа равновесия процесса:
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔG о f,800(С3Н6(г)), если ΔG о f,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л;
исходная концентрация О2 составляет 0,20 моль/л.
Что такое равновесная концентрация в химии
9.5. Обратимость химических реакций. Химическое равновесие
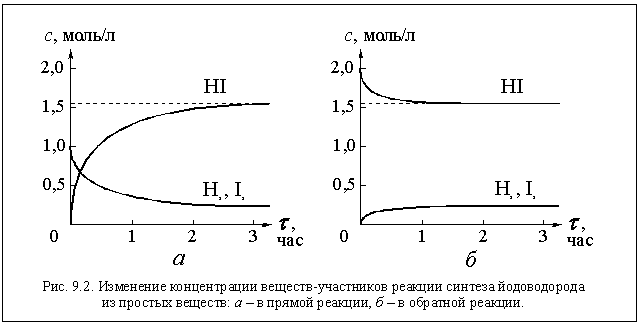
Рассмотрим эндотермическую реакцию
Смешаем в реакторе (в данном случае, в каком-либо закрытом сосуде) нагретые, например, до 450 ° С водород и пары йода. Для простоты расчетов допустим, что концентрации исходных веществ были одинаковыми и равными одному молю на литр, то есть с(Н2) = 1 моль/л и с(I2) = 1 моль/л.
Несмотря на отрицательный тепловой эффект водород и йод начнут реагировать друг с другом, образуя йодоводород. Следовательно, в данной реакции «перетягивает» энтропийный фактор. Действительно, в смеси трех газов (Н2, I2 и HI) порядка меньше, чем в смеси двух газов (Н2 и I2). Экспериментально протекание этой реакции можно обнаружить, измеряя концентрации участвующих в ней веществ. Сразу после смешивания концентрации йода и водорода начнут уменьшаться, в реакторе появится йодоводород, концентрация которого будет постепенно увеличиваться.
H2 + I2 
Состояние, в котором в обратимой реакции концентрации участвующих в этой реакции веществ остаются постоянными, называется состоянием химического равновесия.
В состоянии равновесия молекулы не перестают испытывать соударения, и между ними не прекращается взаимодействие, но концентрации веществ остаются постоянными. Эти концентрации называются равновесными.
Равновесная концентрация обозначается формулой вещества, взятой в квадратные скобки, например:
Как и любая другая концентрация, равновесная концентрация измеряется в молях на литр.
Если бы в рассмотренных нами примерах мы взяли другие концентрации исходных веществ, то после достижения равновесия получили бы другие значения равновесных концентраций. Эти новые значения (обозначим их звездочками) будут связаны со старыми следующим образом:
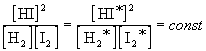
В общем случае для обратимой реакции
aA + bB 
в состоянии равновесия при постоянной температуре соблюдается соотношение
Это соотношение носит название закон действующих масс, который формулируется следующим образом:
при постоянной температуре отношение произведения равновесных концентраций продуктов реакции, взятых в степенях, равных их коэффициентам, к произведению равновесных концентраций исходных веществ, взятых в степенях, равных их коэффициентам, есть величина постоянная.
С(гр) + СО2 
участвует твердый графит С(гр). Формально, пользуясь законом действующих масс, запишем выражение для константы равновесия этой реакции, обозначив ее К’:
Твердый графит, лежащий на дне реактора, реагирует только с поверхности, и его » концентрация» не зависит от массы графита и постоянна при любом соотношении веществ в газовой смеси.
Умножим правую и левую части уравнения на эту постоянную величину:
Получившаяся величина и есть константа равновесия этой реакции:
Аналогичным образом, для равновесия другой обратимой реакции, протекающей также при высокой температуре,
CaCO3(кр) 
получим константу равновесия


2.Составьте уравнения реакций синтеза воды и аммиака из простых веществ. Запишите выражения для констант равновесия этих реакций.
3.Составьте выражения для констант равновесия следующих обратимых химических реакций:
а) 2NO(г) + O2(г) 

в) PCl3(г) + Cl2(г) 

д) CH4(г) + I2(г) 
4.При определенных условиях равновесие в системе установилось при концентрации водорода, йода и йодоводорода 0,25 моль/л; 0,05 моль/л и 0,90 моль/л, соответственно. Рассчитайте константу равновесия этой реакции и определите исходные концентрации водорода и йода.
5.Константа равновесия обратимой реакции
H2(г) + Cl2(г) 
при комнатной температуре равна примерно 1015. Что, основываясь на этом, можно сказать об этой реакции?
Так как почти все реакции в той или иной степени обратимы, в промышленности и лабораторной практике возникают две проблемы: как получить продукт » полезной» реакции с максимальным выходом и как уменьшить выход продуктов » вредной» реакции. И в том, и в другом случае возникает необходимость сместить равновесие либо в сторону продуктов реакции, либо в сторону исходных веществ. Чтобы научиться это делать, надо знать, от чего зависит положение равновесия любой обратимой реакции.
Положение равновесия зависит:
1) от значения константы равновесия (то есть от природы реагирующих веществ и температуры),
2) от концентрации веществ, участвующих в реакции и
3) от давления (для газовых систем оно пропорционально концентрациям веществ).
Для качественной оценки влияния на химическое равновесие всех этих очень разных факторов используют универсальный по своей сути принцип Ле Шателье (французский физикохимик и металловед Анри Луи Ле Шателье сформулировал его в 1884 году), который применим к любым равновесным системам, не только химическим.
Если на систему, находящуюся в равновесии, воздействовать извне, то равновесие в системе сместится в направлении, в котором происходит частичная компенсация этого воздействия.
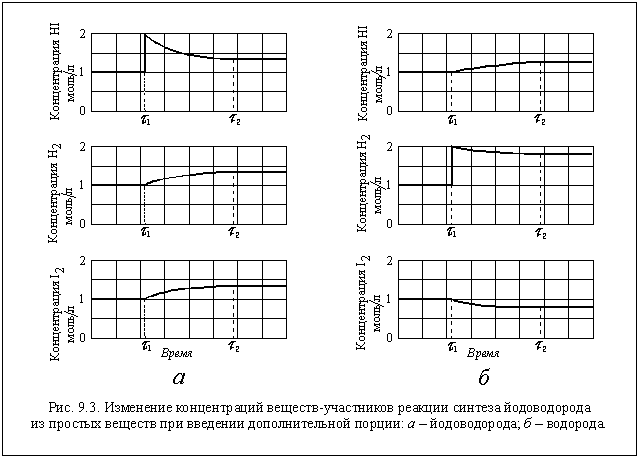
В качестве примера влияния на положение равновесия концентраций веществ-участников реакции рассмотрим уже известную вам обратимую реакцию получения йодоводорода
H2(г) + I2(г) 
По закону действующих масс в состоянии равновесия
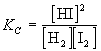
Пусть в реакторе объемом 1 литр при некоторой постоянной температуре установилось равновесие, при котором концентрации всех участников реакции одинаковы и равны 1 моль/л ([H2] = 1 моль/л; [I2] = 1 моль/л; [HI] = 1 моль/л). Следовательно, при этой температуре КС = 1. Так как объем реактора 1 литр, n(H2) = 1 моль, n(I2) = 1 моль и n(HI) = 1 моль. В момент времени t 1 введем в реактор еще 1 моль HI, его концентрация станет равной 2 моль/л. Но, чтобы КС оставалась постоянной, должны увеличиться концентрации водорода и йода, а это возможно только за счет разложения части йодоводорода по уравнению
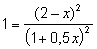
Откуда x = 0,667. Следовательно, [H2] = 1,333 моль/л; [I2] = 1,333 моль/л; [HI] = 1,333 моль/л.
Все эти изменения концентраций наглядно показаны на рисунке 9.3 а.


2СО(г) + О2(г) 
3.Для каждой из следующих обратимых реакций запишите выражение константы равновесия и перечислите все способы смещения равновесия вправо:
Скорость химической реакции рассчитывается с учетом коэффициента перед формулой данного вещества в уравнении реакции (bБ).
Данное определение применимо только для реакций, протекающих в жидкой или газовой фазе.
Задача
В реакции Н2 + I2 = 2HI концентрация водорода изменилась с 0,1 моль/л до 0,05 моль/л за 2 секунды. Определите скорость реакции.
Решение
c1(H2) = 0,1 моль/л
c2(H2) = O,05 моль/л
D t = 2 c
b(H2) = 1
Задача
В реакции 2СО + О2 = 2СО2 при определенных условиях скорость равна 0,5 моль/(лЧ с). В некоторый момент времени с1(СО2) = 2 моль/л. Какова будет концентрация диоксида углерода через три секунды?
Решение
с1(СО2) = 2 моль/л
D t = 2 с
v = 0,5 моль/(лЧ с)
b(СО2) = 2
c2(CO2) > c1(CO2) c2(CO2) = (2 + 3) моль/л = 5 моль/л
Если реагирующие вещества газообразны, то продукты реакции могут получиться только при столкновении молекул исходных веществ. Чем больше таких соударений, тем быстрее идет реакция. Число столкновений пропорционально концентрациям исходных веществ. Следовательно, скорость реакции А + Б = Д (все вещества газообразны) будет выражаться уравнением (закон действующих масс для скорости реакции):
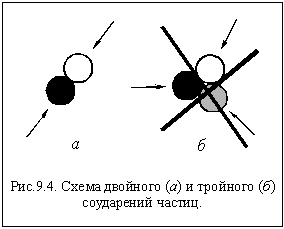
И в газах, и в жидкостях одновременно могут сталкиваться только две частицы (рис. 9.4 а). Тройное соударение крайне маловероятно (рис 9.4 б).
Поэтому большинство реакций, выражающихся иногда очень сложными уравнениями, протекает в несколько стадий, для осуществления каждой из которых необходимы только двойные соударения. Если экспериментально удается выяснить, из каких стадий складывается та или иная реакция, то говорят, что для этой реакции известен ее механизм.
Например, механизм реакции 4HBr + O2 = 2H2O + 2Br2, протекающей в газовой фазе при температуре около 500 ° С, включает три стадии:
HBr + O2 = HOOBr;
HOOBr + HBr = 2HOBr;
HOBr + HBr = H2O + Br2.
Скорость этих реакций различна, а общая скорость суммарной реакции определяется скоростью самой медленной из этих стадий (в данном случае первой).
Практически важно то, что по суммарному уравнению реакции невозможно определить механизм этой реакции. Например, реакция H2(г) + I2(г) = 2HI(г) простая, то есть проходит в одну стадию, а, казалось бы, совершенно аналогичная реакция
Скорости реакций, протекающих в жидких растворах, от давления практически не зависят.
Если реагирующие вещества не образуют между собой раствора (жидкого или газового), то реакция протекает только на поверхности соприкосновения этих веществ. Скорость такой реакции зависит от площади этой поверхности. Действительно, щепки горят быстрее полена, а древесная пыль в смеси с воздухом иногда даже взрывается. Таким образом, скорость этих реакций зависит
1) от температуры;
2) от концентрации реагентов в том, или ином растворе;
3) от давления (если в реакции участвуют газы) и
4) от площади поверхности соприкосновения реагентов.
Многие, даже очень быстрые реакции, при простом соприкосновении реагентов не идут. Например, смесь водорода с кислородом может очень долго находиться при комнатной температуре, не изменяясь. Но стоит только поднести к ней горящую спичку, как реакция начинает протекать очень быстро, часто со взрывом (поэтому смесь водорода с кислородом в объемном отношении 2:1 даже называют » гремучим газом» ). В чем же причина?
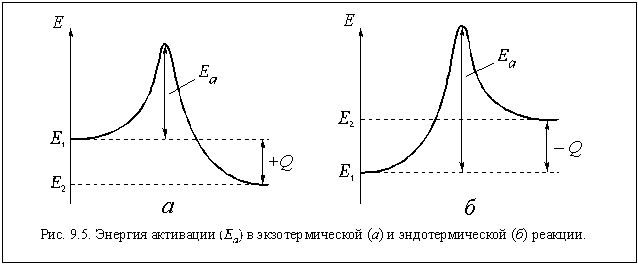
Мы уже говорили, что не любые соударения молекул или других химических частиц приводят к их взаимодействию, а только эффективные, то есть те соударения частиц, суммарная энергия которых больше какого-то определенного значения. Эта » пороговая» энергия называется энергией активации данной реакции.
Физический смысл энергии активации становится понятным, если рассмотреть графики изменения энергии частиц в ходе реакции, показанные на рис. 9.5.
Пусть нам необходимо получить вещество АБ по обратимой реакции
А +Б 
Катализаторы используются не только для ускорения химических процессов. Если между реагентами возможно несколько реакций, то, используя катализатор, можно провести практически только ту, которая требуется.
Снижая энергию активации, катализатор ускоряет как прямую, так и обратную реакцию, и поэтому он не может быть использован для смещения равновесия.


2.Изменится ль скорость реакции йода с водородом, если в реакционную смесь ввести аргон? Ответ поясните.
3.Как изменится скорость реакции А + В = С, протекающей в газовой фазе в одну стадию, если а) концентрацию вещества А увеличить в 2 раза; б) концентрацию вещества В уменьшить в 2 раза; в) концентрации каждого из этих веществ увеличить в 2 раза; г) концентрацию вещества А уменьшить в 2 раза, а концентрацию вещества В увеличить в 2 раза; д) увеличить в 2 раза давление в реакторе?
4.В смеси водорода с кислородом при комнатной температуре объемные доли газов не меняются неопределенно долго. Можно ли считать, что в этой смеси установилось химическое равновесие?
5.В интервале температур от 30 до 80 °С скорость некоторой реакции увеличивалась в 2 раза при нагревании на каждые 10 °С. Определите, во сколько раз увеличится скорость этой реакции при увеличении температуры от 35 до 55 °С.
6.Как вы думаете, почему скоропортящиеся продукты хранят в холодильнике?
Притянувшиеся к аноду ионы Cl, отдают свои » избыточные» электроны аноду (тоже » разряжаются» ), а образующиеся атомы хлора соединяются в молекулы:
В результате на катоде образуется натрий, а на аноде выделяется газообразный хлор.
Несмотря на то, что процессы образования продуктов реакции разделены в пространстве, можно записать уравнение этой реакции (так, как мы это делали для обычных ОВР):
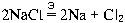
Буква » Э» над знаком равенства означает, что реакция протекает при электролизе.


Укажите причины, по которым остальные вещества ему не подвергаются.
2.Составьте электронные уравнения полуреакций и химические уравнения электролиза выбранных вами веществ. 
2. Окислительно-восстановительные реакции.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору