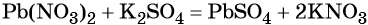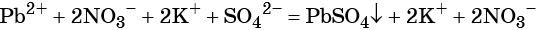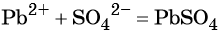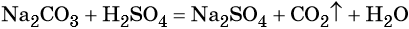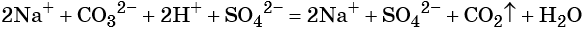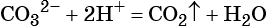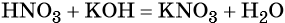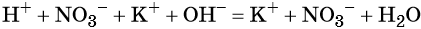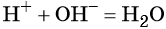Что такое реакция ионного обмена
Реакции ионного обмена
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
| Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит. |
| Например, нитрат серебра взаимодействует с бромидом калия |
AgNО3 + КВr = АgВr↓ + КNО3
Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe 3+ + 3OH — = Fe(OH)3
На ионы мы не разбиваем:
| Например, взаимодействие сульфида цинка и серной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H + + SO4 2 — = Zn 2+ + SO4 2 — + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H + = Zn 2+ + H2S
| Например, взаимодействие гидрокарбоната натрия и гидроксида натрия |
Составляем уравнение реакции и проверяем растворимость всех веществ:
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na + + НСО3 — + Na + + ОН — = 2Na + + CO3 2- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3 — + ОН — = CO3 2- + H2O
| Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na + + [Al(OH)4] — + 4H + + 4Cl — = Na + + Cl — + Al 3+ + 3Cl — + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4] — + 4H + = Al 3+ + 4H2O
Реакции ионного обмена
Содержание:
Что есть реакция ионного обмена? Определение
Химическое взаимодействие ионов в электролитах называется реакцией ионного обмена (РИО).
Сущность РИО заключается в связывании ионов.
Напоминание. Электролиты – это водные растворы кислот, солей или оснований, в которых эти вещества распадаются (диссоциируют) на свободные заряженные ионы.
Необходимое условие РИО. Правило Бертолле
Главное условие необратимого протекания ионнообменной реакции между электролитами – образование осадка, газообразного вещества или малодиссоциирующего соединения (слабого электролита, в т.ч. воды).
Данное утверждение носит название правила Бертолле. Этот французский химик сформулировал его в 1803 г.
Следует помнить, что это правило справедливо при взаимодействии ненасыщенных растворов.
Особенности РИО. Суть необратимого процесса
Более реально состояние реагентов в растворе демонстрирует запись в виде заряженных ионов:
Эти уравнения получили названия:
(2) – полное ионное уравнение,
(1) – молекулярное уравнение реакции.
Вывод: уравнение в ионной форме отражает сущность процесса, показывает за счёт чего возможно его протекание.
Знать: в обратимых РИО не бывает сокращенной ионной формы уравнения.
Правила (алгоритм) составления уравнений ионно-обменных реакций
В обычных химических уравнениях разложение молекул на ионы не учитывается. Чтобы отразить сущность взаимодействия электролитических растворов, пользуются ионными уравнениями, которые составляются по определённым правилам.
Примеры РИО с выделением газа и выпадением осадка
Применение РИО
Во многих отраслях индустрии, сельском хозяйстве, в решении проблем экологии используются реакции ионного обмена. Несколько примеров применения РИО.
В заключении интересный факт: домашние хозяйки, сами того не зная, используют правило Бертолле, когда применяют реакцию ионного обмена между столовым уксусом и пищевой содой. Выделяющийся при этом газ способствует «поднятию» теста.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакции ионного обмена протекали, необходимо, чтобы выполнялись не только условия: образование осадка, газа или воды, но и вещества –реагенты должны быть растворимыми.
Вывод:
Реакции ионного обмена и условия их осуществления
Реакциями ионного обмена называют химические реакции, которые протекают между ионами без изменения степеней окисления элементов и приводят к обмену составных частей реагентов.
Уравнения обменных реакций записывают в молекулярной форме (с указанием формул всех реагирующих веществ со стехиометрическими коэффициентами); в полной ионной форме (с указанием всех существующих в растворе ионов) и в сокращённой ионной форме (с указанием только тех ионов, которые непосредственно взаимодействуют между собой). При написании уравнений реакций в ионной форме формулы малодиссоциирующих веществ (слабых электролитов) записывают в молекулярной форме.
Уравнения реакций обмена в водных растворах электролитов составляют так.
Реакции ионного обмена в растворах электролитов протекают практически необратимо и до конца, если в качестве продуктов образуются осадки (малорастворимые вещества), газы (легколетучие вещества), слабые электролиты (малодиссоциированные соединения) и комплексные ионы.
Если при взаимодействии растворов электролитов не образуется ни одно из указанных видов соединений, химическое взаимодействие практически не происходит.
Уравнения обменных реакций можно записать в молекулярной форме, полной ионной форме, с указанием всех существующих в растворе ионов и в сокращённой ионной форме, которая, собственно, и выражает взаимодействие ионов. Следует отметить, что при написании уравнений реакций в ионной форме малодиссоциирующие вещества (слабые электролиты) записывают в молекулярной форме.
Пример 1. Реакция между нитратом свинца и сульфатом калия. В результате этой реакции образуется нерастворимый сульфат свинца и выделяется растворимый нитрат калия:
(полная ионно-молекулярная форма),
(сокращённая ионно-молекулярная форма).
Пример 2. Взаимодействие карбоната натрия с серной кислотой. При этом выделяется углекислый газ и вода, а в растворе остаются катионы натрия и сульфат-ионы:
(полная ионно-молекулярная форма),
(сокращённая ионно-молекулярная форма).
Пример 3. Реакция между азотной кислотой и едким калием. В результате данной реакции образуется малодиссоциированное соединение — вода и в растворе остаются катионы калия и нитрат-ионы:
(полная ионно-молекулярная форма),
(сокращённая ионно-молекулярная форма).
Тренировочные задания
1. Осадок образуется при взаимодействии водных растворов
2. Газ выделяется при взаимодействии водных растворов
3. Краткое ионное уравнение H + + OH – = H2O описывает взаимодействие
1) гидроксида кальция и фосфорной кислоты
2) гидроксида лития и фосфорной кислоты
3) гидроксида натрия и бромоводородной кислоты
4) гидроксида алюминия и бромоводородной кислоты
4. Краткое ионное уравнение 3Ba 2+ + 2PO4 3– = Ba3(PO4)2↓ описывает взаимодействие
1) карбоната бария и фосфорной кислоты
2) карбоната бария и фосфата натрия
3) хлорида бария и фосфорной кислоты
4) хлорида бария и фосфата натрия
5. Краткое ионное уравнение Ba 2+ + SO4 2– = BaSO4↓ описывает взаимодействие
1) хлорида бария и сульфата натрия
2) хлорида бария и сернистой кислоты
3) гидроксида бария и сульфата натрия
4) гидроксида бария и серной кислоты
6. Краткое ионное уравнение Ag + + Cl – = AgCl↓ описывает взаимодействие
1) хлорида кальция и бромида серебра
2) фосфата серебра и соляной кислоты
3) карбоната серебра и хлорида натрия
4) нитрата серебра и хлорида калия
7. Краткое ионное уравнение H + + OH – = H2O отвечает взаимодействию
1) азотной кислоты и гидроксида железа (III)
2) бромоводородной кислоты и гидроксида натрия
3) азотной кислоты и гидроксида меди
4) сернистой кислоты и гидроксида кальция
8. Краткое ионное уравнение 2Н + + S 2– = Н2S↑ отвечает взаимодействию
1) соляной кислоты и сульфида железа (II)
2) сернистой кислоты и сульфида калия
3) азотной кислоты и сульфида меди
4) азотной кислоты и сульфида натрия
9. Краткое ионное уравнение 2Н + + CO3 2– = CO2↑ + H2O отвечает взаимодействию
1) соляной кислоты и карбоната кальция
2) сернистой кислоты и карбоната бария
3) азотной кислоты и карбоната калия
4) серной кислоты и карбоната бария
10. Краткое ионное уравнение 2Н + + CaCO3 = Ca 2+ + CO2↑ + H2O отвечает взаимодействию
1) соляной кислоты и карбоната кальция
2) сернистой кислоты и карбоната кальция
3) фосфорной кислоты и карбоната кальция
4) серной кислоты и карбоната кальция
11. Краткое ионное уравнение Al 3+ + 3OH – = Al(OH)3↓ отвечает взаимодействию
1) сульфата алюминия и гидроксида кальция
2) сульфата алюминия и гидроксида бария
3) сульфата алюминия и гидроксида меди
4) сульфата алюминия и гидроксида натрия
12. Краткое и полное ионное уравнения совпадают для реакции
1) соляной кислоты и карбоната калия
2) уксусной кислоты и карбоната бария
3) уксусной кислоты и гидроксида калия
4) серной кислоты и гидроксида калия
13. Одновременно в растворе не могут существовать ионы
14. Одновременно в растворе могут существовать ионы
15. Образование осадка происходит при взаимодействии водных растворов
16. Образование газа происходит при взаимодействии водных растворов
1) сульфата калия и хлорида бария
2) гидроксида алюминия и серной кислоты
3) хлорида кальция и карбоната натрия
4) соляной кислоты и карбоната натрия
17. С выпадением осадка протекает реакция ионного обмена между растворами
1) нитрата натрия и фторида калия
2) хлорида алюминия и избытка гидроксида калия
3) нитрата серебра и фторида натрия
4) нитрата магния и гидроксида калия
18. С выделением газа протекает реакция ионного обмена между растворами
1) карбоната калия и бромоводородной кислоты
2) сульфата натрия и гидроксидом калия
3) нитрата серебра и бромида цинка
4) нитрата алюминия и гидроксида бария
19. С выделением газа протекает реакция ионного обмена между растворами
1) гидроксида бария и азотной кислоты
2) сульфата алюминия и нитрата бария
3) нитрата серебра и йодида лития
4) азотной кислотой и карбоната аммония
20. С выделением воды протекает реакция ионного обмена между растворами
1) нитрата меди и хлорида железа
2) гидрокарбоната натрия и гидроксида натрия
3) нитрата ртути и бромида лития
4) нитрата аммония и нитрита натрия
Реакции ионного обмена
В разбавленных растворах электролитов (кислот, оснований, солей) химические реакции протекают обычно при участии ионов. При этом все элементы реагентов могут сохранять свои степени окисления (обменные реакции) или изменять их (окислительно – восстановительных реакции).
В соответствии с правилом Бертолле, ионные реакции протекают практически необратимо, если образуются твердые малорастворимые вещества (они выпадают в осадок), легколетучие вещества (они выделяются в воде газов) или растворимые вещества — слабые электролиты (в том числе и вода). Ионные реакции изображаются системой уравнений – молекулярным, полным и кратким ионным. Ниже полные ионные уравнения опущены.
При написании уравнений ионных реакций надо обязательно руководствоваться таблицей растворимости.
Примеры реакций с выпадением осадков:
a) Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O
Ba 2+ + SO4 2- = BaSO4↓
б) AgNO3 + KI = AgI↓ + KNO3
Ag + + I — = AgI↓
в) MgCl2 + 2KOH = Mg(OH)2↓ + 2KCl
Mg 2+ + 2OH — = Mg(OH)2↓
г) 3Zn(CH3COO)2 + 2Na3PO4 = Zn3(PO4)2↓ + 6Na(CH3COO)
3Zn 2+ + 2PO4 3- = Zn3(PO4)2↓
Обратите внимание, AgCO3, BaCO3 и CaCO3 ПРАКТИЧЕСКИ НЕРАСТВОРИМЫЕ В ВОДЕ И ВЫПАДАЮТ В ОСАДОК КАК ТАКОВЫЕ, НАПРИМЕР:
Ba(NO3)2 + K2CO3 = BaCO3↓ + 2KNO3
Ba 2+ + CO3 2- = BaCO3↓
Соли остальных катионов, такие как MgCO3, CuCO3, FeCO3, ZnCO3 и другие, хотя и нерастворимые в воде, но не осаждаются из водного раствора при проведении ионных реакций (т.е. их нельзя получить этим способом).
Например карбонат железа (II) FeCO3, полученный «сухим путем» или взятый в виде минерала сидерит, при внесении в воду осаждается без видимого взаимодействия. Однако при попытке его получения по обменной реакции в растворе между FeSO4 и K2CO3 выпадает осадок основной соли (приведен условный состав, на практике состав более сложный) и выделяется углекислый газ:
2FeSO4 + H2O + 2Na2CO3 = 2Na2SO4 + Fe2CO3(OH)2↓ + CO2↑
2Fe 2+ + H2O + 2CO3 2- = Fe2CO3(OH)2↓ + CO2↑
Аналогично FeCO3, сульфид хрома (3) Cr2S3 (нерастворимый в воде) не осаждается из раствора:
Примеры реакций с выделением газа:
а) BaS + 2HCl = BaCl2 + H2S↑
S 2- + 2H + = H2S↑
б) Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O
CO3 2- + 2H + = CO2↑+ H2O
в) CaCO3(T) + 2HNO3 = Ca(NO3)2 + CO2↑ + H2O
CaCO3(T) + 2H + = Ca 2+ + CO2↑ + H2O
Примеры реакций с образованием слабых электролитов:
а) 3NaOH + H3PO4 = Na3PO4 + 3H2O
3OH — + H3PO4 = PO4 3- + 3H2O
б) Mg(CH3COO)2 + H2SO4 = MgSO4 + 2CH3COOH
CH3COO — + H + = CH3COOH
в) NH4F + HBr = NH4Br + HF
F — + H + = HF
Если реагенты и продукты обменной реакции не являются сильными электролитам, ионный вид уравнения отсутствует, например:
Mg(OH)2(T) + 2HF = MgF2↓ + 2H2O
Реакции ионного обмена — виды, условия протекания и примеры
Условия протекания реакций между электролитами
В химии такие взаимодействия называют гидролизом. Этот процесс можно описать по правилам составления уравнений.

Их суть заключается в следующем:
должны быть уравнены суммы электрических зарядов ионов в правой и левой стороне уравнения;
в растворах компонентами являются вещества в виде ионов;
если в уравнении описывается нерастворимый компонент, то это означает, что он в природе слаборастворимый;
если в решение уравнения включены не растворяющиеся в водной среде вещества, то это значит что они не диссоциируют.
Данные химические реакции описываются уравнениями. Виды этих уравнений — это сокращенный ионный, полный ионный и молекулярный алгоритм описания процессов.
Молекулярные уравнения реакций

В таких уравнениях компоненты описываются в виде молекул. Их записывают таким образом:
FeCl3 + 3KOH = Fe(OH)3↓ + 3KCl.
Из формулы видно, что к положительному заряду одного компонента добавляется противоположный заряд другого вещества.
Стрелка вниз указывает, что реакция химических компонентов образует осадок. Если в результате преобразований происходит выделение газа, то ставят стрелку вверх.
Алгоритм взаимодействия других ионов описывается по той же схеме.
Важно помнить, что составить ионное уравнение возможно на основе молекулярной формулы. Должна быть четкая последовательность.
Полные ионные уравнения
Практически с помощью молекулярного уравнения нельзя в полном объеме описать химическую реакцию.

Например, реакция соляной кислоты с гидроксидом натрия записывается в молекулярном виде:
HCl + NaOH = NaCl + H2O.
Но по этой формуле невозможны расшифровки процесса в полном объеме. Точно это записывают так:
H+ + Cl— + Na+ + OH— = Na+ + Cl— + H2O.
Теперь видно, что все необратимые реакции разбиты по отдельным частицам. Такая разбивка на ионы называется полной формулой ионного обмена.
Сокращенные ионные уравнения
На практике реакцию ионного обмена нельзя описать полностью полным уравнением. Это объяснятся присутствием с обеих сторон идентичных составляющих – катионов.

В формуле это Cl— и Na+. Если их убрать, получаем упрощенный вид уравнения:
Из этого становится понятным, что происходит нейтрализация воды. К этому все сводится. Хотя все описанные правила имеют одинаковую цель – полностью описать химические процессы.