Что такое рефлекс сокращение мышц
Невролог «СМ-Клиника» рассказала о течении гиперкинеза у взрослых
Возможно, вы слышали выражение «Пляска святого Витта» — в исторических источниках так называли специфические проблемы нервной системы. Сегодня их называют гиперкинезами. Что это за болезнь и как ее лечить?
АЛЕНА ПАРЕЦКАЯ
Врач-патофизиолог,
иммунолог, член
Санкт-Петербургского
общества патофизиологов
ВАЛЕНТИНА КУЗЬМИНА
К.м.н., врач-невролог «СМ-Клиника»
До середины прошлого века считалось, что гиперкинезы – это вариант невроза. Но исследования в неврологии помогли определить, что это одно из проявлений серьезных нервных болезней.
Что нужно знать о гиперкинезе
Что такое гиперкинез
Причины гиперкинеза у взрослых
Гиперкинезы – это не заболевание, а синдром (набор определенных симптомов, проявлений). Они являются признаками повреждения нервной системы из-за:
Первичные – это наследственные повреждения нервной системы: болезнь Вильсона, хорея Гентингтона, оливопонтоцеребеллярные дегенерации.
Вторичные – они возникают из-за различных проблем, поражений нервной системы, полученных в течение жизни (черепно-мозговые травмы, энцефалиты, отравление угарным газом, последствия алкоголизма, тиреотоксикоза, ревматизма, опухоли и т.д.).
Психогенные – это гиперкинезы, которые возникают в результате острых психотравм, хронических поражений – истерических неврозов, психозов, тревожных расстройств. Эти формы бывают очень редко, но не исключены.
Проявления гиперкинеза у взрослых
Ключевые проявления патологии – это двигательные акты, которые возникают помимо воли самого человека. Их описывают как непреодолимое желание двигаться именно таким, необычным образом. Кроме того, возникают дополнительные симптомы, которые типичны для основного заболевания. Самые частые варианты проявлений:
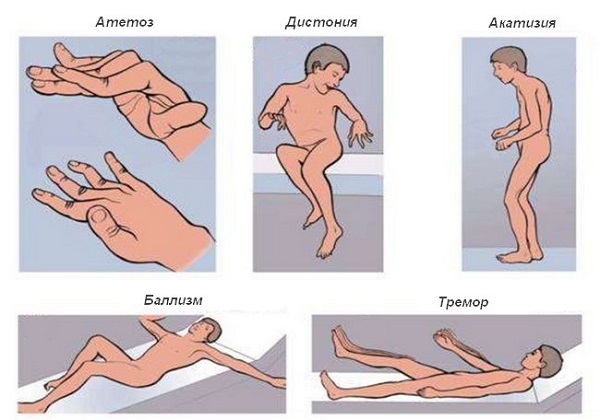
Тремор или дрожание – попеременные сокращения мышц сгибателей-разгибателей, имеющие как высокую, так и низкую амплитуду. Они могут быть в разных частях тела, пропадая при движении или в покое (либо, наоборот, усиливаясь).
Нервный тик – резкие, отрывистые сокращения мышц, имеющие низкую амплитуду. Тики обычно локализуются в одной группе мышц, их можно частично подавлять волевым усилием. Бывают моргание, подергивание уголка глаза, мигание, повороты головы, сокращение уголка рта, плеча.
Миоклонии – сокращения в хаотичном порядке отдельных мышечных волокон. За счет них некоторые группы мышц могут совершать непроизвольные движения, рывки.
Хорея – неритмичные рывковые движения, производимые с большой амплитудой. При них двигаться произвольно крайне тяжело, обычно они начинаются с конечностей.
Баллизм – резкие и непроизвольные вращательные движения в плече или бедре, из-за чего конечность совершает бросковые движения.
Блефароспазм – резкое непроизвольное смыкание века из-за повышения тонуса мышц.
Оромандибулярная дистония – непроизвольные смыкания челюстей с открытием рта при жевании, смехе или разговоре.
Писчий спазм – резкое сокращение мышц в области кисти при письме, нередко вместе с дрожанием кисти.
Атетоз – медленные извивающиеся движения в пальцах, стопе, кистях, лице.
Торсионная дистония – медленные скручивающие движения в области торса.
Лицевой гемиспазм – спазм мышц начинается с века, переходя на всю половину лица.
Виды гиперкинеза у взрослых
Гиперкинезы бывают различными, в зависимости от того, какая часть нервной системы и экстрапирамидного пути повреждена. Варианты различаются по темпу движений и особенностям так называемого «двигательного рисунка», времени возникновения и характеру этих движений.
Неврологи выделяют несколько групп гиперкинезов, по локализации их патологической основы.
Повреждения в подкорковых образованиях – их проявления будут в форме хореи, торсионной дистонии, атетоза или баллизма. Движения человека характеризует отсутствие какой-либо ритмичности, достаточно сложные, необычные движения, нарушение тонуса мышц (дистония) и широкие вариации движений.
Повреждения в стволе мозга – в этом случае будет типичным тремор (дрожание) появление миоритмий, тиков, лицевых спазмов, миоклоний. Для них характерна ритмичность, движения относительно простые и стереотипные.
Поражения корковых и подкорковых структур – для них типичны приступы эпилепсии, генерализованные гиперкинезы, диссинергия Ханта, моклонусы.
Если рассматривать скорость движений, которые непроизвольно возникают в теле, можно выделить:
постоянные движения, которые могут исчезать только во сне (это, например, дрожание или атетоз);
приступообразные, которые возникают периодами, ограниченными во времени (это тики, миоклонии).
Лечение гиперкинеза у взрослых
Диагностика
Основной план диагностики подразумевает консультацию невролога. Врач оценивает тип гиперкинеза, определяет сопутствующие симптомы, психические функции, интеллект. Также назначаются:
Современные методы лечения
– Из современных методов лечения, – объясняет врач-невролог Валентина Кузьмина, – можно выделить ботулинотерапию. Например, первичный писчий спазм можно уменьшить с помощью холинолитиков, но более перспективный метод лечения – инъекции ботулотоксина в мышцы, вовлеченные в гиперкинез.
При выраженном кинетическом компоненте тремора, а также треморе головы и голосовых складок, эффективен клоназепам.
При мозжечковом треморе, плохо поддающемся лечению, обычно используют ГАМК-ергические препараты, а также утяжеление конечности с помощью браслета.
Профилактика гиперкинеза у взрослых в домашних условиях
– Специфических мер профилактики развития заболевания не существует, – подчеркивает врач-невролог Валентина Кузьмина. – Профилактика ухудшения уже имеющегося заболевания направлена в первую очередь на ограничение психоэмоциональных нагрузок, стрессов. Также важным является соблюдение здорового образа жизни – полноценное питание, правильный режим отдыха и работы и др.
Популярные вопросы и ответы
Почему опасны гиперкинезы, когда нужно обращаться к врачу, нужно ли пить лекарства и можно ли полечиться самим, рассказала врач-невролог Валентина Кузьмина.
Какие могут последствия у гиперкинеза взрослых?
Среди основных последствий гиперкинеза у взрослых можно выделить проблемы с работой и в быту. Гиперкинезы не являются состоянием, опасным для жизни пациента. В некоторых случаях отсутствие лечения может привести к развитию ограничений подвижности суставов, вплоть до контрактур. Ограничения подвижности могут значительно осложнять осуществление таких простых бытовых действий, как одевание, расчесывание волос, умывание и т.д.
Постепенное развитие атрофии мышц приводит к полной неподвижности и инвалидности пациента.
Существуют ли лекарства от гиперкинеза?
Да, лекарства существуют, пить их надо будет постоянно, иначе гиперкинез усилится. Основной целью лечения является уменьшение имеющейся симптоматики и повышение качества жизни пациента.
Можно ли вылечить гиперкинез народными средствами?
Нет. Подобные методы не имеют доказанной эффективности, более того, они могут серьезно навредить, привести к прогрессированию основного заболевания из-за упущенного времени.
Гиперкинезы – формы, причины, симптомы и лечение
Причины патологии
Главная причина гиперкинезов – это дисфункция церебрального двигательного аппарата. Это нарушение может быть вызвано различными факторами:
Гиперкинезы в ряде случаев возникают как побочный эффект при приеме психостимуляторов или нейролептиков.
Патогенез
Гиперкинезы возникают вследствие нарушений в деятельности экстрапирамидной системы ЦНС. Она отвечает за регулирование напряжения мышц, контролирует положение тела в пространстве и управляет мимикой. Несогласованность в работе мозговой коры, мозжечка, ядер двигательного анализатора искажает импульсы двигательных нейронов, поступающих к мыщцам. В результате моторика человека искажается и принимает аномальный характер.
Общая симптоматика
К главным симптомам гиперкинезов относятся двигательные акты, совершаемые пациентами против их воли, так называемые насильственные. Сами пациенты описывают их как результат непреодолимого желания, которому они не могут противостоять.
В перечень симптомов, представляющих гиперкинезы, входят:
Формы гиперкинезов могут варьировать от прерывисто частых до постоянных. Некоторым больным удается усилием воли контролировать определенные формы гиперкинезов (например, тики), но через некоторое время приступ насильственных движений снова проявляет себя с еще большей силой.
Виды гиперкинезов
Существуют различные критерии, которые используются для классификации патологии. Благодаря им, можно выделить следующие виды гиперкинезов:
Гиперкинезы при ДЦП у детей начинают проявляться в возрасте 1,5-2 года. Дети с такой патологией с трудом координируют свои движения, которые часто выглядят как толчки, рывки и скручивания. Повторяющиеся движения могут быть быстрыми и ритмичными или, наоборот, медленными и беспорядочными.
Гиперкинезы при ДЦП могут сопровождаться нарушениями глотания, задержкой и расстройствами речи, лабильностью эмоциональной системы.
Возможные осложнения
Постепенное развитие атрофии мышц приводит к полной неподвижности и инвалидности пациента.
Диагностика
Прежде, чем определить, как лечить гиперкинез, необходимо провести точную и достоверную диагностику. При этом обращают внимание на клиническую картину заболевания, оценку психологического и интеллектуального состояния пациента.
В диагностике гиперкинезов используются:
Некоторым пациентам назначают консультацию генетика. Она необходима, если есть подозрение о том, что гиперкинезы являются симптомами наследственных заболеваний.
Диагностика гиперкинезов – это длительный процесс, на который понадобится несколько недель. Определение причин патологии позволит лечить гиперкинез более эффективно.
Лечение гиперкинезов
Традиционное лечение гиперкинезов подразумевает применение консервативной терапии. Пациенту подбирают необходимые лекарственные средства следующих групп:
В процессе лечения подбор препаратов осуществляется индивидуально, с учетом состояния пациента. Подбор лучше проводить в условиях стационарного лечения.
Помимо медикаментозной терапии в лечении применяются массажи, выполнение упражнений ЛФК, физиолечение. Пациентам с таким диагнозом показано санаторно-курортное лечение.
Лечение гиперкинезов у детей подразумевает назначение препаратов Пирацетам и Пантокальцин. Они снижают двигательную активность, нормализуют работу сосудистой системы головного мозга. Для улучшения метаболизма клеток головного мозга применяют Глицин, Гликозил, для расслабления мускулатуры – средство Ацедипрол. Для обеспечения клеток головного мозга кислородом принимают витамины группы В.
При гиперкинезах детям назначают массажи, водные и физиотерапевтические процедуры, лечебную физкультуру. В особо сложных случаях показано хирургическое вмешательство.
В целом гиперкинезы не представляют опасности для жизни пациента, но вызывают значительные трудности в его нахождении в обществе и формировании взаимодействия с другими людьми. Полностью исключить самопроизвольные движения пациента нельзя, но при регулярном лечении можно достичь снижения их интенсивности, тем самым улучшив качество жизни человека.
На данный момент не существует эффективных профилактических мер, которые способны снизить риск развития патологии. Среди общих рекомендаций – своевременное выявление и лечение перинатальных, травматических и токсических поражений мозга, консультации генетиков лицам с наследственной предрасположенностью к патологии.
Неврогенная возбудимость кишечника, не классифицированная в других рубриках (K59.2)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Неврогенная возбудимость кишечника представляет собой нарушение желудочно-кишечной и аноректальной функции вследствие поражения нервной системы, что приводит к невозможности эвакуации кишечного содержимого или к недержанию стула.
Примечание
В данную подрубрику включена: «Неврогенная возбудимость кишечника, не классифицированная в других рубриках».
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
I. На основании патофизиологических процессов и клиники нейрогенные расстройства кишечника разделяют на 2 группы:
2. Гипотония (арефлексия) кишечника (также называют «синдромом поражения нижних двигательных нейронов»). Арефлексия кишечника развивается при травме поясничного отдела (нижняя часть спины) или крестцового (включая копчик) отдела спинного мозга. Этот вид травмы уменьшает перистальтику и рефлекторный (автоматический) контроль анального сфинктера. Отмечается недержание кала.
II. По срокам развития (по периодам) некоторые авторы выделяют:
— острую нейрогенную дисрефлексию кишечника, возникающую в первые 24 часа на фоне спинального (дистрибутивного шока);
— хроническую дисрефлексию на фоне отсутствия спинального шока.
Этиология и патогенез
Эпидемиология
Признак распространенности: Распространено
Распространенность неврогенной возбудимости кишечника во взрослой популяции варьируется в широких пределах 1-5% (в зависимости от критериев оценки, по некоторым данным до 20%).
В зависимости от патологии распространенность может быть выше.
В группах пациентов с инсультом недержание кала отмечалось в 20-25% случаев в течение первого года.
В группе пациентов с рассеянным склерозом распространенность нарушений работы кишечника оценивается как 39-75%, то есть составляет практически 2/3 от всех пациентов с этим заболеванием.
В группе амбулаторных пациентов со спинальной травмой 95% пациентов нуждаются хотя бы в однократном медицинском вмешательстве по поводу нейрогенного кишечника, а 50% необходимо такое лечение постоянно.
50% пациентов с болезнью Паркинсона имеют кишечную дисфункцию (запоры).
Распространенность запоров был у пациентов с сахарным диабетом и нейропатией составляет 12-88%. 20% диабетиков предъявляют жалобы на эпизоды недержания кала и мочи.
10-50% госпитализированных по разным поводам пациентов имеют нейрогенную дисфункцию кишечника.
Пол. Различий по гендерному признаку не выявлено.
Возраст. Не выявлено различий.
Раса. Не выявлено различий.
Факторы и группы риска
Риск развития повышается при наличии заболеваний, указанных как этиологически значимые (см. раздел «Этиология и патогенез»).
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Чувствительность симптома:
— 34-53% лиц с расщеплением позвоночника;
— 56% лиц с церебральным параличом;
— 30% лиц, перенесших инсульт;
— 20-50% лиц с рассеянным склерозом;
— 75% лиц с травмами и заболеваниями спинного мозга.
3. Другие важные симптомы:
3.1 Прочие органные дисфункции:
— недержание мочи;
— дисфункции со стороны других органов или отделов желудочно-кишечного тракта (при уровне поражения выше Th6).
3.2 Симптомы основного, этиологически важного заболевания.
3.3 Симптомы осложнений (см. раздел «Осложнения»).
Физикальные исследования
Общий подход
Изменения, выявляемые при физикальном обследовании:
1. При повреждении нижних нейронов анальная область становится сглаженной на вид.
2. Живот может быть вздутым, безболезненным, сигмовидная кишка может пальпироваться в виде увеличенного, плотного образования.
3. Анально-кожный рефлекс (так называемый «рефлекс анального сфинктера»). В норме при незначительном болевом раздражении кожи в области ануса происходит непроизвольное сокращение анального сфинктера. Рефлекс обычно присутствует, если рефлекторные дуги на уровнях S2, S3, S4 не повреждены. Этот рефлекс не коррелирует с функцией внутреннего сфинктера ануса.
4. Бульбокавернозный рефлекс: сокращение анального сфинктера в ответ покалывание (сжатие) головки полового члена или на подтягивание катетера Фолея является нормальной реакцией (следует отличать от движений баллона катетера). Сохранность бульбокавернозного рефлекса указывает на неполное повреждение. Тем не менее, если это единственный признак, то он не считается указанием на хороший прогноз в отношении восстановления.
6. Брюшные кожные рефлексы. При проведении острым предметом по коже одного из квадрантов живота возникает сокращение подлежащих брюшных мышц, что приводит к смещению пупка в направлении этого квадранта:
— верхний брюшной рефлекс: Т8-9;
— нижний брюшной рефлекс: Т10-12.
Рефлекс является корковым (то есть дуга рефлекса поднимается до коры, а потом спускается к брюшным мышцам). Наличие реакции указывает на неполное повреждение спинного мозга выше нижнегрудного уровня.
7. Ректальное пальцевое исследование. Позволяет оценить наличие и характер стула в прямой кишке, наличие колоректальной опухоли или иной патологии прямой кишки. Также позволяет тактильно оценить тонус наружного сфинктера при исследовании бульбокавернозного рефлекса (если он не определяется визуально).
Острое полное поражение спинного мозга и нижних двигательных нейронов проявляется снижением или отсутствием тонуса сфинктера, что обычно отмечается при поражении выше уровня L3.
8. Сенсорная чувствительность анальной области (все четыре квадранта), области седла и конечностей должна быть оценена с помощью легкого покалывания булавкой.
9. Сила мышц тазового дна и сфинктеров может быть оценена при произвольном и непроизвольном напряжении (попросить пациента натужиться или покашлять).
Что такое рефлекс сокращение мышц
Мышечный тонус определяется двумя факторами: механико-эластическими характеристиками мышечной и соединительной ткани; рефлекторной сократимостью мышц (тоническим рефлексом на растяжение). Первый фактор, или «внутренняя жесткость» мышечной ткани, имеет несомненное значение в развитии или поддержании спастического мышечного гипертонуса, поскольку в какой-то степени мышца подобна обыкновенной пружине, возвратная сила, действие которой пропорционально изменению ее длины и в то же время зависит от модуля упругости материала, из которого сделана пружина. Однако основная роль в поддержании и изменении мышечного тонуса отводится функциональному состоянию сегментарной дуги рефлекса растяжения (миотатического, или проприоцептивного рефлекса).
Рецепторным элементом миотатического рефлекса является инкапсулированное мышечное веретено. Каждая мышца содержит большое количество этих рецепторов. Мышечное веретено состоит из интрафузальных мышечных волокон (в сравнении с обычными экстрафузальными мышечными волокнами они значительно тоньше) и ядерной сумки, оплетенной спиралевидной сетью тонких нервных волокон, представляющих собой первичные чувствительные окончания. На некоторых интрафузальных волокнах имеются еще и вторичные, гроздевидные чувствительные окончания. При растяжении интрафузальных волокон первичные чувствительные окончания усиливают исходящую из них импульсацию, которая через быстро проводящие афферентные волокна типа Iа проводятся к альфа-большим мотонейронам спинного мозга. Оттуда через также быстропроводящие альфа-1-эфферентные волокна импульс идет к экстрафузальным белым мышечным волокнам, которые обеспечивают быстрое (фазическое) сокращение мышцы. От вторичных чувствительных окончаний, реагирующих на тонус мышцы, афферентная импульсация проводится по тонким волокнам II типа через систему вставочных нейронов к альфа-малым мотонейронам, которые иннервируют тонические экстрафузальные мышечные волокна (красные мышечные волокна), обеспечивающие поддержание тонуса и позы.
Гамма-мотонейроны находятся под влиянием центральных (супрасегментарных) воздействий, передающихся по волокнам, которые идут от мотонейронов оральных отделов головного мозга в составе пирамидного, ретикулоспинального, вестибулоспинального трактов. Таким образом, мышечный тонус может регулироваться непосредственно головным мозгом, что очень важно для выполнения произвольных движений. При этом если роль пирамидной системы заключается в преимущественной регуляции фазических (т.е. быстрых, целенаправленных) компонентов произвольных движений, то экстрапирамидная система обеспечивает плавность произвольных движений, их «настройку» в соответствии с решаемой задачей, т.е. преимущественно регулирует тоническую иннервацию мышечного аппарата.
В регуляции мышечного тонуса принимают участие и тормозные механизмы, которые реализуются с помощью рецепторов Гольджи, расположенных в сухожилиях мыщц, и вставочных клеток Реншоу, находящихся в передних рогах спинного мозга. Сухожильные рецепторы Гольджи при растяжении или значительном напряжении мышцы посылают афферентные импульсы, которые проводятся по быстропроводящим волокнам 1b типа в спинной мозг и оказывают тормозящее воздействие на мотонейроны передних рогов. Вставочные нейроны Реншоу активизируются через коллатерали при возбуждении альфа-мотонейронов и действуют по принципу отрицательной обратной связи, тормозя активность последних. Таким образом, нейрогенные механизмы регуляции мышечного тонуса многообразны и сложны.
Боковой (латеральный) амиотрофический склероз (и синдром БАС)
Боковой (латеральный) амиотрофический склероз (БАС) (также известен как болезнь моторных нейронов, Мотонейронная болезнь, болезнь Шарко, в англоязычных странах — болезнь Лу Герига) — прогрессирующее, неизлечимое дегенеративное заболевание центральной нервной системы, при котором происходит поражение как верхних (моторная кора головного мозга), так и нижних (передние рога спинного мозга и ядра черепно-мозговых нервов) двигательных нейронов, что приводит к параличам и последующей атрофии мышц.
Болезнь известна не так давно. Впервые описана Жан-Мартеном Шарко в 1869г. По статистике выявляется у 2-5 человек на 100 000 населения в год, что говорит о том, что данная патология относительно редко встречается. Всего в мире насчитывается около 70 тысяч больных боковым амиотрофическим склерозом. Обычно заболевание заявляет о себе у людей старше 50 лет.
Совсем недавно было высказано мнение, что случаи бокового амиотрофического склероза чаще регистрируются у высокоинтеллектуальных людей, профессионалов в своем деле, а также у спортсменов-атлетов, которые на протяжении всей жизни отличались крепким здоровьем.
Точная этиология БАС неизвестна.
Сущность болезни заключается в дегенерации двигательных нейронов, т.е. под воздействием ряда причин запускается процесс разрушения нервных клеток, ответственных за сокращения мышц. Этот процесс затрагивает нейроны коры больших полушарий, ядер головного мозга и нейроны передних рогов спинного мозга. Двигательные нейроны погибают, а их функции никто больше не выполняет. Нервные импульсы к мышечным клеткам больше не поступают. И мышцы слабеют, развиваются парезы и параличи, атрофия мышечной ткани.
Если в основе бокового амиотрофического склероза лежит мутация в гене супероксиддисмутазы-1, то процесс выглядит примерно следующим образом. Мутантная супероксиддисмутаза-1 накапливается в митохондриях двигательных нейронов (в энергетических станциях клетки). Это «мешает» нормальному внутриклеточному транспорту белковых образований. Белки соединятся друг с другом, как бы слипаются, и это запускает процесс дегенерации клетки.
Если причиной становится избыток глутамата, то механизм запуска разрушения двигательных нейронов выглядит так: глутамат открывает каналы в мембране нейронов для кальция. Кальций устремляется внутрь клеток. Избыток кальция, в свою очередь, активирует внутриклеточные ферменты. Ферменты как бы «переваривают» структуры нервных клеток, при этом образуется большое количество свободных радикалов. И эти свободные радикалы повреждают нейроны, постепенно приводя к их полному разрушению.
Предполагается, что роль других факторов в развитии БАС также заключается в запуске свободнорадикального окисления.
Классификация БАС, формы:
Общими симптомами, характерными для любой из форм бокового амиотрофического склероза, являются:
Начальные проявления заболевания:
•слабость в дистальных отделах рук, неловкость при выполнении тонких движений пальцами, похудание в кистях и фасцикуляции (мышечные подергивания)
•реже заболевание дебютирует слабостью в проксимальных отделах рук и плечевом поясе, атрофиями в мышцах ног в сочетании с нижним спастическим парапарезом
•возможно также начало заболевания с бульбарных расстройств – дизартрии и дисфагии (25% случаев)
•крампи (болезненные сокращения, спазмы мышц), нередко генерализованные, встречаются практически у всех больных БАС, и нередко являются первым признаком заболевания
Для БАС в большинстве случаев характерна асимметричность симптоматики.
При этой форме заболевания возможно два варианта:
Также может дебютировать двумя способами:
В руках по мере прогрессирования болезни формируется парез с атрофическими изменениями, повышением рефлексов, повышением тонуса и патологическими стопными признаками. Аналогичные изменения возникают и в ногах, но несколько позже.
Это разновидность бокового амиотрофического склероза, когда заболевание протекает с преимущественным поражением центрального мотонейрона. При этом во всех мышцах туловища и конечностей формируются парезы с повышением мышечного тонуса, патологическими симптомами.
Бульбарная и высокая формы БАС являются прогностически неблагоприятными. Больные с таким началом заболевания имеют меньшую продолжительность жизни по сравнению с шейно-грудной и пояснично-крестцовой формами. Какими бы ни были первые проявления заболевания, оно неуклонно прогрессируют.
Парезы в различных конечностях приводят к нарушению способности самостоятельно передвигаться, обслуживать себя. Вовлечение в процесс дыхательной мускулатуры приводит вначале к появлению одышки при физической нагрузке, затем одышка беспокоит уже в покое, появляются эпизоды острой нехватки воздуха. В терминальных стадиях самостоятельное дыхание просто невозможно, больным требуется постоянная искусственная вентиляция легких.
Продолжительность жизни больного БАС составляет по разным данным от 2 до 12 лет, однако более 90% больных умирают в течение 5 лет от момента постановки диагноза. В терминальную стадию болезни больные полностью прикованы к постели, дыхание поддерживается с помощью аппарата искусственной вентиляции легких. Причиной гибели таких больных может стать остановка дыхания, присоединение осложнений в виде пневмонии, тромбоэмболии, инфицирования пролежней с генерализацией инфекции.
Среди параклинических исследований наиболее существенное диагностическое значение имеет электромиография. Выявляется распространенное поражение клеток передних рогов (даже в клинически сохранных мышцах) с фибрилляциями, фасцикуляциями, позитивными волнами, изменениями потенциалов двигательных единиц (увеличивается их амплитуда и длительность) при нормальной скорости проведения возбуждения по волокнам чувствительных нервов. Содержание КФК в плазме может быть незначительно повышено
Боковой амиотрофический склероз нужно заподозрить:
•при развитии слабости и атрофий, а возможно и фасцикуляций (мышечных подергиваний) в мышцах кисти
•при похудания мышц тенара одной из кистей с развитием слабости аддукции (приведения) и оппозиции большого пальца (обычно асимметрично)
•при этом наблюдается затруднение при схватывании большим и указательным пальцами, затруднения при подбирании мелких предметов, при застегивании пуговиц, при письме
•при развитии слабости в проксимальных отделах рук и плечевом поясе, атрофий в мышцах ног в сочетании с нижним спастическим парапарезом
•при развитии у пациента дизартрии (нарушений речи) и дисфагии (нарушений глотания)
•при появлении у пациента крампи (болезненных мышечных сокращений)
Диагностические критерии БАС:
Критерии подтверждения БАС:
Диагноз БАС подьверждается:
Дифференциальный диагноз БАС (синдромы похожие на БАС):
•Спондилогенная шейная миелопатия.
•Опухоли краниовертебральной области и спинного мозга.
•Краниовертебральные аномалии.
•Сирингомиелия.
•Подострая комбинированная дегенерация спинного мозга при недостаточности витамина В12.
•Семейный спастический парапарез Штрюмпеля.
•Прогрессирующие спинальные амиотрофии.
•Постполиомиелитический синдром.
•Интоксикации свинцом, ртутью, марганцем.
•Недостаточность гексозаминидазы типа А у взрослых при ганглиозидозе GM2.
•Диабетическая амиотрофия.
•Мультифокальная моторная невропатия с блоками проведения.
•Болезнь Крейцтфельдта-Якоба.
•Паранеопластический синдром, в частности при лимфогранулематозе и злокачественной лимфоме.
•Синдром БАС при парапротеинемии.
•Аксональная нейропатия при болезни Лайма (Лайм-боррелиозе).
•Синдром Гийена-Барре.
•Миастения.
•Рассеянный склероз
•Эндокринопатии (тиреотоксикоз, гиперпаратиреоз, диабетическая амиотрофия).
•Доброкачественные фасцикуляции, т.е. фасцикуляции, продолжающиеся годами без признаков поражения двигательной системы.
•Нейроинфекции (полиомиелит, бруцеллез, эпидемический энцефалит, клещевой энцефалит, нейросифилис, болезнь Лайма).
•Первичный боковой склероз.
Диагностические исследования при синдроме БАС.
Для уточнения диагноза и проведения дифференциального диагноза при синдроме БАС рекомендутся следующее обследование больного:
Анализ крови (СОЭ, гематологические и биохимические исследования)
Рентгенография органов грудной клетки
Исследование функций щитовидной железы
Определение содержания витамина В12 и фолиевой кислоты в крови
Креатинкиназа в сыворотке
МРТ головного мозга и при необходимости, спинного мозга
Эффективного лечения заболевания не существует. Единственный препарат, ингибитор высвобождения глутамата рилузол (Рилутек), отодвигает летальный исход на 2 – 4 месяца. Его назначают по 50 мг два раза в день.
Основу лечения составляет симптоматическая терапия:
•Физическая активность. Пациент должен по мере своих возможностей поддерживать физическую активность По мере прогрессирования заболевания возникает необходимость в кресле-каталке и других специальных приспособлениях.
•Диета. Дисфагия создаёт опасность попадания пищи в дыхательные пути • Иногда возникает необходимость в питании через зонд или в гастростомии.
•Применение ортопедических приспособлений: шейного воротника, различных шин, устройств для захвата предметов.
•При крампи (болезненным мышечных спазмах): карбамазепин (Финлепсин, Тегретол) и/или витамин Е, а также препараты магния, верапамил (Изоптин).
•При спастичности: баклофен (Баклосан), Сирдалуд, а также клоназепам.
•При слюнотечении атропин, или гиосцин (Бускопан).
•При невозможности приема пищи вследствие нарушения глотания накладывают гастростому или вводят назогастральный зонд. Раннее проведение чрезкожной эндоскопической гастростомии продлевает жизнь пациентов в среднем на 6 месяцев.
•Церебролизин в высоких дозах (10-30 мл в/в капельно 10 дней повторными курсами). Существует ряд небольших исследований, показывающих нейропротективную эффективность церебролизина при БАС.
•Антидепрессанты: Серталин или Паксил или Амитриптилин (часть больных БАС предпочитает именно его как раз из-за побочных действий – он вызывает сухость во рту, соответственно уменьшает гиперсаливацию (слюнотечение), часто мучающую больных БАС).
•При появлении дыхательных нарушений: искусственная вентиляция легких в условиях стационаров, как правило, не проводится, но некоторые больные приобретают портативные приборы ИВЛ и проводят ИВЛ в домашних условиях.
•Ведутся разработки к применению гормона роста, нейротрофических факторов при БАС.
•Последнее время активно ведутся разработки лечения стволовыми клетками. Этот метод обещает быть перспективным, но все же пока находится на стадии научных экспериментов.
•Боковой амиотрофический склероз является фатальным заболеванием. Средняя продолжительность жизни больных БАС 3 – 5 лет, тем не менее, 30% больных живут 5 лет, а около 10 – 20% живут более 10 лет от начала заболевания.
•Неблагоприятные прогностические признаки – пожилой возраст и бульбарные нарушения (после появления последних больные живут не более 1 – 3 лет).


.jpg)





