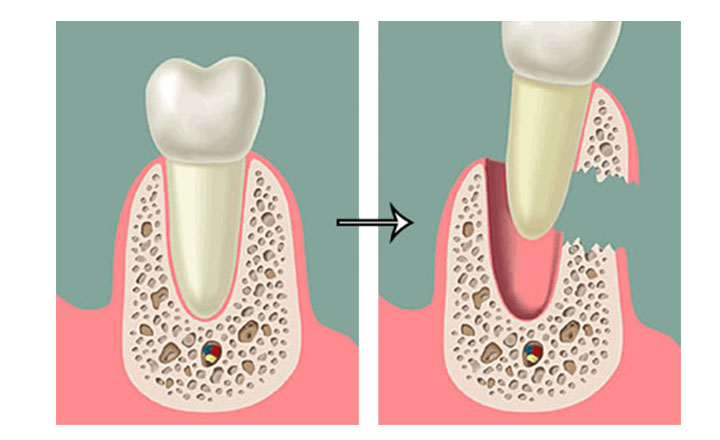
Что такое резорбция кости
Особенности диагностики и лечения заболеваний, сопровождающихся резорбцией костных структур
Peculiarities of diagnostics and treatment of diseases, accompanied by resorption of bone structures
И. К. Луцкая
д. м. н., профессор, заведующая кафедрой терапевтической стоматологии БелМАПО
Основной объем работы хирурга-стоматолога на амбулаторном приеме занимают операции удаления зуба. На следующем месте по частоте стоят хирургические вмешательства на пародонте, цистотомия. В настоящее время расширяются показания к установке внутрикостных имплантатов с последующим протезированием. При этом одной из серьезных проблем, с которыми сталкиваются специалисты, является резорбция костной ткани на фоне воспалительного процесса, осложнений ранее выполненного лечения зубов или после оперативного вмешательства [3, 7]. В качестве примера можно рассматривать первичное образование кистозной полости в области корня или вторичное рассасывание альвеолярной кости после удаления зуба.
Одним из наиболее распространенных методов диагностики большинства заболеваний зубов и челюстей человека является рентгенологическое обследование пациента. Достижения стоматологии в последнее десятилетие ознаменовались не только появлением новых способов лечения и профилактики, но и развитием рентгеновской техники, разработкой новых методик рентгенографии [6]. Это закономерно вызвало повышение частоты использования и расширение спектра рентгенологических исследований зубочелюстной системы.
При осложненном кариесе рентгенологические исследования необходимы для определения характера и распространенности поражения периапикальных тканей, осуществляется точная диагностика заболеваний тканей пародонта. При травматических повреждениях, опухолях, опухолеподобных заболеваниях, кистах, деформациях и системных поражениях костей черепа рентгенологическое исследование является ведущим способом первичной диагностики и оценки эффективности лечебных мероприятий, своевременного выявления осложнений [3, 4].
На рентгенограммах кости лицевого скелета, челюстей имеют характерную структуру, так называемый костный рисунок, который отображает особенности функции и анатомического строения. Патологические процессы приводят к изменению костного рисунка, что позволяет врачу-стоматологу диагностировать различные заболевания.
Так, остеопороз — дистрофический процесс, в основе которого лежит уменьшение и замещение костной ткани остеоидным веществом, жировой тканью, кровью. При остеопорозе снижается количество костных балочек в единице объема кости, они истончаются, костномозговые пространства расширяются.
По характеру теней на рентгенограмме остеопороз делят на очаговый и диффузный. Первый представлен отдельными, размером от 1 до 5 мм, очагами разрежения костной ткани с четкими или нечеткими контурами и предшествует секвестрации при остеомиелите кости. Для диффузного остеопороза характерно равномерное разрежение костной ткани, кортикальный слой кости истончен, иногда разволокнен, костномозговые пространства расширены. Такой вид остеопороза встречается после утраты зубов.
Деструкция — разрушение кости и замещение ее патологической тканью (гноем, грануляциями и т. д.). На рентгенограмме очаг деструкции имеет меньшую плотность по сравнению с рядом расположенными неизмененными участками.
Деструктивные изменения костного вещества чаще всего наблюдаются при воспалительных и опухолевых поражениях костей. Разрушение идет, с одной стороны, путем рассасывания костных балок и трабекул в результате непосредственного воздействия патологического процесса (гнойное воспаление, распад, некроз, прорастание опухолевой тканью и др.), а с другой — рефлекторным нейрогуморальным путем. При этом костномозговые пространства сливаются и увеличиваются в объеме.
Резорбция — рассасывание костных структур или дентина, в том числе верхушек корней, которое может носить физиологический характер (корни временных зубов) или являться следствием патологического процесса. Если на рентгенограмме в области верхушки корня обнаруживается деструктивный очаг с лучше или хуже очерченными контурами, это может быть обусловлено различными стадиями гранулирующего, гранулематозного и фиброзного периодонтита. Рентгеновское изображение кисты, находящейся в процессе формирования, вначале может не отличаться от других стадий развития хронического периодонтита. Дальнейшее формирование кисты приводит к увеличению размеров. При рентгенологическом исследовании в области верхушки корня зуба обнаруживается очаг просветления, имеющий шаровидную форму. Границы этой полости гладкие и четко очерченные. Нередко вокруг полости образуется тонкий склеротический ободок.
При тяжелом течении пародонтита на рентгенограмме определяются значительные по площади участки просветления, характеризующие убыль костной ткани более 1/2 длины корня у многих зубов, иногда полное рассасывание межзубной перегородки и выраженные изменения в области фуркации корней. Вертикальная резорбция приводит к образованию глубоких костных карманов вдоль зубного ряда [3, 6].
Среди оперативных методов лечения особое место занимает реконструктивная хирургия с использованием остеозамещающих материалов, которые способствуют восстановлению костной ткани и активизируют процессы регенерации тканей живого организма [1, 2, 5].
Репаративная регенерация костной ткани как биологический процесс генетически предрасположенна, процесс нельзя ускорить [5]. Однако существуют факторы регенерации, на которые можно оказывать оптимизирующее воздействие, поэтому возрастает роль средств, обладающих положительным влиянием на остеогенез. Термин «направленная регенерация кости», предложенный Д. Басером, определяет принцип создания благоприятных условий для развития костных клеток между дефектом кости и окружающими мягкими тканями для предотвращения проникновения в область остеорепарации эпителия. По данным литературы, при обеспечении наиболее благоприятных условий особого внимания заслуживают средства, способствующие образованию костной ткани и ее обызвествлению. С этой целью используют барьерные мембраны в сочетании с остеопластическим материалом, что должно обеспечивать реализацию тех способностей, которыми изначально обладает костная ткань [5, 7].
Большой интерес вызывают кальцийфосфатные соединения (гидроксиапатит), как материал, наиболее близкий по составу костной ткани, минеральному компоненту и твердым тканям зуба.
В настоящее время выпуск препаратов на основе гидроксиапатита освоен многими производителями: в России («Остим-100», «Колапол», «Гидроксиапол» и «Коллапан»), в Республике Беларусь («КАФАМ», гель гидроксиапатита). Материалы применяются с различными типами антибиотиков и антисептиков, не требуют специального инструментария и оборудования, изготавливаются в различных формах (блоки, пластины, гранулы, порошки, суспензии). Все типы гидроксиапатита используются при хирургическом лечении различных стоматологических заболеваний.
Средство на основе нанокристаллического гидроксиапатита (кальция фосфата) предназначено для имплантации в костную ткань с целью активации остеорепаративных процессов, обладает повышенной способностью трансформироваться в биологических средах в ионы кальция и фосфаты, что обеспечивает лучшее усвоение указанных ионов непосредственно в «зоне интереса» — костной ране (зона между отломками при переломах, костный дефект, секвестральная полость и т. д.).
Кальций снижает проницаемость клеточных мембран и сосудистой стенки, предотвращает развитие воспалительных реакций. Ионы кальция участвуют в передаче нервных импульсов, в свертывании крови и других физиологических процессах.
Гидроксиапатит способствует оптимизации заживления костной раны, формированию функционально и структурно полноценного остеорегенерата по типу первичного заживления костной раны. Применение препарата позволяет уменьшить длительность болевого периода у пациентов после операции и способствует скорейшей ликвидации отека мягких тканей в этой зоне. Гидроксиапатит характеризуется низкой растворимостью в биологических средах и медленным поступлением ионов кальция в межуточную среду и кровь.
Применение в стоматологии:
Рис. 1. Радикулярная киста верхней челюсти. КЛКТ-исследование.
Рис. 2. Рентгенограмма моляра после резекции верхушки корня.
Примером препаратов на основе гидроксиапатита может служить «Коллапан» — препарат, применяемый для восстановления костной ткани, профилактики и лечения гнойных осложнений. Состоит из гидроксилапатита и коллагена. Полностью замещается костной тканью, сохраняет антимикробную активность в ране до 20 суток, в течение которых происходит равномерное выделение антибиотика в костной полости [2].
Выпускается в виде гранул, геля, пластин: различный вид материала обусловлен удобством заполнения костных дефектов различной формы и расположения.
Выбор вида препарата зависит от возбудителя заболевания. Наличие в материале антимикробных средств различного спектра действия позволяет целенаправленно выбрать вид «Коллапана», соответствующий возбудителю заболевания, что значительно повышает эффективность лечения.
«Коллапан» не вызывает отторжения, нагноения, аллергических реакций. Противопоказанием к применению является индивидуальная непереносимость антибиотика, входящего в состав препарата.
В зависимости от формы заполняемого дефекта возможно как изолированное, так и сочетанное применение гранул, пластин, геля. Пластины легко режутся ножницами, скальпелем. Гель вводится при необходимости создания более полного контакта гранул и пластин с костной тканью. Применяют при пародонтите, удалении зуба, резекции верхушки корня, дентальной имплантации, периимплантитах, софт-синус-лифтинге, хронических периодонтитах, перфорациях зоны бифуркации, альвеолитах.
Клинический случай № 1
Операция удаления зубов с предварительным иссечением эпителиального края десны.
При помощи глазного скальпеля производили разрезы вдоль маргинальной десны с вестибулярной и оральной поверхности таким образом, чтобы со стороны костных карманов разрез проходил ниже маргинальной части десны на 1—2 мм; со стороны сохранившейся альвеолярной кости разрез выполнялся максимально близко к краю десны.
Вглубь тканей разрез выполнялся под углом от края десны до уровня дна зубодесневого кармана и распространялся вплоть до цемента корня, что позволяло произвести иссечение эпителия вдоль края десны, патологических грануляций в кармане и поддесневых зубных отложений.
Рис. 3. Лунка удаленного зуба заполнена остеопластическим материалом.
Рис. 4. Раневая поверхность после удаления группы зубов.
Рис. 5. Внутрикостные имплантаты.
Рис. 6. Нормальная структура кости в области имплантатов. Рентгенограмма.
Клинический случай № 2
Органосберегающая операция с цементотомией при локализованном пародонтите.
Осуществлялось обезболивание соответствующего участка челюсти, выполнялся разрез в межзубном пространстве параллельно основанию сосочка между проксимальными сторонами зубов. Рассечение межзубных мягких тканей производили на участке зубного ряда, превышающем область намеченного вмешательства на 1—2 зуба с каждой стороны, и дополняли разрезом, позволяющим углубить преддверие полости рта. Затем поочередно с каждой стороны отслаивали лоскуты с обеих сторон альвеолярного отростка и отводили на расстояние, обеспечивающее свободное манипулирование в операционном поле.
Удаление грануляций и вегетации эпителия скальпелем начинали с апикальных частей поверхности лоскутов. Далее приступали к удалению грануляций, прилежащих к зубу и альвеолярной кости, инструментами для снятия зубного камня и малыми кюретажными ложками. Острые костные выступы на альвеолярном отростке сошлифовывали алмазной головкой.
Обработку корней недепульпированных зубов проводили, соскабливая острыми инструментами (экскаватор, различные по форме острые крючки) поверхностные отложения зубного камня вместе с грануляциями и некротизированными тканями на поверхности цемента. Корни депульпированных зубов подвергали цементотомии удлиненным бором с затупленной и отполированной торцевой частью, удерживая его под различными углами относительно поверхности корня зуба.
Рану тщательно промывали растворами антисептиков. Костные карманы заполняли препаратом гидроксиапатита с коллагеном. Швы накладывали из кетгута с удлиненным сроком рассасывания. Даны рекомендации по уходу за раной. Осуществляется послеоперационное наблюдение.
Клинический случай № 3
Рис. 7. КЛКТ-снимок. Киста в области верхней челюсти слева.
Рис. 8. Удалены зубы. Сделана цистэктомия.
Рис. 9. Гемостаз после операции цистэктомии.
Заключение
Воспалительные процессы в челюстно-лицевой области нередко сопровождаются деструкцией костной ткани, выражающейся рассасыванием костных балочек и замещением их продуктами патологического распада или вновь образованной грануляционной тканью. Диагностика подобных изменений осуществляется (или уточняется) на основании рентгенологического исследования костей лицевого черепа. На рентгеновском снимке обнаруживаются участки просветления, соответствующие определенной клинической картине. Эффективность лечения заболеваний, проявляющихся резорбцией костных структур, существенно повышается при местном использовании препаратов, обладающих остеотропным воздействием, прежде всего, на основе гидроксиапатита.
- Луцкая Ирина Константиновна, д. м. н., профессор, заведующая кафедрой терапевтической стоматологии БелМАПО, Беларусь, Минск
д. м. н., профессор, заведующая кафедрой терапевтической стоматологии БелМАПО, Беларусь, Минск
Lutskaya I.K., dms, professor, Head of the Department of Therapeutic Dentistry Belorussian Medical Academy of Postgraduate Education, Belarus, Minsk
Коржев Алексей Олегович, врач стоматолог-хирург, УЗ «8-я городская клиническая стоматологическая поликлиника» г. Минска, Беларусь, Минск
Korzhev A. O., 8th city clinical dental clinic, Belarus, Minsk
Есьман Андрей Алексеевич, главный врач, УЗ «8-я городская клиническая стоматологическая поликлиника» г. Минска, Беларусь, Минск
Esman A.A., 8th city clinical dental clinic, Belarus, Minsk
220040, Минск, ул. Сурганова, 70—71
Тел. +375 29 631-65-28
Аннотация. В статье приводятся сведения, характеризующие рентгенологическую картину заболеваний, сопровождающихся деструкцией альвеолярной кости. Особенности патологического процесса проявляются специфическими изменениями структуры, что отражается на рентгеновском снимке и позволяет уточнить клинический диагноз. Оперативное лечение выявленных заболеваний ставит целью исключение этиотропных факторов. Эффективность регенерации костных структур можно существенно повысить, заполняя дефекты кости остеотропластическим препаратом на основе гидроксиапатита кальция.
Annotation. The article provides information characterizing x-ray picture of the diseases accompanied by destruction of the alveolar bone. Features of a pathological process manifested specific changes in the structure, which is reflected in the x-ray and allows us to Refine the clinical diagnosis. Surgical treatment of identified diseases aims to the exclusion of causal factors. The efficiency of regeneration of bone structures can be considerably increased by filling the bone defects osteuropaeischen a drug on the basis of gidroksiapatit calcium.
Ключевые слова: рентгенодиагностика; деструкция альвеолярной кости; остеопластический материал.
Key words: x-ray diagnostics; destruction of the alveolar bone; osteoplastic material.
Литература
1. Безруков В. М., Григорьян А. С. Гидрокисапатит как субстрат для костной пластики: Теоретические и практические аспекты проблемы // Стоматология. — 1996. — № 5. — С. 7—12.
3. Кулаков А. А. Клинико-лабораторное обследование в предоперационной подготовке к внутрикостной дентальной имплантации у больных остеопорозом / А. А. Кулаков, М. С. Седова, М. В. Гунько // Материалы XIII Международной конференции челюстно-лицевых хирургов и стоматологов «Новые технологии в стоматологии». — Санкт-Петербург, 2008. — С. 125—126.
4. Луцкая И. К. Имплантация одиночного зуба во фронтальном отделе верхней челюсти / И. К. Луцкая, Т. Л. Шевела // Дентальная имплантология и хирургия. — 2014. — № 3. — С. 63—65.
5. Параскевич В. Л. Дентальная имплантология. Основы теории и практики / В. Л. Параскевич. — Минск: Юнипресс, 2002. — 368 с.
6. Ружило-Калиновска И., Ружило Т. К. Трехмерная томография в стоматологической практике. Перевод с польск. — Львов: ГалДент, 2012. — 584 с.
7. Wortche R. An alternative method for sinus floor elevation //EDI Jornal. — 2013. — № 1. — Vol. 9. — P. 80—85.
Резорбция костной ткани
Содержимое
Костная ткань получает нагрузку постоянно – жевание и другие процессы сохраняют тонус твердых тканей, удерживающих зубы. Когда зуб отсутствует, нагрузка в зоне дефекта сводится к минимуму, за счет чего ость расслабляется, теряет плотность, объем. Установить имплант в такую кость не всегда представляется возможным.
Что такое атрофия костной ткани
Кость – живая структура, которая постоянно меняется. Около четверти структуры кости составляют органические соединения – белки, коллаген и прочие. Остальная часть – гидроксиапатиты, которые отвечают за жесткость кости. В зависимости от сочетания этих элементов кость может быть губчатой – легкой и пористой – и компактной – плотной и прочной. В нормальном состоянии процессы в разрушения и образования новой ткани идут непрерывно. Если система нарушается – нарушается и баланс процессов.
Атрофия в большинстве случаев начинается после удаления зуба. Любые ткани в организме поддерживают свое нормальное состояние за счет активного использования. Части, не участвующие в работе, атрофируются – это свойство организма. В первый год после удаления зуба объем твердой ткани сокращается на четверть.
Причины убыли костной ткани
Расслабление, потеря объема костной ткани происходит не только после удаления зуба. Для этого есть несколько других причин:
Резорбция кости и имплантация
Недостаточный объем, искажение структуры кости – серьезная проблема для нормальной имплантации. Корень должен устанавливаться в плотную кость, чтобы прочно зафиксироваться и прижиться в тканях правильно. Если убыль кости незначительна, установить имплант возможно, главное, чтобы его размер соответствовал ситуации. Если же резорбция значительна, для имплантации потребуется восстановление объема за счет реконструкции челюсти.
Как предотвратить атрофию кости
Так как атрофия в большинстве случаев начинается после потери зуба, основной метод ее предотвращения – незамедлительное протезирование. Это можно сделать тремя способами:
Два первый метода позволяют восстановить процесс жевания и эстетику, но они не позволяют возобновить нагрузку на кость. Только корневой имплант, вживленный в твердую ткань, позволяет правильно распределять нагрузку, тем самым обеспечивая здоровье кости.
Если из-за атрофии имплантация невозможна, пациенту показано восстановление объема костной ткани. На верхней челюсти такая операция называется синус-лифтинг. Проводится методом поднятия мембраны гайморовой пазухи и введения в образовавшееся пространство специального костнозамещающего материала. Остеопластика может проводиться двумя способами – открытым и закрытым. Открытый проводится с разрезом в боковой части челюсти. При закрытом материал вводится через прокол, без разрезов и швов.
Имплантация может проводиться после стабилизации и приживления костного материала – через несколько месяцев после операции. Дополнение объема кости также может быть проведено одновременно с имплантацией.
Резорбция костной ткани
Резорбция костной ткани – это естественный процесс, который начинается с возрастом у каждого человека. В год теряется около 1-2% костной ткани, и это считается нормальным, но при сильной атрофии возможны серьезные заболевания (в частности, остеопороз). Помимо возраста, существует и целый ряд других факторов, влияющих на этот процесс. Например, в группу риска входят курящие люди, у которых риск атрофии костной ткани намного выше. Индивидуальные особенности во многом определяют и то, насколько интенсивно происходит рассасывание костной ткани челюсти.
Причины атрофии костной ткани
Главной причиной, как уже было отмечено, является отсутствие нагрузки на ткани. Они не получают давления и перестают полноценно насыщаться питательными веществами, в результате чего кость постепенно истончается. Среди других провоцирующих факторов выделяют:
Вследствие атрофии костной ткани и отсутствия зубов нарушается жевательная функция, что может привести к болезням пищеварительной системы. Происходит смещение зубов, ухудшение внешнего вида зубного ряда и нарушение дикции. В запущенных случаях внешне меняются контуры лица, кожа становится дряблой и появляются другие признаки старения.
Чтобы получить информацию о ценах и сроках лечения звоните:
или заполните форму обратной связи:
Причины резорбции
Из-за недостаточной нагрузки в местах отсутствующих зубов костная ткань начинает уменьшаться в объеме. Это особенно выражено при отсутствии фронтальных зубов, так как кость в этой области тонкая и рассасывается очень быстро. При потере других зубов процесс также необратим, если вовремя не заняться протезированием зубов. Длительное отсутствие последних зубов может не только осложнять пережевывание пищи, но и влиять на овал лица из-за сильной атрофии кости. Аналогичное можно сказать и о потере зубов в боковых отделах, из-за чего начинается провисание кожи лица. Даже установка мостов не позволяет избежать резорбции, так как десна по истечении времени начинает проседать. Более того, считается, что протезирование на мостовидных протезах только усугубляет этот процесс.
В некоторых случаях атрофия начинает прогрессировать и после установки имплантата, причем в каждом конкретном случае это индивидуально. У одних людей процесс может начаться по истечении нескольких лет, а у других – спустя месяц после выполненной процедуры. При одномоментной имплантации (вживление корня в лунку удаленного зуба) кость еще не успевает атрофироваться, поэтому с этой точки зрения экспресс-имплантация имеет принципиальное преимущество. Диагностируется резорбция с помощью ортопантомограмм и компьютерной томографии, а ее величину можно определить по глубине десневых карманов. Горизонтальная равномерная резорбция в пределах 1 мм считается нормальным явлением, но при неравномерной или вертикальной резорбции, а также глубоких десневых карманах можно говорить о неблагоприятном течении послеоперационного периода.
Причинами атрофии костной ткани могут стать несколько факторов – от непрофессионально выполненной процедуры до индивидуальных особенностей. На развитие этого процесса влияет, в частности, поверхность имплантата и негерметичность соединения между корнем и абатментом, а также появившаяся микроподвижность. Имеет значение также качество установки ортопедической конструкции и соблюдение пациентом правил гигиены полости рта. Резорбция костной ткани вокруг установленного титанового стержня может привести к таким серьезным последствиям, как потеря имплантата. В нашей клинике имплантацию выполняют опытнейшие хирурги, поэтому врачебные ошибки исключены. Однако полностью застраховаться от резорбции невозможно, поэтому после имплантации следует посещать врача для контроля состояния тканей вокруг имплантата.
Как предотвратить резорбцию костной ткани
Самым эффективным способом предотвратить рассасывание костной ткани и восстановить утраченный зуб является своевременно выполненная имплантация. В этом случае в кость вживляется искусственный корень, который и передает ей жевательную нагрузку. Однако при сильной атрофии становится проблематично установить импланты зубов нужной длины и обеспечение его стабильности. По этой причине до процедуры установки имплантата дополнительно выполняется наращивание кости для получения необходимой высоты и плотности. Выполняется это несколькими способами, один из которых – направленная регенерация тканей. Данный метод предполагает использование синтетических или природных костных материалов и специальных мембран. Для верхней челюсти выполняется синус-лифтинг, в процессе которого приподнимается гайморова пазуха и в образовавшуюся полость внедряется костный материал.
Современные подходы к диагностике и лечению остеопороза
Рисунок 1. Микроархитектоника здоровой (слева) и остеопоретической (справа) трабекулярной кости. Методы диагностики остеопороза Денситометрия. Ультразвуковая сонография. Рентгенография. Исследование биохимических маркеров костного метаболи
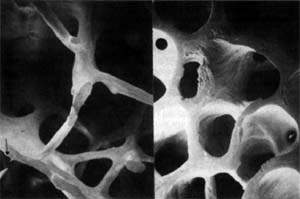 |
| Рисунок 1. Микроархитектоника здоровой (слева) и остеопоретической (справа) трабекулярной кости. |
Методы диагностики остеопороза Денситометрия. Ультразвуковая сонография. Рентгенография. Исследование биохимических маркеров костного метаболизма.
Остеопороз — это системное заболевание скелета, характеризующееся снижением костной массы и нарушением микроархитектоники костной ткани, ведущими к повышенной хрупкости костей с последующим увеличением риска их переломов (рис. 1). Помимо наиболее распространенного постменопаузального остеопороза, в настоящее время в цивилизованных странах в связи с растущей продолжительностью жизни все чаще встречается сенильный остеопороз, а также вторичный остеопороз, обусловленный различными заболеваниями (эндокринная патология, ревматические болезни, заболевания желудочно-кишечного тракта и пр.) или связанный с длительным приемом некоторых лекарственных препаратов, например кортикостероидов.
В настоящее время для диагностики остеопороза используются преимущественно неинвазивные методы, которые легковыполнимы, безопасны и могут повторяться неоднократно у одного и того же больного. К таким методам относятся рентгенографическое исследование, костная денситометрия и исследование биохимических маркеров костного метаболизма. Каждый из этих методов занимает свою нишу в диагностике заболе-вания.
С целью ранней диагностики остеопороза применяются различные технологии, объединенные под общим названием «костная денситометрия», с ее помощью можно определить минимальную плотность костной ткани (МПК), являющуюся главным критерием прочности кости. В настоящее время выделяют четыре типа и два подтипа технологий для измерения МПК:
В данном перечне отсутствует фотонная денситометрия — предшественница рентгеновской денситометрии, в последнее время используемая весьма редко.
 |
| Рисунок 2 |
Системы DXA являются наиболее изученными и широко применяются в клинической практике (рис. 2). DXA позволяет измерять МПК в центральных отделах скелета: в поясничном отделе позвоночника и в проксимальном отделе бедренной кости. В этих участках происходят наиболее тяжелые переломы. Кроме того, многие из этих приборов снабжены программой «все тело», позволяющей определить содержание минералов во всем скелете, а также исследовать мягкие ткани — мышечную и жировую. В новых модификациях приборов DXA имеется возможность латерального сканирования и морфометрического измерения позвонков,что значительно повышает информативность этого метода. Метод DXA также адаптирован для оценки состояния МПК в области периферических участков скелета, в частности в области предплечья и пяточной кости (рис. 3).
Радиографическая абсорбциометрия используется редко, поскольку требует специально оборудованного центра, где при помощи микроденситометра производится сканирование рентгеновских снимков фаланг и определяется их оптическая плотность.
 |
| Рисунок 3 |
Для определения МПК позвоночника можно использовать и QCT, которая является единственным методом, представляющим результаты исследования в трехмерном измерении. Возможность проведения измерений в поперечном сечении, заложенная в QCT, позволяет выделить этот метод среди других, так как он дает возможность дифференцированно оценивать МПК в трабекулярной и кортикальной костной ткани, фиксируя истинные значения МПК в г/см3 [1]. В отличие от DXA при QCT нет искажений МПК, связанных с тучностью пациента, а также вызванных сопутствующей патологией, например спондилоартритом и остеофитами, обызвествлением стенки аорты или участками остеосклероза, развивающимися в результате дегенеративных заболеваний или переломов позвонков. Но большие дозы облучения при QCT, а также высокая стоимость обследования ограничивают широкое применение этой технологии в диагностике остеопороза, использование ее оправданно лишь в ситуациях, требующих дифференциальной диагностики (рис. 4).
 |
| Рисунок 4 |
В последние годы активно развивается ультразвуковая сонография, которая, в отличие от рентгеновской денситометрии, позволяет обследовать другие характеристики костной ткани: SOS — скорость распространения ультразвука в кости и BUA — широковолновое рассеивание (затухание) ультразвуковой волны в исследуемом участке скелета. Эти параметры, по данным многих исследователей, отражают степень эластичности и прочности костной ткани и достаточно высоко коррелируют с МПК позвоночника и шейки бедра [2]. В настоящее время многие специалисты высказывают мнение о том, что с помощью ультразвуковой денситометрии можно предсказывать риск переломов, тем самым обосновывая ее значение как метода для скрининга. Вопрос о возможности применения этих приборов в диагностике остеопороза и оценке эффективности терапии продолжает дискутироваться.
Рентгенография довольно активно используется для диагностики остеопороза и его осложнений. Однако ее нельзя отнести к методам ранней диагностики, поскольку рентгенологические признаки остеопороза появляются тогда, когда 20 — 30% костной массы уже потеряно [3]. Наиболее сложно оценить выраженность остеопороза в позвоночнике, поскольку ни один из его рентгенологических признаков не является специфичным. Часто рентгенография позволяет выявить остеопороз лишь на поздней стадии, когда уже имеются остеопоретические переломы. Для объективной оценки степени снижения минерализации костей разработаны так называемые полуколичественные методы. В основе их лежит вычисление вертебральных, феморальных и метакарпальных индексов. Но они также не могут претендовать на достаточную точность и чувствительность при выявлении ранней стадии заболевания (остеопении), хотя успешно применяются при эпидемиологических исследованиях распространенности остеопороза в популяции [4, 5]. Таким образом, основной функцией ренгенографического метода в диагностике остеопороза является обнаружение переломов, динамическое наблюдение за появлением новых переломов и дифференциальная диагностика остеопоретических переломов от других типов деформаций позвоночника.
С помощью методов «костной денситометрии» можно судить об основных параметрах прочности костной ткани, однако эти методы не дают никакой информации об уровне костного метаболизма. Уровень формирования и резорбции костной ткани может быть оценен несколькими способами: путем измерения ферментной активности костных клеток (остеобластов и остеокластов) или определения продуктов деградации костного матрикса, которые высвобождаются в циркуляцию в процессе костного обмена (табл. 1).
Таблица 1. Биохимические маркеры костного метаболизма
маркеры
мочи
Представленные в таблице костные маркеры являются предикторами потери костной массы, переломов костей скелета и используются для мониторинга антиостеопоретической терапии. По этим биохимическим показателям можно судить об эффективности терапии, об адекватности дозы препарата и о его переносимости. Особенно полезны костные маркеры для оценки эффективности терапии в сравнительно короткие промежутки времени, когда денситометрическое исследование еще не информативно (полагают, что повторные денситометрические исследования надо выполнять не чаще одного раза в год). Уровень маркеров костного метаболизма изучался в основном у женщин постменопаузального периода. Оказалось, что уровень почти всех маркеров, за исключением IPCP, повышен и коррелирует со снижением МПК [6]. Полагают, что сочетание денситометрии и исследования биохимических маркеров костного метаболизма позволит получить более полную информацию о риске развития постменопаузального остеопороза. По мнению P. Delmas (1996) увеличение скорости костной резорбции (по оценке уровней биохимических маркеров) существенно повышает риск развития переломов независимо от исходной костной массы пациентов [7]. Это связано с тем, что хрупкость кости при остеопорозе зависит не только от МПК, но и от нарушения микроархитектоники костной ткани, выраженность которой можно оценить с помощью биохимических маркеров костной резорбции. Это предположение подтверждается данными P. Garnero et al. (1996), полученными в рамках исследования EPIDOS [6]. Доказано, что увеличение уровня СТх или свободного диоксипиридинолина на 1SD от нормы ассоциировалось с 1,3- и 1,4-кратным увеличением риска переломов шейки бедра (рис. 5).
 |
| Рисунок 5. Комбинированная оценка МПК и скрытой костной резорбции для определения риска перелома шейки бедра у пожилых. МПК определялась по критериям ВОЗ с учетом показателей ниже 2,5 SD от нормальных показателей МПК у молодых здоровых женщин (Ts core |
При этом снижение МПК шейки бедра и увеличение маркеров костной резорбции, независимо друг от друга, связаны с высоким риском переломов шейки бедра. Для оценки эффективности проводимой терапии рекомендуется исследовать биохимические маркеры через каждые три месяца после начала лечения. При исследовании биохимических маркеров необходимо принимать во внимание факторы, влияющие на воспроизводимость результатов: диета, условия хранения материала, биологические факторы (циркадные и сезонные колебания, менструальный цикл, возраст, пол, наличие сопутствующих заболеваний и т. д.).
Многолетний опыт изучения остеопороза за рубежом показывает, что ни один из существующих в настоящее время лекарственных препаратов не может надежно восстановить количество и качество кости, поэтому основной мерой в борьбе с этим заболеванием является профилактика. Профилактику остеопороза надо начинать рано и уделять особое внимание средовым факторам, влияющим на достижение пика костной массы, который наступает примерно к тридцати годам. В числе этих факторов — питание и физическая активность, адекватное поступление в организм витамина D и инсоляция. К наиболее важным периодам относятся период роста кости (юношество), беременность, лактация и перименопауза. Пик костной массы может быть значительно улучшен за счет включения в рацион продуктов с повышенным содержанием кальция (прежде всего молочные и рыбные продукты). Суточное потребление кальция должно составлять в среднем 1000 — 1500 мг, предпочтительно с пищей. Регулярные физические упражнения с весовой нагрузкой в период роста кости приводят к увеличению пика костной массы. У взрослых после достижения пика костной массы адекватное потребление кальция, постоянная физическая нагрузка и наличие регулярного менструального цикла также способствует сохранению костной массы. Профилактику остеопороза среди взрослого населения нужно проводить в «группах риска».
Проблема лечения остеопороза за рубежом изучается давно, причем особенно активно в последнее десятилетие, что связано с введением денситометрии. Однако до настоящего времени не разработаны общепринятые терапевтические программы и режимы лечения этого заболевания, что, по-видимому объясняется его многофакторной природой и сложным патогенезом. Основная цель лечебных мероприятий — сбалансирование процессов костного метаболизма и сохранение или улучшение качества жизни пациента. Для этого необходимо добиться замедления или прекращения потери костной массы; уменьшить болевой синдром в позвоночнике и периферических костях; улучшить функциональное состояние больного и предотвратить возможные падения; восстановить трудоспособность и психоэмоциональное состояние. Наряду с этиопатогенетической терапией препаратами, направленными на нормализацию процессов ремоделирования костной ткани и на сохранение минерального гомеостаза, применяется и симптоматическая терапия, включающая в себя диету с повышенным содержанием солей кальция и фосфора, нестероидные противовоспалительные средства, анальгетики, миорелаксанты, которые позволяют уменьшить болевой синдром, мышечное напряжение и тем самым расширить двигательную активность пациента и ускорить начало реабилитационных мероприятий.
Реабилитация подразумевает лечебную физкультуру, ношение корсетов, плавание, курсы легкого массажа.
Все препараты для лечения остеопороза можно разделить на три группы:
В этиопатогенетической терапии остеопороза предпочтение отдается группе препаратов, подавляющих резорбцию костной ткани, вследствие их более высокой эффективности и сравнительно небольшого побочного действия.
В целом терапия остеопороза должна быть комплексной и проводить ее следует длительно в виде непрерывного или курсового лечения. Поскольку в настоящее время нет идеального препарата для лечения остеопороза, перспективна комбинированная терапия, в которой сочетаются препараты с различным механизмом действия, что позволяет потенцировать их антиостеопоретическое действие, снизить частоту и выраженность побочных эффектов.
| Профилактика остеопороза заключается в сбалансированном питании, физической активности, и адекватном поступлении в организм витамина D |
При комбинированной терапии лекарственные средства назначают одновременно или последовательно. Их выбор осуществляется индивидуально для каждого больного в зависимости от формы остеопороза, скорости костного обмена, тяжести клинического течения, сопутствующих заболеваний. Основным критерием эффективности любого антиостеопоретического средства является снижение частоты переломов, однако в каждом конкретном случае надо ориентироваться в первую очередь на показатели МПК по данным костной денситометрии и на биохимические маркеры костного обмена. Увеличение МПК более чем на 1% и нормализация биохимических показателей, если они были изменены, свидетельствуют об эффективности проводимой терапии. Учитываться должна и положительная динамика клинической картины: уменьшение болевого синдрома, повышение функциональной активности.
Таким образом, в настоящее время имеется довольно большой выбор диагностических методов, позволяющих установить диагноз остеопороза на разных стадиях, а также эффективных лекарственных препаратов, влияющих на различные звенья патогенеза остеопороза, способных уменьшить или купировать клинически выраженные симптомы заболевания, а также предупредить развитие переломов.