Что такое ригидность мышц и тремор покоя
Симптомы и признаки болезни Паркинсона у пожилых людей
Болезнь Паркинсона является медленно прогрессирующим заболеванием нервной системы. Возникает она из-за повреждения нервных клеток, производящих дофамин — особые молекулы, которые отвечают за психоэмоциональную сферу и движение мышц.
Для болезни Паркинсона описана классическая тетрада симптомов:
Тремор
Тремором называют мелкую дрожь. Обычно он развивается одним из первых симптомов. Чаще всего первой начинает дрожать кисть одной руки. Могут присутствовать специфические движения пальцев, как будто человек катает горошину. Постепенно тремор распространяется на другую руку и на ноги. Может быть дрожание головы в вертикальном или горизонтальном направлении, типа кивков «да-да» или «нет-нет». Могут дрожать отдельно веки, нижняя челюсть. Очень редко тремор охватывает все тело.
Тремором называют мелкую дрожь. Обычно он развивается одним из первых симптомов. Чаще всего первой начинает дрожать кисть одной руки. Могут присутствовать специфические движения пальцев, как будто человек катает горошину. Постепенно тремор распространяется на другую руку и на ноги. Может быть дрожание головы в вертикальном или горизонтальном направлении, типа кивков «да-да» или «нет-нет». Могут дрожать отдельно веки, нижняя челюсть. Очень редко тремор охватывает все тело.
Для болезни Паркинсона характерен тремор в покое. Во время движения дрожь уменьшается, а во сне вообще проходит. Но бывают случаи тремора интенционного и постурального. Интенционный проявляется дрожанием, которое возникает в конечности, когда она уже заканчивает начатое движение. Когда целятся пальцем в мишень, сначала все хорошо, но чем ближе к нажатию, тем сильнее он дрожит. Постуральный тремор возникает при необходимости удерживать статичную позу, например держать руки вытянутыми.
Мышечная ригидность
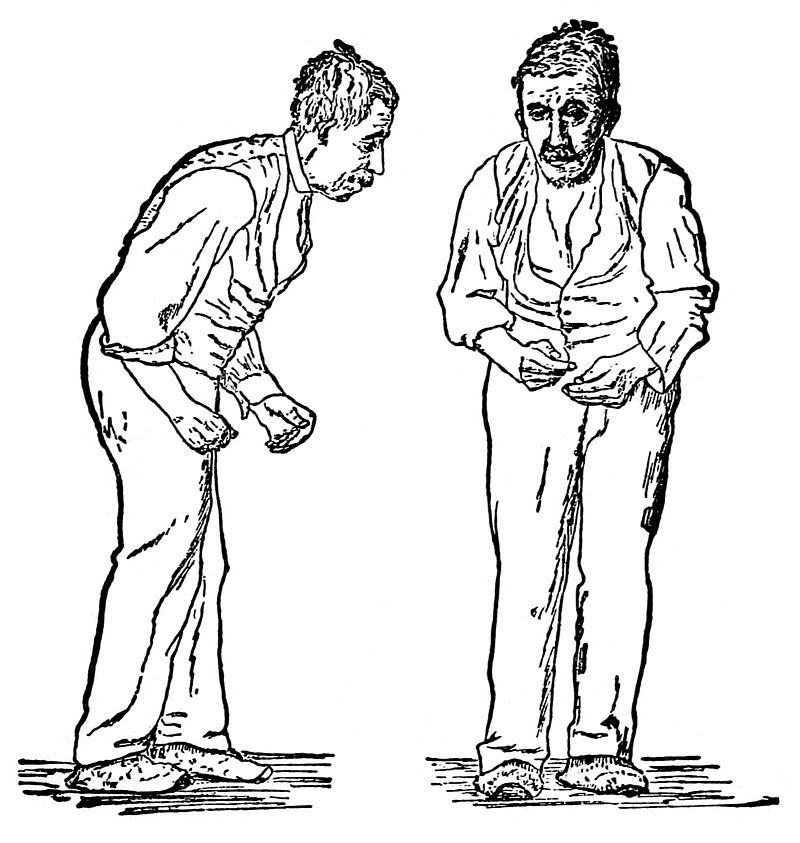
Неподатливость мышц и повышение их тонуса также являются одними из основных симптомов болезни Паркинсона. Для этого симптома даже описан собственный термин — пластичная восковая гибкость. Она характеризуется тем, что конечности и тело застывают в заданном положении. При этом страдают определенные мышцы, и их скованность приводит к формированию так называемой позы просителя. Человек сутулится, его голова наклоняется вперед, руки чуть сгибаются в локтевых суставах и прижимаются к туловищу, а ноги присгибаются в тазобедренных и коленных суставах. Если посторонний человек попробует разогнуть конечность больного, то он ощутит такие ступенчатые движения, которые характерны для шестеренок в механизмах. Явление также получило свое название — симптом зубчатого колеса. Мышцы теряют способность возвращаться в исходное положение после выполнения действия. Поэтому больные могут на некоторое время застывать в разных позах.
Гипокинезия
Гипокинезия — это снижение двигательной активности. Характерна общая скованность движений. Для того чтобы совершить какой-либо жест, больной должен приложить усилия. Внешне это выглядит так, как будто движения совершаются после паузы, они медленные.
Меняется походка человека. Он передвигается мелкими семенящими шагами, стопы при этом располагаются параллельно друг другу. Руки не движутся в такт ходьбе, а прижаты к туловищу. Страдает мимика. Лицо становится неподвижным и бесстрастным. Отображение эмоциональных реакций запаздывает. Такие люди даже моргают редко. Меняется голос, он становится монотонным и тусклым. Если человек произносит длинное предложение или фразу, они к концу затухают.
Постуральная неустойчивость
Нарушение фиксации позы может возникать еще на ранних этапах, например больные не могут держать руки, вытянутые вперед. Но это не такие серьезные отклонения, чтобы на них обращали внимание и пациенты, и врачи. А вот ближе к поздним стадиям заболевания начинаются серьезные проблемы. Например, отмечаются сложности с началом движения и его прекращением, как бы трудно побороть инерцию покоя и движения. Во время движения тело наклоняется по ходу инерции, в частности при движении вперед оно наклоняется и как бы опережает ноги. Это нарушает центр тяжести и приводит к частым падениям и травмам.
Другие симптомы болезни Паркинсона
Помимо нарушения движений, при болезни Паркинсона может отмечаться масса других симптомов, некоторые из них приводят к дезадаптации и инвалидизации:
Без лечения симптомы болезни Паркинсона неуклонно прогрессируют, и уже через 15 лет от начала заболевания около 90 % пациентов имеют инвалидность. Но современные методы терапии (медикаментозной и хирургической) позволяют держать ситуацию под контролем, увеличить продолжительность жизни и повысить ее качество у людей с такими проблемами.
Адрес пансионата: Санкт-Петербург, п. Парголово, ул. Ломоносова, д. 30, Лит. Б.
Мышечная ригидность
Мышечная ригидность представляет собой повышенный тонус мышц, затрудняющий их подвижность. Она часто развивается после чрезмерных физических нагрузок. В тканях накапливается молочная кислота и другие конечные продукты обмена веществ, которые вызывают ригидность.
Причины
Врачи Юсуповской больницы выявляют причину мышечной ригидности и применяют инновационные методики лечения заболеваний центральной и периферической нервной системы, экстрапирамидных нарушений, проявлением которых является ригидность мышц. Мышечная ригидность, или мышечное напряжение, в частности, является симптомом болезни Паркинсона.
Симптомы
Вначале мышечная ригидность характеризуется лёгким дискомфортом, небольшой скованности мышц в области головы и спины. Со временем напряженность становится сильнее и распространяется на мышцы верхних и нижних конечностей. В руках и ногах появляются болезненные спазмы. Ощущение вязкого, воскообразного сопротивления в конечностях появляется даже в состоянии покоя.
При сильных эмоциональных нагрузках, стрессовой ситуации, во время активного движения мышечная напряжённость усиливается. Человек старается совершать как можно меньше движений. Обострение может длиться несколько дней. У пациента развивается нарушения сна, он жалуется на периодические пробуждения во время ночного отдыха.
Мышечная ригидность лица является одним из симптомов столбняка. При ригидности мышц шеи пациенты предъявляют жалобы на сильную боль области затылка. Она усиливается и приобретает пульсирующий характер при движении шеи, повороте головы. Мышечная ригидность может развиться после приёма ядов.
Мышечная ригидность ног – это проявление болезни Паркинсона. Скованность и повышенный тонус врачи Юсуповской больницы наблюдают во всех группах мышц, особенно сгибателей. У пациентов меняется походка, часто происходит искривление поясничного отдела позвоночника, развивается поясничный лордоз. Они приобретают характерную позу «просителя» – голова и спина наклоняются впёред, руки плотно прижаты к телу и согнуты в локтях. Нижние конечности также немного согнуты в коленных и тазобедренных суставах.
Лечение
Врачи Юсуповской больницы лечат пациентов, у которых выявлена ригидность мышц, после выяснения её причины. Для этого неврологи проводят обследование на современных аппаратах ведущих американских и европейских фирм. Врачи выполняют лабораторные исследования с применением современных реагентов, обладающих высокой чувствительность. Для выяснения причины мышечной ригидности используют инновационные диагностические методики.
При патологии центральной и периферической нервной системы, паркинсонизме проводят лечение этих заболеваний. Врачи индивидуально подходят к лечению каждого пациента. Терапия зависит от заболевания, его тяжести, общего состояния пациента и сопутствующей патологии.
В случае ригидности мышц конечностей, развившейся в связи с чрезмерной нагрузкой или травмой, пациенту рекомендуют обеспечить покой повреждённому участку тела, при необходимости выполняют иммобилизацию. В остром периоде травматического повреждения конечности необходимо отказаться от любых нагрузок, не поднимать и не переносить тяжестей.
При лёгких формах мышечной ригидности реабилитологи Юсуповской больницы выполняют локальный или общий массаж, проводят прогревающие физиотерапевтические процедуры, индивидуально подбирают комплекс расслабляющих упражнений ЛФК. В случае более тяжёлых форм ригидности мышц применяют коротковолновую диатермию, гидротерапию, используют восковые ванны и горячее обёртывание.
При сильных болях ставят инъекции ненаркотических анальгетиков. В случае воспалительной природы мышечной ригидности назначают нестероидные противовоспалительные препараты, миорелаксанты, витамины группы В.
При наличии показаний пациенты принимают противоэпилептические препараты. В Юсуповской больнице пациентам с тяжёлыми формами мышечной ригидности выполняют плазмаферез, мануальную терапию, рефлексотерапию. Эффективным методом лечения является лазерная терапия. Местно используют согревающие и обезболивающие гели и мази.
Если у вас или ваших родных появились симптомы мышечной ригидности, не откладывайте визита к врачу. Позвоните по телефону и запишитесь на приём к неврологу Юсуповской больницы. После проведенного обследования и выяснения причины повышения тонуса мышц врач назначит индивидуальное лечение.
Что такое ригидность мышц и тремор покоя
1 Российская медицинская академия последипломного образования;
2 Центр экстрапирамидных заболеваний (Москва);
3 Кабинет экстрапирамидных расстройств Приморской краевой клинической больницы №1 (Владивосток)
Болезнь Паркинсона (БП) – прогрессирующее нейродегенеративное заболевание, характеризующееся сочетанием гипокинезии с мышечной ригидностью и/или тремором покоя, а также с позднее развивающейся постуральной неустойчивостью и широким спектром немоторных нарушений, включая вегетативные, психические, диссомнические и сенсорные симптомы. В качестве основного звена патогенеза БП рассматривается формирование нейротоксических агрегатов небольшого пресинаптического белка альфа-синуклеина (основного компонента телец Леви) сопровождающееся гибелью пигментированных нейронов вентролатеральных отделов компактной части черной субстанции. Однако в последние годы установлено, что с поражением черной субстанции коррелируют лишь основные двигательные симптомы паркинсонизма, в то же время дегенеративный процесс при БП вовлекает и другие группы нейронов в различных зонах головного мозга, а также и в периферической нервной системе, что лежит в основе многочисленных немоторных проявлений болезни [1, 3].
Эпидемиология
По данным сплошного популяционного исследования, распространенность БП в России составляет 139 случаев на 100 000 населения, заболеваемость БП – 16 случаев на 100 000 населения в год. С увеличением возраста риск БП увеличивается, и выявляемость БП среди лиц старше 65 лет составляет уже около 1%. Большинство случаев заболевания возникают в возрасте 60–70 лет. Однако в 15% случаев БП дебютирует в возрасте до 45 лет.
Исходя из имеющихся данных и половозрастной структуры населения России, можно примерно оценить общую численность больных с БП в нашей стране в 210 тысяч, при этом ежегодно заболевание возникает примерно у 20 тысяч пациентов. Ориентировочные расчеты показывают, что, как минимум, четверть пациентов (то есть более 50 тысяч) оказываются вне сферы медицинской помощи, причем в большинстве своем это пациенты с ранней стадией заболевания [3].
Диагностика
Диагноз БП проводится в 2 этапа. На первом (синдромальном) этапе синдром паркинсонизма требуется отличить от других состояний, имитирующих его (таблица 1).
Таблица 1. Состояния, требующие дифференциальной диагностики с паркинсонизмом.
| При наличии тремора | В отсутствие тремора |
| Усиленный физиологический тремор Гепатолентикулярная дегенерации | Апатико-абулический синдром Деменция с феноменом паратонии (противодержания) Кататония |
Ключевое значение в дифференциальной диагностике имеет выявление признаков гипокинезии. Начальные симптомы гипокинезии могут характеризоваться затруднениями при письме, нажатии кнопок на пульте, чистке зубов, печатании на клавиатуре, доставании мелких предметов, например, монет из сумки или кармана, надевании тапочек и т.д. Иногда уже на ранней стадии проявляется слабость и отставание одной из ног при ходьбе с изменением привычного рисунка походки. Характерно ослабление содружественных движений рук при ходьбе (ахейрокинез), нарушение подзарядки часов («симптом ролекса»). Могут обратить внимание ослабление голоса, замедление, ослабление интонирования или нечеткость речи (особенно при быстром произнесении морфологически сложных слов). При осмотре для выявления гипокинезии пациента просят выполнить определённые движения в течение примерно 20 секунд в максимально быстром темпе и с максимальной амплитудой. При этом врачу следует обращать внимание на замедленную инициацию движения, асимметрию движений, но главное – на особую форму истощаемости движений (декремент), которые по мере повторения все более замедляются, уменьшаются по амплитуде, требуют от пациента все больших усилий. Феномен истощаемости может выявляться при всех оцениваемых движениях, но иногда отмечается только в одном из тестов. Следует учитывать, что замедленность и неловкость движений, характерные для пациентов с паркинсонизмом, на ранней стадии можно спутать с проявлениями пирамидной и мозжечковой недостаточности, а также тяжелой депрессии, однако для этих состояний не характерен декремент движений по мере их повторения. Следует учитывать, что гипокинезию бывает трудно выявить на фоне грубого тремора в конечности, однако и в этом случае важно не пропустить диагностически значимый феномен: при паркинсонизме после выполнения теста на гипокинезию пациент часто держит руку в фиксированной напряженной позе и не способен быстро расслабиться.
Ригидность мышц проявляется устойчивым (в отличие от спастичности) сопротивлением пассивным движениям в лучезапястных, локтевых, плечевых, коленных суставах, а также в шее, а субъективно – скованностью и неприятными болезненными ощущениями в конечностях. У части пациентов при проверке тонуса выявляется феномен «зубчатого колеса». Следует отличать ригидность от феномена противодержания (gegenhalten), характерного для пациентов с деменцией и поражением лобных долей. Противодержание быстро меняется в зависимости от направления и скорости пассивного движения.
Медленный (3–4 Гц) тремор покоя в одной руке или ноге – одно из частых начальных проявлений паркинсонизма. Наличие классического тремора покоя по типу «скатывания пилюль» или «счета монет» наиболее характерно для БП. Для выявления латентного тремора пациента просят совершать движения другой рукой, походить, выполнить задачу на отвлечение (например, отнимать от 100 по 7). Для выявления тремора в ноге нужно осмотреть пациента в положении сидя или лежа. Вместе с тем, в отсутствие гипокинезии тремор покоя не позволяет диагностировать ни паркинсонизм, ни БП. Следует учитывать, что, с одной стороны, в покое может наблюдаться эссенциальный и дистонический тремор, с другой стороны, при БП часто наблюдается постуральный и кинетический тремор.
Начальным проявлением БП, особенно у лиц молодого возраста, может быть дистония стопы, появляющаяся или усиливающаяся при ходьбе, значительно реже – дистония иной локализации.
Ранние немоторные нарушения. Начиная с самой ранней (продромальной) стадии заболевания пациента могут беспокоить эмоциональная угнетенность, повышенная раздражительность, быстрая утомляемость или ощущение постоянной усталости, а также такие вегетативные нарушения, как расстройства потоотделения («дефектный термостат»), например, профузное потоотделение в холодную погоду, а также склонность к запорам, учащенные и/или императивные мочеиспускания, усиленное слюнотечение в ночное время (симптом «мокрой подушки»), эректильная дисфункция. Гипоосмия часто возникает уже на премоторной стадии БП, однако редко привлекает внимание самого пациента, и для ее выявления необходимо формализованное исследование (с помощью специальных методик, например, обонятельного теста Пенсильванского университета – UPSIT). Важное диагностическое значение может иметь выявление признаков синдрома нарушения поведения во сне с быстрыми движениями глаз (тревожные сновидения, вокализации, сноговорение, движения, отражающие содержание сновидений), которые могут опережать другие проявления заболевания на многие годы. Указанные немоторные проявления могут повышать точность диагноза, основывающегося на ранних моторных симптомах болезни.
Дебютными проявлениями БП бывают также хронические болевые синдромы, чаще всего в спине и плечелопаточной области, связанные с повышенным мышечным тонусом, ограничением мобильности и постуральными нарушениями.
Уже на ранней стадии могут выявляться признаки умеренного когнитивного расстройства, в частности неустойчивость внимания и замедленность мышления, трудности поиска слов (феномен «кончика языка»).
«Красные флажки». Второй этап – этап нозологической диагностики – сводится к дифференциальной диагностике БП с другими нозологическими формами паркинсонизма. Он требует клинической оценки анамнестических данных и данных, выявляемых при неврологическом осмотре. Важное значение имеет выяснение лекарственного анамнеза. Такие препараты, как метоклопрамид, вальпроат натрия, циннаризин, амиодарон, могут быть причиной лекарственного паркинсонизма. Отмена препарата, спровоцировавшего развитие паркинсонизма, может не приводить к немедленному регрессу симптомов. Иногда после отмены «виновного» препарата и кратковременного улучшения состояние вновь ухудшается, что указывает на скрыто развивающийся дегенеративный процесс, который был «демаскирован» побочным действием лекарственных средств.
При неврологическом осмотре могут выявляться симптомы, атипичные для БП, требующие исключения иных заболеваний, вызывающих синдром паркинсонизма. Среди них можно выделить: симметричность, быстрое прогрессирование симптоматики с ранней утратой способности к передвижению в течние 5 лет, раннее развитие постуральной неустойчивости с падениями, отсутствие стойкого положительного эффекта адекватных доз препаратов леводопы, раннее развитие вегетативной недостаточности, быстрое присоединение деменции (в течении 1-го года), ограничение подвижности глазных яблок (особенно парез взора вниз), раннее развитие тяжелых псевдобульбарных синдромов, аксиальная дистония, пирамидные и мозжечковые знаки, наличие очаговых нарушений корковых функций.
Дополнительные методы исследования
В настоящий момент нет методов лабораторного или инструментального исследования, которые были бы обязательны у каждого пациента с подозрением на БП. В последние годы больным с БП часто проводят КТ или МРТ головного мозга, однако чаще всего в этом нет необходимости, и в большинстве случаев диагноз может быть установлен на основе клинических данных. Тем не менее, если клиническая картина у больного с синдромом паркинсонизма отклоняется от классического варианта, свойственного БП, в частности, отсутствует типичная реакция на дофаминергические средства, – необходимо проведение нейровизуализации.
При начале заболевания до 50 лет важно исключить гепатолентикулярную дегенерацию, о которой могут свидетельствовать роговичное кольцо Кайзера–Флейшера, низкий уровень церулоплазмина, повышение интенсивности сигнала от базальных ганглиев и мозжечка на Т2-взвешенных МРТ изображениях, повышенная экскреция меди с мочой.
Диагностическую значимость может иметь и транскраниальная сонография глубинных структур мозга, выявляющее при БП гиперэхогенные изменения в проекции черной субстанции, связанные с накоплением железа и установленные в 92% случаев клинически вероятной БП, однако его результаты можно интерпретировать лишь в клиническом контексте.
Из практически важных, но пока отсутствующих в нашей стране, методов диагностики следует упомянуть позитронно-эмиссионную томографию (ПЭТ) и однофотонную эмиссионную компьютерную томографию (ОФЭКТ), позволяющие изучить синаптическую передачу на всех уровнях, а также проводить мониторинг патологического процесса. При выявлении снижение накопления F18-флюородопы при ПЭТ и β-CIT при ОФЭКТ в полосатом теле можно говорить о вовлечении в патологический процесс пресинаптических нигростриарных терминалей (первичный паркинсонизм). Определение снижение накопления 11С-раклоприда (лиганд D2рецепторов) при ПЭТ будет указывать на уменьшение количества дофаминовых рецепторов в полосатом теле (паркинсонизм «плюс»).
Общие принципы начала лечения
Поскольку на данный момент способность замедлять процесс дегенерации за счет нейропротективного эффекта (возможность защищать интактные клетки от повреждения) или нейрорепаративного эффекта (возможность восстанавливать активность частично поврежденных клеток) ни у одного из применяющихся средств убедительно не доказана, лечение основывается пока на симптоматическом действии. Тем не менее потенциальная возможность нейропротективного эффекта, подтверждаемая экспериментальными или клиническими данными, должна учитываться при назначении лечения.
В настоящее время широкое распространение получила концепция, подчеркивающая важность раннего назначения дофаминергической терапии – немедленно после установления диагноза – с тем, чтобы быстрее скорректировать нейрохимический дисбаланс в мозге и поддержать процессы компенсации.
Если ранее подчеркивалась необходимость возможно более длительного сохранения монотерапии, то в настоящее время преимущества такого подхода не представляются очевидными – по сравнению с ранним переходом к комбинации средств с разным механизмом действия. Вопрос о необходимости монотерапии или комбинированной терапии должен решаться индивидуально. В любом случае при выборе препаратов и их дозы следует стремиться не к полному устранению симптомов, а к существенному улучшению функций, позволяющему поддерживать бытовую и профессиональную активность. В то же время следует избегать внесения в схему лечения сразу нескольких изменений (например, повышения дозы сразу нескольких средств или добавления сразу нескольких препаратов), это позволяет оценить отдельно эффективность и безопасность каждого из назначаемых средств.
Принципы выбора противопаркинсонического препарата
Выбор препарата на начальном этапе лечения проводят с учетом возраста, выраженности двигательного дефекта, трудового статуса, состояния нейропсихологических функций, наличия сопутствующих соматических заболеваний, индивидуальной чувствительности пациента. Помимо достижения оптимального симптоматического контроля, выбор препарата определяется необходимостью отсрочить момент развития моторных флуктуаций и дискинезий (таблица 2).
Таблица 2. Выбор препарата для начального лечения болезни Паркинсона.
| Препараты | Возможность использования в качестве средства первого выбора | Степень симптоматического улучшения | Нейро-протективный потенциал | Риск побочного действия | |
| Флуктуации и дискинезии | Другие побочные эффекты | ||||
| Леводопа | + | +++ | +? | ↑ | ↑ |
| Агонисты дофаминовых рецепторов | + | ++ | +? | ↓ | ↑ |
| Ингибитор МАО В | + | + | +? | ↓ | ↑ |
| Амантадин | + | + | +? | ↓ | ↑ |
| Холинолитики | — | + | — | ? | ↑ |
У лиц моложе 50 лет при легкой или умеренной выраженности двигательных нарушений в отсутствие выраженных когнитивных нарушений назначают один из следующих препаратов: агонист дофаминовых рецепторов, ингибитор моноаминооксидазы типа В, амантадин. При более легком двигательном дефекте может быть назначен ингибитор МАО В, при более выраженном дефекте предпочтительнее начинать с лечения с одного из агонистов дофаминовых рецепторов. Неэрголиновые агонисты (например, прамипексол, ропинирол, ротиготин или проноран) ввиду более благоприятного профиля побочных эффектов предпочтительнее, чем эрголиновые (бромокриптин, каберголин). При недостаточной эффективности или плохой переносимости одного из агонистов дофаминовых рецепторов может быть испробован другой агонист дофаминовых рецепторов или препарат другой фармакологической группы. Рациональна комбинация агониста дофаминовых рецепторов, ингибитора МАО типа В и амантадина, к которой следует переходить постепенно, добавляя препарат новой группы, если ранее назначенное средство не обеспечило ожидаемого эффекта.
Антихолинергические средства (например, бипериден) показаны при наличии выраженного тремора покоя либо болезненной дистонии при условии сохранности нейропсихологических функций. Их целесообразно добавлять к комбинации агониста дофаминовых рецепторов с ингибитором МАО В и/или амантадином, если она у пациента относительно молодого возраста не обеспечила подавления тремора в той степени, в которой это необходимо для поддержания его трудоспособности.
Если указанные препараты в максимально переносимых дозах и их комбинация не обеспечивают адекватного состояния двигательных функций и социальной адаптации больных, назначают препарат леводопы в минимальной эффективной дозе [4].
У лиц в возрасте 50–70 лет при умеренном двигательном дефекте и относительной сохранности когнитивных функций лечение начинают с ингибитора МАО типа В (при легких симптомах паркинсонизма) или одного из агонистов дофаминовых рецепторов. В дальнейшем целесообразен постепенный переход к комбинации агониста дофаминовых рецепторов, ингибитора МАО типа В и амантадина (при условии хорошей переносимости). Больным после 60 лет антихолинергические средства, как правило, не следует назначать из-за риска ухудшения познавательных функций и других побочных эффектов. При недостаточной эффективности комбинации указанных выше препаратов добавляют препарат леводопы в минимальной эффективной дозе (200–400 мг в сутки).
У лиц в возрасте 50–70 лет при выраженном двигательном дефекте, ограничивающем трудоспособность и(или) возможность самообслуживания, а также при наличии выраженных когнитивных нарушений и необходимости получения быстрого эффекта лечение начинают с препаратов, содержащих леводопу. Если небольшие или средние дозы леводопы (300–500 мг леводопы в сутки) не обеспечивают необходимого улучшения, к ним последовательно могут быть добавлены агонист дофаминовых рецепторов, амантадин и ингибитор МАО В.
У пожилых лиц (старше 70 лет), особенно при наличии выраженного когнитивного снижения и соматической отягощенности, лечение следует начинать с препаратов леводопы. Указанные возрастные границы относительны, и общий принцип скорее заключается в том, что чем моложе больной, тем позже следует вводить препараты леводопы. Кроме того, решающее значение играет не столько хронологический, сколько биологический возраст больных.
Применение препарата прамипексола с длительным высвобождением на ранней стадии БП
Разработка новых лекарственных форм противопаркинсонических препаратов, обеспечивающих их длительное высвобождение и допускающих однократный прием в течение дня, не просто делает лечение более удобным, но и, улучшая приверженность пациентов лечению, повышает долгосрочную эффективность терапии. Кроме того, при медленном высвобождении препарата в течение суток достигается более стабильная его концентрация в крови, что может обеспечить его лучшую переносимость и эффективный контроль симптомов заболевания в течение всего дня (как в дневное, так и в ночное время).
Новая лекарственная форма прамипексола с длительным (контролируемым) высвобождением, предполагающая однократный прием в течение дня, применяется в европейских странах и США с 2009 года, а в нашей стране – с 2012 года. Она представляет собой матриксную таблетку, в которой активное вещество равномерно распределено в полимерном матриксе. В желудочно-кишечном тракте матрикс впитывает жидкость и превращается в гель, который равномерно высвобождает прамипексол в течение 24 ч. Поскольку прамипексол хорошо растворяется в жидкой среде, независимо от ее pH, активное вещество высвобождается из матрикса и всасывается на протяжении всего кишечника. Скорость опорожнения желудка и моторика кишечника не оказывают существенного влияния на действие препарата. Параметры всасывания не зависят также от того, принимается препарат натощак или после еды [2].
При разработке новой лекарственной формы была учтена возможность простого, одномоментного перехода от традиционной формы препарата к новой. Условием этого является то, что равные суточные дозы препарата с немедленным высвобождением (принимаемым 3 раза в день) и длительным высвобождение (принимаемым 1 раз в день) оказывают одинаковое противопаркинсоническое действие. Различие между новой и традиционной лекарственными формами прамипексола заключается лишь в скорости высвобождения активного вещества. Период полужизни прамипексола при применении обеих форм один и тот же, но благодаря контролируемому высвобождению обеспечивается более длительное поддержание терапевтической концентрации препарата в крови [5].
Эквивалентность действия равных суточных доз препаратов прамипексола с немедленным и длительным высвобождением была подтверждена в целом ряде клинических испытаний.
Следует подчеркнуть особое удобство новой лекарственной формы прамипексола, которую достаточно принимать один раз в день, для пациентов с ранней стадией БП, продолжающих работать. Во избежание побочного действия препарат назначается путем медленного титрования – по той же схеме, что и препарат с немедленным высвобождением. Для этого таблетки прамипексола с длительным высвобождением выпускаются в нескольких дозировках: 0,375, 0,75, 1,5, 3 и 4,5 мг. Лечение начинают с дозы 0,375 мг 1 раз в день, далее при условии хорошей переносимости каждые 7 дней переходят на следующий уровень дозы до достижения оптимального эффекта, максимально до 4,5 мг/сут (таблица 3). После достижения дозы 1,5 мг/сут титрование иногда целесообразно проводить медленнее, так как развитие полного лечебного эффекта может требовать нескольких недель. Рекомендуемая доза для поддерживающей терапии (как на ранней, так и на развернутой или поздней стадиях заболевания) может колебаться от 0,375 до 4,5 мг/сут. Наиболее часто применяемая доза – 3 мг/сут.
Таблица 3. Схема титрования прамипексола с длительным высвобождением.
| Неделя | Доза |
| 1-я | 0,375 мг 1 раз в день |
| 2-я | 0,75 мг 1 раз в день |
| 3-я | 1,5 мг 1 раз в день |
| 4-я | 2,25 мг 1 раз в день |
| 5-я | 3 мг 1 раз в день |
| 6-я | 3,75 мг 1 раз в день |
| 7-я | 4,5 мг 1 раз в день |
Лекарственные средства, эффективность которых при БП не доказана
В клинической практике широко применяют лекарственные средства, эффективность которых при БП не доказана и которые, следовательно, не могут быть рекомендованы к применению при этом заболевании. Прежде всего, к ним относятся так называемые ноотропные, нейрометаболические и вазоактивные препараты. Возможно, некоторые из этих средств оказывают определенное лечебное действие, но прежде, чем рекомендовать конкретный препарат, следует провести адекватную оценку его эффективности. Специалисты, занимающиеся лечением БП, прекрасно знают, что определенная часть больных хорошо реагирует на плацебо, причем этот эффект оказывается нестойким. Соответственно, затраты на подобное лечение оказываются бессмысленными.