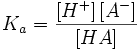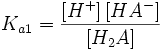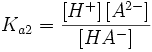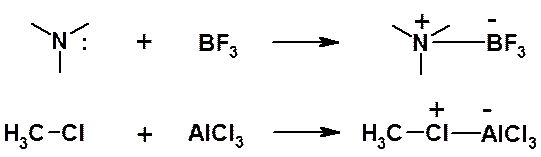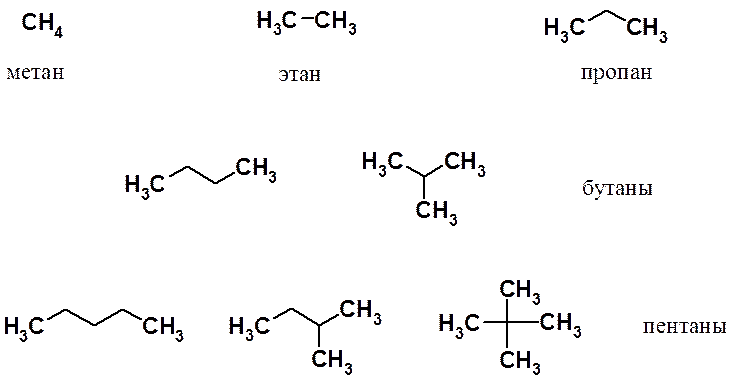Что такое рка в химии
Константа кислотности
Константа диссоциации кислоты (Ka) — константа равновесия реакции диссоциации кислоты на ион водорода и анион кислотного остатка. Для многоосновных кислот, диссоциация которых проходит в несколько стадий, оперируют отдельными константами для разных стадий диссоциации, обозначая их как Ka1, Ka2 и т. д.
Содержание
Примеры расчета
(A — условное обозначение аниона кислоты, [HA] — равновесная концентрация в растворе частицы НА):
Одноосновная кислота
HA = H + + A −
Двухосновная кислота
H2A = H + + HA −
HA − = H + + A 2 −
Следует понимать, что фигурирующая в выражениях концентрация HA — это равновесная концентрация недиссоциировавшей кислоты, а не изначальная концентрация кислоты до её диссоциации.
Величина pK
См. также
Полезное
Смотреть что такое «Константа кислотности» в других словарях:
константа кислотности — (константа диссоциации кислоты) – константа равновесия Ка, характеризующая степень переноса протона от кислоты к воде как к растворителю. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
константа кислотности — rūgštingumo konstanta statusas T sritis Standartizacija ir metrologija apibrėžtis Rūgšties protolizės pusiausvyros konstanta. atitikmenys: angl. acidity constant vok. Aziditätskonstante, f rus. константа кислотности, f pranc. constante d’acidité … Penkiakalbis aiškinamasis metrologijos terminų žodynas
константа кислотности — rūgštingumo konstanta statusas T sritis chemija apibrėžtis Rūgšties protolizės pusiausvyros konstanta. atitikmenys: angl. acidity constant rus. константа кислотности … Chemijos terminų aiškinamasis žodynas
константа диссоциации кислоты — см. константа кислотности … Химические термины
Уровень кислотности — Водородный показатель, pH (произносится «пэ аш»), это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным… … Википедия
ФУНКЦИИ КИСЛОТНОСТИ — определяют протонирую щую способность р ров к т. Если протонируется нейтральная молекула В, Ф. к. обозначают H0, если анион или катион H или … Химическая энциклопедия
Угольная кислота — Угольная кислота … Википедия
КИСЛОТЫ И ОСНОВАНИЯ — Термины кислоты и основания вполне сформировались в 17 в. Их содержание неоднократно пересматривалось и дополнялось. Этот процесс происходил и происходит в острых столкновениях представителей разных взглядов на природу К. и о. Развитие взглядов… … Химическая энциклопедия
Десорбционные методы ионизации в масс-спектрометрии — Десорбционные методы ионизации в масс спектрометрии группа методов ионизации в масс спектрометрии, для которых процессы десорбции твердого анализируемого вещества и его ионизации практически неотделимы во времени. Наиболее полное развитие… … Википедия
Уравнение Бренстеда — Уравнение Бренстеда уравнение, количественно описывающее зависимость скорости катализируемых кислотами или основаниями реакций от природы кислоты. Впервые предложено в 1924 г. Бренстедом и Педерсеном. Для кислотного катализа уравнение… … Википедия
Что такое рка в химии
5. КИСЛОТНОСТЬ И ОСНОВНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
В настоящее время для оценки кислотности и основности соединений, в том числе и органических, применяют две теории: теория Бренстеда и теория Льюиса. Теория Бренстеда (1923 г.) является протолитической или протонной теорией кислот и оснований, а теория Льюиса (1925 г.) – апротонной или электронной теорией кислот и оснований.
КИСЛОТНОСТЬ И ОСНОВНОСТЬ ПО БРЕНСТЕДУ
Согласно теории Бренстеда, кислотой называют соединение, способное отдавать протон, т. е. кислота – донор протона, а основание – соединение, способное присоединять протон, т. е. основание является акцептором протона.
Теория Бренстеда называется протонной или протолитической теорией кислот и оснований, так как определения кислота и основание взаимосвязаны между собой процессом присоединения и отщепления протона.
Кислотно-основный процесс, согласно теории Бренстеда, может быть представлен следующей схемой:
Кислота А–Н, теряя протон, превращается при этом в основание АӨ, которое называется сопряженным основанием данной кислоты. Основание же В, присоединяя протон за счет неподеленной пары электронов, превращается в кислоту ВН+, которая является сопряженной данному основанию.
Таким образом, кислота А–Н и сопряженное основание АӨ, основание В и сопряженная кислота ВН+ образуют две сопряженные кислотно-основные пары.
Кислотность и основность соединений – понятия относительные. Эти два свойства неразрывно связаны между собой и проявляются одновременно, т. е. если одно соединение в данной реакции выступает в роли кислоты, то другое обязательно – в роли основания. Определенное соединение может быть кислотой по отношению к одному веществу и основанием по отношению к другому. Относительность этих понятии становится очевидной при рассмотрении конкретного примера.
Уксусная кислота, которая в воде проявляет кислотные свойства, в безводной серной кислоте ведет себя как основание.
Количественно силу кислот и оснований можно выразить с помощью константы равновесия данной реакции. Величину константы равновесия чаше всего определяют в водной среде. Для реакции:
Учитывая то, что вода в данной реакции выступает в роли растворителя, т. е. концентрация ее практически не изменяется (55,6 моль·л-1), концентрацией воды можно пренебречь. В данном случае константу равновесия называют константой кислотности или константой диссоциации К и выражают формулой:
Любая протолитическая реакция обратима и характеризуется константой диссоциации.
Большинство органических соединений, проявляющих кислотные свойства, в водной среде являются слабыми кислотами, константы которых выражаются малыми величинами. Например, Кa уксусной кислоты при 25°С равна 1,76·10-5. Оперировать такими малыми величинами в практической работе не удобно, поэтому используют значения рКa – показатель константы – отрицательный логарифм константы диссоциации: рКa = – lgKa (например: рКa для СН3СООН равняется 4,75).
Рассматривая зависимость между значениями величин Кa, рКa и силой кислоты, следует отметить одну закономерность: чем больше величина Кa (константа кислотности), тем сильнее кислота, чем больше величина рКa, тем кислота слабее.
Подобно кислотам силу оснований иногда выражают величиной Кb (константа основности), характеризующей легкость, с которой основание отрывает протон от воды:
Для удобства пользуются величиной рКb
При этом, чем меньше рКb, тем сильнее соответствующее основание. Однако намного удобнее выражать степень ионизации кислот и оснований в одной шкале (в шкале рКb) подобно тому, как значение рН одинаково хорошо характеризует и кислотность, и основность. Для основания величина рКa обычно означает кислотность сопряженной кислоты – протонной формы основания рК+вн. Сопряженная кислота в виде R–NH3 отдавая протон, превращается в основание R–NH4+.
Типы органических кислот
В зависимости от природы элемента, который связан с атомом водорода, кислоты разделяют на четыре основные группы:
Наряду с указанными типами кислот известны кислоты: Si-H, Р–Н, As–H, т. е. кислотой может быть любое соединение, содержащее связь А–Н и способное к отщеплению протона. Теория Бренстеда применима к любым типам кислот, способным к диссоциации с разрывом связи элемент–водород.
Кислотность соединений в основном определяется устойчивостью образующегося аниона, которая обусловлена делокализацией (распределением) отрицательного заряда.
Чем устойчивее сопряженное основание, тем сильнее кислота. Устойчивость аниона определяется следующими факторами: природой атома, связанного с атомом водорода (реакционный и кислотный центр); электронодонорными или электроноакцепторными свойствами заместителя, связанного с реакционным центром, и природой растворителя.
При равных других факторах устойчивость анионов, а следовательно, и кислотность возрастают с увеличением электроотрицательности и поляризуемости атомов кислотного центра. С увеличением электроотрицательности увеличивается сила, с которой атом может удержать пару электронов после отщепления водорода. Поскольку в пределах периода периодической системы электроотрицательность атомов возрастает слева направо (поляризуемость не меняется), то ОН-кислоты сильнее соответствующих NH-кислот, а те, в свою очередь, сильнее СН-кислот, например:
В пределах группы периодической системы электроотрицательность атомов уменьшается сверху вниз, но увеличивается их объем, а следовательно, возрастает поляризуемость, т. е. возможность делокализации внешнего электронного облака. Это способствует повышению стабильности аниона и приводит к возрастанию кислотности. Поэтому SH-кислоты обладают большей кислотностью, чем ОН-кислоты, например:
Наряду с природой кислотного центра и строением радикала, значительное влияние на проявление кислотных свойств оказывает растворитель. Наиболее эффективным растворителем является вода, она имеет высокую диэлектрическую постоянную и способна связывать катионы и анионы за счет сольватации. Эффект сольватации приводит к устойчивости образовавшегося аниона, а следовательно, кислотность соединений возрастает.
Типы органических оснований
Согласно теории Бренстеда, любое соединение, способное присоединять протон, может выступать в роли основания; это могут быть как нейтральные молекулы, так и заряженные частицы. В нейтральных молекулах для проявления основных свойств необходимо наличие атома с неподеленной парой электронов или наличие кратной связи. Основаниями могут быть анионы: алкоксид-ион ROӨ; алкилмеркаптид-ион RSӨ, карбанион R3CӨ (триалкилметанид-ион) и другие.
В n-основаниях центром основности, или центром протонирования (местом присоединения протона), чаше всего выступают такие элементы, как азот, кислород, сера. В зависимости от центра основности ониевые основания делятся на три основные группы:
Основность органических соединений в основном определяется устойчивостью образовавшегося катиона, которая обусловлена делокализацией положительного заряда.
На основность значительное влияние оказывает электроотрицательность и поляризуемость элементов, составляющих центр основности, электронодонорное или электроноакцепторное влияние радикала, связанного с центром основности, и природа растворителя.
Большая электроотрицательность атомов основного центра способствует более прочному удержанию им неподеленнои электронной пары, что характеризует меньшую основность соединения, иначе говоря. чем больше электроотрицательность атома, тем меньше основность. Таким образом, аммониевые основания проявляют более сильные основные свойства по сравнению с оксониевыми. Увеличение же поляризуемости атома приводит к уменьшению основности сопряженного основания и увеличению кислотности сопряженной кислоты. Поэтому сульфониевые основания слабее оксониевых.
Существенную роль в проявлении основных свойств играет растворитель. Эффект сольватации способствует устойчивости образовавшегося катиона, а следовательно, приводит к повышению основности.
КИСЛОТЫ И ОСНОВАНИЯ ЛЬЮИСА
Теория кислот и оснований Льюиса, в отличие от теории Бренстеда, является более обшей. Согласно этой теории основанием считается любая частица (атом, молекула или анион), способная отдавать электронную пару для образования ковалентной связи, а кислотой – любая частица (атом, молекула, катион), способная принимать пару электронов с образованием ковалентной связи.
То есть, по Льюису, основание является донором, а кислота – акцептором пары электронов. Из приведенного определения видно, что основания Льюиса тождественны основаниям Бренстеда. Однако кислоты Льюиса охватывают более широкий круг соединений.
Кислотой Льюиса считается любая частица, имеющая вакантную орбиталь.
Согласно теории Льюиса, к кислотам относятся не только соединения, отщепляющие протон (протонные кислоты), но и другие вещества, имеющие вакантную орбиталь и способные принимать пару электронов (апротонные кислоты). Кислотами Льюиса, например, являются такие соединения, как BF4, AlC13, FeCl3, SbCl3, ZnCl2, HgCl3 и др.
Кислотно-основный процесс по Льюису состоит в образовании ковалентнои связи между основанием и кислотой за счет электронной пары основания и вакантной орбитали кислоты. Так, основания Льюиса, имеющие неподеленные пары электронов, образуют с кислотами Льюиса n-комплексы:
Легкость протекания кислотно-основного взаимодействия по Льюису определяется силой кислоты и основания.
Кислотность и основность разбавленных растворов кислот и оснований
Мерой силы кислоты или основания, согласно теории Брёнстеда – Лоури является константа кислотности или основности соответственно. Поскольку наиболее распространенным растворителем является вода, измерения проводят обычно в воде. Кислота в воде отдает ей свой протон:
НХ + Н2 O ↔ Н3 O + + X –
Применяя закон действующих масс, получим:
В разбавленных растворах [Н2 O ] = const (=55,5 моль/л), поэтому можно записать
Применяя аналогичный вывод для основания, получим:
Величина Кв называется константой основности и является мерой основности относительно стандарта (в данном случае Н2O ). Аналогично величине pH константы кислотности и основности можно выразить в логарифмической форме:
Константы кислотности и основности связаны соотношением:
где Kw — константа автопротолиза растворителя (для воды — ионное произведение). Принимая во внимание ( 75 ), получаем уравнение ( 76 ) в виде:
pKw=pKa +pKв ( 77)
рКа = 14 – рКв (78)
Константы кислотности слабых кислот, нерастворимых в воде, определяют в других растворителях относительно друг друга, выстраивая таким образом единую шкалу кислотности. Полученные значения рКа носят приблизительный характер и могут быть использованы только для качественных оценок, например, данные таблицы 6-4 по константам кислотности относительно воды некоторых кислот Бренстеда.
Согласно табл. 6-4, в воде кислотами являются HCIO4, СН3СООН, основаниями — С2Н5ОН, С2Н2, NH3, С2Н4, С2Н6; в аммиаке кислоты — HCIO4, СН3СООН, С2Н5ОН, С2Н2, основания — С2Н4 и С2Н6.
Силу кислоты выражают количественно через константу кислотности:
где: Ka – константа кислотности; Kp – константа равновесия.
Кислота там сильнее, чем больше константа кислотности. Часто пользуются значениями рКа. Чем меньше величина рКа, тем сильнее кислота.
Например, рКа фенола = 10, рКа этанола = 16. Это означает, что фенол на шесть порядков (в миллион раз) более сильная кислота, чем этиловый спирт.
Основность может быть выражена через рКb.
Важно помнить, что рКа воды = 15,7. Все вещества, которые имеют рКа больше, чем вода, не способны проявлять кислые свойства в водных растворах. Вода, как более сильная кислота, подавляет диссоциацию более слабых кислот. Так как у большинства органических соединений кислотные свойства выражены во много раз слабее, чем у воды, разработан полярографический подход к оценке их кислотности (И.П. Белецкая и др.). Он позволяет оценивать кислотность до рКа = 50, хотя для очень слабых кислот значения рКа можно оценить только очень приблизительные.
Чрезвычайно важна качественная оценка кислотности как в рядах близких по строению веществ, так и для соединений различных классов. Способность кислоты отдавать протон связана со стабильностью образующегося аниона. Чем стабильнее образующийся анион, тем меньше его стремление захватить протон обратно и превратиться в нейтральную молекулу. При оценке относительной стабильности аниона надо учитывать несколько факторов.
Природа атома, отдающего протон. Атом тем легче теряет протон, чем выше его электроотрицательность и поляризуемость. Поэтому в ряду кислот способность к диссоциации уменьшается следующим образом:
Этот ряд прекрасно соответствует свойствам атомов, известным из периодической таблицы.
Влияние окружения. Если сравниваются близкие по строению вещества, оценка проводится сравнением электронной плотности на атоме, отдавшем протон. Все структурные факторы, способствующие уменьшению заряду, стабилизирует анион, а увеличению заряда – дестабилизируют. Таким образом, все акцепторы увеличивают кислотность, все доноры – уменьшают.
Это происходит независимо от того, за счет какого эффекта передачи электронов (индуктивного или мезомерного) происходит перераспределение электронной плотности.
Сольватационный эффект. Сольватация (взаимодействие с молекулами растворителя) повышает стабильность аниона за счет перераспределения избытка электронной плотности между анионом и молекулами растворителя. В общем случае закономерность следующая:
· чем полярнее растворитель, тем сильнее сольватация;
· чем меньше ион, тем лучше он сольватируется.
Основность по Брёнстеду – способность вещества предоставить свою пару электронов для взаимодействия с протоном. Как правило, это вещества, содержащие в молекуле атомы азота, кислорода и серы.
Чем слабее основный центр удерживает пару электронов, тем выше основность. В ряду
основность уменьшается. Эту последовательность легко запомнить, используя мнемоническое правило “NOS”.
Среди оснований Брёнстеда существует зависимость: анионы более сильные основания, чем соответствующие нейтральные молекулы. Например, гидроксид-анион ( – ОН) более сильное основание, чем вода (Н2О). При взаимодействии основания с протоном могут образовываться ониевые катионы:
Качественная оценка основности у близких по строению веществ проводится с использованием той же логики, что и оценка кислотности, но с обратным знаком.
Поэтому все акцепторные заместители основностьи уменьшают, все донорные – увеличивают.
Кислоты и основания по Льюису
Основания по Льюису – доноры электронной пары, как и основания по Брёнстеду.
Часто в реакциях с кислотами Льюиса в качестве оснований участвуют органические соединения, являющиеся донорами пары p-электронов:
В органической химии принято следующее:
· если используют термин «кислота» в льюисовском понимании – говорят «кислота Льюиса».
Лекция № 5
Углеводороды
Алканы
Алканы (насыщенные ациклические соединения, парафины)
Термин «насыщенный» означает, что каждый углерод в молекуле такого вещества связан с максимально возможным числом атомов (с четырьмя атомами).
Строение метана подробно изложено в лекции № 2.
Изомерия, номенклатура
Три первых члена гомологического ряда (метан, этан и пропан) существуют в виде одного структурного изомера. Начиная с бутана число изомеров стремительно растет: у пентана три изомера, а у декана (С10Н22) их уже 75.
Конформационная изомерия
Чтобы распечатать файл, скачайте его (в формате Word).
Разница между рКа и рН
В физической химии pKa и pH являются двумя терминами, связанными с кислотностью системы. Это логарифмические значения. Самый простой способ выразить и сравнить очень большие или очень маленькие суммы
Содержание:
Ключевые области покрыты
1. Что такое рКа
— определение, ценности, отношения
2. Что такое рН
— определение, ценности, отношения
3. В чем разница между рКа и рН
– Сравнение ключевых различий
Ключевые термины: Кислотность, Константа диссоциации кислоты, Основность, pH, pKa
Что такое рКа
Константа диссоциации кислоты этого равновесия равна
[A – ] = Концентрация сопряженного основания
[ЧАС + ] = Концентрация ионов H +
[HA] = концентрация присутствующей кислоты
Тогда значение pKa константы диссоциации кислоты может быть указано, как показано ниже.
Рассматривая значение pKa, мы можем определить, является ли кислота сильной кислотой или слабой кислотой. Если значение рКа высокое, кислота слабая. Это связано с тем, что более высокое значение pKa указывает на то, что Ka является низким. Для того чтобы значение Ка было низким, [ – ][ЧАС + ] значение должно быть ниже, чем значение [HA]. Это означает, что кислота была диссоциирована частично. Но если значение [ – ][ЧАС + ] выше, чем [HA], тогда Ka будет высоким, а pKa будет низким соответственно. Это указывает на то, что это сильная кислота.
Что такое рН
В аналитической химии показатели pH используются для определения конечной точки определенной реакции. Эти индикаторы очень чувствительны к изменениям рН и показывают разные цвета для разных значений рН в водных растворах.
Тем не менее, значение рН является хорошим показателем кислотности или щелочности в водоеме. рН-метры могут быть использованы для измерения рН воды или любого другого раствора.
Разница между рКа и рН
Определение
Индикация кислотности
рКа: pKa указывает, является ли кислота сильной кислотой или слабой кислотой.
pH: pH показывает, является ли система кислотной или щелочной.
Подробности даны
рКа: рКа дает подробную информацию о диссоциации кислоты в водном растворе.
pH: pH дает подробную информацию о концентрации H + ионы в системе.
Ценности
рКа: Если pKa кислоты высокое, это слабая кислота, а если pKa кислоты низкое, это сильная кислота.
pH: Если pH системы высокий, система является щелочной, но если pH низкий, эта система является кислой.
Влияние других параметров
pH: рН зависит от Н + концентрация.
Заключение
Как pKa, так и pH являются очень важными параметрами в лабораторных условиях. Основное различие между pKa и pH заключается в том, что pKa указывает на диссоциацию кислоты, тогда как pH указывает на кислотность или щелочность системы.