Что такое санация в медицине в реанимации
Санация трахеобронхиалього дерева
Эндоскопическое отделение
Наиболее распространенными антисептиками, применяемыми при санации бронхиального дерева, являются 0. 1% раствор фурагина калиевой соли и 0, 1% или 0, 2% раствор диоксидина на 2% растворе гидрокарбоната натрия. Санирующий раствор готовят непосредственно перед употреблением. Перед введением в бронхиальное дерево его обязательно подогревают до температуры 36-37°. На одну санацию используют от 60 до 140 мл й смеси.
Слизь, вырабатываемая бронхиальными клетками, содержит большое число сульфгидрильных групп, способных формировать связи друг с другом с образованием трехмерной мукоидной структуры. Эти связи, называемые «дисульфидными мостиками», очень прочны и могут быть разорваны только восстановителями.
В настоящее время при заболеваниях органов дыхания, сопровождающихся образованием вязкой мокроты слизисто-гнойного или гнойного характера, применяются бронхосекретолитические препараты.
Одним из эффективных препаратов этой группы является N-ацетилцистеин (флуимуцил) — это N-ацетиловое производное естественной аминокислоты L-ацетилцистеина.
Флуимуцил — это препарат, оказывающий прямое муколити- ческое действие; он воздействует на образование слизи путем разрыва дисульфидных мостиков макромолекул мукопротеина, присутствующих в бронхиальном секрете. Это фармакологическое действие связано с наличием в молекуле флуимуцила свободной сульфгидрильной группы, делающей его биологически активным препаратом. В результате воздействия флуимуцила образуются молекулы меньшего молекулярного веса, и происходит разжижение слизи, поскольку препарат уменьшает ее вязкость. Количество и периодичность проведения лечебных бронхоскопий зависит от тяжести заболевания.
Санационная бронхоскопия является высокоэффективным методом лечения бронхолегочных заболеваний, особенно у больных в тяжелом состоянии, находящихся на аппарате искусственного дыхания в реанимационных отделениях.
Санация дыхательных путей: как избавиться от мокроты
Время чтения: 3 мин.
У больных спинальной мышечной атрофией часто возникают сложности с самостоятельным удалением мокроты или слизистого отделяемого из верхних и нижних дыхательных путей. Это связано с нарушением глотания, а также с повышенной секрецией мокроты во время простудных заболеваний, которым пациенты с СМА, к сожалению, часто подвержены.
Справиться с этой проблемой поможет специальный прибор — аспиратор.
Рассказываем, как пользоваться аспиратором, какие катетеры подходят для разных видов санации, а также о способах и правилах санации верхних дыхательных путей и носовой полости. Текст подготовлен совместно с фондом «Семьи СМА» по материалам видео-инструкции «Санация дыхательных путей: как избавиться от мокроты. В помощь родителям».
Когда нужно делать санацию дыхательных путей?
Если мы видим слизистое отделяемое из носа или во рту у ребенка, слышим шумное дыхание или чувствуем клокотание, положив руку на его грудную клетку — значит, ребенку требуется санация.
Что такое аспиратор?
Аспиратор — это прибор, который с помощью вакуума удаляет мокроту и слизь из верхних или нижних дыхательных путей через специальные трубочки. Аспираторы бывают стационарные, работающие от сети, и портативные, с аккумулятором.
Аспираторы / Фонд «Семьи СМА»
Аспиратор работает от напряжения 220 вольт. У него есть кнопка включения и регулятор силы всасывания. Обычно его устанавливают на максимум: иначе мощности домашнего аспиратора не хватит, чтобы эффективно удалить всю мокроту и слизь.
Для санации используются различные виды катетеров. Их делают разноцветными: каждый цвет соответствует определенному диаметру катетера.
Катетеры разной толщины, помеченные разным цветом / Фонд «Семьи СМА»
Чем толще катетер, тем эффективнее он удаляет мокроту и, к сожалению, тем больше неприятных ощущений доставляет ребенку. Более тонкий катетер практически незаметен, им можно заходить через носовую полость. Но он не всегда удаляет все, что нужно, и процедура санации затягивается.
Желательно иметь под рукой сразу несколько катетеров разного диаметра, и в каждой ситуации выбирать оптимальный.
Когда следует использовать аспиратор?
Аспиратор необходим после каждого использования откашливателя, поскольку откашливатель не всегда полностью удаляет мокроту из легких. Часто мокрота скапливается в области горла — ее нужно обязательно удалить. Завершить санацию можно с помощью слюноотсоса. Это поможет убрать мокроту, которая скопилась в дыхательных путях.
Аспиратор можно использовать самостоятельно для санации слюны или слизи, которая скопилась в ротовой полости.
Порядок работы с аспиратором
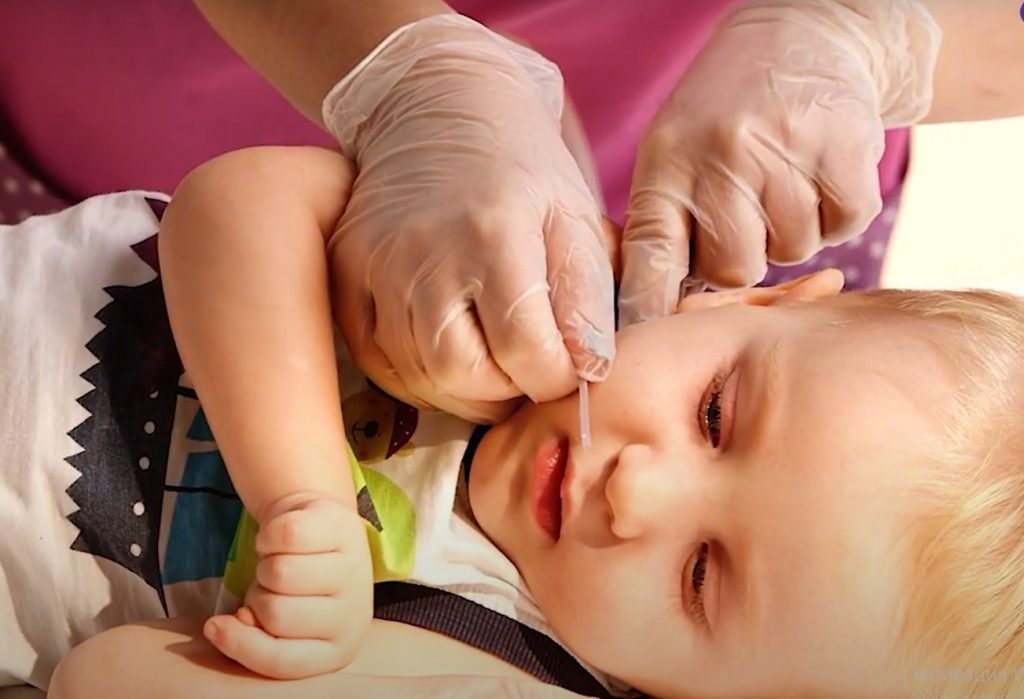
Прежде чем начать санацию, наденьте перчатки. Если такой возможности нет — хотя бы воспользуйтесь антисептиком для рук.
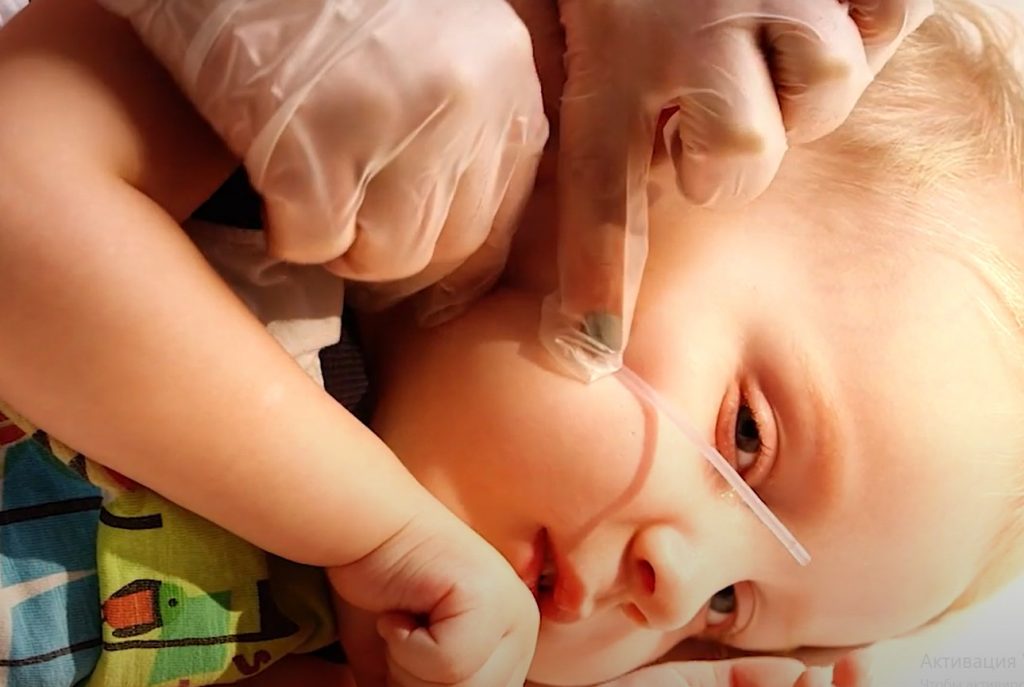
Не заводите катетер слишком глубоко, чтобы не спровоцировать у ребенка позывы к рвоте. Чтобы узнать нужную глубину, измерьте расстояние от верхней челюсти по губе до угла нижней челюсти.
Измеряем расстояние от верхней челюсти по губе до угла нижней челюсти / Фонд «Семьи СМА»
Для санации дыхательных путей через нос:
Отмеряем нужную длину, прикладывая катетер к кончику носа, ушку и углу челюсти / Фонд «Семьи СМА»
Если вводить зажатый катетер, можно травмировать слизистую ребенка.
Уход за аспиратором
Чашку, в которую собирается аспират, нужно мыть ежедневно, по мере заполнения. На чаше указана ее вместимость.
Фильтры следует менять по мере загрязнения, но не реже, чем раз в 6 месяцев.
Каждый электроаспиратор оснащен индикатором, который определяет давление. Давление не должно превышать 80 мм ртутного столба.
После завершения санации аспирационный катетер нужно промыть водным раствором хлоргексидина.
При санации детей с трахеостомой катетер не должен выходить за границы трахеостомической трубки. Если катетер будет слишком длинным, он травмирует слизистую, что может впоследствии привести к трахеомаляции и пролежням. Чтобы этого избежать, можно взять старую трубку, которой ребенок уже не пользуется, ввести в нее катетер и маркером сделать отметку. Этот эталонный катетер держать около кроватки ребенка и первое время с ним сверяться.
Санационная бронхоскопия
Среди всех эндоскопических методов исследования бронхоскопия давно занимает особое место, являясь не только одним из первых диагностических методов, но и важнейшим и эффективным способом лечения больных хроническими воспалительными и нагноительными заболеваниями легких. Последовательная разработка прямых методов исследования гортани, трахеи и бронхов началась с момента внедрения прямой ларингоскопии в 1884 г. Kirstein. На основании углубленных анатомических исследований Killian доказал, что бронхи, имеющие плотный хрящевой скелет, менее ранимы при эндоскопии, чем мягкие стенки пищевода. Вместе со своими учениками Brunnings и Eicken Killian изобрел упрощенный бронхоскопический прибор, который был в дальнейшем значительно усовершенствован. Кроме того, ими была детально разработана техника и методика бронхоскопии (цит. по Еловой М. Я. ). Первым бронхоскопическим вмешательством Киллиана было извлечение инородного тела (куска кости) в 1897 г. В 1904 г. Jackson написал первую монографию о трахеобронхоскопии, в которой он называет Killian отцом бронхоскопии. Термин «бронхоскопия» также предложил Killian. На основании обобщения литературных данных и собственных наблюдений автор подчеркивает роль бронхоскопии в распознавании и извлечении инородных тел из трахеи и бронхов. В 1911 г. В. Д. Соколов на основании собственных наблюдений привел данные об успешном применении бронхоскопии при лечении больных абсцессом легкого.
В 1924-1926 г. г. М. Ф. Цитович, В. К. Трутнев, А. Г. Лихачев и др. также опубликовали работы по применению бронхоскопии с лечебной целью при различных заболеваниях бронхов и легких (цит. по Еловой М. М. ). Таким образом, приоритет внедрения бронхоскопии в клинику внутренних болезней принадлежит русским врачам.
Основными лекарственными веществами, которые используют во время лечебных бронхоскопий, являются антисептики, антибиотики, муколитики и иммуномодуляторы.
Санационную бронхоскопию начинают с удаления содержимого из трахеобронхиального дерева с помощью отсоса. После этого промывают наиболее пораженные бронхи раствором антисептика. Одномоментно вводят не более 20 мл санирующей смеси с последующей аспирацией ее с помощью отсоса. Лечебную бронхоскопию заканчивают введением муколитика и/или антибиотика.
Слизь, вырабатываемая бронхиальными клетками, состоит из гликопротеидов, сульфомуцинов и воды; она содержит большое количество сульфгидрильных групп, способных формировать связи друг с другом с образованием трехмерной мукоидной структуры. Эти связи, называемые «дисульфидными мостиками», очень прочны и могут быть разорваны только восстановителями.
При патологических состояниях формируется повышенное количество дисульфидных мостиков, что приводит к увеличению вязкости и эластичности бронхиального секрета и повышает риск развития инфекции в скоплениях секрета. Впоследствии образуется гнойная мокрота.
больных хронической обструктивной болезнью легких, представляется нецелесообразным вследствие возможного развития бронхоспазма вплоть до астматического статуса, увеличения склонности к кровохарканью, аллергическим реакциям и усилению деструкции межальвеолярных перегородок при дефиците альфа 1-антитрипсина.
В настоящее время при заболеваниях органов дыхания, сопровождающихся образованием очень вязкой, трудно отделяемой мокроты слизисто-гнойного или гнойного характера, применяются лекарственные средства, известные как муколитики или бронхосекретолитические препараты.
Исследования, проведенные на животных, показали, что флуимуцил повышает мукоцилиарную активность. Это благоприятное воздействие на мукоцилиарный транспорт объясняется улучшением деятельности ресничек и приводит к более эффективной элиминации слизи и меньшей степени ее адгезии к эпителию.
Увеличивается количество данных, показывающих, что оксидативный стресс играет важную роль в развитии различных заболеваний человека. Источник стресса может быть внутренним (например, активированные клетки воспаления, клетки с окислительно-восстановительным циклом ксенобиотиков) или внешним (например, табакокурение).
Эти недостатки преодолеваются при использовании флуимуцила, в котором радикал ацетил соединен с аминогруппой. Таким образом, появляется возможность вводить такое количество цистеина, которое необходимо для поддержания адекватного уровня глютатиона в легких.
Отсюда следует, что бронхоскопия с самого начала своего существования стала важнейшим лечебно-оперативным эндоскопическим методом у больных с заболеваниями бронхо-легочной системы.
Что такое санация в медицине в реанимации
Проблема лечения больных острой эмпиемой плевры (ОЭП) по-прежнему остается актуальной и сохраняет практическую значимость из-за высокой частоты заболевания, неблагоприятных исходов и летальности, которая достигает 25% [7, 29, 35, 51, 64]. ОЭП у 4 – 20% больных переходит в хроническую, которая является ведущей причиной стойкой утраты трудоспособности среди всех гнойно-воспалительных заболеваний органа дыхания [9, 15, 19, 26, 56, 57].
Актуальность проблемы обусловлена увеличением частоты патологических состояний, течение которых осложняет ОЭП. Последняя является наиболее частым и тяжелым осложнением воспалительных и гнойно-деструктивных заболеваний легких (ГДЗЛ) [7, 35, 39, 49, 65], травм и операций на грудной клетке и её органах [1, 25, 44]. Развитие пиопневмоторакса и ОЭП наблюдается у 10-30% больных абсцессами и гангренами легких и в 15-20% случаев – при туберкулезных плевритах [7, 35]. За последние 10-15 лет отмечается стабильное увеличение заболеваемости воспалением легких, которая в 4% случаев осложняется развитием ОЭП [49, 69], особенно при нозокомиальной и аспирационной пневмониях.
Травма груди является причиной развития ОЭП в 6-12% случаев [4, 7], при этом она осложняет течение закрытых травм груди в 2,9-5,2% наблюдений, неогнестрельной травмы – в 1,7-5,4%. При огнестрельной травме грудной клетки и её органов частота ОЭП увеличивается до 21,7% [7, 10]. После длительных и травматичных операций, выполняемых у пациентов с местнораспространенными и осложненными формами рака легкого развитие ОЭП наблюдается в 2,5-6,5% случаях [7, 15], а после операций по поводу ГДЗЛ – у 4,8-28% пациентов [8, 19, 26, 32]. У 4-20% больных ОЭП переходит в хроническую форму, наиболее часто хронизация процесса в плевре наблюдается у больных ГДЗЛ [4, 5, 6, 19, 52].
Важное значение в формировании, развитии и исходах ОЭП имеет характер и вирулентность микрофлоры. Грамотрицательная флора в плевральном экссудате при ОЭП наблюдается в 20-30% случаев, грамположительная – в 30-40%, в основном, это S. aureus, S. Pneumoniae и S. pyogenes. В 20-30% наблюдений микрофлора является смешанной и довольно часто – в ассоциации с неклостридиальными анаэробами (протей, кишечная палочка и др.). После хирургических вмешательств на органах грудной клетки спектр возбудителей представлен в основном S. aureus и аэробными грамотрицательными бактериями, а в 5-20% наблюдений экссудат оказывается стерильным [20, 21, 46, 64, 65]. Отсутствие аэробных микроорганизмов при исследовании содержимого из плевральной полости, имеющего неприятный запах и наличие высокого уровня осадка, свидетельствует об анаэробном характере возбудителей. Последнее имеет важное значение при выборе метода локальной санации и используемых санационных сред: предпочтение в данной ситуации отводится методам, способствующим максимальному удалению экссудата и использованию антисептиков из группы окислителей [35].
При ГДЗЛП чаще всего происходит прорыв в плевральную полость субплеврально расположенных абсцессов легкого, при этом развивается ОЭП с деструкцией легочной ткани [6, 38, 59]. Если в плевральную полость прорывается более или менее центрально расположенный абсцесс, имеющий сообщение с бронхом, возникает пиопневмоторакс, в большинстве случаев впоследствии формируются стойкие бронхоплевральные свищи. При расположении абсцесса вблизи плащевой зоны легкого в части случаев патогенные микроорганизмы проникают в плевральную полость лимфогенным или гематогенным путями. В данной ситуации нагноение экссудата может не сопровождаться деструктивными процессами в легочной паренхиме. В некоторых случаях течение эмпиемы носит торпидный характер, при этом гнойное воспаление постепенно распространяется как в ткани грудной стенки, так и в сторону легкого. Это приводит к развитию флегмоны грудной стенки, а при переходе на легочную ткань – множественных бронхоплевральных свищей и так называемого решетчатого легкого [20]. В формировании ОЭП наблюдаются 3 последовательно развивающиеся стадии [9, 15, 26, 29]:
I стадия серозная – на фоне воспаления обеих плевральных листков появляется серозный экссудат в полости плевры, который содержит небольшое количество нейтрофильных лейкоцитов. Плевральная жидкость относительно прозрачная, практически не содержит осадка при длительном отстаивании.
II стадия гнойно-фибринозная – происходит инфицирование плеврального экссудата контактным, лимфогенным или гематогенным путем, что сопровождается увеличением количества микроорганизмов в и его инфицирование. В плевральной жидкости увеличивается количество патогенных микроорганизмов, полиморфно-ядерных лейкоцитов и детрита. Экссудат быстро теряет прозрачность, возрастает доля плотного осадка. На плевральных листках образуются фибринозные пленки, возникают сращения между париетальной и висцеральной плеврой, которые способствуют, с одной стороны – отграничению гнойного процесса, а с другой – к возникновению множественных внутриплевральных полостей. Гнойный экссудат из-за возрастания объема фибринозных напластований, продуктов распада микроорганизмов, нейтрофилов, слущенного мезотелия плевры загустевает и самостоятельно разрешиться не может, кроме того это существенно препятствует локальной санации ОЭП.
III стадия фиброзной организации – характеризуется образованием плотных шварт, окутывающих легкое в пределах патологического процесса, что приводит к формированию стойкого компрессионного ателектаза с выраженными нарушениями функции внешнего дыхания и оксигенации крови, внутрилегочного шунтирования, с последующим развитием плевропневмофиброза.
Лечение больных ОЭП предусматривает использование дренирования и локальной санации гнойной полости, бронхологическую санацию при наличии гнойно-деструктивного процесса в легком, воздействие на инфекцию – этиотропную терапию и коррекцию нарушенных функций органов и систем [17, 37, 64], а при наличии бронхоплеврального сообщения дополнительное применение эффективных методов профилактики во время операции и в послеоперационном периоде [2, 8, 42, 44]. Кратность, интенсивность и объем бронхологической санации зависит от степени и распространенности эндобронхита, объема и характера патологического процесса в легком, приведшего к развитию ОЭП [3]. По каждому из этих компонентов лечения до настоящего времени среди торакальных хирургов продолжается дискуссия о выборе наиболее эффективных лечебных технологий.
На наш взгляд, наиболее важным представляется применение адекватных и высокоактивных методов санации эмпиемы плевры особенно в I стадии, применение которых пролонгируется и во II стадии [18, 36, 66]. III стадия ОЭП представляет наибольшие сложности в плане санации и поэтому требует более активных хирургических вмешательств, среди которых, особенно на начальном этапе, наиболее оптимальными являются эндовидеохирургические и другие миниинвазивные вмешательства.
Эффективность эндовидеоторакоскопических операций при ОЭП показана в многочисленных исследованиях, преимущества её перед стандартной торакотомией несомненны [27, 45, 48, 54, 70, 71, 72], тем не менее, их применение ограничено необходимостью однолегочной интубации при даче наркоза, низкими показателями функции внешнего дыхания и оксигенации крови, наличием тяжелых сопутствующих заболеваний, особенно сердечно-сосудистой системы и, наконец, отсутствием оборудования и подготовленных специалистов во многих ЛПУ. Недостаточно изучены возможности комбинированной торакоскопической санации, использование протеолитических ферментов, фибринолитических препаратов и других санационных сред [30, 55]. Анализ работ, посвященных этиотропной терапии ОЭП, показал возрастание количества госпитальных штаммов микрофлоры, являющихся причиной данного осложнения при ГДЗЛ [9, 22, 30, 33, 63]. В связи с этим многие авторы считают актуальной проблему ранней этиологической диагностики, что влечет за собой проблему рациональной антибактериальной терапии, в том числе с использованием физических методов локального воздействия на микрофлору [16, 26, 32, 35, 64].
Наиболее тяжелым контингентом среди больных с заболеваниями органов дыхания являются пациенты с ГДЗЛ, осложненных эмпиемой плевры, особенно с наличием бронхоплевральных сообщений [35, 39, 43, 61]. Большинство из них имеет признаки эндотоксикоза тяжелой степени и дыхательной недостаточности, часто сопряженной с сердечно-сосудистой недостаточности. Более чем у половины пациентов имеются коморбидные заболевания, которые утяжеляют течение основного заболевания, а в некоторых случаях даже являются причиной летальных исходов. В данном случае следует более дифференцированно подходить к выбору методов обследования больных и применения комплексной программы лечения [20, 35, 62, 66], среди которых основными принципами являются:
1. Адекватное дренирование гнойных очагов в легком и плевре, бронхологическая санация трахеобронхиального дерева;
2. Комбинированные методы санации плевральной полости, лазеротерапия, УФО, а при наличии бронхоплевральных сообщений – временная окклюзия бронхов;
3. Рациональная антибактериальная терапия с учетом чувствительности возбудителя к антибиотикам;
4. Эфферентная, квантовая терапия и другие методы экстракорпоральной детоксикации;
5. Коррекция нарушений иммунного статуса и гомеостаза;
6. Коррекция дыхательной функции легких и нарушений со стороны других органов и систем жизнеобеспечения организма.
Е.А. Цеймах (2010) считает, что лечение больных ОЭП, в том числе осложненной пиопневмотораксом должно быть комплексным и проводиться с дифференцированной коррекцией фагоцитов и макрофагов в крови, принимая во внимание состояние протеолитических систем. Для этой цели он предлагает применять плазмаферез, плазмалейкоаферез, введение криоплазменно-антиферментного комплекса, препаратов, корригирующих прокоагулянтную, метаболическую и протеолитическую активность фагоцитов, местное применение ингибиторов и активаторов протеолиза в зависимости от фазы воспаления в плевральной полости. Данный комплекс лечебных технологий позволил автору уменьшить летальность в 2,3 раза и увеличить в 1,5 раза количество больных, выписанных с выздоровлением [44].
Острые абсцессы и гангрена легких, осложненные эмпиемой плевры, сопровождаются выраженной эндогенной интоксикацией, что привлекает внимание торакальных хирургов к технологиям экстракорпоральной детоксикации [4, 34, 35], наиболее часто из которых используется плазмаферез [35]. Однако для достижения клинического эффекта плазмафереза в группе больных ОЭП необходимо полное и своевременное восполнение эксфузированной аутоплазмы донорской плазмой, растворами альбумина и протеина. В настоящее время адекватная коррекция потерь, связанных с данной процедурой затруднительна в связи с дефицитом донорской плазмы и других препаратов крови, а также не исключает возможности развития анафилактических реакций и инфицирования больного [4, 20].
Опорожнение гнойников, в том числе и при ОЭП, является неоспоримым компонентом лечения нагноительных заболеваний [9, 40, 35]. При эвакуации гнойного экссудата из плевральной полости нужно стремиться к максимальному расправлению легкого, ликвидации остаточной полости и ее облитерации. Стартовым методом в данном случае считается пункция эмпиемной полости, цель которой состоит в максимальном удалении гнойного экссудата с последующим бактериологическим исследованием, а также в выявлении возможности легкого к расправлению [6, 26, 29, 35, 68].
В начале воспалительного процесса в плевральной полости, особенно при отсутствии выраженной гипертермии, антибиотики желательно не вводить в полость плевры, так как они способствуют уплотнению плевральных листков и стабилизации ОЭП, что в последующем может создать проблему для расправления легкого. В результате стимуляции кининовой системы, гиперпродукции белков острой фазы воспаления антибиотики способствуют пролонгации системной воспалительной реакции, угнетению репаративных процессов в патологическом очаге, нарушается обмен белков. В данном случае более предпочтительны антисептики: хлоргексидин, нитрофураны, раствор гипохлорита натрия [18, 21, 64].
При ограниченной, чаще паракостальной и базальной локализации ОЭП без деструкции легочной ткани (без бронхоплеврального сообщения) и при малым количестве гнойного экссудата пункционный метод является довольно эффективным при условии систематического его использования. Однако более эффективно сочетать пункцию плевральной полости с адекватным ее промыванием растворами антисептиков, добиваясь полного контакта санационной среды со всеми криптами и лакунами эмпиемной полости [66, 67].
Основной лечебной технологией при ОЭП является дренирование и санация плевральной полости с постоянной аспирацией её содержимого по показаниям [35, 41, 51, 53]. Впервые предположение о возможности санации эмпиемной полости возникла по аналогии с перитонеальным лаважем [7]. В более сложных анатомических соотношениях брюшной полости с множеством карманов и межпетлевых пространств, склеенных при перитоните фибрином, удается добиться положительного результата. С этих позиций полость эмпиемы представляется более благоприятным объектом.
Непрерывное промывание полости эмпиемы санационными средами, обладающими антибактериальным эффектом, в данной ситуации будет более эффективным, чем однократное (в течение суток) удаление гнойного экссудата с последующим введением антибактериальных препаратов. Это обусловлено тем, что продукция жидкости плевральными листками в экссудативной фазе, миграция в зону воспаления клеток крови, других компонентов острого воспаления способствует увеличению субстрата для патогенных микроорганизмов, их интенсивному размножению.
Кроме того, также следует иметь в виду высокую всасывательную способность плевральных листков, которая в сочетании с основными фармакокинетическими свойствами антибактериальных препаратов, особенно с коротким периодом элиминации, дает определенные преимущества при использовании метода дренирования и санации плевральной полости [3, 20]. Это обеспечивает наиболее эффективное не только локальное, но и системное действие антибактериальных препаратов.
Дренирование эмпиемной полости рекомендуют проводить до 3-6 недель, с последующим формированием фиброторакса [1, 3, 9, 11, 72]. А.В. Левин и соавт. (2011) предлагают использовать при эмпиеме с деструкцией легочной ткани и при наличии бронхоплеврального сообщения бронхоблокацию с помощью оригинального устройства [23], а И.И. Котов (2000) при ОЭП со стойким бронхоплевральным сообщением – кроме создания вакуума в плевральной полости рекомендует проводить временную окклюзию дренирующего полость эмпиемы бронха [20].
Если в результате дренирования не удается добиться полного удаления жидкости, происходит утолщение как париетальной, так и висцеральной плевры, и компрессия легкого; в данной ситуации производится радикальная хирургическая операция [29, 42, 44, 68]. При анаэробной и стафилококковой инфекции торакотомию и декортикацию легкого производят в III стадии ОЭП [20, 44, 72]. Практически во всех случаях при проведении декортикации легкого наблюдается повреждение плащевой зоны легкого, а в некоторых случаях декортикацию невозможно выполнить из-за морфологических особенностей, тяжести состояния больного, наличия коморбидных заболеваний, что заставляет хирургов продолжать консервативную терапию [21, 60].
Для расправления компрессионного ателектаза в III стадии рекомендуется выполнение декортикации легкого с помощью эндовидеохирургических технологий, комбинируя их с физическими методами воздействия на возбудителя инфекции в эмпиемной полости (ультразвук или плазма) [12, 13, 14, 54]. Основным показанием к данной лечебной технологии при ОЭП является недостаточно эффективное промывание плевральной полости прерывистым методом в течение 2 недель или наличие стойкого бронхоплеврального сообщения в течение 1 месяца [28, 47, 61, 67]. Большинство торакальных хирургов считает, что видеоторакоскопическая санация выполнима лишь при ОЭП до развития рубцовых процессов [48, 71, 72].
Когда заболевание переходит в хроническую фазу, адекватная санация эмпиемной полости возможна только при традиционной торакотомии или миниторакотомии с использованием комплекта специальных инструментов [22, 24, 25, 67]. Однако сроки перехода ОЭП в хроническую многими торакальными хирургами регламентируется в широком диапазоне и составляют от 1 до 8-12 мес. Г.И. Лукомский в качестве основного признака диверсификации форм эмпиемы плевры считает наличие способности легкого к расправлению [26]. Подобная технология лечения с использованием видеоторакоскопии способствует уменьшению операционной травмы и сопровождается сокращением количества и тяжести послеоперационных осложнений, а также снижением сроков стационарного лечения, что имеет не только клиническое, но и экономическое и социальное значение [1, 44, 48, 67].
Особая роль при лечении ОЭП отводится введению стрептокиназы, урокиназы, альтеплазы и протеолитических ферментов в плевральную полость [35, 45, 55, 58]. Основным мотивом для применения указанных лекарственных средств являются фибринозные напластования, ограниченные полости с мелкими секвестрами, которые ограничивают возможности локальной санации. Однако экспериментальные исследования показали, что стрептокиназа и урокиназа не снижают вязкости гнойного экссудата. В основном эффект от их применения наблюдался лишь в виде разрушения перегородок внутри эмпиемной полости [58].
Так, двойное слепое рандомизированное исследование, проведенное в Великобритании, не подтвердило целесообразности применения стрептокиназы при лечении ОЭП. Применение стрептокиназы не способствовало снижению операционной активности и летальности, а также не повлияло на продолжительность стационарного лечения и клинические исходы. Следует отметить, что серьезные побочные эффекты чаще встречались в группе больных, получавших санацию с использованием стрептокиназы, чем в группе сравнения, что дало основание E.P.N. Herrejon (2009) установить противопоказания для внутриплеврального введения тромболитических препаратов при ОЭП [58].
Комплексная санация гнойно-деструктивных очагов в легких и плевре позволяет сократить количество и степень тяжести осложнений, сократить сроки лечения и, что особенно важно при ОЭП – снизить частоту хронизации процесса [37, 43]. Исследования, проведенные М.Д. Романовым в группе больных ГДЗЛ [35, 38], позволили установить признаки вторичного иммунодефицита в дебюте формирования ОЭП. При этом стандартная антибактериальная терапия сопровождается угнетением иммунного статуса, что приводит к персистенции микроорганизмов в зоне патологического очага, в итоге нагноительный процесс продолжается [63].
Окончательно не решен вопрос о средствах для проведения санации эмпиемной полости в зависимости от фазы воспалительного процесса и результатов бактериологического и цитологического контроля. Большинство торакальных хирургов используют для санации эмпиемных полостей растворы хлоргексидина, фурацилина, борной кислоты и других антисептиков. R. Agarwal e. a. (2006) получили выраженный клинический эффект от использования 10% раствора йодоповидона у пациентов с ОЭП [50].
Среди методов физического воздействия на микрофлору привлекают внимание технологии, связанные с использованием УФ и лазерного облучения эмпиемных полостей [17, 18, 36, 37]. Так, Б.С. Демидов и соавт. (1986) успешно применяли углекислый лазер для санации открытых эмпием плевры, включающий облучение стенок полости электромагнитными колебаниями оптического диапазона, отличающийся тем, что, с целью закрытия бронхиальных свищей, облучение проводили УФ-лучами при длине волны 250 – 350 нм в течение 1-3 мин ежедневно [11].
Н.Р. Мукушевым и соавт. в 1991 г. разработано устройство для УФ-излучения внутриполостного применения, состоящее из источника излучения – ртутно-кварцевой лампы Q-145 с длиной волны 250-350 нм в 1 мл, и приставки электропитания лампы с реле времени. После санации раны через торакостомное “окно” источник излучения помещается внутрь плевральной полости и ее стенки облучают в течение 1-3 мин. Затем полость тампонируют. Сеансы облучения проводят ежедневно или через день в зависимости от состояния плевральной полости под бактериологическим контролем до полной санации. Стерильность плевральной полости наступала после трех-пяти сеансов. Автором проводилось облучение микроорганизмов in vitro с установкой источника излучения на расстоянии 5 см с различной экспозицией. Экспериментальные исследования показали, что УФ-облучение с помощью данного устройства обладает бактерицидным действием на синегнойную и кишечную палочки, более стойкими оказались золотистый стафилококк и гемолитический стрептококк [31]. Однако указанные методы применяются только при «открытой» эмпиеме плевры и требуют сложного технического обеспечения процедуры.
Таким образом, в лечении больных ОЭП, особенно являющихся осложнениями абсцессов и гангрены легких, остается много нерешенных проблем. При этом выбор лечебной технологии санации эмпиемной полости является основной задачей в гнойной торакальной хирургии; следует иметь в виду фазу воспаления, локализацию процесса, наличие бронхоплеврального сообщения и его размеры. Необходимо принимать во внимание вид и вирулентность возбудителя инфекции, состояние организма, возраст и наличие фоновых и коморбидных заболеваний, а также преимущества и недостатки конкретной лечебной технологии санации плевральной полости. Следует учитывать также эффективность санационных сред, используемых у больных ОЭП, так как пролонгирование сроков лечения способствует ухудшению локальных процессов в эмпиемной полости, прогрессированию негативных тенденций в подлежащей легочной ткани.
Миниинвазивные торакоскопические лечебные технологии, обладают определенными преимуществами перед традиционными методами лечения, тем не менее, показания к их применению при ОЭП окончательно не установлены, недостаточно разработаны на наш взгляд и комбинированные методы санации с использованием физических компонентов. Существующие комбинированные методы санации применяются по ограниченным показаниям, требуют выполнения торакостомы и являются довольно сложными для технического исполнения.
Таким образом, можно констатировать, что консервативное лечение с использованием хирургических технологий санации плевральной полости является ведущим методом лечения больных ОЭП. При развитии последней в результате гнойно-деструктивных заболеваний легких следует учитывать характер, распространенность патологического процесса в легком, выраженность эндобронхита, наличие бронхоплеврального сообщения, что требует дополнительных усилий в плане бронхологической санации, интенсификации методов экстракорпоральной детоксикации. Выбор технологий локальной санации следует проводить с учетом стадии процесса, наличия бронхоплеврального сообщения, характера и вирулентности микрофлоры, способности плевральных листков к элиминации лекарственных препаратов и ответной реакции к физическим методам воздействия на микрофлору и характер репаративных процессов.
На кафедре госпитальной хирургии ФГБОУ ВПО «МГУ им. Н.П. Огарёва» разрабатываются комбинированные технологии санации эмпиемных полостей у больных острой эмпиемой плевры [17, 18, 36, 37]. В связи с этим возникает необходимость проведения анализа клинических результатов санационных технологий в зависимости от причины возникновения, вида эмпиемы плевры и наличия (или отсутствия) бронхоплеврального сообщения, выявления возможных осложнений, а также перспективы их дальнейшего совершенствования [36]. Подобное исследование является необходимым для усовершенствования лечебных технологий и уточнения показаний к ним при данной патологии.