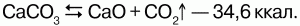Что такое сао в химии
Кальций
Кальций Са
Серебристо-белый металл, мягкий, пластичный. Во влажном воздухе тускнеет и покрывается пленкой из СаО и Са(ОН)2.Весьма реакционноспособный; воспламеняется при нагревании на воздухе, реагирует с водородом, хлором, серой и графитом:
Восстанавливает другие металлы из их оксидов (промышленно важный метод — кальцийтермия):
Получение кальция в промышленности:
Кальций применяется для удаления примесей неметаллов из металлических сплавов, как компонент легких и антифрикционных сплавов, для выделения редких металлов из их оксидов.
Оксид кальция СаО
Уравнения важнейших реакций:
Получение СаО в промышленности — обжиг известняка (900-1200 °С):
Гидроксид кальция Са(ОН)2
Основный гидроксид. Техническое название гашёная известь. Белый, гигроскопичный. Имеет ионное строение Са 2+ (ОН — )2. Разлагается при умеренном нагревании. Поглощает влагу и углекислый газ из воздуха. Малорастворим в холодной воде (образуется щелочной раствор), еще меньше — в кипящей воде. Прозрачный раствор (известковая вода) быстро мутнеет из-за выпадения осадка гидроксида (суспензию называют известковое молоко). Качественная реакция на ион Са 2+ — пропускание углекислого газа через известковую воду с появлением осадка СаС03 и переходом его в раствор. Реагирует с кислотами и кислотными оксидами, вступает в реакции ионного обмена. Применяется в производстве стекла, белильной извести, известковых минеральных удобрений, для каустификации соды и умягчения пресной воды, а также для приготовления известковых строительных растворов — тестообразных смесей (песок + гашёная известь + вода), служащих связующим материалом для каменной и кирпичной кладки, отделки (оштукатуривания) стен и других строительных целей. Отвердевание («схватывание») таких растворов обусловлено поглощением углекислого газа из воздуха.
Уравнения важнейших реакций:
Получение Са(ОН)2 в промышленности — гашение извести СаО (см. выше).
Оксид кальция: свойства, получение, применение.
Как получают оксид кальция?
1. Промышленный способ получения данного вещества заключается в термическом (под воздействием температуры) разложении известняка :
CaCO3 (известняк) = CaO (кальция оксид) + CO2 (углекислый газ)
2. Также кальция оксид можно получить посредством взаимодействия простых веществ:
2Ca (кальций) + O2 (кислород) = 2CaO (кальция оксид)
3. Третий способ получения оксида кальция заключается в термическом разложении кальция гидроксида (Ca(OH)2) и кальциевых солей нескольких кислородсодержащих кислот:
2Ca(NO3)2 = 2CaO (получаемое вещество) + 4NO2 + O2 (кислород)
1. Внешний вид: кристаллическое соединение белого цвета. Кристаллизуется по типу хлорида натрия (NaCl) в кубической кристаллической гранецентрированной решетке.
2. Молярная масса составляет 55,07 грамм/моль.
3. Плотность равна 3,3 грамм/сантиметр³.
Термические свойства оксида кальция
1. Температура плавления равна 2570 градусов
2. Температура кипения составляет 2850 градусов
3. Молярная теплоёмкость (при стандартных условиях) равна 42.06 Дж/(моль·К)
Химические свойства оксида кальция
Растворяться в воде (H2O) с выделением энергии. При этом образуется гидроксид кальция. Эта реакция выглядит так:
CaO (оксид кальция) + H2O (вода) = Ca(OH)2 (кальциевый гидроксид) + 63,7 кДж/моль;
Реагировать с кислотами и кислотными оксидами. При этом образуются соли. Вот примеры реакций:
CaO (кальциевый оксид) + SO2 (сернистый ангидрид) = CaSO3 (сульфит кальция)
CaO (кальциевый оксид) + 2HCl (соляная кислота) = CaCl2 (кальциевый хлорид) + H2O (вода).
Применение оксида кальция:
1. Основные объемы рассматриваемого нами вещества используются при производстве силикатного кирпича в строительстве. Раньше негашеную известь использовали в качестве известкового цемента. Его получали при ее смешивании с водой (H2O). В результате оксид кальция переходил в гидроксид, который потом, поглощая из атмосферы (CO2), сильно твердел, превращаясь в кальция карбонат (CaCO3). Несмотря на дешевизну этого метода, в настоящее время цемент известковый практически не применяется в строительстве, так как он обладает способностью хорошо впитывать и накапливать в себе жидкость.
2. В качестве огнеупорного материала оксид кальция подходит как недорогой и доступный материал. Плавленый кальциевый оксид имеет устойчивость к воздействию воды (H2O), что позволило его применять в качестве огнеупора там, где использование дорогостоящих материалов нецелесообразно.
3. В лабораториях используют высший оксид кальция для сушения тех веществ, которые с ним не реагируют.
5. В промышленности кальциевый оксид используют для удаления сернистого ангидрида (SO2) из дымовых газов. Применяют, как правило, 15% раствор водяной. В результате реакции, в которой взаимодействуют гашеная известь и диоксид серы, получается гипс CaCO4 и CaCO3. При проведении экспериментов ученые добивались показателя в 98% отчистки дыма от диоксида серы.
6. Используется в специальной «самогреющейся» посуде. Емкость с небольшим количеством кальциевого оксида располагается между двух стенок сосуда. При прокалывании капсулы в воде начинается реакция с выделением некоторого количества тепла.
Оксид кальция (СаO) – негашеная или жженая известь – белое огнестойкое вещество, образованное кристаллами. Кристаллизуется в кубической гранецентрированной кристаллической решетке. Температура плавления – 2627 °C, температура кипения – 2850 °C.
Называется жженой известью из-за способа его получения – обжигание карбоната кальция. Обжиг производят в высоких шахтных печах. В печь закладывают слоями известняк и топливо, а затем разжигают снизу. При накаливании происходит разложение карбоната кальция с образованием оксида кальция:
При этом концентрация газа может быть выражена с помощью его парциального давления, то есть равновесие в системе устанавливается при определенном давлении диоксида углерода.
Давление диссоциации вещества – равновесное парциальное давление газа, получающееся при диссоциации вещества.
1) при взаимодействии простых веществ: 2Ca + O2 = 2CaO;
2) при термическом разложении гидроксида и солей: 2Ca(NO3)2 = 2CaO + 4NO2? + O2?.
1) взаимодействует с водой: СаO + H2O = Са(OH)2;
2) реагирует с оксидами неметаллов: СаO + SO2 = CaSO3;
3) растворяется в кислотах, образуя соли: CaO + 2HCl = CaCl2 +H2O.
Гидроксид кальция (Ca(OH)2 – гашеная известь, пушонка) – белое кристаллическое вещество, кристаллизуется в гексагональной кристаллической решетке. Является сильным основанием, плохо растворимым вводе.
1) образуется при растворении кальция и оксида кальция вводе: CaO + H2O = Са(OH)2 + 16 ккал;
2) при взаимодействии солей кальция со щелочами: Ca(NO3)2 + 2NaOH = Ca(OH)2 + 2NaNO3.
1) при нагревании до 580 °C разлагается: Са(OH)2 = СаO + H2O;
2) реагирует с кислотами: Ca(OH)2 + 2HCl = CaCl2 + 2H2O.
Эта тема принадлежит разделу:
Шпаргалка по неорганической химии
Шпаргалка по неорганической химии. Ольга Владимировна Макарова.
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
Все темы данного раздела:
Материя и ее движение
Материя – это объективная реальность, обладающая свойством движения. Все существующее есть различные виды движущейся материи. Материя существует независимо от созна
Вещества и их изменение. Предмет неорганической химии
Вещества– виды материи, дискретные частицы которых имеют конечную массу покоя (сера, кислород, известь и т. д.). Из веществ состоят физические тела. Каждое
Периодическая система элементов Д.И. Менделеева
Периодический закон был открыт в 1869 году Д.И. Менделеевым. Им же была создана классификация химических элементов, выраженная в форме периодической системы. До Ме
Значение периодической системы Менделеева.
Периодическая система элементов явилась первой естественной классификацией химических элементов, показавшей, что они взаимосвязаны друг с другом, а также послужила дальнейшим исследованиям.
Теория химического строения
Теорию химического строенияразработал А.М. Бутлеров.Она имеет следующие положения: 1) атомы в молекулах соединены друг с
Общая характеристика P-, S-, D-элементов
Элементы в периодической системе Менделеева делятся на s-, p-, d-элементы. Это подразделение осуществляется на основе того, сколько уровней имеет электронная оболочка атома элемента
Ковалентная связь. Метод валентных связей
Химическая связь, осуществляемая общими электронными парами, возникающих в оболочках связываемых атомов, имеющих антипараллельные спины, называется атомной, или ковалентной
Неполярная и полярная ковалентные связи
При помощи химической связи атомы элементов в составе веществ удерживаются друг возле друга. Тип химической связи зависит от распределения в молекуле электронной плотности.
Многоцентровые связи
В процессе развития метода валентных связей выяснилось, что настоящие свойства молекулы оказываются промежуточными между теми, которые описывает соответствующая формула. Такие молек
Ионная связь
Связь, возникшая между атомами с резко выраженными противоположными свойствами (типичным металлом и типичным неметаллом), между которыми возникают силы электростатического притяжени
Водородная связь
В 80-х годах XIX в. М.А. Ильинскийи Н.Н. Бекетовустановили, что атом водорода, соединенный с атомом фтора, кислорода или азота, способен образовыва
Превращение энергии при химических реакциях
Химическая реакция– превращение одного или нескольких исходных веществ в другие по химическому составу или строению вещества. По сравнению с ядерными реакц
Цепные реакции
Существуют химические реакции, в которых взаимодействие между компонентами происходит довольно просто. Существует весьма обширная группа реакций, протекающих сложно. В этих реакциях
Общие свойства неметаллов
Исходя из положения неметаллов в периодической системе Менделеева, можно выявить свойства для них характерные. Можно определить количество электронов на внешнем эн
Водород
Водород (Н)– 1-й элемент периодической системы Менделеева – I и VII группа, главная подгруппа, 1 период. На внешнем s1-подуровне имеется 1 валентный электрон и 1 s2
Перекись водорода
Пероксид, или перекись водорода– кислородное соединение водорода (перекись). Формула: Н2О2 Физические свойства:перекись водорода – бесцветная сироп
Общая характеристика подгруппы галогенов
Галогены– элементы VII группы – фтор, хлор, бром, йод, астат (астат мало изучен в связи с его радиоактивностью). Галогены – ярко выраженные неметаллы. Лишь йод в ре
Хлор. Хлороводород и соляная кислота
Хлор (Cl) –стоит в 3-м периоде, в VII группе главной подгруппы периодической системы, порядковый номер 17, атомная масса 35,453; относится к галогенам.
Краткие сведения о фторе, броме и йоде
Фтор (F); бром (Br); йод (I)относятся к группе галогенов. Стоят в 7-й группе главной подгруппы периодической системы. Общая электронная формула: ns2np6.
Общая характеристика подгруппы кислорода
Подгруппа кислорода, или халькогенов – 6-я группа периодической системы Д.И. Менделле-ва, включающая следующие элементы: 1) кислород – О; 2) сера
Кислород и его свойства
Кислород (О)стоит в 1 периоде, VI группе, в главной подгруппе. р-элемент. Электронная конфигурация 1s22s22p4. Число электронов на внешнем ур
Сера и ее свойства
Сера (S)в природе встречается в соединениях и свободном виде. Распространены и соединения серы, такие как свинцовый блеск PbS, цинковая обманка ZnS, медный блеск Cu
Сероводород и сульфиды
Сероводород (H2S) –бесцветный газ с резким запахом гниющего белка. В природе встречается вводах минеральных ключей вулканических газах, гниении отбросов, а также пр
Свойства серной кислоты и ее практическое значение
Структура формулы серной кислоты: Получение:основным методом производства серной кислоты из SO3 является контактный метод.
Получение.
1. В промышленности азот получают путем сжижения воздуха с последующим испарением и отделением азота от других газовых фракций воздуха. Полученный азот содержит примеси благородных газов (аргона).
Общая характеристика подгруппы азота
Подгруппа азота – пятая группа, главная подгруппа периодической системы Д.И. Менделеева. В нее входят элементы: азот (N) ; фосфор (P) ; мышьяк (
Нашатырь (хлорид азота).
Получение: впромышленности до концаХ1Х векааммиак получали как побочный продукт при коксовании каменного угля, который содержит до 1–2 % азота. В начале
Соли аммония
Соли аммония– сложные вещества, включающие катионы аммония NH4+ и кислотные остатки. Физические свойства:соли аммония – т
Оксиды азота
С кислородом Nобразует оксиды: N2O, NO, N2O3 NO2, N2O5 и NO3. Оксид азота I – N2O –закись азота, «веселящий газ». Физические свойства:
Азотная кислота
Азотная кислота– бесцветная, «дымящаяся» на воздухе жидкость с едким запахом. Химическая формула HNO3. Физические свойства.При температуре
Аллотропные модификации фосфора
Фосфор образует несколько аллотропных видоизменений – модификаций. Явление аллотропных модификаций у фосфора вызвано образованием различных кристаллических форм. Белый фосфо
Минеральные удобрения
Минеральные удобрения– неорганические вещества, в основном соли, включающие в себя необходимые для растений элементы питания и используемые для повышения плодородия
Углерод и его свойства
Углерод (С)– типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, Ar = 12,011 а.е.м., заряд ядра +6.
Аллотропные модификации углерода
Углерод образует 5 аллотропных модификаций: кубический алмаз, гексагональный алмаз, графит и две формы карбина. Гексагональный алмаз найден в метеоритах (минерал
Оксиды углерода. угольная кислота
Углерод с кислородом образует оксиды: СО, СО2, С3О2, С5О2, С6О9 и др. Оксид углерода(II) – СО. Физические свойства:угарный газ, б
Кремний и его свойства
Кремний (Si) –стоит в 3 периоде, IV группе главной подгруппы периодической системы. Физические свойства:кремний существует в двух модификациях: амо
Существуют три типа внутренней структуры первичных частиц.
1. Суспензоиды (или необратимые коллоиды)– гетерогенные системы, свойства которых можно определить развитой межфазовой поверхностью. По сравнению с суспензиями более высокодисперсн
Соли кремниевой кислоты
Общая формула кремниевых кислот – n SiO2?m H2O.В природе находятся в основном в виде солей, в свободной форме выделены немногие, например, HSiO (орток
Получение цемента и керамики
Цементявляется важнейшим материалом в строительстве. Цемент получают обжигом смеси глины с известняком. При обжиге смеси CaCO3 (кальцированная сода)
Физические свойства металлов
Все металлы имеют ряд общих, характерных для них свойств. Общими свойствами считаются: высокая электропроводность и теплопроводность, пластичность. Разброс параметров у мет
Химические свойства металлов
Металлыобладают низким потенциалом ионизации и сродством к электрону, поэтому в химических реакциях выступают в качестве восстановителей, в растворах образуют
Металлы и сплавы в технике
В периодической системе из 110 известных элементов 88 – металлы. В XX векепри помощи ядерных реакций были получены радиоактивные металлы, которых не существ
Основные способы получения металлов
Большое количество металлов находится в природе в виде соединений. Самородными металламиназываются те, которые встречаются в свободном состоянии (золото, платина, р
Коррозия металлов
Коррозия металлов(corrosio – разъедание) – физико-химическая реакция металлов и сплавов с окружающей средой, в результате чего они теряют свои свойства. В основе ко
Защита металлов от коррозии
Защита металлов и сплавов от коррозии в агрессивных средах основывается на: 1) повышении коррозионной стойкости самого материала; 2) снижении агрессивности
Общая характеристика подгруппы лития
Подгруппа лития– 1 группа, главная подгруппа – включает щелочные металлы: Li – литий, Na – натрий, K – калий, Cs – цезий, Rb – рубидий, Fr – франций. Общая электрон
Натрий и калий
Натрий и калий –щелочные металлы, стоят в 1 группе главной подгруппы. Физические свойства: схожи по физическим свойствам: легкие серебрис
Едкие щелочи
Щелочи образуют гидроксиды щелочных металлов 1 группы главной подгруппы при растворении их в воде. Физические свойства:растворы щелочей в воде мылкие на ощ
Соли натрия и калия
Натрий и калий образуют соли со всеми кислотами. Соли натрия и калия очень похожи по химическим свойствам. Характерная особенность этих солей – хорошая растворимость в воде, поэтому
Общая характеристика подгруппы бериллия
К подгруппе бериллия относятся: бериллий и щелочноземельные металлы: магний, стронций, барий, кальций и радий. Наиболее распространены в природе в виде соединений,
Кальций
Кальций (Са) –химический элемент 2-й группы периодической системы, является щелочноземельным элементом. Природный кальций состоит из шести стабильных изотопов. Конф
Жесткость воды и способы ее устранения
Так как кальций широко распространен в природе, его соли в большом количестве содержатся в природных водах. Вода, имеющая в своем составе соли магния и кальция, называется ж
Общая характеристика подгруппы бора
Внешняя электронная конфигурация у всех элементов подгруппы – s2p1. Характерным свойством подгруппы IIIAявляется полное отсутствие металлических свойств у бора и ти
Алюминий. Применение алюминия и его сплавов
Алюминий расположен в 3-й группе главной подгруппы, в 3 периоде. Порядковый номер 13. Атомная масса
27. Р-элемент. Электронная конфигурация: 1s22s22p63s23p1.На вне
Оксид и гидроксид алюминия
Оксид алюминия – Al2O3. Физические свойства:оксид алюминия – белый аморфный порошок или очень твердые белые кристаллы. Молекулярная масса = 101,96, плотность – 3,97
Общая характеристика подгруппы хрома
Элементы подгруппы хромазанимают промежуточное положение в ряду переходных металлов. Имеют высокие температуры плавления и кипения, свободные места на электронных о
Оксиды и гидроксиды хрома
Хром образует три оксида: CrО, Cr2О3 и CrО3. Оксид хрома II (CrО)– основный оксид – черный порошок. Сильный восстановитель. CrО растворяется в разбавленной соляной
Хроматы и дихроматы
Хроматы– соли хромовой кислоты Н2Сг04,существующей лишь водных растворах с концентрацией не выше 75 %. Валентность хрома в хроматах – 6. Хроматы ще
Общая характеристика семейства железа
Семейство железавходит в состав побочной подгруппы восьмой группы и является в ней первой триадой, включающей в себя железо, кобальти никел
Доменный процесс
Доменный процесс –выплавка чугуна в доменной печи. Доменная печь выкладывается огнеупорными кирпичами высотой 30 м и внутренним диаметром 12 м. Верхняя половина – ш
Чугун и стали
Сплавы железа – металлические системы, основным компонентом которых является железо. Классификация сплавов железа: 1) сплавы железа с углеродом (н
Тяжелая вода
Тяжелая вода– оксид дейтерия D2O с кислородом природного изотопного состава, бесцветная жидкость без запаха и вкуса. Тяжелая водабыла откр
Химические и физические свойства.
У тяжелой воды температура кипения – 101,44 °C, температура плавления – 3,823 °C. Кристаллы D2Oимеют такую же структуру, как и кристаллы обычного льда, различие в размерах
Соли соляной кислоты
Соли соляной кислоты или хлориды– соединения хлора со всеми элементами, имеющими меньшее значение электроотрицательности. Хлориды металлов
Получение связанного азота из атмосферного воздуха в плазменных реакторах интенсивно исследуется как у нас в стране, так и за рубежом, особенно в последние 10 лет. Пока плазменный метод по всем показателям уступает аммиачному, в первую очередь по расходу электроэнергии, который примерно в 7-10 раз выше. Однако разница становится менее ощутимой, если плазменный процесс совмещают с разложением фосфорсодержащего сырья в атмосфере воздуха с одновременной фиксацией азота. Дальнейшая переработка дает возможность получать из пятиокиси фосфора и окислов азота смесь фосфорной и азотной кислот для производства комплексных удобрений. Открываются определенные перспективы и для утилизации других компонентов фосфорсодержащего сырья. При диссоциации фосфорсодержащего сырья в плазме происходит практически полное его обесфторивание и выделение четырехфтористого кремния. Кроме того, отпадает необходимость в переработке фосфогипса, как это имеет место при сернокислотной переработке фосфатов, поскольку в плазмохимическом процессе образуется окись кальция. Варьируя температуру плазмохимического процесса, можно сначала обесфторить фосфорсодержащее сырье, а затем при более высокой температуре (около 3500 К) превращать его в пятиокись фосфора или получить в присутствии добавок (например, двуокиси кремния и углерода) элементарный фосфор, силикат и карбид кальция и окись углерода.
Оксид кальция, формула CaO, нередко называют негашеной известью. Настоящая публикация поведает вам о свойствах, получении, а также применении этого вещества.
Оксид представляет собой кристаллическое вещество, имеющее кубическую границентрированную кристаллическую решетку. 

Вот и все основные сведения об этом соединении. Как уже упоминалось выше, его часто называют негашеной известью. А знаете ли вы, что понятие извести в химии весьма растяжимое? Существуют также гашеная, хлорная и натровая извести.
Что такое сао в химии
57. Оксид и гидроксид кальция
Оксид кальция (СаO) – негашеная или жженая известь – белое огнестойкое вещество, образованное кристаллами. Кристаллизуется в кубической гранецентрированной кристаллической решетке. Температура плавления – 2627 °C, температура кипения – 2850 °C.
Называется жженой известью из-за способа его получения – обжигание карбоната кальция. Обжиг производят в высоких шахтных печах. В печь закладывают слоями известняк и топливо, а затем разжигают снизу. При накаливании происходит разложение карбоната кальция с образованием оксида кальция:
Так как концентрации веществ в твердых фазах неизменны, то константу равновесия этого уравнения можно выразить так: K = [CO2].
При этом концентрация газа может быть выражена с помощью его парциального давления, то есть равновесие в системе устанавливается при определенном давлении диоксида углерода.
Давление диссоциации вещества – равновесное парциальное давление газа, получающееся при диссоциации вещества.
Чтобы спровоцировать образование новой порции кальция, необходимо повысить температуру или удалить часть получившегося CO2, при этом уменьшится парциальное давление. Поддерживая постоянное более низкое парциальное давление, чем давление диссоциации, можно добиться непрерывного процесса получения кальция. Для этого при обжигании извести в печах делают хорошую вентиляцию.
1) при взаимодействии простых веществ: 2Ca + O2 = 2CaO;
2) при термическом разложении гидроксида и солей: 2Ca(NO3)2 = 2CaO + 4NO2? + O2?.
1) взаимодействует с водой: СаO + H2O = Са(OH)2;
2) реагирует с оксидами неметаллов: СаO + SO2 = CaSO3;
3) растворяется в кислотах, образуя соли: CaO + 2HCl = CaCl2 +H2O.
Гидроксид кальция (Ca(OH)2 – гашеная известь, пушонка) – белое кристаллическое вещество, кристаллизуется в гексагональной кристаллической решетке. Является сильным основанием, плохо растворимым вводе.
Известковая вода – насыщенный раствор гидроксида кальция, имеющий щелочную реакцию. На воздухе мутнеет в результате поглощения углекислого газа, образуя карбонат кальция.
1) образуется при растворении кальция и оксида кальция вводе: CaO + H2O = Са(OH)2 + 16 ккал;
2) при взаимодействии солей кальция со щелочами: Ca(NO3)2 + 2NaOH = Ca(OH)2 + 2NaNO3.
1) при нагревании до 580 °C разлагается: Са(OH)2 = СаO + H2O;
2) реагирует с кислотами: Ca(OH)2 + 2HCl = CaCl2 + 2H2O.