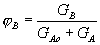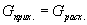Что такое селективность реакции
Что такое селективность реакции
1.2.Выход продукта и селективность
Максимальная масса продукта, которая может быть получена из данного сырья, рассчитывается по уравнению реакции, при этом учитывается содержание в сырье реагента, подлежащего превращению.
Для сложных реакций, когда с одним и тем же исходным веществом могут происходить несколько химических превращений и образовываться различные продукты, оценивать ход процесса лишь по степени превращения или выходу недостаточно. Степень превращения может быть высокой, т. е. большая часть исходных продуктов вступает в химическую реакцию, но не всегда приводит к образованию нужных (целевых) продуктов. Наряду с целевыми могут образовываться побочные продукты. Чем больше образуется целевых и меньше побочных продуктов, тем эффективнее протекает процесс. Для характеристики таких сложных процессов и установление доли целевых продуктов в общем, количестве полученных веществ пользуются величиной селективности.
Поскольку общая масса полученных продуктов равна массе прореагировавшего вещества 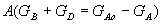
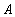
Материальный баланс составляется из расчёта расхода сырья и полученных продуктов на единицу основного продукта. Поскольку на практике приходится иметь дело не с чистыми веществами, а с сырьём сложного химического состава, при составлении материального баланса учитывается масса всех компонентов. Для этого используются данные анализов.
В большинстве случаев масса вещества определяется отдельно для твёрдой, жидкой и газовой фаз. Таким образом, уравнение материального баланса имеет вид:
где 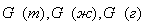
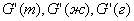
В практических расчётах не всегда присутствуют все три фазы, может быть несколько веществ в какоё-то одной фазе и тогда уравнение (1.1) может упрощаться или усложняться. Нередко материальный баланс составляется для какой-нибудь одной фазы гетерогенного процесса, происходящего в реакторе. Тогда в процессе перехода веществ из одной фазы в другую масса веществ, поступающих в реактор в составе этой фазы (например, газовой), не равна массе веществ, выходящих из реактора. В реакторе увеличивается или уменьшается масса веществ в данной фазе. В этом случае общее уравнение материального баланса, например, для газовой фазы, примет вид:
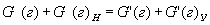
где 
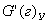
Результаты расчётов сводятся в таблицу материального баланса по массе исходных веществ и продуктов реакции и выражаются в кг. При несовпадении 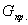
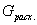
Селективность (химия)
Математически общая химическая селективность S выражается для продукта j в замкнутой системе по формуле:
Для непрерывной системы выход рассчитывается с использованием молярных расходов:
Селективность реакции обычно зависит от температуры, состава, давления и многих других факторов, таких как однородность раствора. Его необходимо тщательно смоделировать, чтобы не повлиять на урожайность во время индустриализации («масштабирования») процесса.
Резюме
Селективность в органической химии
Мгновенная селективность, глобальная селективность и урожайность
Глобальная селективность, определенная выше, представляет собой интегрированную форму мгновенной селективности. Мгновенная дискриминация определяется следующим образом:
С помощью набора дифференциальной записи можно выразить мгновенную селективность как алгебраическую функцию скоростей реакции:
Общая селективность, которая представляет собой среднее значение мгновенной селективности, получается путем интегрирования:
В случае идеальных реакторов:
Знание мгновенной селективности позволяет определить концентрацию интересующего продукта j для заданной скорости превращения ограничивающего реагента i :
∫ нет ^ j ( 0 ) нет ^ j ( т ) d нет ^ j знак равно ν j ν я ∫ нет ^ я ( 0 ) нет ^ я ( т ) s j / я ⋅ d нет ^ я <\ displaystyle \ int \ limits _ <<\ hat
Общая селективность позволяет определить выход продукта j :
Общая химическая технология. Химические процессы и реакторы (стр. 2 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 11 |
Таким образом, для обратимых сложных реакций

Как и степень превращения, выход продукта для реакционных систем с постоянным объемом может быть определен как отношение концентраций. Следует также помнить, что выход, выражаемый как доля от некоторой предельно возможной величины, изменяется от 0 до 1.
Селективность. Выход продукта характеризует полученный результат, как долю от предельно возможного результата. Целесообразно оценить и реальную ситуацию, т. е. дать количественную оценку эффективности целевой реакции по сравнению с побочными взаимодействиями.
Критерием для такой оценки является селективность. Селективность, как и два предыдущих критерия эффективности, выражают в долях единицы или процентах.
Полная, или интегральная, селективность φ – это отношение количества исходного реагента, расходуемого на целевую реакцию, к общему количеству исходного реагента, пошедшего на все реакции (и целевую, и побочные):

Мгновенной, или дифференциальной, селективностью φ/ называют отношение скорости превращения исходных реагентов в целевой продукт к суммарной скорости расходования исходных реагентов:

где 

Использование дифференциальной селективности при анализе технологических процессов будет описано в гл. 3. Здесь рассмотрим только полную селективность.
Для реакций (III) полная селективность по целевому продукту R может быть выражена через количество полученного продукта R и количество реагента А, суммарно израсходованного на реакцию.
С учетом стехиометрических соотношений количество реагента А, вступившего в реакцию образования целевого продукта, равно (a/r) nR.
Тогда полная селективность

Знаменатель в уравнении (1.15) можно заменить через количество полученных продуктов целевой и побочной реакции с учетом стехиометрических соотношений:
Пример 1.2. Рассмотрим в качестве примера параллельные реакции
4NH3 + 5О2 
4NH3 + ЗО2 
Целевой является реакция получения оксида азота NO.
Селективность можно рассчитать по количеству полученных на выходе из реактора продуктов целевой реакции (оксида азота) и побочной реакции (азота):
Между выходом целевого продукта, степенью превращения исходного реагента и селективностью существует простая связь. Рассмотрим ее сначала на примере необратимых параллельных реакций (IV).
В соответствии с уравнением (1.13) выход продукта R

Реально полученное количество продукта R можно выразить через селективность, пользуясь уравнением (1.15)

После подстановки уравнения (1.17) в уравнение (1.16) получим

Если параллельные реакции обратимы, то максимально возможное количество продукта R, которое могло бы получиться при отсутствии побочной реакции, определяется условиями равновесия. Тогда для определения выхода продукта нужно применить уравнение (1.14). Подставляя в него значение количества реально полученного продукта R, выраженного с помощью уравнения (1.17), будем иметь более общее уравнение связи между выходом, селективностью и степенью превращения:


Из уравнений (1.18) и (1.19) следует, что при выборе условий проведения сложных химических реакций недостаточно обеспечить только высокое значение степени превращения реагентов или только высокую селективность; высокое значение выхода целевого продукта определяется некоторой совокупностью этих критериев эффективности.
Оптимальными значениями выхода, селективности и степени превращения будут, как правило, такие, достижение которых позволяет обеспечить максимальную экономическую эффективность процесса.
Производительность и интенсивность. Важным критерием эффективности работы отдельных аппаратов, цехов или заводов в целом является производительность.
Производительность – это количество продукта, полученное в единицу времени:

где П – производительность; nR – количество продукта; τ – время. Производительность измеряется в кг/ч, т/сут, т/год и т. д. Например, производительность современного агрегата синтеза аммиака составляет 1360 т аммиака в сутки; производительность агрегата по производству серной кислоты – 1 млн т серной кислоты в год и т. д. Иногда производительность оценивают по количеству переработанного сырья, например производительность печи обжига колчедана – 450 т колчедана в сутки. Если известны концентрация продукта в реакционной смеси, для определения производительности удобно воспользоваться следующей формулой:
где cR – концентрация продукта; v – объемный расход реакционной смеси.
Максимально возможная для данного агрегата, машины производительность (проектная) называется мощностью. Одним из основных направлений развития химической промышленности является увеличение единичной мощности агрегатов, так как оно ведет к снижению удельных капитальных затрат, повышению производительности труда.
Для сравнения работы аппаратов различного устройства и размеров, в которых протекают одни и те же процессы, используют понятие «интенсивность».
Интенсивностью называется производительность, отнесенная к какой-либо величине, характеризующей размеры аппарата, – его объему, площади поперечного сечения и т. д.

где V – объем аппарата. Интенсивность измеряется в кг/(ч · м3), т/(сут · м3) и т. д.
При разработке новых процессов или усовершенствовании существующих стремятся к созданию высокоинтенсивных аппаратов. Увеличение интенсивности аппарата часто возможно при создании таких условий проведения процесса, которые обеспечивают его протекание с высокой скоростью.
При анализе работы каталитических реакторов принято относить производительность аппарата в целом к единице объема или массы катализатора, загруженного в реактор. Такую величину, численно равную количеству продукта, полученного с единицы объема или массы катализатора, называют производительностью катализатора, или его напряженностью.
проектировании технологических процессов очень важны термодинамические расчеты химических реакций. Они позволяют сделать заключение о принципиальной возможности данного химического превращения; предварительно выбрать условия проведения процесса; определить равновесный состав продуктов; рассчитать теоретически достижимые степени превращения исходных веществ и выходы продуктов, а также энергетические эффекты (теплоту реакции, теплоту изменения агрегатного состояния и т. д.). Это необходимо для составления энергетических балансов и определения энергетических затрат.
В самом широком смысле термодинамика – это наука о преобразовании энергии. Понятие «энергия» неотъемлемо от движения материи. Движение связано с материей, являясь формой ее существования, а энергия есть мера движения материи. Факт взаимного превращения различных форм движения материи при сохранении количества этого движения является содержанием закона сохранения и превращения энергии.
Наиболее важные понятия термодинамики – «теплота процесса» и «работа». Преобразование теплоты в работу или работы в теплоту осуществляется обычно в термодинамическом процессе посредством рабочего тела. Термодинамическая система называется однородной, если во всех частях системы свойства одинаковы. Совокупность физических свойств рабочего тела (или термодинамической системы) в рассматриваемых условиях называется состоянием тела (или системы). Величины, характеризующие состояние термодинамической системы, называют термодинамическими параметрами. К ним относят температуру, давление, удельный объем, плотность, молярный объем, удельную внутреннюю энергию и др.
Термодинамические параметры делят на экстенсивные и интенсивные. Величины, пропорциональные массе (или количеству вещества) рассматриваемого рабочего тела или термодинамической системы, называются экстенсивными. Это – объем, внутренняя энергия, энтальпия, энтропия и т. п. Экстенсивные параметры обладают свойством аддитивности.
Интенсивные величины не зависят от массы термодинамической системы, и только они служат термодинамическими параметрами состояния. Это – температура, давление, а также экстенсивные величины, отнесенные к единице массы, объема или количества вещества. Изменение интенсивных параметров для ускорения химико-технологических процессов называется интенсификацией.
§ 2.1. Равновесие химических реакций
Под воздействием подвода или отвода энергии в форме теплоты или работы происходит изменение состояния термодинамической системы (значений термодинамических параметров), называемое термодинамическим процессом. Процессы, представляющие собой непрерывный ряд равновесных состояний, называют равновесными. При этом равновесным считают состояние, в которое приходит система при постоянных внешних условиях, характеризуемое неизменностью во времени термодинамических параметров и отсутствием в системе потоков вещества и теплоты.
Устойчивое равновесие характеризуется следующими общими условиями:
1) неизменностью равновесного состояния системы во времени при постоянных внешних условиях;
2) подвижностью равновесия (самопроизвольным восстановлением состояния равновесия после снятия внешнего воздействия, вызвавшего отклонение системы от положения равновесия);
3) динамическим характером равновесия, т. е. установлением и сохранением равновесия вследствие равенства скоростей прямого и обратного процессов;
4) возможностью подхода к состоянию равновесия с двух противоположных сторон;
5) минимальным значением энергии Гиббса G в изобарно-изотермических и энергии Гельмгольца F в изохорно-изотермических процессах (dG = 0, d2G > 0, dF = 0, d2F > 0).
Из этих общих условий выводятся конкретные условия для химического равновесия.
Химические реакции, как правило, обратимы: наряду с химическим взаимодействием между исходными веществами (прямая реакция) протекает взаимодействие и между продуктами (обратная реакция). По мере протекания процесса скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается; в какой-то момент времени скорости прямой и обратной реакций становятся равными – наступает состояние химического равновесия. Химическое равновесие характеризуется неизменностью числа молекул веществ, составляющих химическую систему, при неизменных внешних условиях. Так как условием равновесия при постоянных температурах Тир служит минимум энергии Гиббса (G = 0), то в условиях химического равновесия должно также соблюдаться равенство

где μJ – химический потенциал компонента J; nJ – количество компонента J (моль).
Известно, что химическим потенциалом называется величина
Большая положительная величина μ указывает на высокую реакционную способность частиц.
Закон действующих масс. Впервые зависимость направления химического процесса от концентрации реагирующих веществ установил Н. Н. Бекетов (1865), убедительно обосновав это положение значительным числом опытов. В математической форме закон действующих масс был выражен Гульдбергом и Вааге (1867).
Рассмотрим кинетический вывод закона действующих масс на примере гомогенной реакции
аА + bВ 
Как известно из курса общей химии, скорость прямой реакции пропорциональна произведению концентраций реагентов А и В:
а скорость обратной реакции – произведению концентраций продуктов R и S:
Каждая концентрация возведена в степень, равную стехиометрическому коэффициенту компонента в химическом уравнении. Из условия равенства скоростей прямой и обратной реакций в момент химического равновесия
где – равновесные концентрации.
Отношение констант скоростей, называемое константой равновесия, обозначим через Кс. Получаем выражение закона действующих масс:
Как следует из выражения (2.1), константа равновесия не зависит от концентрации, так как изменение концентрации одного из участников реакции вызовет такие изменения концентрации всех остальных веществ, что Кс сохранит свое числовое значение. Таким образом, основное значение закона действующих масс состоит в том, что он устанавливает связь между равновесными концентрациями всех реагирующих веществ.
При анализе реакций, протекающих в газовой фазе, константу равновесия выражают через парциальные давления:
Так как в соответствии с уравнением Менделеева – Клапейрона
рJ = сJRT, то
где ∆n = (r + s – a – b), если все участники реакции (I) – газообразные вещества.
Константу равновесия можно выразить также через отношение молярных долей NJ участников реакции:
или через их количество nJ (моль):
Для реальных систем константу равновесия выражают через летучести f или активности а. Так, для рассматриваемой реакции (I)
При небольших давлениях при любых температурах

Константа равновесия и энергия Гиббса. Уравнение изотермы Вант-Гоффа. Для рассматриваемой реакции (I) изменение энергии Гиббса выразится уравнением

Поскольку все участники реакции – идеальные газы, то при постоянной температуре

где – стандартный химический потенциал вещества J (индекс ° означает стандартное состояние). Для идеальных газов за стандартное принято их состояние, при давлении 0,098 МПа и температуре 298 К. Подставляя химические потенциалы, выраженные в соответствии с формулой (2.4), в уравнение (2.3) и группируя слагаемые, получим
Так как первое выражение в скобках есть ∆Go, т. е. изменение энергии Гиббса в стандартном состоянии, то
В условиях химического равновесия ∆G = 0 и, следовательно,
Стандартная энергия Гиббса является характерной для реакции постоянной величиной. Поэтому и выражение под знаком логарифма должно быть постоянным. Обозначив его через Kр, получим

Величина Кр, входящая в уравнение (2.5), является термодинамической константой равновесия.
Не следует забывать, что в выражение термодинамической константы равновесия входят не абсолютные значения равновесных парциальных давлений или концентраций веществ, участвующих в реакции, а относительные, т. е. безразмерные величины (например, давления, отнесенные к значениям стандартного давления). Поэтому термодинамические константы равновесия безразмерны.
Уравнение (2.5) называется уравнением изотермы Вант-Гоффа. Оно в общем виде связывает между собой энергию Гиббса и константу равновесия, которую можно вычислить, зная ∆Go.
Значения стандартных энергий Гиббса образования многих тысяч химических соединений сведены в таблицы термодинамических свойств и приведены в справочной литературе. В случае отсутствия табличных значений ∆Go их рассчитывают, используя уравнение

где ∆Н°, ∆S° – стандартные изменения энтальпии и энтропии. Значения этих стандартных термодинамических величин также приводятся в литературе.