Что такое сероконверсия при коронавирусе
Иммунный ответ на коронавирус SARS-CoV‑2 у больных COVID‑19
Академик Российской академии наук, д.м. н., президент
ФБГУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
В статье представлен анализ результатов исследований иммунного ответа и памяти к SARS-CoV‑2, включая все ветви адаптивного иммунитета, иммуноглобулины, В-клетки памяти, CD8+- и CD4+-T-клетки у больных в динамике в течение 6–8 месяцев после начала заболевания.
Гуморальное звено
Факт первичного иммунного ответа слизистых на COVID‑19 необычен и требует объяснения. Обсуждаются две гипотезы.
Первая: вирусы контаминируют слизистые дыхательных путей и ЖКТ за 7–14 дней до появления системного ответа и клинических проявлений инфекции, поражая клетки микробиоты — используют их для репродукции вируса.
Вторая: кросс-реактивная продукция антител, предпосылкой которой являются Spike-реактивные CD4+-Т-клетки, обнаруженные у большинства пациентов с COVID‑19 и более чем у 34 % неинфицированных людей. Это подтверждает существование общих эпитопов эндемичных коронавирусов, вызывающих банальные ОРВИ и COVID‑19.
Важно, что изотипы иммуноглобулинов (либо IgG, либо IgA) конкурировали за нейтрализующую активность по отношению к SARS-CoV‑2 в зависимости от локализации. Сывороточные антитела IgG сильно коррелировали с величиной IgG-ответа и тяжестью заболевания. У пациентов, например, с IgA-назальным ответом определялась высокая активность нейтрализации вирусов. Инфекция у таких больных протекала бессимптомно.
Это, с одной стороны, предполагает возможность нейтрализации вируса с помощью IgA слизистых без системного ответа, что имеет отношение к исходам заболевания. А с другой стороны, из-за множества корреляций, наблюдаемых между типами антител и их активностью в разных анатомических участках, клиническая интерпретация гуморального ответа существенно затруднена.
Кроме того, эти данные имеют важное значение для нашего понимания защиты вакцинации, индуцирующей системный ответ на вакцинные гены или белки коронавируса по классическому пути и обеспечивающей иммунный ответ слизистых оболочек на 3–6‑й неделе после вакцинации. В идеале вакцина должна не только защитить реципиента от неизбежной болезни, но и предотвратить бессимптомное носительство, что закрыло бы проблему бессимптомных носителей в популяции.
Титры Spike IgА и RBD IgА сохранялись на стабильном уровне на протяжении всего периода наблюдения t1/2— 210 дней, но у отдельных пациентов уровень специфических IgА-антител достоверно снижался через 90 дней.
Нельзя дать однозначный ответ в отношении серонегативных случаев COVID‑19. По-видимому, кроме протективного эффекта иммунитета слизистых, ответ напрямую связан с уровнем вирусной нагрузки SARS-CoV‑2. С одной стороны, высокие вирусные нагрузки связаны с более ранним ответом антител, в то время как у пациентов с низкой вирусной нагрузкой не может быть сероконверсии. С другой стороны, кинетика иммунного ответа может быть показателем скорости элиминации вируса у больного.
Идентификация специфичных В-клеток памяти к Spike, RBD и NCP с использованием флюоресцентно окрашенных зондов на IgD– и (или) CD27+ c последующей дифференцировкой по изотипам поверхностных IgM, IgG или IgA показала следующее. Количество специфических В-клеток увеличивалось в течение 120 дней после начала заболевания с последующим выходом на плато, в то время как Spike-специфические В-клетки памяти у людей, не заболевших COVID‑19, практически не встречались. RBD-специфические В-клетки появлялись на 16‑й день, и их количество увеличивалось в течение последующих 4–5 месяцев. Интересно, что только 10–30 % Spike-специфических В-клеток памяти было специфично для домена RBD через 6 месяцев после выздоровления больных.
NCP-специфичные В-клетки памяти также стабильно увеличивались в те же сроки и определялись спустя 5–6 месяцев после заболевания. Представленность изотипов иммуноглобулинов Spike-специфических В-клеток имела следующую динамику. В ранней фазе (20–60 дней) после заболевания IgM+ и IgG+ на В-клетках были представлены одинаково. В период после 60 дней до 240‑х суток преобладали IgG+ Spike-специфические В-клетки. Частота IgА+ Spike-специфических клеток составляла примерно 5 %, и они равномерно распределялись в течение всего периода наблюдения в 8 месяцев. Корреляция между сывороточным IgA и IgA слизистых оболочек не проводилась.
Сходная картина динамики наблюдалась и в случае IgG+, IgM+ и IgА+ к эпитопам RBD и NCP коронавируса. В то же время долгосрочное присутствие циркулирующих В-клеток памяти, направленных как против основных SARS-CoV‑2‑нейтрализующих таргетов (Spike и RBD), так и против не нейтрализующего таргета (NCP), свидетельствует о клеточной памяти, сохраняющейся после естественного воздействия вируса. Это может быть использовано для планирования ревакцинации. Тот факт, что почти все RBD- специфические IgG+-В-клетки памяти экспрессировали CD27, свидетельствует о долгосрочной иммунной памяти.
Анализ полученных данных говорит о том, что снижение нейтрализующих и других антител к SARS-CoV‑2 после клинического выздоровления вовсе мунитета. Просто с развитием и сохра- нением памяти В-клеток, способных активизироваться при встрече с новыми штаммами коронавируса, уровень антител в сыворотке снижается, в то время как IgА-ответ слизистых сохраняется на постоянном уровне в течении всего периода наблюдения.
Клеточный ответ
Процент больных с обнаруживаемыми циркулирующими CD8+-Т-клетками памяти через месяц после возникновения симптомов составил 70 %. К 6–9 месяцам клетки обнаруживались у 50 % выздоровевших пациентов. Фенотипические маркеры показали, что большинство SARS-CoV‑2‑специфичных CD8+-Т-клеток представлены терминально дифференцированными клетками памяти.
Циркулирующие SARS-CoV‑2‑специфичные CD4+-Т-клетки памяти через месяц после начала заболевания обнаруживались у 93 % пациентов. Через 6–9 месяцев уровень этих клеток был стабильным, а сами они выявлялись у более чем у 90 % пациентов, перенесших COVID‑19. Причем это касалось как Spike-специфичных, так и мембраноспецифичных CD4+-Т-клеток памяти.
Интересно, что при сравнении параметров иммунного ответа у больных с тяжелым и легким течением инфекции гуморальные показатели были более высокими у тяжелых больных, в то время как CD8+-Т-клетки были стабильными, а CD4+ — более низкими в тяжелых случаях заболевания. Объяснений этому феномену нет, важно, что слабый ответ Т-клеток наблюдается в острой фазе заболевания. Кроме того, важна и методология исследования клеточного им-мунитета.
Нарушения клеточного ответа проиллюстрированы дефицитом интерферонов I и II типов у пациентов с тяжелыми и среднетяжелыми формами COVID‑19 по сравнению с легкими и бессимптомными случаями заболевания. Это может быть связано с подавлением воспаления интерлейкином‑12 (IL‑12) и развитием вторичного дефекта клеточного иммунитета.
Иммунное взаимодействие
Большой интерес представляет изучение взаимодействия гуморального и клеточного ответа на SARS-Cov‑2. В исследованиях RBD-IgG, Spike IgА, RBD-В-клеток памяти, CD8+- и CD4+-Т-клеток в динамике у одних и тех же пациентов установлено, что у большинства из них (64 %) положительные показатели отмечались через 1–2 месяц после начала заболевания. Через 5–8 месяцев число реконвалесцентов, позитивных на пять тестов, снизилось до 43 %. В то же время как минимум три из пяти тестов были положительными спустя 6–9 месяцев. Важно отметить, что IgG на Spike дает на порядок больше положительных ответов, чем на RBD-антиген. Попытки связать гуморально- клеточные взаимодействия не привели к успеху из-за неоднородности участников исследования и методик оценки иммунного ответа.
Неопределенный результат
В метаанализе 22 исследований (4969 пациентов) установлены неблагоприятные признаки тяжелых форм болезни и летальных исходов, такие как лимфопения и нейтрофилез. Поскольку CD4+-Т-клетки необходимы для сбалансированного и эффективного иммунного ответа, неудивительно, что низкий уровень лимфоцитов может отражать гипервоспалительные процессы и способствовать более тяжелому течению заболевания и повышенной смертности.
Нейтрофилы как неотъемлемая часть врожденной защиты контролируют баланс микробиоты и элиминацию продуктов клеточной деструкции за счет производства активных форм кислорода и высвобождения нейтрофильных внеклеточных ловушек в венозном кровотоке. Лимфопения (менее 500 клеток в 1 мкл) указывает на повышение риска тяжелой формы заболевания и смертельных исходов при COVID‑19 в 3 раза. Стойкий нейтрофилез со сдвигом влево свидетельствует об истощении костномозгового резерва, а при сдвиге вправо отражает нарушения выхода клеток в ткани. Этот легко контролируемый анализом крови параметр указывает на более чем семикратное увеличение для пациента риска заболеть тяжело и погибнуть от COVID‑19.
Попытки выявить закономерности иммунного ответа на SARS-CoV‑2 оказались пока безуспешными.
Во-первых, можно сделать вывод, что переболевшие коронавирусной инфекцией сохраняют иммунную память в последующие 6–9 месяцев. Дальнейшие динамические исследования покажут, в какие сроки наступает снижение иммунного ответа, требующее профилактической вакцинации и (или) ревакцинации.
Во-вторых, и это очень интересно, каждый изученный компонент иммунного ответа и иммунной памяти демонстрирует различную кинетику. Это связано с индивидуальным ответом на инфекцию, наличием преморбида и частого превращения моноинфекции в смешанные инфекции SARS-CoV‑2 с активизировавшейся микробиотой больного.
В-третьих, неоднородность ответа может быть центральным признаком, характеризующим иммунную память к SARSCoV‑2. Биологические специфические IgG имеют 21 день периода полураспада, уровень антител с течением времени отражает продукцию короткоживущих, а потом и долгоживущих плазматических клеток. С точки зрения исчезновения возбудителя в течение нескольких дней после появления клиники, процесс наработки антител должен быть снижен к 6 месяцам, но, если SARS-CoV‑2 Spike и RBD IgG сохраняются дольше 8 месяцев, это означает, что вирус персистирует в организме хозяина или его микробиоте. Нельзя исключать и связь с пролонгированным иммунным ответом естественной реиммунизации циркулирующими эпидемическими альфа-коронавирусами, поддерживающими иммунный ответ.
В-четвертых, выявление и анализ SARSCoV‑2‑специфических В-клеток памяти потенциально могут применяться в качестве маркера гуморального ответа при вакцинации. Сейчас исследования поствакцинального иммунного ответа проводятся с использованием иммунофлуоресцентного анализа с оценкой IgM- и IgG-антител в качестве маркеров эффективности вакцины (рис. 3). Методы ИФА-диагностики, к сожалению, не стандартизованы едиными белками S, RBD, NCP, качество которых зависит от очистки антигена. Поскольку количество В-клеток памяти стабильно с течением времени, они могут представлять собой более надежный маркер продолжительности гуморальных иммунных реакций, чем иммуноглобулины сыворотки крови.
Таким образом, из результатов исследований иммунного ответа у больных COVID‑19 невозможно сделать какие-либо выводы о защитном иммунитете при новой коронавирусной инфекции. Ведь изучение антител и клеток памяти при этом заболевании пока еще не завершено. А значит, обсуждаемые механизмы защитного иммунитета против SARS-CoV‑2 у людей окончательно не определены.
Источник: Газета «Педиатрия сегодня» №6, 2021
Бессимптомная сероконверсия иммуноглобулинов при SARS-CoV-2-инфекции и как она может уберечь медперсонал от COVID-19.
Ранее сообщалось, что отделения гемодиализа госпиталей подвержены высокому риску распространения инфекционных заболеваний. Причинами называют невозможность соблюдать социальное дистанцирование в открытых отсеках, большое числа сменяющих друг друга пациентов, а также значительное число процедур как при подготовке к гемодиализу, так и во время его проведения.
Целью исследования, проведённого на базе отдельно стоящего амбулаторного педиатрического отделения для гемодиализа с пятью койками и тремя изолированными помещениями в Riley Hospital for Children, Indianapolis, USA и опубликованного в JAMA, было измерить уровни серийных антител против SARS-CoV-2 у пациентов, медсестер, врачей и обслуживающего персонала, присутствовавших при проведении гемодиализа у пациента с симптомами вирусной инфекции.
Начать проведение данного исследования было решено после того как стало известно, что 7 дней назад (день 0) у одного из пациентов наблюдались лихорадка и общие симптомы вирусного заболевания. Результат ПЦР теста на SARS-CoV-2 в мазке из носоглотки оказался положительным, и оставался положительным при повторных тестах на 7, 14 и 19 день. Сеансы гемодиализа ему проводились в изолированной комнате, начиная со дня 0. При этом весь персонал отделения и пациенты, которым производился гемодиализ, всегда были в масках.
Измерения уровня сывороточного IgM и IgG в сыворотке из образцов цельной крови были произведены у 13 пациентов, проходивших гемодиализ в отделении, у 11 медсестер и 10 врачей отделения, а также у 4 человек из обслуживающего персонала на 7, 14 и 21 дни от начала исследования. Сероконверсией считались положительные анализы на IgM или IgG.
Между 0-м и 7-м днем у 2 человек из медицинского персонала отмечались симптомы вирусного заболевания верхних дыхательных путей и лихорадка при отрицательных результатах ПЦР теста. В дальнейшем один из них сероконвертировал на 21-й день, несмотря на 3 отрицательных результата ПЦР. У остальных участников исследования не проводилось назофарингеальное тестирование на SARS-CoV-2 и не было симптомов COVID-19 до 7-го дня.
К 21 дню у 11 из 25 сотрудников отделения (44%) и у 3 из 13 пациентов (23%) были обнаружены положительные антитела к SARS-CoV-2. При том, что ни у одного из участников исследования между 7 и 21 днями не наблюдалось симптомов заболевания. У одного человека из медицинского персонала, который непосредственно опекал ПЦР-положительного пациента и у двух из 11 медицинских работников, которые ухаживали за 2 двумя пациентами с субклинической сероконверсией, в дальнейшем были обнаружены антитела против SARS-CoV-2. Все они оставались бессимптомными, несмотря на то, что у одного из них всё же был положительным результат теста на ПЦР в мазке из носоглотки.
Данное исследование продемонстрировало высокую распространенность субклинической сероконверсии у лиц, находящихся в контакте с возможными носителями SARS-CoV-2. Это дает надежду, что большее число работников здравоохранения может быть антитело положительными, чем можно было бы ожидать. Информация о серопревалентности медсестер и врачей позволит стратегически правильно укомплектовать персонал по уходу за SARS-CoV-2-позитивными больными и пациентами с подозрением на положительную реакцию, и тем самым уменьшить риск заражения, которому подвергаются медицинские работники в период пандемии COVID-19.
Поскольку это исследование имеет небольшой размер выборки и короткое последующее наблюдение, необходимы более масштабные исследования данной проблемы.
Названы особые симптомы коронавируса «Омикрон»: «не классический COVID»
Простудные проявления могут означать заражение новым вариантом вируса
Насморк, головная боль или усталость могут означать, что у вас, вероятно, есть «Омикрон», предупреждают британские эксперты и отмечают, что в нынешних условиях следует остерегаться этих, а не классических симптомов COVID.
Согласно новому крупному исследованию, которое предполагает, что мутантный коронавирус больше похож на простуду, чем на COVID, насморк, головные боли и усталость, по-видимому, являются отличительными чертами «Омикрона».
Как пишет Daily Mail, анализ случаев заболевания в Лондоне, где «Омикрон» растет наиболее быстро, показал, что наиболее распространенными признаками вируса в период с 3 по 10 декабря оказались насморк, головная боль, усталость, чихание и боль в горле.
Ни один из перечисленных признаков вируса не является «классическим», о которых предупреждают британцев: продолжительный кашель, высокая температура или изменение/потеря чувства вкуса и обоняния.
Эпидемиолог профессор Тим Спектор, ведущий научный сотрудник исследования по отслеживанию симптомов COVID, призвал следить за этими контрольными признаками «Омикрона».
Это предупреждение сопровождается многочисленными сообщениями о том, что «Омикрон» вызывает более легкое заболевание, чем предыдущие варианты COVID, но ученые все еще пытаются разгадать, является ли новый вариант коронавируса по своей сути слабее, или у населения выработался более высокий уровень иммунитета, или даже и то, и другое.
В настоящее время в Великобритании признается только три симптома как ранние предупреждающие признаки заражения коронавирусом: новый непрерывный кашель, высокая температура и потеря или изменение нормального чувства вкуса или запаха.
Но эксперты неоднократно призывали к расширению этого списка, говоря, что в нем не учитываются случаи на ранних стадиях, что увеличивает риск передачи вируса.
Центры контроля заболеваний США и другие страны выявили более десяти предупреждающих знаков COVID и предупреждают свое население о таких вещах, как усталость, головная боль и боли в мышцах.
В отдельных комментариях на этой неделе профессор Тим Спектор сказал, что «классические» симптомы COVID, такие как лихорадка, кашель или потеря обоняния, сейчас присутствуют только в меньшинстве случаев. Он добавил, что «Омикрон», похоже, ослабляет защиту вакцины в Великобритании от инфекций, но уколы по-прежнему имеют решающее значение для защиты людей.
Данные Агентства по безопасности здоровья Великобритании (UKHSA) также показывают, что количество случаев заражения COVID, которые настолько легкие, что не проявляют никаких симптомов, также неуклонно растет с тех пор, как вакцины начали массовое распространение в начале этого года.
В конце апреля этого года 1 процент людей, у которых был положительный результат теста на COVID с помощью ПЦР, не сообщили об отсутствии симптомов, но доля положительных тестов от людей без симптомов выросла до чуть менее 10 процентов к началу декабря.
Реальные данные по Южной Африке также показали, что, хотя «Омикрон» может более эффективно избегать защиты, предлагаемой вакцинами, обычно он вызывает только легкие случаи. Официальные лица в ЮАР, проанализировавшие 78000 случаев заболевания «Омикрон», оценили риск госпитализации на пятую часть ниже, чем у «Дельты», и на 29 процентов ниже, чем у исходного коронавируса.
Но британский главный врач Крис Уитти отклонил эти ранние результаты и призвал к «серьезной осторожности» при применении их результатов к нынешней ситуации в Великобритании.
В Великобритании недавнее мероприятие, ставшее «суперраспространителем», на котором 16 из 18 гостей на вечеринке по случаю дня рождения в начале декабря позже дали положительный результат на «Омикрон», привело только к легким симптомам. Большинство гостей на вечеринке в Сомерсете, на юго-западе Англии, были в возрасте от 60 до 70 лет и были полностью вакцинированы, но все же в конечном итоге заразились на вечеринке «Омикроном» от одного человека с положительным результатом теста. Но никто не был госпитализирован и не нуждался в обращении к врачу, большинство из них страдали от насморка или боли в горле.
Хотя понимание ученых признаков вируса со временем улучшилось, считается, что вакцины также играют роль в уменьшении серьезных симптомов COVID. Это связано с тем, что, хотя уколы от COVID не обеспечивают 100-процентной защиты от заражения вирусом, они значительно снижают вероятность серьезного заболевания.
Прививки против COVID делают это, предоставляя организму инструкции по созданию антител, необходимых для борьбы с инфекцией с самого начала, вместо того, чтобы начинать с нуля, и в то же время позволяют вирусу работать без ограничений. Проще говоря, укол от COVID потенциально помогает превратить тяжелый случай вируса в легкий.
Уровень защиты, предлагаемый уколами против COVID от тяжелого заболевания, вызванного «Омикроном», все еще изучается, но моделирование научно-консультативной группой SAGE на этой неделе показало, что два укола против COVID должны снизить риск смерти от «Омикрона» на 84%, но бустер в два раза лучше предотвращает заболевание, по официальным оценкам.
Моделирование SAGE основывалось на предположении, что две дозы Pfizer обеспечивают 83,7% защиты от госпитализации и смерти от высокоразвитого штамма. По оценкам, двухдозовый курс вакцины AstraZeneca снижает риск тяжелого заболевания от «Омикрона» на 77,1%.
Но даже хотч большинство случаев протекает в легкой форме, система здравоохранения Великобритании по-прежнему готовится к увеличению числа людей, которым требуется стационарное лечение из-за «Омикрона». Это связано с тем, что, даже если он более мягкий, этот вариант выглядит более заразным и приведет к отправке в больницу большего количества людей. Профессор Крис Уитти предупредил, что «вполне возможно», что количество ежедневных госпитализаций в связи с коронавирусом в последней волне может превысить пиковое значение в 4583 человека в январе.
Коронавирус SARS-CoV-2, нейтрализующие антитела IgG к S-белку (Roche, Швейцария) (кол.) в Москве
Количественное определение нейтрализующих, или защитных, антител класса IgG к рецептор-связывающему домену (RBD) S-белка коронавируса SARS-CoV-2 в сыворотке крови.
Приём и исследование биоматериала
Когда нужно сдавать анализ Коронавирус SARS-CoV-2, нейтрализующие антитела IgG к S-белку (Roche, Швейцария) (кол.)?
Подробное описание исследования
Исследование может быть использовано для количественной оценки гуморального иммунного ответа у пациентов после перенесённой коронавирусной инфекции, а также после иммунизации против COVID-19 вакциной «Спутник V» (Гам-КОВИД-Вак) и другими, кроме вакцины «ЭпиВакКорона».
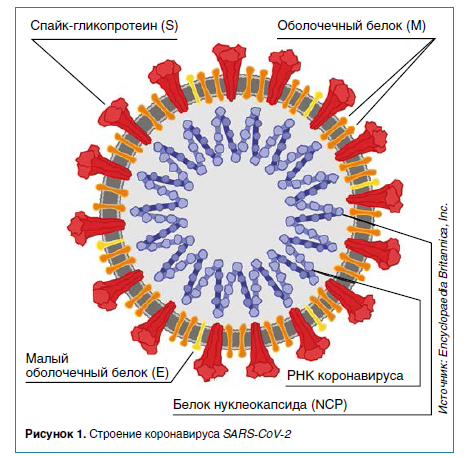
Возбудитель COVID-19 (COronaVIrus Disease 2019) – это РНК-содержащий бета-коронавирус SARS-CoV-2 семейства Coronaviridae. Геном вируса кодирует 4 главных структурных белка: нуклеокапсидный (N), мембранный (М), оболочечный (E) и шиповидный (S).
На внешней поверхности оболочки вириона находятся «шипы», образованные S-белком (от английского Spike – шип). Благодаря «шипам» происходит проникновение вириона в клетку. S-белок состоит из двух функциональных субъединиц: S1 (содержащая RBD-домен) обеспечивает связывание с рецептором клетки-мишени (АПФ2, ACE2), S2 способствует слиянию вируса и клеточной мембраны. Эти особенности белка S сделали его перспективной мишенью при разработке вакцин против SARS-CoV-2.
Рецепторы АПФ2 представлены на оболочках клеток органов дыхательной и центральной нервной системы, пищевода, подвздошной кишки, почек, мочевого пузыря, сердца. Новый коронавирус способен поражать нервные клетки, в том числе клетки головного мозга, с чем связывают расстройство восприятия запахов у некоторых пациентов.
Как правило, инфекционный процесс начинается после проникновения вируса в эпителиальные клетки, выстилающие слизистые оболочки верхних дыхательных путей. В зараженных клетках начинается активная репликация вируса – многократное увеличение числа копий вирусных частиц, или вирионов. Новые вирионы выходят из пораженных клеток и заражают все большее количество здоровых клеток уже не только верхних, но и нижних дыхательных путей. В том числе возможно поражение альвеолярных клеток II типа, что определяет развитие пневмонии.
Инфекция SARS-CoV-2 может протекать бессимптомно (до 50% случаев), в легкой и в тяжелой формах. В последнем случае возможно развитие острого респираторного синдрома (Severe Acute Respiratory Syndrome, SARS) на фоне двусторонней пневмонии. Инкубационный период длится 2–14 суток (чаще 5–7 суток), после чего у пациента появляются симптомы острой респираторной вирусной инфекции.
Все инфицированные коронавирусом, даже те, у кого инфекция протекает в стёртой или в бессимптомной форме, являются источником инфекции уже в первые дни после заражения. Они выделяют вирусные частицы в окружающую среду с выдыхаемым воздухом, при разговоре, кашле, чихании. Вирусовыделение в среднем продолжается около 20 суток, однако в отдельных случаях может продолжаться дольше месяца.
В настоящее время во многих странах ведётся разработка вакцин против SARS-CoV-2, большая часть которых должна стимулировать иммунный ответ к RBD-домену S-белка. В Российской Федерации пока зарегистрировано две вакцины для профилактики COVID-19. Обе вакцины направлены на формирование клеточного и гуморального иммунитета. То есть, активацию иммунных клеток – Т-лимфоцитов – и выработку антител класса IgG к RBD-домену S-белка.
В связи с тем, что новая коронавирусная инфекция пока недостаточно изучена, а также с коротким сроком применения вакцин, пока достоверно не известен срок циркуляции в крови нейтрализующих антител.
Особенности и преимущества методики
Тест-система: Elecsys Anti-SARS-CoV-2 S для использования на иммунохимических анализаторах cobas® (Roche Diagnostics)
Использованная литература
Другие названия этого исследования
Quantitative Determination of Neutralizing Antibodies to The SARS-CoV-2 Spike (S) Protein
Подготовка к исследованию
Противопоказания и ограничения
Абсолютных противопоказаний нет.
Интерпретация результата
257 BAU/ml, свидетельствует о достаточном уровне гуморального иммунного ответа. Показатели сероконверсии и периода циркуляции антител обусловлены индивидуальными особенностями организма, и нет объективных причин для их оценки у пациентов с достаточным уровнем иммунного ответа.