Что такое симптоматическое лечение остеоартроза
Что такое остеоартроз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Фомичев А. А., травматолога со стажем в 8 лет.
Определение болезни. Причины заболевания
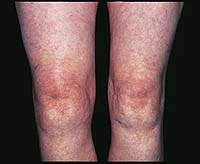
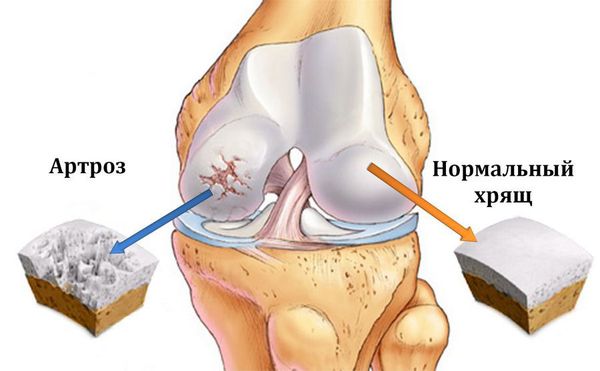
Остеоартроз (артроз) — заболевание суставов, характеризующееся дегенеративным изменением покрывающего кость хряща, проще говоря, его разрушением.
Подавляющее число поражаемых суставов — это коленный, тазобедренный, плечевой и первый плюсне-фаланговый. Поражение других суставов встречается намного реже и часто является вторичным. Остеоартроз поражает 12% трудоспособного населения только европейской части Российской Федерации, причем в последние годы вызванная им нетрудоспособность выросла в 2 раза. [1]
Как и у любого заболевания, у остеоартроза также имеются факторы риска его развития, которые и сегодня активно изучаются, и список ежегодно расширяется. [5] Основными принято считать:
— нарушения обмена веществ;
— повышенный вес тела;
— неполноценное и нерегулярное питание;
— артрит (воспалительный процесс в суставе);
— очаги хронической инфекции или воспаления (например, хронический тонзиллит).
— варикозное расширение вен нижних конечностей.
Симптомы остеоартроза
Общие симптомы артроза включают:
Суставная боль редко бывает острой, чаще ноющего или тупого характера, как правило, прекращающаяся во время покоя. Симптомы часто носят волнообразный характер, могут возникать и прекращаться без попыток лечения. Они могут быть незначительными, умеренными или тяжелыми. Жалобы при остеоартрозе могут оставаться примерно одинаковыми в течение многих лет, но со временем прогрессируют, и состояние ухудшается. Незначительные и умеренные симптомы возможно контролировать на одном уровне, а вот тяжелое течение заболевания может привести к хронической боли, неспособности выполнять ежедневные бытовые действия, что влечет за собой и потерю трудоспособности, вплоть до инвалидизации.
Патогенез остеоартроза
Классификация и стадии развития остеоартроза
Разделяют заболевание на 2 большие группы: первичный (или идиопатический) и вторичный. Первая группа развивается в результате либо неясной причины, либо в результате возрастных изменений. Вторая характеризуется четкими причинами и развивается в результате их патологического процесса (например, на фоне туберкулеза, рассекающего остеохондрита, субхондрального некроза и т.д.)
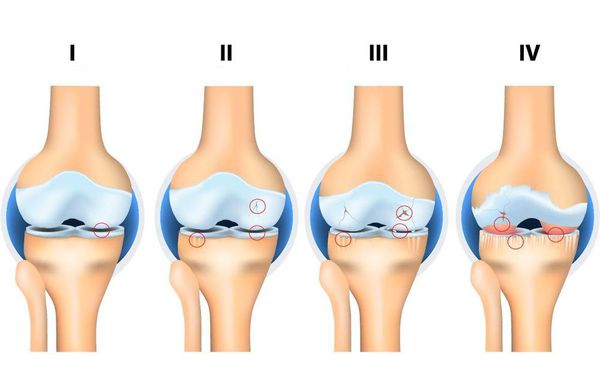
Независимо от причин, которые явились фактором развития остеоартроза, различаются 4 стадии его развития:
1 стадия: твердые структуры сустава в процесс разрушения не вовлекаются, имеются начальные изменения в его мягких структурах и в составе суставной жидкости (которая является питательной средой и снижающей трение сустава), происходит нарушение питания сустава.
2 стадия: сопровождается «запуском» механизма разрушения твердых структур сустава, образуются краевые твердые образования (экзостозы, остеофиты). Умеренные жалобы на изменения в объеме движений.
3 стадия: сопровождается сужением суставного просвета, выраженным разрушением нагружаемой поверхности с образованием костно-хрящевых дефектов, выраженным ограничением движений, постоянным чувством «хруста» при движении, начальными изменениями оси конечности.
4 стадия: тяжелая, при которой движения выраженно ограничены в суставе вплоть до полного его отсутствия (анкилоз), выраженным воспалительным процессом, его деформацией, образованием костных дефектов (в результате полного отсутствия хрящевого покрова).
Осложнения остеоартроза
Без лечения любое заболевание дает осложнения, и артроз не исключение. Если это первичная форма, то к основным осложнениям относятся:
Если это вторичная форма, то осложнения зависят от процесса, вызвавшего развитие артроза. Например, это может привести к остеопорозу, хроническому заболеванию, которое характеризуется прогрессирующим нарушением обмена веществ в костной ткани. Вследствие этого кости становятся хрупкими, нарушается их питание, в итоге остеоартроз осложняется угрозой внутрисуставных переломов. Поэтому так важно обратиться к врачу своевременно. Как писал выдающийся русский хирург Н.И.Пирогов: «Будущее принадлежит медицине профилактической».
Диагностика остеоартроза
Диагностика артроза часто начинается с врача (как правило, это травматолог-ортопед) медицинской помощи первого звена (поликлиники), где выполняется клинический осмотр и интерпретируются данные обследования (КТ, МРТ, рентгенограммы и т.п.), чтобы определить степень и тип остеоартроза. Диагностика и постановка диагноза обычно не вызывают затруднений. Если диагноз неясен или врач предполагает вторичное развитие заболевания, то для уточнения пациент направляется к врачам других специальностей (например, ревматологу). Поставить степень артроза без результатов обследования очень затруднительно. Важным для постановки диагноза и определения тактики лечения является также история заболевания, способы и попытки лечения, так как перед врачом часто стоит сложная задача дифференциальной диагностики (например, симптомы артроза и артрита часто совпадают).
Лечение остеоартроза
На начальных стадиях остеоартроз поддается консервативному лечению при условии комплексного подхода. Лечение требует длительного времени и преследует основную цель: либо остановить процесс разрушения на той стадии, на которой начато лечение, либо этот процесс замедлить. Комплекс включает в себя медикаментозное и немедикаментозное лечение, в который входят курсы ЛФК (лечебной физкультуры и гимнастика), физиотерапия (чаще это фонофорез и магнитотерапия), плавание, противовоспалительная терапия (либо прием внутрь, либо местно в виде гелей или крема), хондропротективной терапии (прием препаратов на основе хондроитина сульфата и глюкозамина) и внутрисуставных инъекций (это могут быть как гомеопатические препараты, так и препараты гиалуроновой кислоты). Хондропротекторы до сих пор применяются врачами-травматологами-ортопедами на территории РФ и СНГ, их назначают курсами внутрь, однако результаты последних научных исследований западных стран опровергают положительное действие в сравнении с эффектом плацебо. [2] При выраженных симптомах и тяжелых стадиях консервативное лечение становится неэффективным, что ставит на первое место лечение оперативное. Учитывая показания, это может быть как малоинвазивное лечение — артроскопия, так и эндопротезирование. При артроскопии (эндоскопии сустава) выполняется его санация под контролем видео-оптики, производится удаление экзостозов (при возможности) и повреждения мягких структур, что при таких стадиях наблюдается достаточно часто. Однако в последнее время пользу от такого вида вмешательства при остеоартрозе все чаще стали ставить под сомнение, так как оно не имеет должного эффекта при хронической боли, [3] а в ряде случаев и может нанести значительный вред при некачественном выполнении. [4]
Эндопротезирование – технически сложная и тяжелая операция, цель которой — создать искусственный, полностью новый сустав. Требует четких показаний и определения рисков при наличии противопоказаний. Сегодня успешно используются эндопротезы для коленного, тазобедренного и плечевого суставов. Дальнейшее амбулаторное наблюдение врачом снижает риски и сроки реабилитации, улучшает качество и эффективность выполненной операции.
Прогноз. Профилактика
Прогнозирование зависит от своевременного обращения к врачу-травматологу-ортопеду и начала комплекса лечения. В плане ликвидации морфологических изменений при остеоартрозе прогноз неблагоприятный, так как полностью восстановить хрящевую структуру сустава невозможно. В пожилом возрасте течение заболевания более тяжелое, чем в молодом. Однако при своевременном обращении к врачу и соблюдении всех рекомендаций можно добиться устранения всех жалоб и восстановить полноценную двигательную функцию сустава.
Симптоматические препараты замедленного действия в терапии остеоартроза

Рассмотрены принципы терапии остеоартроза, состав и схемы применения хондропротекторов (глюкозамина, хондроитина сульфата, гиалуроновой кислоты, диацереина, экстрактов авокадо и сои, морских рыб и хрящевой ткани и мозга телят), анализ цен фармацевтическо
Principles of osteoarthrosis therapy were considered, as well as the composition and usage schemes of chondroprotectors (glucosamin, chondroitin sulfate, hyaluronic acid, diacerein, avocado and soya extracts, salt-water fish and calves’ cartilaginous tissue and cerebrum), price analysis of pharmaceutical market as of March 2012.
Дегенеративно-дистрофические поражения суставов являются одними из наиболее распространенных заболеваний и встречаются у 10–12% населения земного шара. Данная группа заболеваний объединена в 10-й Международной классификации болезней под общим термином «остеоартроз» (ОА) [12]. Установлено, что одним из основных факторов риска развития ОА является возраст. Так, в возрасте 50 лет этому заболеванию подвержены около 50% населения, 60 лет — 80% населения, 70 лет — около 90%, причем более 25% пациентов не могут справляться с основными ежедневными двигательными функциями, остальные предъявляют жалобы на затруднение выполнения функциональных обязанностей, особенно вне дома [21–23, 30, 39]. Среди больных ОА в молодом возрасте преобладают мужчины, а в пожилом возрасте — женщины. По тяжести нарушения функции опорно-двигательного аппарата первое место занимают тазобедренный, коленный и голеностопный, а также плечевой суставы [3, 5].
Экономические аспекты лечения остеоартроза
Экономический ущерб, связанный с патологией костно-мышечной системы (КМС), является достаточно значимым и сопоставим с затратами на лечение онкологических больных [19].
Одно из ведущих мест среди заболеваний КМС занимает ОА. На него приходится до 80% всей суставной патологии и более 50% всех ревматических болезней. Распространенность ОА в разных регионах мира колеблется от 13,6 до 41,7% и значительно увеличивается по мере старения [11].
ОА болеют 10–12% обследованного населения США и Европы всех возрастных групп. Проблема ОА чрезвычайно актуальна и для России. Так, из 11 млн обращений пациентов в связи с ревматическими заболеваниями, зарегистрированными в 1996 г., по меньшей мере 16% (примерно 1 млн 800 тыс.) были связаны с ОА [10].
По данным ежегодных статистических отчетов количество зарегистрированных по обращаемости больных с болезнями КМС и соединительной ткани достигло 11 835,1 тыс. человек, увеличившись за 10 лет более чем на 42%. Первичная заболеваемость всеми ревматическими заболеваниями составила 25,7 на 1000 для общероссийской популяции, в том числе 37,98 на 1000 для взрослых и подростков. Трудовые потери общества, связанные с болезнями КМС и соединительной ткани, постоянно увеличиваются. Среди всех причин временной нетрудоспособности по России они занимают 2-е место в случаях и 3-е — в днях. Ревматические заболевания ежегодно приводят к потере более 65 млн трудовых дней [16, 17].
Все экономические затраты на медицинское обеспечение больных можно подразделить на три группы: прямые, непрямые и дополнительные. Прямые затраты идут на оплату диагностических мероприятий, амбулаторного медикаментозного (чаще всего пожизненного) и немедикаментозного лечения, лабораторных и инструментальных исследований, пребывания в стационаре, зарплату участвующего в обследовании, лечении и реабилитации медицинского персонала, а также оплату ряда немедицинских услуг (транспорта, питания и др.) [14, 20, 38].
Непрямые затраты связаны с непроизведенной продукцией вследствие снижения или утраты трудоспособности пациентов, а нередко — и преждевременным летальным исходом [6, 14, 32, 38].
Согласно официальным статистическим данным, ежегодно в стационарах Санкт-Петербурга больные ОА проводят 30,2 тыс. дней (в 2002 г. было госпитализировано 1866 человек, средняя длительность койко-дня — 16,2). Исходя из средней стоимости койко-дня, определенного системой обязательного медицинского страхования (ОМС), стоимость собственно госпитализации этих больных на тот момент составляла 4,1 млн руб./год. Таким образом, приблизительные общие экономические потери, связанные с заболеваемостью ОА в Санкт-Петербурге, рассчитанные в модельных исследованиях, составляют почти 3,3–6,1% всего бюджета территориального Фонда ОМС Санкт-Петербурга [9].
Отличительной особенностью ревматических заболеваний является высокая инвалидизация. По данным многоцентрового эпидемиологического исследования, проведенного Институтом ревматологии РАМН, данной патологии принадлежит 5-е место среди всех причин инвалидности по показателю первичного выхода (21,3 на 10 000 жителей Российской Федерации) [1, 4].
При OA показатели временной и стойкой утраты трудоспособности сравнимы с таковым при сердечно-сосудистой патологии и выше, чем при любых других заболеваниях [2, 15, 18].
Одними из наиболее экономически затратных элементов в терапии ОА являются операции по протезированию суставов, стоимость которых составляет более 200 тыс. рублей. При этом сами операции не влияют на дальнейшее прогрессирование ОА в других суставах.
Принципы терапии остеоартроза
Основной целью фармакотерапии ОА является минимизация основных клинических проявлений, т. е. улучшение качества жизни пациента, чему способствует назначение эффективных и безопасных для больного лекарственных средств.
Фармакотерапия ОА является длительной и дорогостоящей. Выделяют два направления: 1) быстрое снижение болевого синдрома и воспалительных изменений в суставах с использованием анальгетиков, нестероидных противовоспалительных препаратов (НПВП) и глюкокортикостероидов; 2) замедление деградации компонентов хряща и прогрессирования болезни с помощью симптоматических препаратов замедленного действия (Symptomatic slow acting drugs for osteoarthritis — SYSADOA) [8, 13]. Неселективные НПВС, обеспечивающие эффективное купирование симптомов остеоартроза, часто вызывают побочные эффекты со стороны желудочно-кишечного тракта, сердечно-сосудистой системы и способны усугублять тяжесть ОА, неблагоприятно влияя на состояние хряща путем снижения синтеза глигозаминогликанов, необходимых для его регенерации. Поэтому наиболее перспективной группой являются SYSADOA.
Данная группа, в РФ получившая название хондропротекторов, представлена препаратами глюкозамина, хондроитина сульфата, гиалуроновой кислоты, диацереина, экстрактов авокадо и сои, морских рыб и хрящевой ткани и мозга телят.
Глюкозамина сульфат, хондроитина сульфат, гиалуроновая кислота, экстракт из морских рыб являются базисными препаратами, обеспечивающими компенсацию дефицита гликозаминогликанов, защиту хряща от дегенерации, и оказывают противовоспалительное и вторичное обезболивающее действие.
До 30% глюкозамина сульфата абсорбируется суставным хрящом вследствие тропизма и небольшого размера молекул, что позволяет ему встраиваться в структуры хрящевой ткани, препятствуя ее деградации и стимулируя синтез протеогликанов и гиалуроновой кислоты в синовиальной жидкости [7, 34].
Диацереин подавляет синтез интерлейкина-1, защищая хрящ от дегенерации, а также ингибирует действие других цитокинов, вызывающих воспаление.
Уровень доказательности эффективности применения глюкозамина сульфата и хондроитина сульфата при ОА коленного сустава оценивается как IА, а диацереина и экстрактов из авокадо и сои — IB. Строгие доказательства эффективности экстрактов морских рыб отсутствуют [8].
Биодоступность инъекционных форм существенно выше, чем пероральных. Так, для глюкозамина сульфата она составляет 26% при пероральном приеме и 95% при парентеральном [35]. Пероральная биодоступность хондроитина сульфата равна 13%, данные по биодоступности при парентеральном введении хондроитина отсутствуют [8].
Препараты на основе глюкозамина сульфата, являющиеся наиболее эффективными из группы SYSADOA и с успехом использующиеся в комплексной терапии ОА, до последнего времени не имели российских аналогов. С 2010 года в рамках программы импортозамещения начался выпуск препарата Эльбона, содержащего глюкозамина сульфат.
Инъекционные формы хондропротекторов являются универсальными, так как могут быть использованы как в рамках инициальной терапии ОА для индукции ремиссии, так и для систематического применения в лечении заболевания. Поэтому в данной статье будут рассмотрены 4 парентеральных ЛС.
Состав и схема применения данных препаратов представлены в табл. 1.
Приведенные в таблице препараты вводятся внутримышечно, Алфлутоп также можно вводить внутрисуставно. Дона и Эльбона также имеют пероральные формы (саше, содержащие 1500 мг глюкозамина сульфата № 20), что обеспечивает широкие возможности для применения их в терапии ОА.
Особенностью применения препаратов группы SYSADOA является наступление эффекта спустя 2–8 недель от начала терапии и его сохранение в течение 2–3 месяцев после окончания лечения. Исходя из проведенных клинических исследований, можно сделать следующие выводы: противовоспалительный эффект препаратов группы SYSADOA сравним с НПВП, их можно сочетать друг с другом, эффект сохраняется после окончания курса лечения; применение позволяет снизить дозу НПВП, практически не развиваются побочные эффекты, снижается риск деструкции хряща на фоне приема НПВП.
Ценовая характеристика препаратов
Нами был проведен анализ цен розничного фармацевтического рынка по состоянию на март 2012 года. Средняя цена за упаковку по инъекционным лекарственным формам составила: Дона — 1176,60 ± 82,64 руб., Эльбона — 664,62 ± 51,69 руб., Хондролон — 974,68 ± 107,52 руб., Алфлутоп — 1394,30 ± 202,02 руб. Для получения клинически значимых эффектов структурно-модифицирующих препаратов необходимо, как минимум, проведение двух курсов лечения в год в течение двух лет [26, 29]. В соответствии с этим рассчитана стоимость курса препаратов на год, исходя из того, что глюкозамина сульфат (Дона и Эльбона) применяется в течение 4–6 недель, а для Алфлутопа и Хондролона после первого курса (25–30 инъекций Хондролона, 20 инъекций Алфлутопа) рекомендован второй. Стоимость курса терапии представлена в табл. 2 и на рис.
Клиническая эффективность препаратов SYSADOA
По данным Кокрановского обзора глюкозамина сульфат является одним из наиболее изученных базисных препаратов для лечения ОА и обладает как симптоматическим, так и структурно-модифицирующим действием, потенциально замедляя прогрессирование болезни. Доказательная база включает более 20 исследований, как коротких, так и проспективных, с высокой качественной мощностью (по шкале Gotzsche), отвечающих критериям доказательной медицины [25, 27, 31, 36, 37, 40].
Согласно рекомендациям Европейской антиревматической лиги (European League Against Rheumatism, EULAR) (2003), для ОА коленных суставов доказанным является симптоматический эффект глюкозамина сульфата и хондроитина сульфата [28].
В рандомизированном, плацебо-контролируемом, двойном слепом исследовании показано, что лечение ОА коленного сустава глюкозамином сульфатом, в течение 12 месяцев — 3 лет, предотвращает полную замену сустава в течение контрольного наблюдения после исследования с медианой продолжительности 5 лет. Уменьшение риска хирургической замены коленного сустава составило 73%, по сравнению с пациентами, ранее получавшими плацебо [24].
Для ОА тазобедренных суставов также определены симптоматический эффект и низкая токсичность этих веществ, однако выраженность их влияния на восстановление хряща недостаточная, четкие критерии отбора больных для лечения отсутствуют.
Эффективность и безопасность применения препарата Эльбона подтверждается Отчетом о клиническом исследовании эффективности и безопасности у больных остеоартрозом коленных суставов в Научно-исследовательском институте ревматологии РАМН. На фоне курсового лечения ОА коленного сустава было отмечено достоверное снижение интенсивности боли по шкале ВАШ с 61,8 мм до 38 мм (р
Д. Ю. Ивкин, кандидат биологических наук
А. С. Ивкина
ГБОУ ВПО СПХФА Минздравсоцразвития России, Санкт-Петербург
ОСТЕОАРТРОЗ: патогенез, клиника, лечение
Остеоартроз — хроническое невоспалительное заболевание суставов неизвестной этиологии, характеризующееся прогрессирующей дегенерацией суставного хряща, структурными изменениями субхондральной кости и сопутствующим реактивным синовитом
Остеоартроз — хроническое невоспалительное заболевание суставов неизвестной этиологии, характеризующееся прогрессирующей дегенерацией суставного хряща, структурными изменениями субхондральной кости и сопутствующим реактивным синовитом
 |
| Рисунок 1. Синовит (припухлость, гиперемия, локальное повышение температуры) правого коленного сустава при ОА |
Неоднородность причин, механизмов развития, клиники и исходов позволяют предположить, что остеоартроз (ОА) — собирательное понятие, включающее в себя несколько заболеваний, что затрудняет выбор акцентов терапии. ОА является наиболее распространенной формой суставной патологии, им болеет 10-12% населения. По данным многоцентровых эпидемиологических исследований, распространение ОА среди населения бывшего СССР соответствовало 6,4% и коррелирует с возрастом. По данным ревматологов Европы и США, на долю этого заболевания приходится до 69-70% всех ревматических болезней. Частота встречаемости ОА в семьях больных в два раза выше, чем в популяции, причем риск развития ОА у лиц с врожденными дефектами опорно-двигательного аппарата повышен в 7,7 раза, у лиц с избыточным весом — в два раза.
Патогенез
В основе патогенеза ОА лежат нарушения молекулярной структуры гиалинового хряща. Суставной хрящ представляет собой высокоспециализированную ткань, в которой происходят процессы ремоделирования, включающие как деградацию, так и синтез экстрацеллюлярного матрикса, составляющего основу хрящевой ткани. Особое значение для нормального функционирования хряща имеет соотношение в ткани коллагена, протеогликанов, неколлагеновых гликопротеинов и воды. Ключевая роль при этом отводится хондроцитам — высокодифференцированным клеткам хрящевой ткани, которые по невыясненным до конца причинам при ОА начинают продуцировать «неполноценные» низкомолекулярные белки матрикса (межуточной ткани хряща), что снижает амортизационные свойства хряща. Хондроцит обладает значительной чувствительностью к содержанию протеогликанов в окружающем матриксе хряща и быстро реагирует на их изменения. Состояние хряща зависит от равновесия анаболических и катаболических процессов, причем интенсивность катаболических процессов усиливают цитокины (интерлейкин-1, фактор некроза опухоли-α), циклооксигеназа-2, металлопротеиназы (коллагеназа, стромелизин), продуцируемые как хондроцитами, так и клетками синовиальной оболочки и субхондральной кости. С другой стороны, для восстановления хрящевой ткани важна синтетическая репаративная активность хондроцитов. Здесь большое значение придается факторам роста, особенно инсулиноподобному и трансформирующему, а также морфогенетически измененным костному и хрящевому белкам.
При прогрессировании ОА в результате происходящих дегенеративных процессов хрящ размягчается, разрыхляется. В нем появляются трещины, простирающиеся до кости.
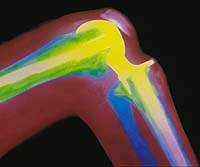 |
| Рисунок 2. Эндопротез коленного сустава. Рентгенограмма |
Костные суставные поверхности, лишенные амортизации из-за деструкции хрящевой ткани, испытывают повышенную и неравномерную механическую нагрузку. В субхондральной кости появляются зоны динамической перегрузки, которые вызывают перераспределительные нарушения микроциркуляции. Это способствует возникновению субхондрального остеосклероза, кистовидной перестройки, изменению кривизны суставных поверхностей и образованию краевых костно-хрящевых разрастаний — остеофитов.
Особая роль в патогенезе ОА отводится синовиту, морфологически характеризующемуся умеренно выраженными пролиферативными и экссудативными реакциями (гиперплазией синовиальной оболочки и ее мононуклеарной инфильтрацией), наиболее выраженными в местах прикрепления синовии к хрящу с последующим исходом в склероз и липоматоз. В субхондральной кости выявляются микропереломы, утолщение костных трабекул и остеофитоз. Экссудативно-пролиферативные реакции как в субхондральной кости, так и в синовиальной оболочке протекают на фоне нарушений региональной гемодинамики и микроциркуляции с развитием тканевой гипоксии. В последующем прогрессирование болезни принимает, по сути, необратимый характер.
Клиническая картина
Боль, деформация и тугоподвижность сустава являются основными клиническими проявлениями ОА.
Боль в суставе — наиболее частый и выраженный симптом при ОА, носит неоднородный характер. Причинами ее могут быть деструктивные процессы в хрящевых и субхондральных структурах, нарушения микроциркуляции, особенно при затруднении венозного кровотока в спонгиозной части кости, фиброз капсулы сустава, воспалительный процесс в мягких околосуставных тканях, спазм близлежащих мышц и реактивный синовит.
В целом для заболевания характерен механический ритм болей — возникновение боли под влиянием дневной физической нагрузки и стихание за период ночного отдыха, что связано со снижением амортизационных способностей хряща и костных подхрящевых структур к нагрузкам. При этом происходит прогибание костных балок в сторону спонгиозной кости.
Возможны непрерывные тупые ночные боли, связанные с венозным стазом в субхондральной спонгиозной части кости и повышением внутрикостного давления.
Кратковременная «стартовая» боль возникает после покоя и вскоре проходит на фоне двигательной активности. Стартовые боли обусловлены трением суставных поверхностей, на которых оседает детрит — фрагменты хрящевой и костной деструкции. При первых движениях в суставе детрит выталкивается в завороты суставной сумки, и боли значительно уменьшаются или прекращаются полностью.
Прогрессирующий фиброз сутавной капсулы ведет к сдавлению нервных окончаний, результатом чего являются боли при определенных движениях, связанные с растяжением капсулы. Реактивный тендобурсит также влияет на зависимость возникновения боли от конкретных движений. При этом часто наблюдаются характерные для сустава болевые зоны, определяющиеся пальпаторно, например, область «гусиной лапки» — внутренняя поверхность коленного сустава.
Возможна так называемая «блокада сустава» или «застывший сустав» — резко выраженный быстро развивающийся болевой синдром вследствие появления «суставной мыши» — костного или хрящевого фрагмента с ущемлением его между суставными поверхностями или внедрением остеофита в мягкие околосуставные ткани. Интенсивность боли при этом лишает пациента возможности сделать малейшее движение в данном суставе.
Рефлекторный спазм близлежащих мышц, а также развитие реактивного синовита вызывают постоянные боли.
Реактивный синовит и воспалительный отек параартикулярных тканей усугубляют клиническую картину. При наличии синовита, помимо боли в суставе как при движении, так и в покое, характерны утреннняя скованность, припухлость сустава, локальное повышение кожной температуры. С прогрессированием заболевания рецидивы синовита учащаются.
Постепенно развиваются деформация и тугоподвижность суставов за счет развития фиброзно-склеротических и гипотрофических изменений параартикулярных тканей. На ранней стадии ОА нарушения функции сустава обусловлены болевым синдромом и рефлекторным спазмом мышц. При прогрессировании заболевания на снижение объема движений влияют сухожильно-мышечные контрактуры, остеофиты, внутрисуставные «свободные тела» и нарушение конгруэнтности суставных поверхностей.
Обычно ОА развивается медленно и начинается как моноартикулярное заболевание, но через некоторое время в патологический процесс включаются и другие суставы, чаще всего те, которые компенсаторно брали на себя повышенную механическую нагрузку, чтобы разгрузить первоначально заболевший сустав.
Клинически значимыми и инвалидизирующими формами ОА являются гонартроз и коксартроз. Клиническая картина ОА определяется конкретным суставом и группой суставов, вовлеченных в патологический процесс.
Неинвазивные методы исследования
Среди неинвазивных методов диагностики гонартроза ведущее место по информативности занимает ультразвуковое двумерное сканирование коленных суставов, которое используют для объективизации и детализации характеристики вторичного синовита, являющегося прогностически неблагоприятным фактором, усугубляющим процессы дегенерации хряща. Наряду с диагностикой наличия синовиальной жидкости можно определить ее характер, особенно над bursa suprapatellaris и появлением жидкости над мыщелками бедренной кости, толщину и характер синовиальной оболочки; при этом ее утолщение при 0,4 см и более, а также контуры суставных поверхностей с учетом однородности контуров хряща на мыщелках бедренной кости и толщину хряща принимают за патологию. Ультразвуковое исследование суставов позволяет также уточнить характер и степень воспалительного процесса для выработки адекватного лечения.
Артроскопия в артрологии для диагностики воспалительных и дегенеративных заболеваний суставов, к сожалению, применяется недостаточно широко и, более того, не выявляет качественных отличий от воспаления синовии при других артритах. Существенно расширяет диагностические возможности артроскопии использование прицельной биопсии, а визуальный контроль позволяет получить фрагмент синовиальной ткани или хряща, наиболее адекватно отражающих развивающийся в суставе патологический процесс, но при этом данная процедура редко показывает распространенность патологического процесса. Артроскопия используется и с лечебной целью — с целью промывания полоски коленного сустава, при которой удаляется хрящевой детрит, а также фрагменты мениска, утолщенной и воспалительной синовии; выполняется аброзивная артропластика при гонартрозе. При коксартрозе ультразвуковое исследование отмечает, наряду с наличием и характером синовиальной жидкости, эхоуплотнение капсулы синовиальной оболочки, хрящевой губы, остеофиты. Однако следует сказать, что как ультразвуковые, так и эндоскопические признаки не могут считаться специфическими при гонартрозе и коксартрозе, поскольку они встречаются и при других заболеваниях суставов, как воспалительного, так и дегенеративного характера.
Современные патогенетические подходы к лечению остеоартроза
Основными целями терапии ОА являются: замедление прогрессирования дегенерации хряща и максимально возможное сохранение функции сустава. Терапевтическая тактика при ОА состоит из трех компонентов:
Задачи, которые ставятся при составлении комплекса лечебных мероприятий, можно решать с учетом следующей шкалы приоритетов: болевой синдром, синовит, нарушение трофики суставов и местного кровотока, гипотрофия и гипотония мышц, контрактура.
Немедикаментозная терапия
Режим. Механическая разгрузка сустава является определяющим фактором как в уменьшении болевого синдрома, так и в лечении ОА в целом. Сюда входят рекомендации по исключению длительного пребывания в фиксированной позе, долгого стояния на ногах, длительной ходьбы, повторяющихся стереотипных движений, переноса больших тяжестей, ведущих к механической перегрузке определенных зон суставов. В далеко зашедших стадиях заболевания пациенту полезно ходить с тростью, костылями. При выраженных болях в фазу обострения может быть назначен полупостельный режим.
Диета. Четких патогенетических рекомендаций по диете ОА на настоящий момент не существует. Важным условием в лечении ОА коленных суставов является снижение избыточной массы тела. В последнее время рекомендуются пищевые добавки (глюкозамин, хондроитин и др.), но эффективность их требует клинических подтверждений.
Медикаментозная терапия
В терапии ОА наиболее часто применяются обезболивающие препараты, нестероидные противовоспалительные препараты (НПВП) и средства с хондропротективными свойствами.
В терапии ОА, который сопровождается болевым и воспалительным синдромами, широко применяются НПВП. В настоящее время известно около 100 НПВП различных классов, но поиск новых лекарственных средств этой группы продолжается. Это связано с потребностью в медикаменте, имеющем оптимальное соотношение обезболивающего и противовоспалительного действия и характеризующемся высокой степенью безопасности. В этом плане большой интерес представляет появившийся на российском рынке препарат ксефокам.
Ксефокам — новый НПВП класса оксикамов.
Подобно другим НПВП, ксефокам обладает обезболивающей и противовоспалительной активностью, связанной с подавлением синтеза простагландинов посредством ингибирования циклооксигеназы (ЦОГ).
Так как большинство НПВП подавляют, как правило, и ЦОГ-1 и ЦОГ-2, то развитие гастропатий, а также нарушение функции почек и агрегации тромбоцитов являются запрограммированным фармакологическим эффектом этих препаратов.
Существует достоверная связь между приемом НПВП и развитием патологии верхних отделов ЖКТ: геморрагий, эрозий, язв в желудке (гастропатий), а также эзофагопатий и дуоденопатий, что проявляется болями или чувством тяжести в эпигастральной области, тошнотой, иногда рвотой, изжогой, дисфагией, метеоризмом, диареей и др. Возможно бессимптомное течение гастропатий, в связи с чем увеличивается риск развития таких серьезных осложнений, как кровотечение и перфорация, нередко ведущих к летальному исходу. Кроме того, длительный прием НПВП вызывает энтеропатии и колонопатии с последующим развитием железодефицитной анемии и гипоальбуминемии.
К образованию эрозий и язв приводит подавление НПВП синтеза простагландинов слизистой ЖКТ, что вызывает:
Высокий риск возникновения язв ЖКТ отмечается при продолжительной терапии НПВП, но максимален в первый месяц приема препарата. Снижение риска в дальнейшем объясняется, по-видимому, адаптационными механизмами, благодаря которым гастродуоденальная слизистая приобретает способность противостоять повреждающему действию НПВП.
Полагают, что при приеме НПВП нарушается репарация хряща и субхондральной кости за счет угнетения синтеза простагландинов, в частности в зонах микропереломов, с образованием очагов деструкции и кист. При этом, купируя болевой синдром и явления синовита, НПВП не задерживают дегенеративно-дистрофических изменений в суставных тканях пациента.
Установлено, что селективное ингибирование ЦОГ-2 оказывает незначительный эффект при острой боли. В то же время при острой боли концентрация ЦОГ-1 увеличивается в три-четыре раза, поэтому для анальгетического эффекта может иметь значение ингибирование именно этого изофермента. Таким образом, оптимальным сочетанием анальгетического и противовоспалительного эффекта обладают препараты, ингибирующие как ЦОГ-1, так и ЦОГ-2. Ксефокам является наиболее мощным ингибитором обоих изоферментов. Эта способность ксефокама в 100-200 раз превышает таковую у эталонных НПВП, например у диклофенака и пироксикама. При этом соотношение ингибиторной активности ксефокама в отношении ЦОГ-1 и ЦОГ-2 (мера селективности) занимает срединное положение по сравнению с аналогичными показателями других НПВП, что и обеспечивает баланс анальгетической и противовоспалительной активности ксефокама.
Ксефокам угнетает высвобождение свободных радикалов кислорода из активированных лейкоцитов, что усиливает его анальгетическую и противовоспалительную активность.
Исследования показали, что в терапевтических дозах ксефокам стимулирует синтез протеогликанов, предотвращая дегенерацию суставного хряща. Эта важная особенность ксефокама делает его препаратом выбора при ОА, поскольку известно, что многие НПВП, напротив, отрицательно влияют на хрящ.
Ксефокам практически весь (на 99%) связывается с белками плазмы, тем не менее он активно проникает в суставные полости, где длительное время (10-12 часов) сохраняется в достаточной терапевтической концентрации — даже когда в плазме его концентрация снижается. Это позволяет принимать препарат всего лишь два раза в день. Благодаря короткому периоду полувыведения из плазмы крови (примерно 4 часа) прием ксефокама сопровождается меньшей выраженностью побочных эффектов, так как в период между введениями доз возможно восстановление протекторных физиологических уровней простагландинов, необходимых для защиты слизистой желудка и поддержания нормального кровотока в почках.
Ксефокам полностью метаболизируется в печени, при этом одна треть его неактивных метаболитов выводится почками, а две трети — печенью и кишечником. Такой двойной путь экскреции снижает нагрузку на данные органы и улучшает переносимость ксефокама. После многократного введения ксефокама не наблюдается его кумуляция в плазме, что снижает риск побочных эффектов по сравнению с НПВП, имеющими более длительный период полувыведения. Фармакокинетика ксефокама примерно одинакова у пожилых людей и лиц молодого или зрелого возраста, поэтому не требуется какой-либо коррекции дозы препарата у пожилых.
Клинические испытания подтвердили высокую эффективность и хорошую переносимость ксефокама у больных ОА. В результате месячного приема лекарства в суточной дозе 16 мг уменьшались боль, длительность утренней скованности, улучшалась функция суставов.
Препараты с хондропротективными свойствами
К средствам, модифицирующим течение ОА, относятся препараты, в основе действия которых лежат:
Традиционно для лечения ОА использовались парентеральные гликозаминогликаны, однако в последнее время предпочтение отдается пероральным препаратам, а именно глюкозаминсульфату и хондроитинсульфату.
Локальная стероидная терапия
При некупируемом реактивном синовите показана пункция сустава, удаление синовиальной жидкости и внутрисуставное введение глюкокортикоидов, которые ингибируют синтез интерлейкина-1 и фактора некроза опухоли-α, участвующих в воспалении и деградации хряща. Широко используются при этом гидрокортизон, метипред, кеналог и дипроспан. Последние препараты характеризуются более выраженным и пролонгированным лечебным действием. Вместе с глюкокортикоидами возможно введение анестетиков (новокаина, лидокаина), действие которых при этом потенцируется. Введение ингибиторов медиаторов воспаления — контрикала (трасилола) или гордокса — благотворно влияет на метаболизм хряща.
В настоящее время рассматривается вопрос о широком внедрении в практику для подавления локального воспаления внутрисуставного введения ксефокама.
Реабилитационные мероприятия
Широко применяемые для восстановительного лечения ОА физиотерапевтические методы уменьшают болевой синдром, а также воспалительные процессы и мышечный спазм, улучшают микроциркуляцию, благоприятно воздействуют на метаболические процессы в тканях сустава. При этом используются ультрафиолетовое облучение, электрические токи, переменные магнитные поля, электрофорез и фонофорез лекарственных средств на суставы. При пролиферативных явлениях, вазотрофических расстройствах и контрактурах показаны тепловые процедуры, включая аппликации парафина, озокерита, иловой и торфяной грязи. При отсутствии синовита эффективны морские, радоновые, сульфидные, бишофитные и йодобромные ванны. Для укрепления мышц рекомендуется применение электромиостимуляции.
При выполнении лечебного массажа больным ОА следует избегать механического раздражения суставной капсулы, обращая особое внимание на работу с прилегающими к суставу мышцами. Тогда снижается болевой мышечный спазм, повышается тонус ослабленных групп мышц, усиливается трофика пораженных суставов и улучшаются функциональные способности больного.
Лечебная физкультура преследует те же цели, что и массаж, и осуществляется по принципу: легкая динамическая нагрузка при полной статической разгрузке. Крайне ошибочными являются нередко встречающиеся советы усиленно разрабатывать сустав, «разгонять соли, превозмогая боль» — это часто провоцирует болевой спазм параартикулярных мышц с нарушением трофики, вызывает обострение синовита и в конечном итоге усугубляет течение ОА.
При выраженном длительном болевом синдроме, не купируемом традиционными средствами, а также при значительных нарушениях функции сустава применяется хирургическое лечение чаще всего на коленных и тазобедренных суставах. Кардинальной операцией является эндопротезирование сустава. Хорошо зарекомендовали себя эндопротезы, в которых узел скольжения состоит из пары металл–полиэтилен.
Профилактика остеоартроза
Важную роль в профилактике ОА играет выявление и своевременная ортопедическая коррекция врожденных аномалий: вывиха бедра, варусной и вальгусной установки голеней, плоскостопия и др. В профессиональной деятельности необходимо исключить длительные статические и стереотипные механические перегрузки суставов. Существенным условием профилактики ОА коленных суставов является нормализация избыточной массы тела.

_575.gif)
.gif)