Что такое синдром беккера
Что такое киста Бейкера? Причины возникновения, диагностику и методы лечения разберем в статье доктора Павлюченко А. Ю., ортопеда со стажем в 5 лет.
Определение болезни. Причины заболевания
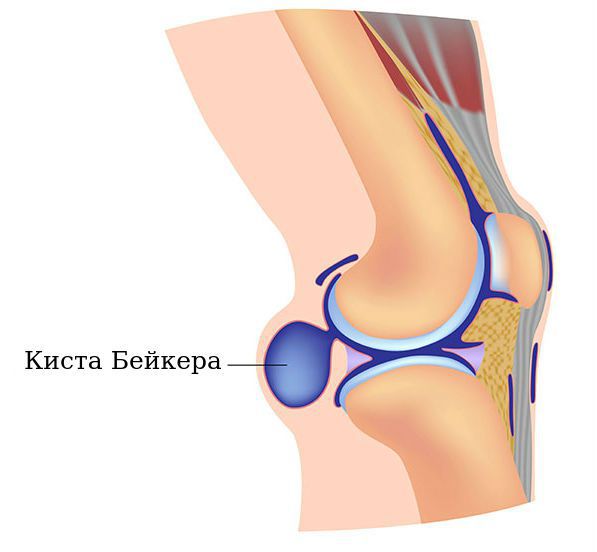
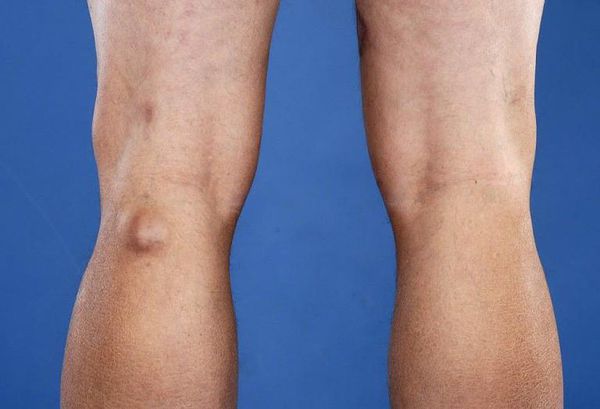
Киста Бейкера — это новообразование в подколенной ямке, которое возникает вследствие вытекания синовиальной жидкости, заполняющей полость сустава. Киста Бейкера может бессимптомно развиваться годами.
Подколенные синовиальные кисты, также известные как кисты Бейкера, обычно встречаются при внутрисуставном заболевании колена, например при остеоартрите. Они могут быть источником боли в задней области колена, болевые ощущения иногда сохраняются даже после хирургического лечения. Размер кисты может быть от 2 мм и достигать 3-6 см и более.
Киста Бейкера может возникнуть в любом возрасте. Реже встречается у детей, которые в раннем возрасте активно занимаются спортом. В таких случаях киста может появиться из-за травмы и анатомической особенности строения коленного сустава.
Киста Бейкера названа в честь британского хирурга Уильяма Моранта Бейкера, который описал 8 случаев подколенных кист. Он пришёл к выводу, что кисты были результатом выпота (скопления жидкости) от остеоартрита. Они напрямую связываются с коленным суставом, и жидкость может течь из сустава в кисту, но не наоборот. Несмотря на одноимённое название, несколько других хирургов описали подколенные кисты до Бейкера. Например, Роберт Адамс в 1840 году описал увеличение бурсы под медиальной ( расположенной ближе к внутренней части голени) головкой икроножной мышцы, которая сообщалась с коленом через клапанное отверстие. Он сделал вывод, что это результат артрита.
До 94 % случаев образования подколенной кисты у взрослых встречается в связи с внутрисуставными поражениями [2] :
Симптомы кисты Бейкера
У пациентов обычно возникают симптомы менисковой или хондральной патологии:
Если киста ощутима, чаще всего она будет твёрдой при полном разгибании колена и мягкой, когда колено согнуто. Это явление, известное как «знак Фушера», наблюдается из-за сжатия кисты между медиальной головкой икроножной и полумембранозной (полуперепончатой) мышц, так как они приближаются друг к другу и к суставной капсуле во время разгибания колена. Это полезно для дифференциации кисты Бейкера от других подколенных образований, таких как аневризмы (расширения) подколенной артерии, ганглии, адвентициальные кисты и опухоли, для которых пальпация не зависит от положения колена.
Патогенез кисты Бейкера
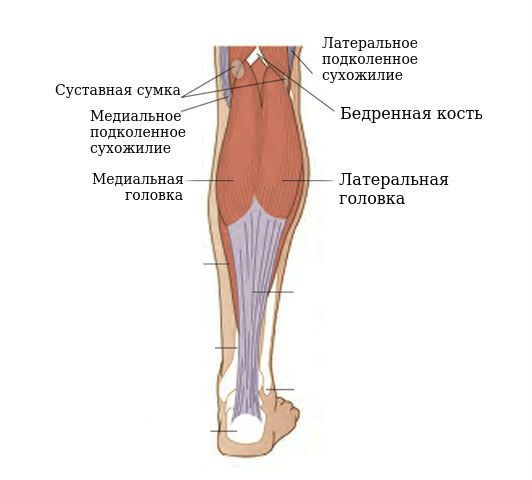
Механизм развития кисты Бейкера обусловлен особенностями анатомического строения коленного сустава и подколенной ямки. Согласно исследованиям, у 40-54 % здоровых людей есть межсухожильные слизистые сумки, расположенные между сухожилиями полумембранозной (полуперепончатой) и икроножной мышц. Это не патология, а вариант нормы, анатомическая особенность.
При развитии воспалительного процесса в коленном суставе ответной реакцией организма является образование избыточного количества жидкости. Это защитная реакция организма от дальнейших возможных повреждений, которые человек может причинить себе в процессе жизнедеятельности.
Скопление жидкости в большом количестве приводит к её просачиванию в межсухожильную сумку через клапанный механизм, за счёт чего сумка увеличивается в размерах.
При обследовании с введением рентгеноконтрастного препарата в подколенную кисту было подтверждено, что благодаря клапанному механизму поток жидкости идёт от коленного сустава в кисту, в то время как обратный поток невозможен.
Поскольку выпот (жидкость) часто присутствует при внутрисуставной патологии, возможно, что киста Бейкера оказывает защитное действие на колено, снижая гидравлическое давление в колене с помощью этого одностороннего клапана. Такой аргумент подтверждается тем фактом, что объём подколенных кист связан с размером выпотов коленного сустава. Это клапанное отверстие позволяет жидкости течь во время сгибания коленного сустава, но во время разгибания колена клапан сжимается из-за напряжения в полумембранозной мышце и медиальной головке икроножной мышцы.
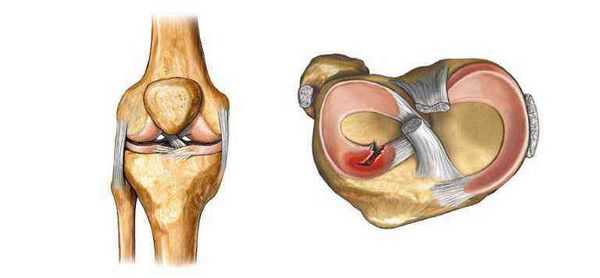
Гистологически стенки кисты напоминают синовиальную ткань с явным фиброзом, может присутствовать хроническое неспецифическое воспаление. Жидкость кисты может быть сгущена присутствием фибрина. Это значит, что процесс давний и мог быть вызван травмой сустава: повреждением связки или мениска и образованием крови в суставе.
Классификация и стадии развития кисты Бейкера
Кисты Бейкера различаются по расположению их в подколенной ямке: выделяют типичные и нетипичные кисты.
К типичным относятся подколенные кисты между медиальной головкой икроножной и полумембранозной мышц, так как они обнаруживаются чаще всего.
Осложнения кисты Бейкера
Осложнения, связанные с наличием подколенных кист, включают:
Известно также о гнойных подколенных кистах, которые являются осложнением гнойного артрита. Они возникают из обычных кист в результате нагноения, вызванного бактериями. Микроорганизмы могут попасть в коленный сустав как гематогенным путём (через кровь), так и экзогенным путём (из внешней среды), когда делают внутрисуставные манипуляции на коленном суставе, либо пункцию кисты.
Ревматологи даже описали пациента с ревматоидным артритом, у которого был постоянный гнойный артрит коленного сустава, несмотря на два последовательных артроскопических вмешательства в область коленного сустава и лечение соответствующими антибиотиками. После удаления такой кисты улучшение было быстрым.
Пациентам с гнойным артритом, с подколенной кистой или ревматоидным артритом в анамнезе рекомендовано сделать ультразвуковое исследование, компьютерную томографию или МРТ. Если при гнойном артрите состояние пациента не улучшается после стандартного лечения, необходимо провести обследование, чтобы исключить наличие подколенной кисты, которая может быть причиной локализованной гнойной инфекции.
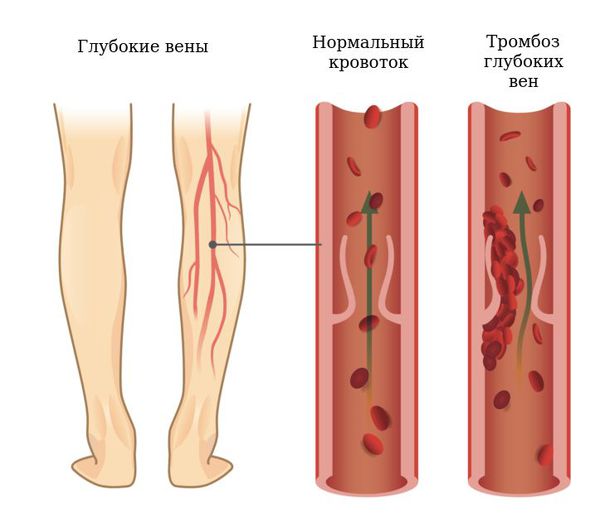
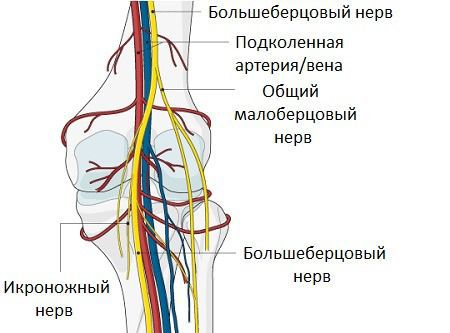
Подколенные кисты могут вызывать компрессию сосудисто-нервного пучка, что приводит к тромбофлебиту, синдрому компартмента (увеличению давления между мягкими тканями, которое может привести к нарушению кровотока и омертвению тканей) и компрессионным невропатиям.
Тромбофлебит может быть восходящим, в этом случае тромб из большой подкожной вены переходит от низкорасположенных отделов вены на голени вверх, до паховой складки. При этой форме есть угроза перехода тромбоза на глубокие вены. Если есть сомнения в диагнозе или возникло подозрение на тромбоз глубоких вен, следует провести УЗИ.
Иногда из-за наличия подколенной кисты может возникнуть компрессия подколенной вены или артерии, приводящая к стенозу или тромбозу. Если присутствует сосудистая компрессия, показано оперативное вмешательство в срочном порядке.
Внутреннее кровотечение после разрыва подколенной кисты может привести к синдрому компартмента. Из-за риска тромбообразования (вследствие сдавления кровеносных сосудов), пациентам с кистой Бейкера часто назначают антитромботические препараты, которые делают кровь более жидкой. По этой причине кровотечения могут быть более обильными и долго не останавливаться, что приводит к увеличению давления между мягкими тканями и нарушению кровоснабжения тканей. При разрыве кисты возможно появление усиливающейся боли или отёка, что должно вызвать подозрение на синдром сдавления. Боль с пассивным растяжением икроножных мышц (признак Хомана) может быть положительной как для тромбоза глубоких вен, так и для синдрома компартмента, в связи с этим диагностика может быть затруднена.
Компрессионные невропатии чаще всего связаны со сдавлением большеберцового нерва, редко может быть задействован и малоберцовый нерв.
Диагностика кисты Бейкера
Дифференциальный диагноз кисты Бейкера включает аневризму подколенной артерии, опухоли мягких тканей, кисту мениска, гематому, тромбоэмболию и серому (скопление серозной жидкости в области операционной раны).
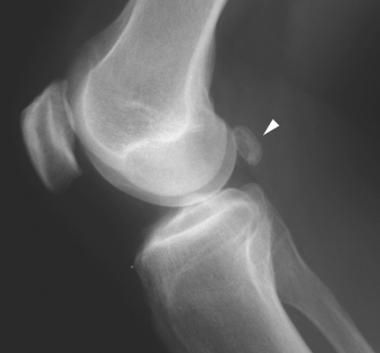
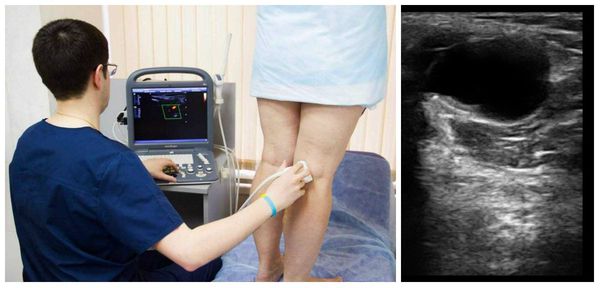
Визуализация коленных суставов с подозрением на подколенные кисты может включать простые рентгенограммы, артрографию, ультразвук и МРТ.
Рентгенографию нужно выполнять на ранней стадии оценки, поскольку они полезны для выявления других состояний, обычно встречающихся в связи с подколенными кистами: остеоартрита, воспалительного артрита и свободных хондромных (хрящевых или костных) тел, которые появляются вследствие хрящевого перерождения синовиальной оболочки.
До появления МРТ прямая артрография широко использовалась для выявления подколенных кист. Данный метод включает в себя внутрисуставную инъекцию коленного сустава газом либо йодированной контрастной средой с последующей мобилизацией сустава для усиления контраста (или газа). После этого на рентгенограммах или при рентгеноскопии можно обнаружить наличие контраста (или газа) в кистах. Недостатком артрографии считается использование ионизирующего излучения и инвазивных методов (пункция) для введения контраста
Ультразвук в значительной степени заменил артрографию как метод предварительной диагностики кист Бейкера. Преимущества метода включают его низкую стоимость, неинвазивное применение и отсутствие излучения, но есть и недостатки: ультразвуку не хватает специфичности, чтобы отличать кисту Бейкера от других состояний, таких как менисковые кисты или менискоидные опухоли. Кроме того, УЗИ не позволяет адекватно визуализировать другие состояния в колене, которые часто сопутствуют подколенным кистам, например разрывы мениска. При ультразвуковом исследовании кисты кажутся безэховыми (выглядят чёрными), что указывает на наличие в них жидкости. Иногда в подколенной кисте могут наблюдаться эхогенные (светлые) участки, представляющие собой свободные тела (элементы хряща, кости или менисков).
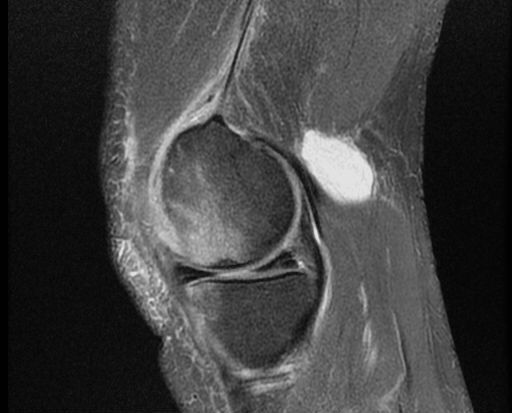
Магнитно-резонансная томография остаётся основным методом диагностики кист Бейкера и дифференцирования их от других состояний. МРТ позволяет оценить весь спектр патологий, связанных с кистой Бейкера, таких как разрыв мениска, хондральные дефекты, свободные тела, синовит, остеоартрит и разрывы связок. Менисковые кисты легче отличить от кист Бейкера с помощью МРТ, чем с помощью ультразвука. Его основным недостатком является высокая стоимость, поэтому ультразвук следует рассматривать как метод скрининга (первичного обследования), если нет необходимости в оценке внутрисуставных структур. Киста на снимках выглядит как скопление жидкости с интенсивностью воды: низкая интенсивность сигнала (тёмное изображение) на T1-взвешенных изображениях и высокая интенсивность сигнала (яркое изображение) на T2-взвешенных изображениях.
Лечение кисты Бейкера
Первоначальное лечение симптоматических подколенных кист не проводится, по крайней мере, в течение первых 6 недель. Если нет сосудистой или нервной компрессии, есть шанс, что они сами исчезнут. В течение этого времени следует делать упор на реабилитацию, направленную на поддержание гибкости колена. Это необходимо, чтобы избежать скованности, которая может развиться от боли, возникающей при терминальном сгибании и разгибании.
Внутрисуставные инъекции кортикостероидов уменьшают размер и симптомы кист, поэтому их применение может рассматриваться при консервативном лечении. Если при таком подходе боль не проходит спустя 2 месяца, то хирургическое лечение должно быть направлено на внутрисуставную причину образования жидкости в суставе, а не на подколенную кисту, кроме тех случаев, когда киста слишком большая и сопровождается осложнениями.
Прогноз. Профилактика
Киста Бейкера может существовать как несколько месяцев, так и всю жизнь. Обратное развитие (рассасывание жидкости) характерно для кист, сформировавшихся недавно, обычно после чрезмерных механических перегрузок коленных суставов во время занятий спортом и напряжённого физического труда.
Прогрессирующая мышечная дистрофия Беккера
Прогрессирующая мышечная дистрофия Беккера — вариант наследственной сцепленной с Х-хромосомой миодистрофии, отличающейся более замедленным и доброкачественным течением. Заболевание характеризуется постепенно усугубляющейся и распространяющейся мышечной слабостью, гипотонией и атрофией, первоначально возникающей в мышцах бедер и тазового пояса. Диагностический поиск включает неврологическое обследование, консультацию генетика и кардиолога, нейрофизиологическое тестирование нервно-мышечного аппарата, ДНК диагностику, биопсию мышц с морфологическим, иммунологическим и гистохимическим изучением полученных образцов. Лечение симптоматическое и, к сожалению, малоэффективное. Прогрессирование болезни приводит к потери больными способности самостоятельно передвигаться к возрасту 40 лет.
Общие сведения
Прогрессирующая мышечная дистрофия Беккера впервые была описана в 1955 г. как доброкачественный вариант течения мышечной дистрофии Дюшенна. В последующем многочисленные исследования в области клинической неврологии, генетики и биохимии обнаружили существенные отличия в характере течения, биохимической и морфологической основе этих заболеваний. В результате клиническая форма Беккера была выделена как самостоятельная нозология.
Мышечная дистрофия Беккера входит в группу миопатий (миодистрофий) — заболеваний, возникающих вследствие нарушений строения и метаболизма мышечной ткани и проявляющихся мышечной слабостью. Патология наследуется рецессивно сцеплено с Х-хромосомой, поэтому болеют только лица мужского пола. Частота встречаемости составляет 1 новорожденный на 20 тыс. детей.
Причины
Патогенез
Симптомы
Прогрессирующая мышечная дистрофия Беккера манифестирует обычно в период от 10 до 15 лет, в некоторых случаях раньше. Начальными признаками заболевания выступают чрезмерная утомляемость и мышечная слабость в тазовом поясе и нижних конечностях. У ряда пациентов первыми проявлениями являются периодические болезненные мышечные судороги (крампи), локализующиеся в ногах. Мышечная слабость обуславливает затруднение при подъеме по лестнице, при необходимости встать из положения сидя. Со временем формируется переваливающаяся «утиная походка». Для того, чтобы встать, пациент вынужден использовать вспомогательные миопатические приемы — опираться руками о расположенные рядом предметы мебели или, при отсутствии таковых, использовать в качестве опоры собственное тело (симптом Говерса).
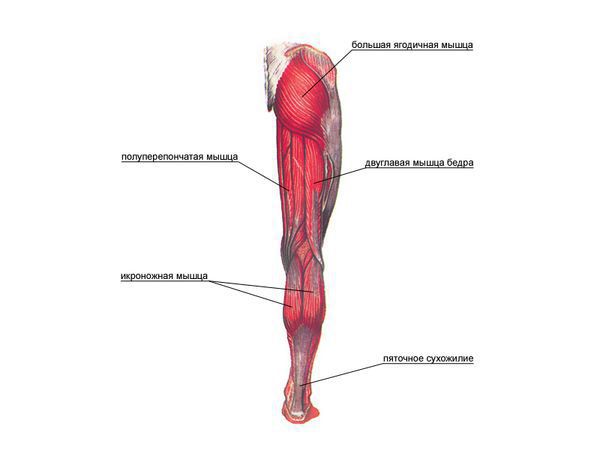
Как и другие наследственные миопатии, заболевание Беккера характеризуется симметрично развивающимися атрофиями мышц. В первую очередь поражаются мышцы бедра и тазового пояса, затем процесс распространяется на мускулатуру плечевого пояса и проксимальных мышц рук. В начале болезни формируются псевдогипертрофии, наиболее выраженные в икроножных, дельтовидных, трех- и четырехглавых мышцах. По мере прогрессирования миодистрофии они трансформируются в мышечные гипотрофии.
Клиническая картина мышечной дистрофии Беккера во многом сходна с миодистрофией Дюшенна. Усугубление мышечной слабости с течением времени приводит к обездвиженности пациента и формированию контрактур суставов. Однако развитие дистрофического процесса в мышечной ткани при дистрофии Беккера идет гораздо медленнее, что обуславливает длительную двигательную активность больных. В среднем пациенты сохраняют способность самостоятельно передвигаться до 35-40-летнего возраста. Кроме того, дистрофия Беккера не сопровождается олигофренией, выраженным искривлением позвоночника и другими скелетными деформациями. Возможна кардиомиопатия дилятационного или гипертрофического типа, блокада ножек пучка Гисса, но сердечно-сосудистые расстройства выражены умеренно. Может наблюдаться снижение либидо, гинекомастия, атрофия яичек, импотенция.
Диагностика
Прогрессирующая мышечная дистрофия Беккера диагностируется неврологом на основании анамнеза, клинических данных, дополнительных обследований и генетического тестирования. В неврологическом статусе наблюдается снижение мышечной силы и умеренное снижение мышечного тонуса в проксимальных отделах конечностей, выпадение коленных рефлексов при симметричном снижении сухожильных рефлексов дистальных отделов ног и верхних конечностей, полная сохранность чувствительности.
Среди клинических анализов наибольшее значение имеет биохимический анализ крови, который выявляет многократное повышение уровня КФК. Данные электронейрографии позволяют исключить поражение нервных волокон, электромиография свидетельствует о первично-мышечном типе поражения. Биопсия мышц проводится только после отрицательных результатов генетического анализа. Морфологическое исследование полученного материала определяет диффузную разнокалиберность, дистрофические и некротические изменения мышечных волокон, разрастание соединительной ткани. Проводится специальное иммунное окрашивание образцов с последующим определением наличия в них дистрофина.
Подтвердить диагноз мышечной дистрофии Беккера позволяет консультация генетика с проведением анализа ДНК. Выявление дупликаций или делеций в гене Хр21 дает возможность установить точный диагноз. Отрицательный результат анализа ДНК не говорит об отсутствии патологии, поскольку могут иметь место точковые мутации, поиск которых представляет собой сложную и более дорогостоящую процедуру.
С целью выявления сердечной патологии назначается электрокардиография, Эхо-КГ, консультация кардиолога. Кардиологическое обследование может обнаружить нарушение внутрижелудочковой проводимости, АВ-блокаду, дилатацию желудочков, гипертрофические изменения миокарда, кардиомиопатию, сердечную недостаточность.
Пренатальная диагностика рекомендована, когда мать является носителем патогенного гена. Если ребенок мужского пола, то вероятность развития заболевания у него составляет 50%. Биопсия хориона может проводиться в сроке 11-14 нед. беременности, амниоцентез — после 15-й недели, забор пуповинной крови (кордоцентез) — на сроке больше 18 нед.
Дифференциальная диагностика
Дифференциальная диагностика проводится с прогрессирующей мышечной дистрофией Дрейфуса, миодистрофией Дюшена, мышечной дистрофией Эрба-Рота, метаболической миопатией, полимиозитом и дерматомиозитом, воспалительной миопатией, спинальной амиотрофией, наследственной полиневропатией.
Лечение миодистрофии Беккера
На современном этапе несколькими группами ученых ведутся настойчивые исследования в области поиска эффективных методов лечения прогрессирующих миодистрофий. В настоящее время пациенты получают в основном метаболическую и симптоматическую терапию. Разработаны различные схемы лечения, позволяющие улучшить двигательные возможности больного и несколько замедлить прогрессирование болезни.
Терапия глюкокортикоидами используется для снижения скорости прогрессирование атрофии мышечной ткани. Пациентам назначают метаболические средства (витамины группы В, левокарнитин), витамин D и препараты кальция для профилактики остеопороза, β-адреноблокаторы и ингибиторы АПФ для предупреждения кардиомиопатии, диуретики при сердечной недостаточности.
Наблюдения показали, что постельный режим усугубляет мышечную слабость. Поэтому пациентам рекомендуется умеренная физическая активность, занятия плаванием. Поддержание мышечной эластичности и силы, а также профилактика контрактур проводится средствами массажа, физиотерапии и лечебной гимнастики. Применение различных ортопедических средств (ходунков, инвалидных колясок, фиксаторов для ног, экзоскелетов) позволяет расширить двигательные возможности пациентов и их способность к самообслуживанию. По показаниям проводится хирургическое лечение контрактур.
Прогноз и профилактика
Прогрессирующая мышечная дистрофия Беккера имеет неблагоприятный прогноз. Хотя обездвиженность у пациентов наступает гораздо позже, чем при дистрофии Дюшенна, в конечном итоге поражение сердечной мышцы и дыхательной мускулатуры приводят к гибели пациентов от сердечной или дыхательной недостаточности. Продуманный уход, адекватная терапия, вентиляционная поддержка дыхания, применение ортопедических средств могут лишь увеличить продолжительность и улучшить качество жизни пациента. Профилактика заключается в предупреждении рождения ребенка с патологией путем генетического консультирования будущих родителей и проведение пренатальной диагностики.
Что такое синдром беккера
Только в редких случаях симптомы заболевания проявляются у мальчиков при рождении или в раннем младенческом возрасте, хотя в некоторых случаях уже в этом возрасте отмечается умеренно выраженная гипотония. Первые двигательные навыки (ребенок начинает поворачиваться, сидеть и стоять), как правило, формируются в соответствии с возрастной нормой, или отмечается умеренная задержка двигательного развития.
Плохой контроль головы в младенческом возрасте может быть первым признаком мышечной слабости. Характерные особенности строения лица отсутствуют, так как слабость мимической мускулатуры развивается на поздних стадиях заболевания. Формирование навыка ходьбы также происходит обычно в нормальном возрасте, около 12 мес, однако слабость мышц тазового пояса может наблюдаться в легкой форме уже на 2-м году жизни.
У детей первых 3 лет жизни может формироваться лордоз в вертикальном положении для компенсации слабости ягодичных мышц. Ранние проявления симптома Говерса часто выявляются к 3 годам жизни; полная картина симптома Говерса развивается в возрасте 5-6 лет. В том же возрасте возникает походка Тренделенбурга, или утиная походка (больной идет, переваливаясь с боку на бок).
Время сохранения двигательной активности широко варьирует. Некоторые пациенты уже в возрасте 7 лет прикованы к инвалидному креслу. Большинство детей продолжают ходить с нарастающими затруднениями, но без применения ортопедических аппаратов до 10 лет. С помощью ортопедических приспособлений, физиотерапии и некоторых методов хирургической коррекции (например, удлинение ахилловых сухожилий) большинство пациентов сохраняют способность к ходьбе до 12 лет.
Сохранение самостоятельной ходьбы имеет большое значение не только в связи с тем, что оно позволяет отсрочить развитие депрессии, сопровождающей потерю личной независимости пациента, но также потому, что формирование выраженного сколиоза обычно не происходит до тех пор, пока пациент продолжает ходить, хотя бы в течение 1 ч в день. Во многих случаях после потери способности к самостоятельной ходьбе у пациентов, прикованных к инвалидному креслу, отмечается быстрое прогрессирование сколиоза.
Неуклонное прогрессирование мышечной слабости продолжается на 2-м десятилетии жизни. Функция дистальных мышечных групп обычно сохранена относительно хорошо, благодаря чему ребенок продолжает пользоваться ложкой (и другими столовыми приборами), карандашом и компьютерной мышкой. Нарушение функции дыхательных мышц проявляется в виде слабого неэффективного кашля, частых инфекционных заболеваний легких и снижения резервного объема легких.
Слабость глоточных мышц может приводить к эпизодам аспирации, назальной регургитации жидкости и носовому тембру голоса. Функция наружных мышц глаза сохранена. Недержание мочи и кала вследствие слабости сфинктеров прямой кишки и мочевого пузыря — редкое и позднее осложнение.
Контрактура наиболее часто возникает в голеностопных, коленных, тазовых и локтевых суставах. Характерен сколиоз. Деформация грудной клетки еще более усугубляет нарушение функции легких и сдавление сердца. Сколиоз может вызывать дискомфорт или болезненность. Увеличение икроножных мышц (псевдогипертрофия) и атрофия мышц бедра — классические симптомы заболевания. Причиной увеличения объема мышц служит гипертрофия отдельных мышечных волокон, инфильтрация мышц жировой тканью и пролиферация коллагена.
Вторая по распространенности локализация псевдогипертрофий,после икроножных мышц — мышца языка, затем следуют мышцы предплечья. Фасцикуляции в языке не возникают. За исключением случаев тяжелой контрактуры голеностопных суставов, ахилловы рефлексы хорошо выражены и сохраняются на конечной стадии заболевания. Коленные рефлексы могут сохраняться до 6 лет, однако они менее выражены, чем ахилловы рефлексы, и в конечном итоге исчезают. На верхних конечностях карпорадиальный рефлекс обычно лучше выражен, чем сгибательный и раз-гибательный локтевой рефлексы.
Кардиомиопатия — постоянный признак заболевания. Тяжесть поражения сердца не всегда коррелирует со слабостью скелетных мышц. Некоторые пациенты умирают от тяжелой кардиоми-опатии на ранних стадиях заболевания, когда еще сохранена способность к самостоятельной ходьбе. У других пациентов в терминальной стадии заболевания определяется хорошая компенсация функции сердца.
Интеллектуальные нарушения развиваются у всех пациентов, хотя только у 20-30 % пациентов IQ ниже 70 баллов. У большинства пациентов имеются трудности обучения, которые, тем не менее, позволяют им учиться по программе средней школы, особенно при применении коррекционных методик. У небольшой части пациентов выявляется глубокая умственная отсталость, однако корреляция с тяжестью миопатии отсутствует. Эпилепсия встречается немного чаще у больных с этим заболеванием, чем среди детского населения в целом.
Дегенеративные изменения и фиброз мышц представляют собой безболезненный процесс. Миалгия и мышечные спазмы не возникают. Кальциноз мышц встречается редко.
Смерть наступает обычно в возрасте около 18 лет. К причинам смерти относится дыхательная недостаточность во сне, некурабельная сердечная недостаточность, пневмония и, иногда, аспирация и обструкция дыхательных путей.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021