Что такое синергизм антибиотиков
Синергизм действия антимикробных пептидов PG-1 и ChBac3.4 с антисептиками в отношении антибиотикоустойчивых бактерий
Полный текст
Аннотация
В исследовании было изучено совместное действие антимикробных пептидов PG-1 и ChBac3.4 с антисептиками (гипохлоритом натрия, диоксидином, пронтосаном, повиарголом, этидроновой кислотой) с целью выявить сочетания, обладающие синергизмом антимикробной активности в отношении антибиотикоустойчивых бактерий. Использовался метод серийных разведений по схеме «шахматной доски» для расчета индексов фракционной ингибирующей концентрации, на основании которых определяли характер совместного действия. Был оценен совместный эффект на метаболическую активность бактерий с помощью флуоресцентного маркера резазурина и на проницаемость бактериальных мембран для хромогенных маркеров — спектрофотометрическим методом. Была изучена сочетанная гемолитическая активность комбинаций. Исследования показали, что гипохлорит натрия проявляет антагонизм антимикробного действия с обоими антимикробными пептидами. С остальными антисептиками сочетанное действие характеризуется аддитивностью или синергизмом. Синергизм наиболее выражен с препаратом высокодисперсного серебра повиарголом. Присутствие антисептиков ускоряет развитие антимикробного эффекта антимикробных пептидов, но не оказывает существенного влияния на динамику их мембранолитического действия на клетки бактерий. Синергизм гемолитической активности проявляется редко. Таким образом, совместное применение антимикробных пептидов и антисептиков перспективно для борьбы с антибиотикоустойчивыми бактериями и может быть использовано для снижения токсических эффектов этих соединений.
Ключевые слова
Полный текст
Об авторах
Мария Сергеевна Жаркова
Автор, ответственный за переписку.
Email: zharkova.ms@yandex.ru
канд. биол. наук, старший научный сотрудник отдела общей патологии и патологической физиологии
Россия, 197376, г. Санкт-Петербург, ул. Академика Павлова, д.12
Екатерина Сергеевна Умнякова
канд. биол. наук, старший научный сотрудник отдела общей патологии и патологической физиологии
Россия, 197376, г. Санкт-Петербург, ул. Академика Павлова, д.12
Анна Геннадьевна Афиногенова
д-р биол. наук, ведущий научный сотрудник, руководитель Испытательного лабораторного центра; профессор кафедры челюстно-лицевой хирургии и хирургической стоматологии
Россия, 197101, г. Санкт-Петербург, ул. Мира, дом 14; 199034, г. Санкт-Петербург, Университетская наб., д.7/9
Геннадий Евгеньевич Афиногенов
Email: oshamova@yandex.ru
Россия, д-р мед. наук, профессор, профессор кафедры челюстно-лицевой хирургии и хирургической стоматологии
Александр Александрович Колобов
д-р биол. наук, заведующий лабораторией химии пептидов
Россия, 197110, г. Санкт-Петербург, ул. Пудожская, д. 7
Ольга Валерьевна Шамова
д-р биол. наук, доцент, заведующий отделом общей патологии и патологической физиологии, заместитель директора по научной работе
Россия, 197376, г. Санкт-Петербург, ул. Академика Павлова, д.12
Список литературы
Дополнительные файлы
© Жаркова М.С., Умнякова Е.С., Афиногенова А.Г., Афиногенов Г.Е., Колобов А.А., Шамова О.В., 2018
Эта статья доступна по лицензии Creative Commons Attribution 4.0 International License.
Синергизм и потенцирование антибиотиков
В последнее время антибиотики часто стали применять в комбинации с другими антибиотиками, а также с химиотерапевтическими веществами разных групп (сульфаниламиды, нитрофураны и др.).
Комбинации такого рода преследуют цели повышения противомикробного действия и ослабления отрицательного влияния их. При комбинированном назначении нескольких веществ с разным механизмом действия нарушают одновременно несколько звеньев метаболизма у возбудителей болезней, поэтому надежнее и быстрее вызывают гибель их. Усилить действие можно при сочетании вещества сильно, но кратковременно действующего, с умеренным по силе, но долго действующим. При этом первое вещество если не убивает, то переводит возбудителя болезни в анабиотическое состояние, а второе вещество мешает выйти ему из такого состояния. Кроме того, назначение комбинированных препаратов часто преследует цель улучшить резорбцию антибиотика микробной клеткой, ослабить выработку ферментов, инактивирующих антибиотик, продлить период пребывания антибиотика в микробной клетке или в организме животного, ослабить местное неблагоприятное влияние, понизить вирулентность микроба, повысить защитные реакции животного и т. д. При правильно составленной комбинации действие химиотерапевтических веществ на возбудителя болезни обычно усиливается, а неблагоприятное влияние на животных ослабевает.
При правильной комбинации двух и более веществ возможен синергизм (суммарное действие в одном направлении) или потенцирование (значительное повышение химиотерапевтического эффекта). При неправильной комбинации чаще всего бывает тот или иной антагонизм, сопровождающийся ослаблением лечебного действия препарата. Поэтому любые комбинации должны быть хорошо обоснованы экспериментально. Лучшими являются те, которые хорошо апробированы и часто используются. Фармацевтическая промышленность выпускает много подобных препаратов, и они описаны в монографии. По практические врачи могут и сами комбинировать вещества для изменения действия в желаемом направлении.
В. Ф. Грезнн, изучая действие пенициллина, стрептомицина, норсульфазола и сульфадимезина, установил, что в сочетании с другими лечебная эффективность этих препаратов значительно выше. Для достижения бактериостатического эффекта в отношении стафилококков достаточно брать пенициллина и стрептомицина в 35 раз, а норсульфазола и сульфадимизина в 1400 раз меньше, чем при применении каждого из них в отдельности. Результаты, полученные in vitro, подтверждены им при лечении кроликов со стафилококковой инфекцией, вызванной лекарственно-устойчивым возбудителем.
Аналогичные исследования проводил В. М. Подкопаев. По его данным, наиболее благоприятно при диспепсиях телят действуют препараты в следующих комбинациях: левомицетин с тетрациклином или стрептомицином; синтомицин с фуразолидоном, фурацилином, стрептомицином, полимиксином, тетрациклином, окситетрациклином и хлортетрациклином; мицерин с фуразолидоном, фурацилином и стрептомицином; тетрациклин с полимиксином, фуразолидоном; стрептомицин со стрептоцидом или со стрептоцидом и фуразолидоном. При комбинации тетрациклина со стрептомицином бактерицидность в отношении кишечной микрофлоры понижается.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Комбинированная антибиотикотерапия
Содержание
Комбинированная антимикробная терапия [ править | править код ]
Комбинированная антимикробная терапия применяется по строгим показаниям. При выборе комбинации препаратов необходимо учитывать возможные взаимодействия между ними, влияющие как на микро-, так и на макроорганизм. Препараты, действующие на разные мишени, могут усиливать или ослаблять антимикробную активность друг друга. Побочное действие комбинации антимикробных средств слагается из побочных эффектов отдельных препаратов, а иногда и превышает простую сумму их побочных эффектов. Например, ванкомицин сам по себе не оказывает выраженного нефротоксического действия, но, по некоторым данным, усугубляет нефротоксичность аминогликозидов (Farberand Moelle-ring, 1983).
Оценка взаимодействия антимикробных средств [ править | править код ]
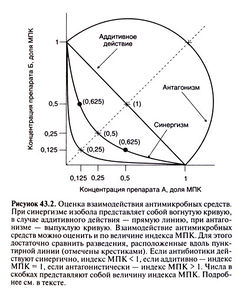
Существует два способа оценки взаимодействия антимикробных средств. В первом случае микроорганизмы высевают на жидкие питательные среды, содержащие разные сочетания последовательных двукратных разведений двух исследуемых препаратов, и инкубируют в течение 18—24 ч. Затем определяют МПК каждого антибиотика в отдельности и в присутствии другого препарата. Если МПК комбинации антибиотиков составляет не более 25% МПК каждого препарата в отдельности, антибиотики действуют синергично. Синергизм может быть обусловлен повышением чувствительности микроорганизма к одному препарату под действием другого. Если МПК комбинации антибиотиков равна половине МПК каждого из них в отдельности, это означает, что препараты действуют независимо друг от друга, а их эффект суммируется (аддитивное действие). Если МПК комбинации антибиотиков меньше, чем МПК каждого из них в отдельности, препараты действуют антагонистически (то есть ослабляют действие друг друга). При сравнении всех (а не только одинаковых) комбинаций двукратных разведений антибиотиков можно построить так называемые изоболы (рис. 43.2). Если антибиотики действуют синергично, изобола представляет собой вогнутую кривую, если аддитивно — прямую линию, если антагонистически — выпуклую кривую. Для каждой точки изоболы можно рассчитать индекс МПК — сумму концентраций, выраженных в долях МПК. Для двух антимикробных средств А и Б его рассчитывают следующим образом:
Индекс МПК = МПК А в присутствии Б/МПКА+МПК Б в присутствии А/МПКБ
В случае аддитивного действия индекс МПК равен единице, при синергизме он меньше 1, при антагонизме — больше. К сожалению, с помощью этого метода нельзя выявить синергичный бактерицидный эффект, так как определяются не МБК, а МПК.
Другой способ оценки взаимодействия препаратов заключается в построении кривых, описывающих динамику гибели микроорганизмов. Культуру микроорганизмов инкубируют в присутствии обоих антимикробных средств и каждого из препаратов в отдельности. Для оценки числа выживших микроорганизмов ее периодически пересевают. О синергизме говорят в том случае, если число бактерий в среде, содержащей комбинацию препаратов, как минимум в 100 раз меньше, чем в среде, содержащей наиболее активный из препаратов. Если число бактерий различается менее чем в 100 раз, говорят об индифферентном действии. Если же число бактерий в присутствии комбинации антимикробных средств больше, чем в присутствии наиболее активного из них, препараты действуют антагонистично.
В 1952 г. Джавиц и Ганнисон предложили простой способ оценки взаимодействия антимикробных средств, основанный на их свойствах (Jawetz and Gunnison, 1952). Авторы заметили, что бактериостатические антибиотики (например, тетрациклины, эритромицин, хлорамфеникол) часто действуют антагонистично по отношению к бактерицидным препаратам (таким, как β-лактамные антибиотики, ванкомицин, аминогликозиды), поскольку первые подавляют деление бактериальных клеток и синтез белка, необходимые для реализации действия большинства бактерицидных антибиотиков. С другой стороны, два бактерицидных препарата обычно действуют синергично. Так, препараты, подавляющие синтез клеточной стенки, и аминогликозиды проявляют синергизм в отношении многих видов бактерий. Исключение составляет рифампицин. Будучи бактерицидным препаратом, он индифферентно или даже антагонистически взаимодействует с другими бактерицидными антибиотиками in vitro. Клиническое значение этого явления не установлено, поскольку in vivo комбинации с рифампицином эффективны.
Показания к комбинированной антимикробной терапии [ править | править код ]
Назначение нескольких антимикробных средств оправдано в следующих случаях: 1) при эмпирической терапии (возбудитель не известен), 2) при лечении смешанных инфекций, 3) при необходимости усилить антимикробное действие в отношении определенного возбудителя, 4) в целях предупреждения лекарственной устойчивости.
Эмпирическая терапия [ править | править код ]
Это самый частый повод для назначения комбинации антимикробных средств. Чтобы правильно подобрать лечение, необходимо знать особенности инфекции, ее наиболее вероятных возбудителей, а также антимикробные спектры препаратов, которые могут применяться в данной ситуации. Если состояние больного тяжелое, антимикробная терапия должна быть направлена против всех возможных возбудителей. Для этого часто приходится назначать несколько препаратов. Например, при внебольничной пневмонии используют цефуроксим в сочетании с макролидами: первый активен в отношении грамотрицательных бактерий, а вторые — в отношении возбудителей атипичных пневмоний, например Mycoplasma pneumoniae. Но такое лечение не должно быть слишком длительным. В нем нет необходимости, если возбудитель уточнен или выяснилось, что инфекция вообще отсутствует. Комбинированная терапия недешева, увеличивает риск побочных эффектов, способствует развитию суперинфекции и отбору полирезистентных штаммов. Неоправданное применение комбинации антимикробных средств бывает обусловлено тем, что врачи начинают лечение до взятия материала на посев или же, получив данные о возбудителе и его чувствительности, не меняют схему лечения. Конечно, отказаться от терапии, доказавшей свою эффективность, может быть трудно. Тем не менее нужно всегда стремиться назначать препарат с наиболее узким спектром действия и минимальными побочными эффектами. Лечение смешанных инфекций. Комбинированная антимикробная терапия показана при смешанной инфекции, возбудители которой чувствительны к разным антимикробным средствам. Например, абсцессы брюшной полости, печени и головного мозга, а также инфекции половых органов часто бывают вызваны смешанной аэробной и анаэробной микрофлорой.
Усиление действия антимикробных средств [ править | править код ]
Совместное применение нескольких антимикробных средств может значительно усиливать их действие, хотя преимущества комбинированного лечения перед монотерапией доказаны лишь для небольшого числа инфекций.
Наиболее убедительные доказательства получены для энтерококкового эндокардита (Wilson et al., 1995). In vitro пенициллины оказывают на Enterococcus faecalis и Enterococcus faecium лишь бактериостатическое действие, а в комбинации со стрептомицином или с гентамицином — бактерицидное. Причем после монотерапии пенициллинами рецидивы возникают намного чаше, чем после комбинированной терапии.
In vitro пенициллины действуют синергично со стрептомицином или гентамицином и в отношении зеленящих стрептококков. В экспериментах на животных комбинация этих препаратов быстрее уничтожала возбудителей в вегетациях на клапанах по сравнению с монотерапией пенициллинами. Поданным клинических исследований, при стрептококковом эндокардите двухнедельная комбинированная терапия столь же эффективна, как и четырехнедельная монотерапия пенициллинами. Кроме того, пенициллины и аминогликозиды проявляют синергизм в отношении Staphylococcus aureus (как in vitro, так и в экспериментальных моделях in vivo). Например, у некоторых больных с инфекционным эндокардитом трехстворчатого клапана, вызванным Staphylococcus aureus, эффективна двухнедельная терапия тобрамицином или гентамицином (в низких дозах) в сочетании с нафциллином, хотя обычно таким больным назначают монотерапию нафциллином в течение 4—6 нед (Chambers etaL, 1988).
Комбинация β-лактамных антибиотиков и аминогликозидов рекомендуется при инфекциях, вызванных Pseudomonas aeruginosa. In vitro β-лактамные антибиотики, активные в отношении псевдомонад, и аминогликозиды действуют синергично в отношении большинства штаммов Pseudomonas aeruginosa. В экспериментах на животных комбинированная терапия тоже оказалась эффективнее, чем монотерапия указанными препаратами. В некоторых, хотя далеко не во всех, клинических испытаниях (Hilfetal., 1989; Vidal etal., 19%; Leibovici et al., 1997) сочетание β-лакгамных антибиотиков с аминогликозидами увеличивало выживаемость при тяжелых псевдомонадных инфекциях. Комбинированную терапию рекомендуется применять и при инфекциях, вызванных другими грамотрицательными палочками. Однако ее преимущества перед монотерапией во многих случаях остаются недоказанными (Ваглеге, 1992; Rybak and McGrath, 1996).
Синергизм сульфаниламидов и ингибиторов дигидрофолатредуктазы (например, триметоприма) обусловлен блокадой последовательных этапов синтеза фолиевой кислоты. Комбинированный препарат триметоприм/сульфаметоксазол активен в отношении микроорганизмов, устойчивых к сульфаниламидам. Его успешно применяют при инфекциях мочевых путей, пневмоцистной пневмонии, брюшном тифе, дизентерии и не которых инфекциях, вызванных устойчивыми к ампициллину штаммами Haemophilus influenzae.
По данным исследований in vitro и экспериментов на животных, фторцитозин и амфотерицин В действуют синергично в отношении Cryptococcus neoformans. При криптококковом менингите в отсутствие ВИЧ-инфекции фторцитозин позволяет снизить дозу амфотерицина В и сократить продолжительность лечения с 10 до 6 нед; риск побочных эффектов при этом снижается, а эффективность лечения остается прежней (Bennett et al., 1979). Кроме того, при криптококковом менингите на фоне СПИДа эта комбинация позволяет быстрее добиться стерильности СМЖ, чем монотерапия амфотерицином В (van der Horst etal., 1997).
Предупреждение лекарственной устойчивости [ править | править код ]
Комбинированная терапия препятствует отбору штаммов, устойчивых к одному из препаратов. Если частота появления мутантов, устойчивых к одному антимикробному средству, составляет, например, 10
6, то вероятность одновременного возникновения обеих мутаций равна произведению этих частот, то есть 10
13. Чтобы это событие произошло, число микроорганизмов должно быть на несколько порядков больше, чем обычно бывает при инфекциях. Предупреждение лекарственной устойчивости лежит в основе комбинированной терапии туберкулеза. При монотерапии микобактерии туберкулеза часто приобретают устойчивость к препарату, а одновременное назначение двух и более противотуберкулезных средств существенно повышает шансы на успех лечения. Другим примером служит лечение стафилококковых инфекций (например, эндокардита протезированных клапанов и остеомиелита) рифампицином. Добавление второго препарата позволяет избежать появления устойчивых к рифампицину штаммов стафилококков (Zim-merli et al., 1998). С той же целью комбинированную терапию назначают и при инфекции, вызванной Helicobacter pylori (Taylor et al., 1997). В отношении прочих инфекций убедительных данных о том, что комбинированная терапия предотвращает возникновение лекарственной устойчивости, нет.
Недостатки комбинированной терапии [ править | править код ]
К ним относятся повышение риска побочных эффектов, появление полирезистентных штаммов и высокая стоимость. Кроме того, как уже было отмечено, бактериостатические и бактерицидные препараты могут действовать антагонистично. Клиническое значение антагонизма антимикробных средств остается неясным. Хотя in vitro он наблюдается довольно часто, in vivo случаи антагонизма редки. Наиболее яркий пример такого антагонизма—лечение пневмококкового менингита.
В 1951 г. Леппер и Даулинг заметили, что при лечении пневмококкового менингита пенициллином летальность составила 21%, а при одновременном назначении хпортетрациклина она увеличилась до 79% (Lepper and Dowling, 1951). Позднее эти данные были подтвержаены другими исследователями, обнаружившими увеличение летальности бактериального менингита у детей с 4,3 до 10,5% при комбинированной терапии ампициллином, хлорамфениколом и стрептомицином по сравнению с монотерапией ампициллином (Mathies at al., 1967).
Антагонизм возникает только в том случае, если оба препарата активны в отношении данного микроорганизма, и в большинстве случаев не играет сколько-нибудь заметной роли. Несмотря на то что комбинация бактериостатического и бактерицидного препарата обычно дает лишь бактериостатический эффект, лечение в большинстве случаев все равно будет успешным благодаря действию защитных механизмов. Если же эти механизмы не срабатывают и для излечения инфекции необходимо бактерицидное действие (например, при менингите, эндокардите, у больных с нейтропенией при инфекциях, вызванных грамотрицательными бактериями), эффективность антимикробной терапии снижается.
Ошибки в антибактериальной терапии инфекций дыхательных путей в амбулаторной практике
Опубликовано в журнале:
Лечащий врач, 2003, №8 Л. И. Дворецкий, доктор медицинских наук, профессор
С. В. Яковлев, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
При выборе способа антибактериальной терапии в амбулаторной практике необходимо учитывать и решать как тактические, так и стратегические задачи. К тактическим задачам антибиотикотерапии относится рациональный выбор антибактериального препарата, обладающего наибольшим терапевтическим и наименьшим токсическим воздействием.
Стратегическая задача антибиотикотерапии в амбулаторной практике может быть сформулирована как уменьшение селекции и распространения резистентных штаммов микроорганизмов в популяции.
В соответствии с этими положениями следует выделять тактические и стратегические ошибки при проведении антибактериальной терапии инфекций дыхательных путей в амбулаторной практике (см. таблицу 1).
Таблица 1. Ошибки антибактериальной терапии в амбулаторной практике.
Тактические ошибки антибактериальной терапии
1. Необоснованное назначение антибактериальных средств
Особую категорию ошибок представляет неоправданное применение антибактериальных препаратов (АП) в тех ситуациях, когда их назначение не показано.
Показанием для назначения антибактериального препарата является диагностированная или предполагаемая бактериальная инфекция.
При всех трудностях принятия решения в подобных ситуациях необходимо отдавать себе отчет в том, что антибактериальные препараты не оказывают влияния на течение вирусной инфекции и, следовательно, их назначение при ОРВИ не оправдано (см. таблицу 2). В то же время предполагаемая возможность предотвращения бактериальных осложнений вирусных инфекций с помощью назначения антибактериальных препаратов не находит себе подтверждения в клинической практике. Кроме того, очевидно, что широкое неоправданное применение антибактериальных препаратов при ОРВИ чревато формированием лекарственной устойчивости и повышением риска возникновения нежелательных реакций у пациента.
Таблица 2. Инфекционные заболевания дыхательных путей преимущественно вирусной этиологии
и не требующие антибактериальной терапии.
Часто врач назначает нистатин или другой антимикотик в случае обнаружения в полости рта или в моче грибов рода Candida. При этом он ориентируется лишь на данные микробиологического исследования и не учитывает наличие или отсутствие симптомов кандидоза, а также факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.).
Выделение грибов рода Candida из полости рта или мочевых путей пациентов в большинстве случаев служит свидетельством бессимптомной колонизации, не требующей коррегирующей противогрибковой терапии.
II. Ошибки в выборе антибактериального препарата
Пожалуй, наибольшее число ошибок, возникающих в амбулаторной практике, связано с выбором антибактериального средства. Выбор антибиотика должен производиться с учетом следующих основных критериев:
Антихеликобактерные средства (ч. 2)
Схема эрадикации бактерии H. pylori подбирается в индивидуальном порядке в зависимости от чувствительности бактерии и реакции организма на выбранные препараты.
Преферанская Нина Германовна
Доцент кафедры фармакологии института фармации им. А.П. Нелюбина Первого МГМУ им. И.М. Сеченова (Сеченовский университет), к.фарм.н.
Амоксициллин (табл./капс. 250 мг, 500 мг) — полусинтетический антибиотик пенициллинового ряда широкого спектра действия, с умеренной активностью в отношении H. pylori. Биодоступность составляет 70–80%, растворимая лекарственная форма — 90%. В тканях достигается терапевтическая концентрация. Амоксициллин характеризуется широким спектром антимикробного действия, низким уровнем резистентности, хорошей всасываемостью в желудочно–кишечном тракте, высокой биодоступностью и кислотостойкостью. Блокада амоксициллином пенициллиносвязывающих белков приводит к остановке роста и гибели микробной клетки.
Период полувыведения — 1–1,5 ч. Выводится на 50–70% почками в неизмененном виде путем канальцевой секреции (80%) и клубочковой фильтрации (20%), печенью — 10–20%. В небольшом количестве выделяется с грудным молоком.
Противопоказаниями служит повышенная чувствительность к амоксициллину, детский возраст до 3 лет.
Важно! Вызывает аллергические реакции, тошноту, нарушения со стороны крови и лимфатической системы очень редко, диарею, очень редко кристаллурию.
Кларитромицин (табл. 250 мг, 500 мг; капс. 250 мг) — относится к группе полусинтетических макролидов, оказывает дозозависимый бактериостатический эффект за счет блокирования белковых систем микробной клетки, взаимодействует с 50S рибосомальной субъединицей, подавляет синтез белка бактерий. Однако при достижении концентрации, которая в 2–3 раза превышает минимальную ингибирующую концентрацию, оказывает бактерицидное действие. Бактерицидное действие оказывает в отношении H. pylori, данная активность Кларитромицина выше при нейтральном pH, чем при кислом. Кларитромицин по эффективности в отношению к H. pylori превышает все другие активные субстанции этой группы. Обладает широким спектром действия и является одним из наиболее эффективных и распространенных макролидов. При приеме внутрь хорошо всасывается, концентрация его в тканях намного превышает сывороточную. Максимальное накопление также наблюдается в слизистой ЖКТ.
Препарат хорошо проникает внутрь клеток (моноцитов, макрофагов, фагоцитов), создавая высокие внутриклеточные концентрации. Высокие концентрации в очаге воспаления делают его средством выбора при H. pylori — ассоциированной патологии желудка и 12-перстной кишки. Благодаря лиофильности способен проникать в клетки и накапливаться в высоких концентрациях в слизистой оболочке желудка и двенадцатиперстной кишки, что имеет большое значение при эрадикации H. pylori.
Также нельзя не вспомнить позитивный эффект санации, присущий Кларитромицину. Широкий спектр активности данного антибиотика по отношению к грампозитивным и грамнегативным бактериям позволяет элиминировать патогенные и условно–патогенные возбудители из полости ЖКТ, колонизация которых наблюдается в условиях хеликобактер–ассоциированных заболеваний. Препарат обладает собственной противовоспалительной активностью, что обусловлено угнетением продукции провоспалительных цитокинов и стимуляцией синтеза противовоспалительных гуморальных факторов. Однако самым главным его качеством является способность разрушать матрикс биопленки. 99% микроорганизмов, к которым относится и H. pylori, существуют не в виде отдельных микроорганизмов, а в составе сложно организованных сообществ — биопленок, которые представляют собой совокупность бактериальных клеток, которые окружены внеклеточным матриксом, который имеет полисахаридную природу. Матрикс выполняет защитную функцию и часто является причиной устойчивости микроорганизмов к действию антибиотиков, резистентность бактерий в составе биопленки возрастает в 10–1000 раз.
Важно! При применении препарата могут возникать диарея, гиперчувствительность, аллергические реакции, часто сыпь, очень редко может вызвать анафилактоидную реакцию, дерматит, нарушение слуха, звон в ушах (частота неизвестна), а также снижение числа лейкоцитов и тромбоцитов.
Метронидазол (ТН «Трихопол», «Флагил», табл. 250 мг) — противопротозойный препарат, относится к производным 5-нитроимидазола, активен в отношении микроаэрофилов H. pylori. Механизм действия заключается в биохимическом восстановлении 5-нитрогруппы внутриклеточными транспортными протеинами анаэробных микроорганизмов и простейших. Препарат оказывает избирательный бактерицидный эффект в отношении тех микроорганизмов, ферментные системы которых способны восстанавливать нитрогруппу. Восстановленная 5-нитрогруппа взаимодействует с дезоксирибонуклеиновой кислотой (ДНК) клетки микроорганизмов. Возникает ингибирование тканевого дыхание, нарушается репликация ДНК, синтез нуклеиновых кислот и синтез белка, что ведет к гибели бактерий.
Метронидазол быстро проникает в ткани (легкие, почки, печень, кожу, желчь, спинномозговую жидкость, слюну, семенную жидкость, вагинальный секрет), в грудное молоко и проходит через плацентарный барьер. Около 30–60 % метронидазола метаболизируется путем гидроксилирования, окисления и глюкуронирования.
Препарат медленно выводится из организма, период полувыведения 8–10 час., при повторных введениях кумулирует. Проникает в ткани и жидкости организма, обеспечивая терапевтические концентрации.
Важно! Вызывает темное окрашивание мочи, металлический привкус во рту, тошноту, рвоту, диарею, могут возникать аллергические реакции: крапивница, кожная сыпь, нарушения со стороны иммунной системы: ангионевротический отек, анафилактический шок.
КОМПЛЕКСНОЕ ПРИМЕНЕНИЕ ЛС
Успешная схема лечения основана на сочетании препаратов, которые предотвращают возникновение резистентности и настигают бактерию в различных участках желудка. Терапия должна гарантировать, что даже небольшая популяция микроорганизмов не останется жизнеспособной. В схемы терапии обязательно включают препараты висмута, химиотерапевтические препараты и ингибиторы протонной помпы (о последних препаратах мы писали в предыдущей статье).
Существуют стандартные схемы лечения двух-, трех- или четырехкомпонентной терапии в период лечения и обострения гастритов, язвенной болезни12-перстной кишки и желудка.
Используют:
√ БИТЕРАПИЮ: Ранитидин + Висмута цитрат (Пилорид);
Амоксициллин + Метронидазол (Хеликоцин);
√ ТРОЙНУЮ ТЕРАПИЮ:
Кларитромицин + Омепразол + Тинидазол (Пилобакт);
√ КВАДРОТЕРАПИЮ:
ЭРАДИКАЦИОННАЯ ТЕРАПИЯ H. pylori включает комплекс нескольких препаратов. Распространенная ошибка, которая зачастую приводит к непредсказуемым результатам, замена даже одного хорошо изученного препарата из стандартной схемы на другой препарат той же группы. Использование данных схем лечения значительно улучшает состояние больных и предупреждают развитие рецидивов.
Применение комбинированных лекарственных препаратов «Пилобакт», «Пилорид», «Хеликоцин» и др. значительно улучшает состояние больных и предупреждает развитие рецидивов. Как правило, терапия обязательно включает антисекреторные препараты, химиотерапевтические средства, гастропротекторы и препараты коллоидного висмута.
Интенсивную терапию проводят до достижения устойчивой ремиссии и отсутствия рецидивов у больных в течение 1,5–2 лет. При необходимости проводят профилактическую противорецидивную терапию. При применении комбинированной терапии необходимо убедиться в безопасном применении сочетанных препаратов, их переносимости и эффективности. При применении таких препаратов могут наблюдаться нежелательные побочные явления: тошнота, рвота (20%), диарея (10%), псевдомембранозный колит (1%), головокружение (2%), чувство жжения в ротовой полости, глотке, кандидоз (15%). Неэффективность лечения может быть обусловлена нарушением правил приема препаратов или развитием устойчивости бактерии к ним. Но несмотря на применение комбинированных схем лечения, у 10–20% пациентов, инфицированных H. pylori, не удается достичь элиминации возбудителя.
Повышают клиническую эффективность эрадикационной терапии комбинации ингибиторов протонной помпы (ИПП) с противомикробными препаратами.
Предполагается, что антисекреторные препараты из группы ИПП могут способствовать повышению концентрации антимикробных средств (Метронидазола и Кларитромицина) в просвете желудка. ИПП уменьшают объем желудочного сока, вследствие чего вымывание антибиотиков с поверхности слизистой уменьшается, а концентрация антибиотиков, соответственно, увеличивается. Кроме того, снижение объема соляной кислоты поддерживает стабильную терапевтическую концентрацию антимикробных препаратов. При проведении эрадикационной антихеликобактерной терапии совместно с ИПП является одним из необходимых условий.
Успешность комбинированных схем терапии определяется во многом правильным выбором антибактериального средства и обеспечением постоянно высокого уровня эрадикации бактерии. Удлинение курса лечения до 10–14 дней также повышает эффективность эрадикации в среднем на 5%, а назначение высоких (двойных) доз ИПП позволяет дополнительно получить 8% показателей эффективности эрадикации H. pylori.
Именно два антибактериальных агента Амоксициллин и Кларитромицин определяют высокую эффективность в отношении микроорганизмов, которые находятся в фазе деления. Поддержка уровня рН в желудке выше чем 3,0 при помощи антисекреторных препаратов резко тормозит процесс деградации Кларитромицина (при рН 1,0 в желудочном соке Т½ составляет 1 час, а при рН 7,0 205 час.), что обеспечивает полноценную эрадикацию H. pylori. На протяжении последних 20 лет в основных схемах эрадикационной терапии сохраняется стойкая комбинация указанных антибиотиков, что связано с фармакокинетическими и фармакодинамическими особенностями данных препаратов.
Схема эрадикации бактерии H. pylori подбирается в индивидуальном порядке в зависимости от чувствительности бактерии и реакции организма на выбранные препараты. Продолжительность курса лечения определяется лечащим врачом. Самолечение такого опасного заболевания, как хеликобактериоз, категорически противопоказано.