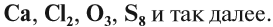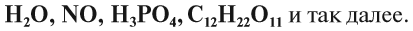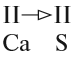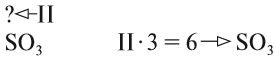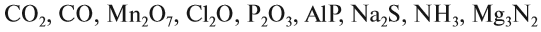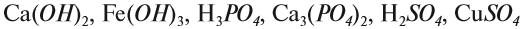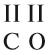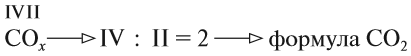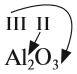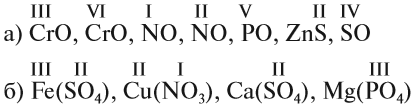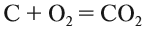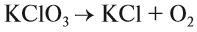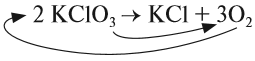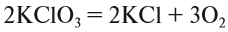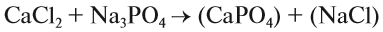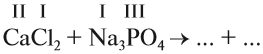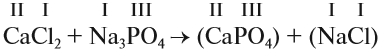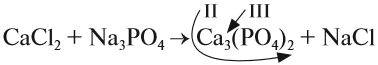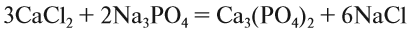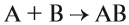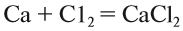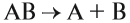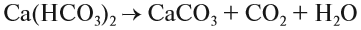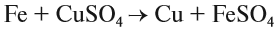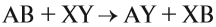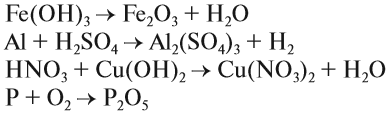Что такое свойства химия 8 класс
Разработка урока по химии 8 класс «Предмет химии. Вещества и их свойства»
Урок по химии в 8 классе на тему «Предмет химии. Вещества и их свойства» (урок по технологии критического мышления).
учитель химии МБОУ “Средняя общеобразовательная школа №26” г. Калуги
Тесник Юлия Валерьевна
Цель урока : создать условия для формирования у учащихся понятий “химия ”, “вещество”, “химический элемент”, “простые вещества ”, “сложные вещества”, “свойства веществ”.
обучающие : содействовать формированию у учащихся знаний, позволяющих выявить чёткие различия между химией и другими естественными науками, между веществом и физическим телом, между формами существования химического элемента;
развивающие : способствовать развитию у учащихся коммуникативных способностей по средствам работы в малых группах;
воспитательные: содействовать воспитанию стойкого позитивного интереса к предмету.
Тип урока: урок изучения нового материала и первичного закрепления знаний.
Форма урока : беседа с демонстрационными и лабораторными опытами.
Оборудование: раздаточный материал (опорный конспект), листы ватмана, таблички с изображением атомов разных видов, цветные карточки-рожицы, оборудование и реактивы для демонстрационного опыта (дихромат аммония, спирт, лучина, спички, асбестовая сетка).
Стадия вызова (ликвидация чистого листа):
Вступление: ребята, сегодня мы приступаем к изучению нового для вас предмета – [имии. Новый материал запоминается легче, если он нанизывается на уже полученные знания. Поэтому сейчас предстоит работа с извлечением этого материала из памяти.
— и ндивидуальная работа – в течение 2 минут ребята индивидуально в тетради составляют кластер “Что я сам знаю о химии?”:
— работа в группах – в течение 5 минут ребята рассказывают о своих ассоциациях учащимся группы (группа по 4 человека), дополняют свой кластер новыми понятиями.
— “защита схемы” – каждая группа представляет свою схему учащимся других групп (четверть ватмана) и отвечает на вопрос “Что мы вместе знаем о химии?”. Составляем единый кластер на доске (каждая группа рассказывает по одной ассоциации, не повторяясь, один ученик записывает ключевые слова на доске) – 5 минут.
Ребята маркируют текст и дополняют свой кластер новыми понятиями.
Вместе с учителем обсуждаем опорный конспект – ключевые определения, дополняем кластер на доске.
По ходу обсуждения закрепляем полученную информацию через выполнение тренировочных упражнений (15 минут):
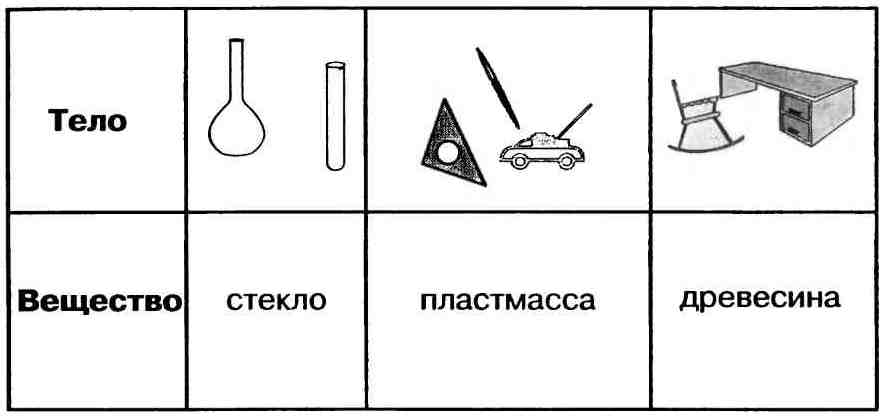
вещества физические тела
На экране показываем изображения веществ и физически тел (карандаш, уголь, чашка, дерево, вода, алюминий, вилка, парта, гвоздь, железо, кольцо, золото, сода)
Учащиеся выходят по одному и записывают каждое название в соответствующий столбик. В заключение упражнения: подытожить – что такое вещество (то, из чего состоят физические тела).
2) физкультминутка – упражнение : ребятам раздаются карточки с изображением атомов разных видов:
Учащиеся выходят в свободное пространство между партами.
С тадия рефлексии (5 минут) – составление синквейна.
— перед тем, как составлять синквейн, вернемся к ключевым словам урока: химия как наука, вещество, химический элемент, простое вещество, сложное вещество, свойства вещества.
— с оставление синквейна – учащиеся составляют синквейн по плану;
Одно существительное, которое выражает суть того, что написано ранее.
Примерный вариант синквейна:
Учить, изучать, удивляться;
Лучше один раз увидеть, чем два услышать!
— прослушиваем синквейны учащихся.
4. Анализ настроения учащихся после урока : при выходе из класса учащиеся проходят через учительский стол, берут цветные карточки-рожицы (рис.1) и кладут их на чашу весов с аналогичной рожицей. Анализируем, какое настроение учащихся перевешивает.
Рис.1. Цветные бумажки-рожицы. 

Хозяин своей жизни тот, кто способен преодолевать свои настроения.
Определенный вид атомов – химический элемент.
При соединении атомов одного химического элемента образуется простые вещества.
Простые вещества – вещества, образованные атомами одного химического элемента.
Сложные вещества — вещества, образованные атомами разных химических элементов.
Таким образом, химический элемент может существовать в трех формах: свободные атомы, простые вещества, сложные вещества.
Различные вещества отличаются друг от друга своими свойствами.
Свойства веществ – это признаки, по которым одни вещества отличаются от других.
Что такое свойства химия 8 класс
Схема. Химические формулы в 8 классе
4. Основные определения в 8 классе
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры.
3. Молекулы находятся в непрерывном движении.
4. Молекулы состоят из атомов.
6. Атомы характеризуются определённой массой и размерами.
При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. Атомы при химических явлениях перегруппировываются, образуя молекулы новых веществ.
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА
Каждое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный качественный и количественный состав.
ВАЛЕНТНОСТЬ
Валентность — свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента.
ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция — явление, в результате которого из одних веществ образуются другие. Реагенты — вещества, вступающие в химическую реакцию. Продукты реакции — вещества, образующиеся в результате реакции.
Признаки химических реакций:
1. Выделение теплоты (света).
2. Изменение окраски.
3. Появление запаха.
4. Образование осадка.
5. Выделение газа.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.
Что такое свойства химия 8 класс
Ключевые слова конспекта: предмет химии, вещества и их свойства, чистые вещества и смеси, способо разделения смесей.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Химия является одной из наук, изучающих природу. Вместе с биологией и физикой химия принадлежит к числу естественных наук.
Вещество — это то, из чего состоит физическое тело. Вещество характеризуется определенными физическими свойствами.
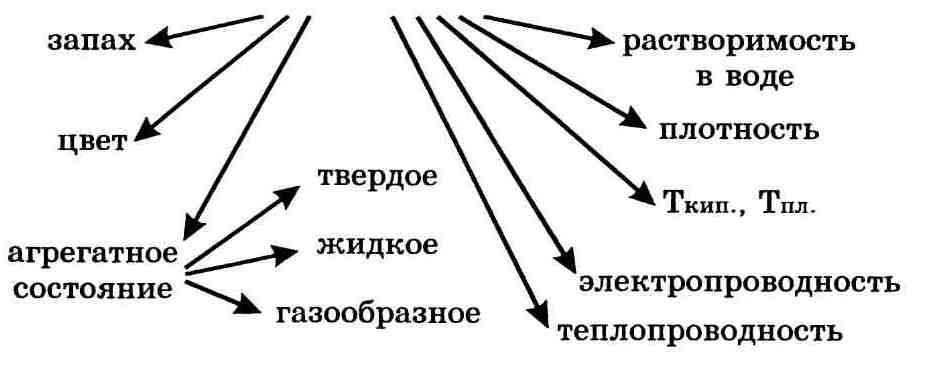
Свойства веществ — это признаки, по которым вещества отличаются друг от друга или сходны между собой, например:
Важнейшие физические свойства вещества следующие: агрегатное состояние, цвет, запах, плотность, растворимость в воде, тепло-и электропроводность, температуры плавления и кипения.
Например, всем известное вещество алюминий можно охарактеризовать так: Алюминий — металл серебристо-белого цвета, сравнительно лёгкий (р = 2,7 г/см3), плавится при температуре 600°С. Алюминий очень пластичен. По электрической проводимости уступает лишь золоту, серебру и меди. Из-за лёгкости алюминий в виде сплавов широко используют в самолёто- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта.
Чистые вещества и смеси
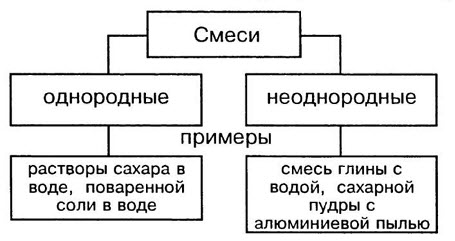
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.
Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
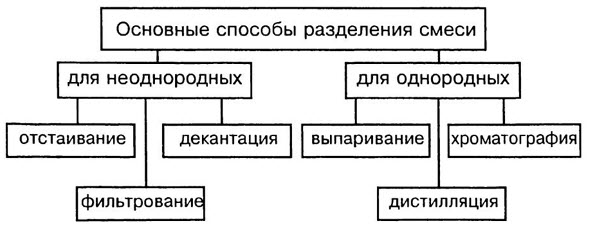
Способ разделения смесей
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.
Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Хроматография. Метод разделения смесей, основанный на различиях относительной растворимости веществ в используемом растворителе (жидкая фаза) и прочности связывания этих веществ поверхностью сорбента (твердая фаза).
Бумажная хроматография. Нанесем каплю раствора смеси двух веществ на расстоянии 2 см от края длинной полоски фильтровальной бумаги. Подвесим полоску в стеклянном цилиндре, на дне которого находится растворитель. Нижнюю часть полоски погрузим в растворитель, при этом пятно со смесью находится чуть выше. Верхняя часть полоски удерживается проволокой у отверстия цилиндра. Сверху цилиндр закроем стеклом, чтобы не испарялся растворитель. Боковые стороны полоски не касаются стенок цилиндра. Растворитель смачивает полоску, и жидкий фронт движется вверх за счет капиллярных сил. Вместе с растворителем по бумаге движутся и растворенные вещества. Если они цветные, то за движением можно наблюдать визуально. Вещество, которое лучше растворимо и менее прочно удерживается сорбентом (бумагой), поднимется выше. Когда фронт поднимется достаточно высоко и пятна разделятся, полоску вынимают и разрезают.
Колоночная хроматография — процесс, родственный рассмотренному. В качестве твердой фазы служит силикагель, помещенный в колонку. Только в этом случае смесь наносят равномерно вверху колонки, а потом добавляют растворитель. Разделенные вещества собирают внизу в разные стаканчики.
Конспект урока «Вещества и их свойства. Чистые вещества и смеси».
Урок 1. Предмет химии. Вещества и их свойства. Химия как часть естествознания (8 класс)
Урок 1 «Предмет химии. Химия как часть естествознания. Вещества и их свойства. Вводный инструктаж по ТБ».
Тип урока: урок изучения новых знаний (УИНЗ).
Цель урока: создать условия для формирования у учащихся понятий “химия ”, “вещество”, “химический элемент”, “простые вещества ”, “сложные вещества”, “свойства веществ”.
образовательная: сформировать представление о предмете химии. Дать первоначальные понятия о веществе, химическом элементе, о простых и сложных веществах, о трёх формах существования химического элемента.
воспитывающая: воспитывать культуру умственного труда, развивать коммуникативные качества личности.
Форма организации урока: беседа, самостоятельная работа, практическая работа.
Методы и методические приемы: частично-поисковый, исследовательский, проблемный
Оборудование: компьютер, проектор; гвоздь, колба, линейка.
1. Организационный этап:
2. Определение отсутствующих.
3. Проверка готовности к уроку.
2. Введение в курс предмета. Мотивация.
Здравствуйте, ребята. Сегодня вы впервые пришли в кабинет, где происходят чудеса. Да-да, вы не ослышались, именно так, здесь вы все будете немножко волшебниками. А я помогу вам в этом. Зовут меня …….. А предмет, который мы будем с вами изучать, называется “химия”. Химия – это одна из самых интересных наук. Ведь повсюду, куда бы мы ни обратили свой взор, нас окружают предметы и изделия, изготовленные из веществ и материалов, которые получены на химических заводах и фабриках. Кроме того, в повседневной жизни, сам того не подозревая, каждый человек осуществляет химические реакции. Например, умывание с мылом, стирка с использованием моющих средств. Я думаю, что все вы пили чай с лимоном. Пили и, наверное, не задумывались, что в чайной чашке происходит самая настоящая химическая реакция. Посмотрите, у меня на столе два стакана чая, в один из них я положила кусочек лимона. Вы видите разницу?
Учащиеся: Разница очевидна. Чай с кусочком лимона стал светлый.
Учитель: Зажигая спичку, замешивая песок и цемент с водой, обжигая кирпич, мы осуществляем настоящие, а иногда и довольно сложные химические реакции. Что такое химические реакции, какие они бывают, от чего зависит скорость химической реакции, и многое другое вы узнаете на уроках химии. А теперь мысленно вернитесь в седьмой класс на уроки физики и вспомните, что изучает этот предмет.
Учащиеся: Физические тела.
3. Изучение нового материала.
Учитель: Верно. Я вам напомню, что любой предмет, любое живое существо ученые называют телом. Компьютер, книга, дерево, птица, кусок сахара, проволока – это тела. Перечислить все тела невозможно, их существует бесчисленное множество. Все физические тела состоят из веществ. У меня на столе находятся физические тела, можно сказать и проще – предметы. Ответьте мне, пожалуйста, из каких веществ они состоят.
Учащиеся: Гвоздь из железа, колба из стекла, линейка из пластмассы.
Учитель: Так что же такое вещество?
А могут разные тела состоять из одного и того же вещества? Если могут, приведите примеры.
Учащиеся: Из стекла могут быть изготовлены посуда, лампочки, оконные стекла и т. д. Из пластмассы – мешки, линейки, ручки, штатив и т. п.
Как вы считаете, из каких веществ (горизонтальный столбик) состоят перечисленные в таблице тела (вертикальный столбик)? Напротив верного ответа, в пустую клетку, поставьте звездочку. Сделайте вывод, что такое вещество.
При правильном заполнении таблицы вы увидите фигуру, напоминающую ковш.
Из курса физики, учитель вместе с обучающимися вспоминает какими свойствами обладают вещества.
Назовите как можно больше веществ, из которых можно сделать физическое тело- стакан. Назовите как можно больше физических тел, сделанных из стекла, полиэтилена, железа.
ВЫВОД: Из нашей с вами беседы можно сказать, что все вещества отличаются друг от друга по внешним признакам. Эти признаки называются физическими свойствами. Какие свойства называют физическими?
К физическим свойствам относятся:
Тепло- и электропроводность;
Температуры кипения и плавления.
а) магнита на железные опилки и на серу,
б) помещаем железные опилки и серу в стакан с водой.
в ) фронтальное обсуждение свойств железных опилок и серы.
Физические свойства веществ изучает физика. У веществ есть еще и химические свойства.
сода + уксусная кислота →
гидроксид натрия + фенолфталеин →
серная кислота + нитрат бария →
Вопрос: Что произошло с веществами? Почему вы решили, что вещества прореагировали друг с другом? Какие изменения веществ вы заметили?
Учащиеся: При смешивании веществ мы наблюдали выделение газа, изменение окраски, выпадение осадка. Происходит химическая реакция.
Учитель: Ребята, мы с вами познакомились с некоторыми веществами, посмотрели чудесные превращения этих веществ. А теперь попытайтесь ответить на вопрос: “Что такое химия?” Посмотрите на экран, здесь написано начало определения (химия – это…). Давайте вместе попробуем его закончить .
Учащиеся: Химия – это наука о веществах, их превращениях.
Учитель: Верно. Но более точно определение звучит так: химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения .
Она изучает строение и состав, а также зависимость свойств вещества от состава и строения.
Как вам известно, из курса физики вещества состоят из молекул, а молекулы – из атомов. Атомы чрезвычайно малы и на кончике иглы их может уместиться миллиарды. Тем не менее, наука достигла такого уровня, что различает атомы по размерам, массе и свойствам. В настоящее время различают 110 видов атомом, из которых состоят все вещества. Таким образом: химический элемент – определенный вид атомов.
Каждый химический элемент имеет 3 формы существования: свободные атомы; простые вещества; сложные вещества. Атомы могут существовать изолированно друг от друга в виде свободных атомов, а могут объединяться друг с другом в молекулы. Если объединяются одинаковые атомы, то образуются простые вещества, а если разные – сложные вещества, (упр.6 стр.10)
ребятам демонстрируются карточки с изображением атомов разных видов (раздаются несколько одинаковых карточек для возможности создания разных комбинаций простых и сложных веществ):
Учитель: В быту вы тоже не обойдётесь без химических знаний, которые правильно и по назначению помогут вам использовать химические вещества. Иначе можно поплатиться здоровьем (приводятся примеры про ртуть, уксус, стиральные порошки, косметику).
Итак, наш урок подходить к завершению. Настало время подвести итоги.
5. Закрепление изученного материала.
Учитель, предлагает ребятам поиграть:
Называю вещество – дружно хлопаем в ладоши. Называю тело – слушаем в классе тишину.
Например: серьги, медь, гвоздь. соль, стекло, ведро, сода, кастрюля, глюкоза, алюминий)
Вопросы для фронтальной беседы.
Что нового вы узнали сегодня на уроке?
Что называется физическим телом?
Приведите несколько примеров физических тел.
Что такое вещество?
Назовите известные вам вещества.
Что называют химическим элементом?
Какие вещества называют простыми, а какие сложными?
Как мне записать в журнале тему нашего урока?
6. Домашнее задание:
§ 1; упр.3, 8, 9 стр. 10-11.
В завершение поделитесь своими впечатлениями об уроке. Для этого продолжите предложения, посвященные сегодняшнему дню.
Сегодня я узнал____________________________________________
Я удивился_________________________________________________
Я хотел бы______________________________________________
Урок 1. Основные понятия и законы предмета «Химия»
Простейшие понятия: вещество, молекула, атом, химический элемент
Что такое химия? Где мы встречаемся с химическими явлениями? Везде. Сама жизнь — это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов…
Что изучает химия? Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество — понятно: это то, из чего состоит окружающий нас мир и мы сами. Но что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество (оно стало другим!), — изменились его свойства:
Все эти изменения — следствие сложных и многообразных химических процессов. Итак,
химия — это наука о веществах и их превращениях.
При этом исследуются не всякие превращения, а только такие, при которых
В этом определении встречаются такие понятия, как «вещество», «молекула», «атом». Разберём их подробнее.
Вещество — это то, из чего состоят окружающие нас предметы. Каждому абсолютно чистому веществу (таких в природе, кстати, не существует) приписывают определённую химическую формулу, которая отражает его состав, например:
Выше приведены молекулярные формулы двух веществ. Следует отметить, что далеко не все вещества состоят из молекул, так как существуют вещества, которые состоят из атомов или ионов. Например, алмаз состоит из атомов углерода, а обычная поваренная соль — из ионов Na + и ионов Cl – (условная «молекула» — NaСl).
Наименьшая частица вещества, которая отражает его качественный и количественный состав, называется молекулой.
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака):
Число атомов в молекуле обозначают при помощи индекса:
Но! Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента:
Аналогично изображают число молекул:
Почему атомы водорода и кислорода имеют разное название, разный символ? Потому что это атомы разных химических элементов.
Химический элемент — это частицы с одинаковым зарядом ядер их атомов.
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях? Из чего состоит атом*?
* Подробнее о строении атома будет рассказано в уроке 3.
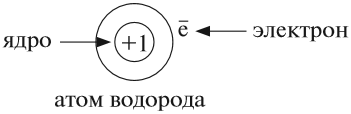
Атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:
В ходе химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ!
Поэтому заряд ядра атома — своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием «водород». Атомы с зарядом ядра +8 составляют химический элемент «кислород».
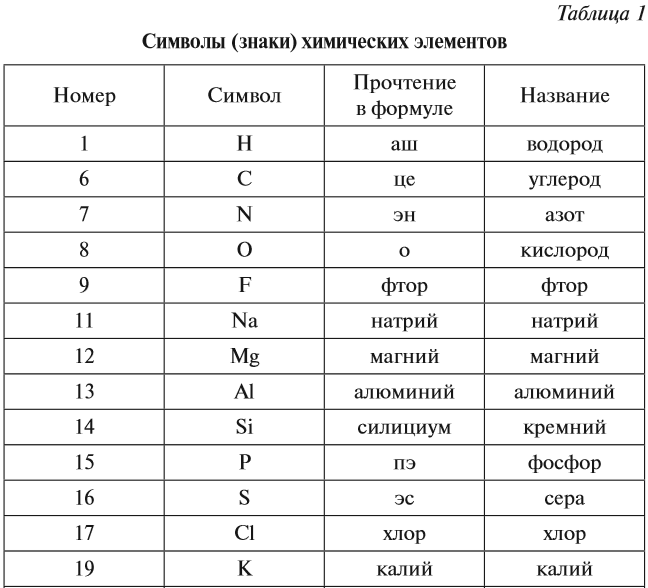
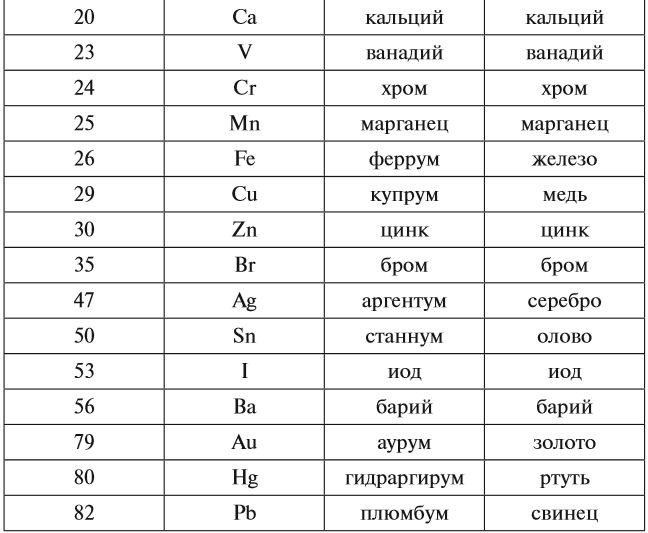
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева (порядковый номер равен заряду ядра атома); определённое название и, для некоторых химических элементов, особое прочтение символа в химической формуле (табл. 1).
Подведём итог. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Но, если вещество состоит из молекул, то любое изменение состава или строения молекулы приводит к изменению самого вещества, его свойств.
Вопрос. Чем отличаются химические формулы веществ: Н2О и Н2О2?
Хотя по составу молекулы этих веществ отличаются на один атом кислорода, сами вещества по свойствам сильно отличаются друг от друга. Воду Н2О мы пьём и жить без неё не можем, а Н2О2 — перекись водорода, пить нельзя, а в быту её используют для обесцвечивания волос.
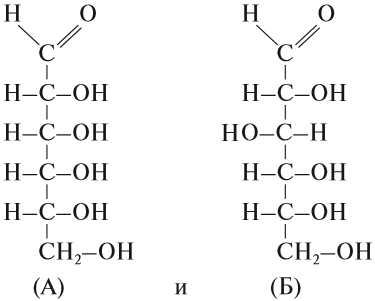
Вопрос. А чем отличаются химические формулы веществ:
Состав этих веществ — аллозы (А) и глюкозы (Б) — одинаков — С6Н12О6. Отличаются они строением молекул, в данном случае — расположением групп ОН в пространстве. Глюкоза — универсальный источник энергии для большинства живых организмов, а аллоза практически не встречается в природе и не может быть источником энергии.
Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
* В 2002 г. появилось сообщение о существовании ещё одного простого вещества кислорода — O4.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:
В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).
Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
Строго говоря, по нижеизложенным правилам определяют не валентность, а степень окисления (см. урок 7). Но поскольку в некоторых соединениях числовые значения этих понятий совпадают, то иногда по формуле можно определять и валентность.
При этом следует учитывать изложенное выше правило о химической связи.
Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:
Задание 1.2. Определите валентности элементов в соединениях:
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях.
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
Задание 1.4. Составьте химические формулы соединений:
Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково! Это правило — следствие Закона сохранения массы вещества: масса исходных веществ равна массе продуктов реакции. Закон был открыт в 18-м веке М. В. Ломоносовым и, независимо от него, А. Л. Лавуазье.
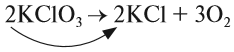
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:
Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
Теперь между правой и левой частями уравнения можно поставить знак равенства:
Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:
Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:
2. Перенесём эти числа в правую часть уравнения:
3. Составим химические формулы полученных веществ по валентностям составных частей:
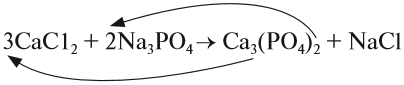
4. Обратим внимание на состав «самого сложного» соединения: Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:
Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Химические реакции бывают разных типов. Основными являются:
1. Реакции соединения:
Здесь из двух и более веществ образуется одно вещество:
2. Реакции разложения:
Здесь из одного вещества получаются два вещества и более веществ:
3. Реакции замещения:
Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:
4. Реакции обмена:
Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:
Выводы
Вещества бывают простые и сложные. Состав веществ показывают при помощи химических формул. Формулы веществ составляют, учитывая валентности составных частей этих веществ. Запись химического процесса при помощи формул называется уравнением химической реакции. Химические реакции бывают разных типов: обмена, замещения, разложения, соединения и другие.