Пластичность металлов чем обусловлена в химии
§ 9. Физические свойства металлов
Из курса химии 9 класса вы уже имеете представление о природе химической связи, существующей в кристаллах металлов, — металлической связи. Напомним, что в узлах металлических кристаллических решёток располагаются атомы и положительные ионы металлов, связанные посредством обобществлённых внешних электронов, принадлежащих всему кристаллу. Эти электроны компенсируют силы электростатического отталкивания между положительными ионами и тем самым связывают их, обеспечивая устойчивость металлической решётки.
Металлическая связь обусловливает все важнейшие физические свойства металлов: пластичность, электро- и теплопроводность, металлический блеск и другие свойства, характерные для этого класса простых веществ.
Пластичность — это свойство вещества изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия.
Способность расплющиваться от удара или вытягиваться в проволоку под действием силы составляет важнейшее механическое свойство металлов. Оно лежит в основе такой уважаемой большинством народов мира профессии, как профессия кузнеца. Недаром покровителем кузнечного дела у разных народов был бог огня: у греков — Гефест, у римлян — Вулкан, у славян — Сварог.
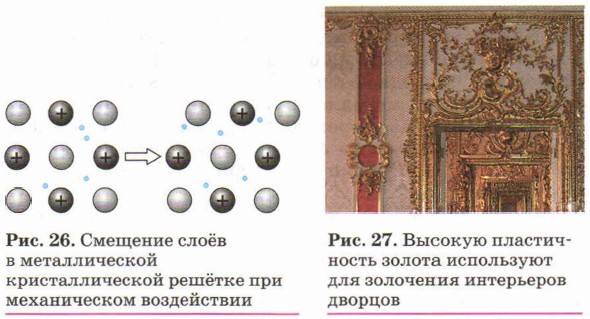
Пластичность металлов обусловлена способностью одних слоёв атом-ионов в кристаллах под внешним воздействием легко смещаться (как бы скользить) по отношению к другим слоям без разрыва связей между ними (рис. 26). Наиболее пластичны золото, серебро и медь. Например, из золота можно изготовить «золотую фольгу» толщиной 0,003 мм, которую используют для золочения изделий (рис. 27).
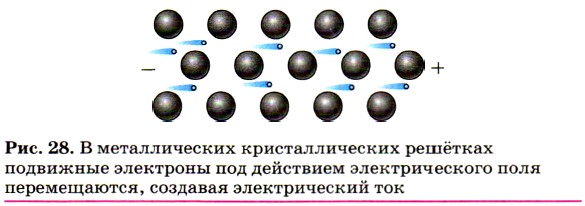
Высокая электропроводность большинства металлов обусловлена присутствием в их кристаллических решётках подвижных электронов, которые направленно перемещаются под действием электрического поля (рис. 28).
При нагревании колебательные движения ионов в кристалле усиливаются, что затрудняет направленное движение электронов и ведёт к снижению электрической проводимости. При охлаждении электропроводность металлов увеличивается и вблизи абсолютного нуля переходит в сверхпроводимость. Наибольшую электропроводность имеют серебро и медь, наименьшую — марганец, свинец, ртуть и вольфрам.
Такое свойство, как теплопроводность металлов, также связано с высокой подвижностью свободных электронов: сталкиваясь с колеблющимися в узлах решётки ионами, электроны обмениваются с ними энергией. С повышением температуры колебания ионов при посредстве электронов передаются другим ионам, и температура всего металлического предмета быстро выравнивается.
Для гладкой поверхности металлов характерен металлический блеск — результат отражения световых лучей. В порошкообразном состоянии большинство металлов теряет блеск, приобретая чёрную или серую окраску, и только алюминий и магний сохраняют блеск в порошке. Из алюминия, серебра и палладия, обладающих наиболее высокой отражательной способностью, изготовляют зеркала, в том числе и применяемые в прожекторах.
Для большинства металлов характерен белый или серый цвет. Золото и медь окрашены соответственно в жёлтый и жёлто-красный цвет. Из других физических свойств металлов наибольший практический интерес представляют твёрдость, плотность и температура плавления.
Для большинства металлов характерен белый или серый цвет. Золото и медь окрашены соответственно в жёлтый и жёлто-красный цвет.
Из других физических свойств металлов наибольший практический интерес представляют твёрдость, плотность и температура плавления.
Для всех металлов (кроме ртути) при обычных условиях характерно твёрдое агрегатное состояние. Однако твёрдость их различна. Наиболее твёрдые — металлы побочной подгруппы VI группы (VIB группы) Периодической системы Д. И. Менделеева. Так, хром по твёрдости приближается к алмазу. Самые мягкие — металлы главной подгруппы I группы (IA группы) Периодической системы Д. И. Менделеева — щелочные металлы. Например, натрий и калий легко режутся ножом.
По плотности металлы делят на лёгкие (плотность меньше 5 г/см 3 ) и тяжёлые (плотность больше 5 г/см 3 ). К лёгким относят щелочные, щёлочноземельные металлы и алюминий. Из переходных металлов сюда включают скандий, иттрий и титан. Эти металлы, благодаря лёгкости и тугоплавкости, всё шире применяют в различных областях техники.
Самый лёгкий металл — это литий (р = 0,53 г/см 3 ). Самый тяжёлый — осмий (р = 22,6 г/см 3 ).
Лёгкие металлы обычно легкоплавки, галлий может плавиться уже на ладони руки, а тяжёлые металлы — тугоплавки. Наибольшей температурой плавления, которая равна 3380 °С, обладает вольфрам. Это свойство вольфрама используют для изготовления ламп накаливания (рис. 29, 2). Кроме него в конструкцию лампы входят ещё семь металлов.
В Российской Федерации в настоящее время, как и ранее в Евросоюзе и США, на государственном уровне принято решение о замене привычных ламп накаливания на более экономичные и долговечные современные лампы, например галогенные, люминесцентные и светодиодные. Галогенная лампа (рис. 29, 2) — это та же лампа накаливания с вольфрамовой нитью, заполненная инертными газами с добавкой паров галогенов (брома или иода).
Люминесцентные (рис. 29, 3) — это хорошо знакомые вам лампы дневного света, имеющие один существенный недостаток — они содержат ртуть, а потому нуждаются в соблюдении особых правил утилизации на специальных пунктах приёма. Светодиодные лампы (рис. 29, 4) — самые экономичные и самые долговечные (срок работы до 100 тыс. ч), но пока и самые дорогие из ламп.
В технике, как вы уже знаете, металлы делят на чёрные (железо и его сплавы) и цветные (все остальные, более подробно о них будет рассказано в следующем параграфе) (рис. 30). Золото, серебро, платину и некоторые другие металлы относят к драгоценным металлам (рис. 31). 1
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
1. Назовите самый легкоплавкий металл.
2. Какие физические свойства металлов используют в технике?
3. Фотоэффект, т. е. свойство металлов испускать электроны под действием лучей света, характерен для щелочных металлов, например для цезия. Почему? Где это свойство находит применение?
4. Какие физические свойства вольфрама лежат в основе его применения в лампах накаливания?
Влияние различных факторов на пластичность
Влияние температуры
О пластичности металла при любых условиях его деформации до последнего времени судили по результатам испытаний образцов на растяжение. На основании этих данных считают, что пластичность всех металлов тем выше, чем выше температура, при которой он подвергается обработке. В действительности такое влияние температуры не является общим.
Ю. М. Чижиков рекомендует пять типовых закономерностей влияния температуры на предел пластичности Δh/H, характеризуемый относительным обжатием (рис. 51). Кривая 1 характеризует металлы и сплавы, пластичность которых с повышением температуры увеличивается. Эта кривая типична для углеродистых и легированных конструкционных сталей и др. Кривая 2 приведена для металлов и сплавов, пластичность которых с повышением температуры понижается. Эта кривая годна только для некоторых высоколегированных сплавов, но она представляет больший интерес, показывая, что с повышением температуры пластичность не всегда повышается. Кривая 3 характеризует металлы и сплавы, пластичность которых очень мало изменяется с повышением температуры. К ним относятся многие качественные легированные стали. Согласно кривой 4 при повышении температуры до какой-то средней пластичность возрастает; при дальнейшем увеличении температуры она снижается. Кривая 5 показывает, что при каких-то средних температурах происходит снижение пластичности; при более высоких или более низких температурах пластичность получается более высокой. Эта кривая типична для технически чистого железа.
Влияние химического состава стали
Содержание углерода в стали до 0,8—1 % незначительно уменьшает пластичность металла. Повышение содержания углерода в стали приводит к тому, что металл в литом состоянии можно обрабатывать только ковкой. Так, стали, содержащие около 1,5 % С, в литом состоянии обрабатывают ковкой. После ковки или после дробления первичной структуры и превращения ее во вторичную их можно прокатывать.
Углерод принадлежит к активным элементам, влияющим на изменение сопротивления деформации. Особенно заметное влияние углерода на повышение сопротивления деформации начинается при содержании его 0,5 % и выше.
Марганец повышает способность металла пластически деформироваться благодаря тому, что он с серой образует сульфид, который находится в металле в виде шарообразных включений. При повышенном содержании марганца (12% и более) пластичность металла зависит от условий разливки стали. Так, горячоотлитый металл вследствие грубозернистой структуры прокатывается и куется хуже. Металл, отлитый при низкой температуре, имеет мелкозернистое строение и хорошо поддается обработке давлением, но сопротивление его деформации резко повышается.
Никель является хорошим поглотителем газов, находящихся в расплавленном металле. Это свойство никеля особенно существенно при наличии в стали водорода. В отличие от марганца никель и соединении с серой (сульфид никеля) располагается в стали по границам зерен, что способствует появлению красноломкости. Сульфиды никеля, обладая пониженной температурой плавления, увеличивают склонность сталей к пережогу. Влияние никеля на сопротивление деформации незначительное.
Хром способствует образованию крупнокристаллической структуры. Крупнозернистая столбчатая структура в крупных слитках при охлаждении может вызвать появление межкристаллических трещин. Особенно это заметно в хромистых сталях с большим содержанием углерода. В некоторых высокоуглеродистых сталях типа ЭХ12 или хромонн- келсвых (3—4 % Ni, 1—5 % Cr) указанные трещины могут выходить даже на поверхность. Хром в стали, особенно при содержании никеля или повышенном содержании углерода, резко повышает сопротивление деформации вследствие наличия карбидов хрома, стойких даже при высоких температурах.
Ванадий, как и марганец, имея сродство к кислороду, является хорошим раскислителем. Кроме того, ванадий, подобно кремнию, служит хорошим дегазификатором. Практикой и исследованиями установлено, что ванадий способствует образованию мелкозернистой структуры слитка, при этом пластичность стали повышается.
Вольфрам уменьшает пластичность стали в горячем состоянии и увеличивает сопротивление деформации. Некоторые марки стали с содержанием вольфрама в литом состоянии сначала обрабатывают ковкой и только после вторичного нагрева слитка прокатывают его в валках.
Стали с содержанием молибдена относятся к самозакаливающимся. Содержание в стали молибдена не уменьшает способность пластического изменения формы при ковке или прокатке. В то же время сопротивление деформации несколько повышается. Недостаток сталей, содержащих молибден в большом количестве (до 1,5% и более), состоит в свойстве их при охлаждении подвергаться воздушной закалке, что иногда сопровождается появлением трещин. В сталях с малым содержанием молибдена (0,25—0,3%) это явление не наблюдается.
В металле сера находится чаще всего в виде соединений FeS и MnS. При наличии в стали легирующих элементов (Cr, W и особенно Ni сера, соединяясь с ними, образует сульфиды, которые выделяются по границам зерен металла. Эти сульфиды, обладая пониженной температурой плавления и прочностью, обусловливают красноломкость стали при пластической обработке в области температур 800— 1000°С. Кроме того, сульфиды создают опасность пережога металла при температурах, близких к 1200°С.
Наличие водорода в стали способствует образованию внутренних трещин-флокенов. Прямого влияния на пластичность и сопротивление деформации водород не оказывает.
В металле азот находится в виде соединений с другими элементами. Содержание нитридов в пределах 0,002— 0,005 % заметного влияния на пластичность металла не оказывает. При повышении содержания нитридов до 0,03 % и выше металл становится хладноломким и красколомким. Однако добавление азота, в частности в коррозионно-стойкую сталь, уменьшает размеры первичного зерна при отливке. Так, содержание азота в пределах 0,15—0,2 % в коррозионно-стойкой стали при содержании хрома до 25 % способствует получению мелкозернистой структуры и улучшению пластичности с одновременным повышением сопротивления деформации. Неметаллические включения в виде оксидов (особенно FeO) отрицательно влияют на пластичность металла при высоких температурах. По данным ряда исследований, количество оксидов не должно превышать 0,01 %. При большем содержании в металле оксидов независимо от их формы и природы даже при деформации ковкой получаются трещины.
Кроме рассмотренных общих технологических свойств (пластичности и сопротивления деформации), каждый металл или сплав имеет еще специфические особенности, которые нужно знать и учитывать при разработке технологических режимов. Так, автоматная сталь (углеродистая сталь с повышенным содержанием серы) обладает низким коэффициентом трения, что затрудняет ее захват валками при прокатке.
Многие легированные стали склонны к образованию трещин, чрезмерному обезуглероживанию, перегреву. Все эти и другие особенности каждого металла необходимо учитывать, чтобы правильно вести технологический процесс.
Общие физические и химические свойства металлов
Общие физические свойства металлов
Благодаря наличию свободных электронов (“электронного газа”) в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность – способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение “электронного газа”.
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий – литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются “легкими металлами”.
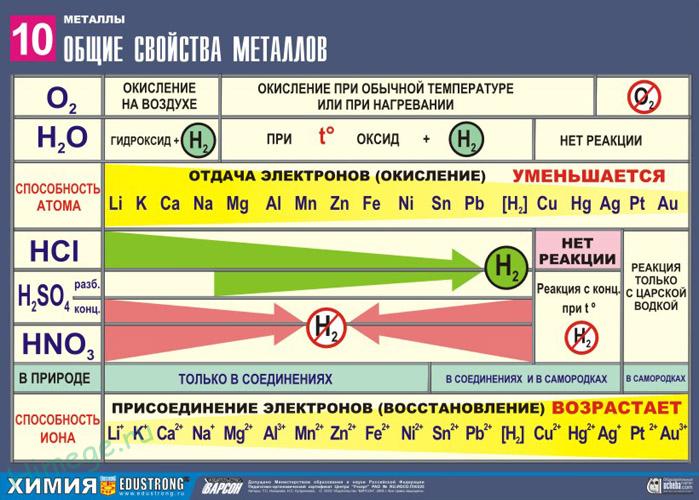
Общие химические свойства металлов
Сильные восстановители: Me 0 – nē → Me n +
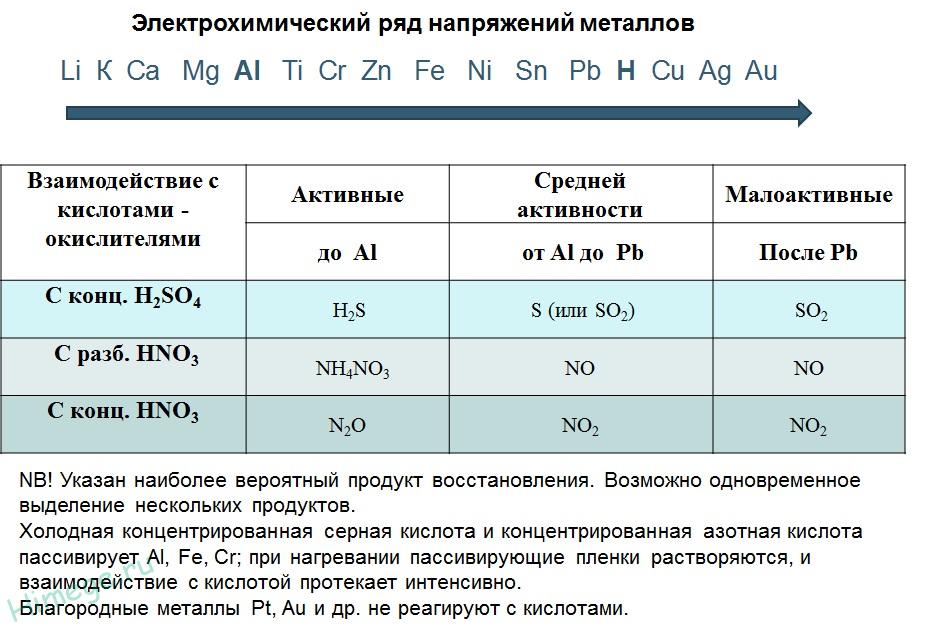
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
1. Реакции металлов с неметаллами
1) С кислородом:
2Mg + O2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl2 – t° → NiCl2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH
2. Реакции металлов с кислотами
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
3. Взаимодействие металлов с водой
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2) Металлы средней активности окисляются водой при нагревании до оксида:
3) Неактивные (Au, Ag, Pt) – не реагируют.
4. Вытеснение более активными металлами менее активных металлов из растворов их солей:
В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте – металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg – только серной (концентрированной) и азотной кислотами, а Рt и Аи – «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО2 и SО2; создается кислотная среда, и катионы Н + вытесняются активными металлами в виде водорода Н2 (водородная коррозия).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия). Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара. Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь), имеют высокую коррозионную стойкость.
Физические свойства металлов
Физические свойства металлов
Металлическая связь и особенности кристаллического строения обуславливают особые физические свойства металлов.
Металлическая связь основана на обобществлении электронов, входящих в состав атомов металла. Все электроны на внешних энергетических уровнях атомов металлов обобществленные, т.е. принадлежат всем атомам вещества. И эти электроны легко отрываются и попадают на энергетические уровни таких же атомов металлов. Постоянно перемещаясь по кристаллической решетке, электроны компенсируют силы электростатического отталкивания между положительно заряженными ионами и тем самым связывают их в устойчивую металлическую решетку.
Содержимое разработки
9. Физические свойства металлов
Металлическая связь и особенности кристаллического строения обуславливают особые физические свойства металлов.
Металлическая связь основана на обобществлении электронов, входящих в состав атомов металла. Все электроны на внешних энергетических уровнях атомов металлов обобществленные, т.е. принадлежат всем атомам вещества. И эти электроны легко отрываются и попадают на энергетические уровни таких же атомов металлов. Постоянно перемещаясь по кристаллической решетке, электроны компенсируют силы электростатического отталкивания между положительно заряженными ионами и тем самым связывают их в устойчивую металлическую решетку.
Металлическая связь – это связь в металлах и сплавах между атом-ионами посредством обобществленных электронов.
Разобраться в том, какой электрон принадлежал какому атому, просто невозможно, так как все оторвавшиеся электроны становятся общими, соединяясь с ионами. Эти электроны временно образуют атомы, потом снова отрываются и соединяются с другим ионом. Этот процесс продолжается бесконечно. Таким образом, в металлических соединениях атомы непрерывно превращаются в ионы и наоборот.
Именно строением металлической связи обусловлены физические свойства металлов.
К физическим свойствам металлов относятся:
Электропроводность и теплопроводность.
Высокая плотность и температура плавления.
Рассмотрим каждое из свойств более подробно.
Металлический блеск обусловлен металлической связью между атомами, для которой свойственны обобществленные электроны. Они как раз и испускают под воздействием света свои, вторичные волны излучения, которые мы воспринимаем как металлический блеск.
В порошкообразном состоянии большинство металлов теряют металлический блеск и приобретают серую или черную окраску.
Металлический блеск в порошкообразном состоянии сохраняют алюминий и магний.
Прекрасно отражают свет палладий Pd, ртуть Hg, серебро Ag, медь Cu.
Из алюминия, серебра и палладия, основываясь на их отражательной способности, изготавливают зеркала, в том числе и применяемые в прожекторах.
Электропроводность и теплопроводность.
Все металлы хорошо проводят электрический ток и имеют высокую теплопроводность, также благодаря наличию металлической связи. При нагревании металла, увеличивается скорость движения электронов. Быстро движущиеся по кристаллической решетке электроны выравнивают температуру по всей поверхности металла, проводя тепло. Высокая теплопроводность металлов используется для изготовления из них посуды.
Высокая электропроводность металлов обусловлена направленным движением электронов в кристаллической решетке при воздействии электрического тока. Серебро Ag, медь Cu, золото Au и алюминий Al обладают наибольшей электропроводностью, поэтому медь Cu и алюминий Al используют в качестве материала для изготовления электрических проводов.
Наименьшей электропроводностью обладают марганец Mn, свинец Pb, ртуть Hg и вольфрам W.
Пластичность – это физической свойство вещества изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия.
Большинство металлов пластично, так как слои атом-ионов металлов легко смещаются относительно друг друга и между ними не происходит разрыва связи.
Наиболее пластичные металлы – золото Au, серебро Ag, медь Cu. Из золота Au можно изготовить тонкую фольгу толщиной 0,003 мм, которую используют для золочения изделий.
Именно на пластичности металлов основано кузнечное дело и возможность изготавливать различные предметы с помощью механического воздействия на металл.
Все металлы (кроме ртути) при нормальных условиях представляют собой твердые вещества. Твердость металлов различна. Наиболее твердыми являются металлы побочной подгруппы шестой группы Периодической системы Д.И. Менделеева. Наименее твердыми являются щелочные металлы.
Температура плавления металлов находится в диапазоне от 39 (ртуть Hg) до 3410 о С (вольфрам W). Температура плавления большинства металлов высока, однако некоторые металлы, например, олово Sn и свинец Pl, можно расплавить на электрической плите.
Физические свойства металлов и в настоящее время широко используются в промышленности и электронике.
В технике все металлы делятся на черные, к ним относятся железо и его сплавы, и цветные.
Изделия из различных видов металлов используются повсеместно благодаря их пластичности, но чаще всего в сплавах.
К драгоценным металлам относят золото, серебро, платину и некоторые другие редко встречающиеся металлы.