Пластина ксеноперикардиальная что это
Медицинские интернет-конференции
Языки
Ксеноперикардиальная герниопластика: возможности и перспективы.
Баулин А.В., Середин С.А., Квасов А.Е., Митрошин А.Н., Баулин В.А., Венедиктов А.А., Лембас А.Н., Никишин Д.В.
Резюме
Развитие современной герниологии напрямую связано с разработкой и внедрением новых, перспективных материалов для протезирующих операций. Нами предпринята попытка изучения возможности применения децеллюлированной ксеноперикардиальной пластины для пластики грыж живота. Экспериментальное исследование на 30 крысах линии Вистар показало, что ксеноперикард обладает хорошей биоинтеграцией, не вызывает реакции отторжения и гнойных осложнений в течение 12 месяцев наблюдения. В клинике ксеноперикардиальная пластика выполнена нами у 23 больных. В течение 18 месяцев наблюдения протез-ассоциированных осложнений и рецидивов не выявлено. Разработаны новые способы герниопластики при паховых и срединных вентральных грыжах.
Abstract. The development of modern herniology directly related to the development and introduction of new advanced materials for prosthetic operations. We have attempted to explore the possibility of a plate for cell devoiced xenopericardial plastics abdominal hernia. Experimental study on 30 Wistar rats showed that xenopericardial plate has good biointegration, does not cause rejection reactions and septic complications within 12 months of observation. Us made xenopericardial hernioplasty in 23 patients. Within 18 months of follow-prosthesis-associated complications and recurrences have been detected. Developed new methods of hernioplasty in inguinal and medial ventral hernias.
Ключевые слова
Статья
Введение. Многочисленные способы устранения дефектов брюшной стенки на сегодняшний день не позволяют говорить о решении данной проблемы [1, 3, 5, 6, 7]. «Золотым» стандартом в герниологии стала пластика «без натяжения» вне зависимости от локализации дефекта и данное обстоятельство уже не вызывает никаких сомнений даже у противников аллопластических методик. Продолжаются споры лишь о предпочтительности тех или иных синтетических материалов для пластики [8, 10]. В настоящее время при всем многообразии выбора синтетических материалов альтернативы полипропиленовым эндопротезам нет. Популярность материала обусловлена рядом положительных свойств полипропиленовой нити: биоинертность, монофиламентность, несмачиваемость и отсутствие эффекта «фитиля», а так же доступностью полипропиленовых эндопротезов, выпускаемых российскими производителями. Периодическое появление сообщений об осложнениях эндопротезирования [4, 6, 7, 9], вносит определенный диссонанс в общую положительную картину и заставляет исследователей искать новые пути решения проблемы [2]. Любой синтетический эндопротез, являясь инородным телом, обусловливает формирование в зоне имплантации соединительной ткани, как капсулы, отграничивающей его. В случае контакта синтетического эндопротеза с полым органом крайне высока вероятность образования свища, что следует рассматривать как реакцию отторжения. Биологические эндопротезы не нашли широкого применения в клинике, прежде всего из-за риска развития реакции тканевой несовместимости. Кроме того, нельзя не принимать во внимание порой негативную реакцию пациента, в ответ на предложение имплантировать ему материал животного происхождения. Разработка новых материалов для герниопластики в этой связи видится весьма актуальной.
ООО «Кардиоплант», г. Пенза, налажен серийный выпуск ксеноперикардиальной пластины для применения в хирургической практике. Децеллюлированный ксеноперикард обладает высокими прочностными свойствами, пластичностью, удобством применения. Материал зарегистрирован в Федеральной службе по надзору в сфере здравоохранения и социального развития № ФСР 2010/07629. Изучению перспектив применения и разработке новых способов герниопластики с использованием ксеноперикардиальной пластины посвящено данное исследование.
Цель исследования: улучшить результаты лечения больных вентральными грыжами.
Задачи:
1. Провести серию экспериментальных исследований, направленных на изучение реакции тканей брюшной стенки животных в ответ на имплантацию ксеноперикардиальной пластины производства ООО «Кардиоплант», г. Пенза.
2. Разработать и внедрить в клиническую практику способы ксеноперикардиальной герниопластики.
Материал и методы. В эксперименте на 30 крысах линии Вистар обоего пола под ингаляционным наркозом произведена имплантация ксеноперикардиальной пластины в ткани брюшной стенки. Экспериментальное исследование проведено в условиях специально оборудованного вивария, в соответствии с «Правилами гуманного обращения с лабораторными животными», методическими указаниями МЗ РФ «Деонтология медико-биологического эксперимента» (1987), а так же Хельсинкской декларацией от 1975 г. с пересмотром от 1983 г. Выведение животных из опыта производили на 14, 30 и 60-е сутки. При гистологическом исследовании изучали особенности тканевой реакции экспериментальных животных в ответ на имплантацию ксеноперикарда. Проведенные ранее на кафедре травматологии и ортопедии успешные экспериментальные исследования по ксенопротезированию сухожилий давали нам надежду на благополучное завершение работы. В результате, за время наблюдения нами не отмечено случаев отторжения материала и развития инфекционных или иных осложнений. Развивающаяся вокруг имплантата лейкоцитарная инфильтрация уменьшалась к 60-м суткам после операции. В зоне ксеноперикарда определяли грануляционную ткань с новообразованными сосудами и участками кальцификации. Спустя 12 месяцев после имплантации отмечена полная интеграция ксеноперикарда в окружающих тканях, с прорастанием между волокнами имплантата фибробластов и развитием в зоне имплантации ткани, схожей по строению с апоневрозом.
Положительные результаты экспериментальной работы позволили нам применить ксеноперикардиальную пластину в клинической практике.
В качестве протезирующих способов, при которых можно было бы использовать ксеноперикардиальную пластину рассматривались способы Лихтенштейна при паховой грыже, способ профессора Белоконева В.И. при срединных первичных и послеоперационных грыжах, и inlay способ при боковых грыжах. Кроме того, нами были разработаны способы герниопластики с укреплением обеих стенок пахового канала (патент РФ № 2392874 «Способ протезирующей герниопластики паховых грыж», опубликован 27.06.2010, бюллетень № 18, авторы Баулин А.В., Баулин В.А., Митрошин А.Н., Сиваконь С.В., Титова Е.В., Баулин Вл.А.) и способ комбинированной герниопластики, направленный на реконструкцию белой линии живота за счет ксеноперикардиальной пластины (положительное решение на выдачу патента РФ по заявке № 2010111220 «Способ протезирующей пластики срединных вентральных грыж с реконструкцией белой линии живота», авторы Баулин А.В., Митрошин А.Н., Нестеров А.В., Квасов А.Е., Середин С.А., Баулин В.А.).
При паховых грыжах нами был разработан способ герниопластики с укреплением обеих стенок пахового канала. Способ осуществляли следующим образом. Вначале выполняли грыжесечение по общепринятым требованиям. Доступ: разрез длиной 8 см производили выше на 2-2,5 см и параллельно паховой связке. По завершении манипуляций с грыжевым мешком визуализировали поперечную фасцию и препарировали пространство позади поперечной мышцы живота, отделяя последнюю от поперечной фасции на глубину 2,5 – 3 см, для расположения первого листка эндопротеза. Затем ксеноперикардиальную пластину сгибали пополам с образованием двух листков, моделируя их по размерам пахового промежутка, с таким расчетом, чтобы гладкая поверхность имплантата была обращена внутрь. Первый листок имплантата моделировали по сформированному пространству позади поперечной мышцы. По верхнему краю смоделированного первого листка имплантата фиксировали две лигатуры по краям, которые проводили через поперечную и внутреннюю косую мышцы сзади наперед по верхнему краю препарированного пространства на переднюю поверхность внутренней косой мышцы и завязывали, чем обеспечивали фиксацию верхнего края первого листка. После этого формировали отверстие в первом листке имплантата, соответствующее внутреннему отверстию пахового канала, через которое проводили семенной канатик. Затем общий для обоих листков нижний край – зону сгиба – одиночными узловыми швами фиксировали к паховой и, частично, к куперовской связке. Медиальный край первого листка при этом должен перекрывать область лонного бугорка, заходя на переднюю стенку влагалища прямой мышцы живота, к которой его фиксировали дополнительными швами. Затем верхний край второго листка имплантата фиксировали к апоневрозу наружной косой мышцы живота с внутренней стороны одиночными узловыми швами, проводя нити изнутри кнаружи. В завершении пластики над вторым листком имплантата сшивали рассеченный апоневроз наружной косой мышцы живота, формируя наружное отверстие пахового канала по общепринятым требованиям.
При послеоперационной вентральной грыже первая операция была выполнена профессором кафедры хирургии МИ ПГУ Никольским В.И. в Пачелмской ЦРБ 27.11.2009 пациенту Р., 34. Произведена комбинированная герниовентропластика по Белоконеву В.И. в модификации. В качестве эндопротеза использованы две полиперфорированные ксеноперикардиальные пластины 10х10 см. Послеоперационное течение без осложнений, больной выписан на 10-е сутки. На способ ксеноперикардиальной пластики получен патент РФ на изобретение № 2400160 «Способ протезирующей герниопластики срединных вентральных грыж» (опубликован 27.09.2010, бюллетень № 27, авторы: Никольский В.И., Титова Е.В., Баулин А.В.).
Наши дальнейшие разработки были направлены на поиск оптимального способа герниопластики при срединных вентральных грыжах. В двух репрезентативных группах проведен анализ оперативных вмешательств, выполненных в связи с клиникой «острого живота», у больных, ранее (более 12 месяцев) оперированных по поводу срединных вентральных грыж с применением эндопротезов и без них. Среднее время, потраченное на выполнение лапаротомии через зону протезирующей герниопластики составило 26±9,4 минуты. На выполнение лапаротомии «по рубцу» в зоне аутогерниопластики хирургами было затрачено 13±3 минуты. При этом средняя продолжительность операции в первой группе составила 110±13 минут, а во второй группе 89±6,2 минуты. Неизбежная ликвидация наиболее короткого «пути» в брюшную полость с формированием в области эндопротеза прочного соединительнотканного массива приводит к значительному увеличению времени, требующегося для лапаротомии, что в ряде случаев может оказаться недопустимым.
В ходе поиска наиболее рационального способа протезирующей пластики нами разработана и была применена у 10 больных комбинированная герниовентропластика, включающая элементы пластики по В.И.Белоконеву и Н.А.Баулину, с восстановлением белой линии живота за счет собственных тканей (патент РФ № 2398526). Показания к данному способу пластики определяли индивидуально, исходя из размеров грыжевого дефекта (до W3) и потенциальной возможности выполнения какой-либо операции на органах брюшной полости в будущем. Основной этап операции осуществляли следующим образом. По завершении манипуляций с грыжевым мешком производили рассечение передних листков влагалищ прямых мышц живота на всем протяжении дефекта симметрично справа и слева, отступая от внутреннего края не менее 3 см. Провизорно проводили два ряда сквозных П-образных швов через внутренние листки рассеченных передних стенок влагалищ прямых мышц, после чего производили одномоментное сближение краев, тракцией за проведенные лигатуры, формируя апоневротическую дубликатуру. Нити не завязывали, оставляя их в натяжении. При сближении краев дефекта происходит своеобразное вытяжение брюшной стенки, с обнажением прямых мышц за счет латерализации наружных листков рассеченных передних стенок влагалищ прямых мышц живота справа и слева. Сетку-эндопротез выкраивали раздельно справа и слева по форме обнаженных прямых мышц с таким расчетом, чтобы она не перекрывала область дубликатуры. Фиксацию выкроенной сетки производили по краю дефекта одиночными узловыми или непрерывными швами, а в зоне сформированной дубликатуры – за наложенные ранее сквозные П-образные швы. Операцию завершали дренированием и ушиванием операционной раны.
В анатомо-хирургическом эксперименте нами разработан комбинированный способ протезирующей герниопластики, при котором для укрепления передней брюшной стенки был использован синтетический протез, а восстановление белой линии живота произведено за счет биологического материала (положительное решение о выдаче патента по заявке на изобретение № 2010111220). Способ основан на выше описанных принципах и позволяет ликвидировать срединные дефекты W3-W4. Главным его преимуществом видим в том, что используемый нами биопротез (ксеноперикард) выполняет роль матрицы, для воссоздания белой линии живота.
Результаты. С ноября 2009 по июнь 2011 гг. с использованием в качестве эндопротеза ксеноперикардиальной пластины «Биоплам» оперированы 23 пациента (8 мужчин и 15 женщин) с вентральными грыжами различной локализации, из них 4 пластики по способу Лихтенштейна и 9 пластик с укреплением обеих стенок пахового канала по разработанной нами методике при паховых грыжах; 4 пластики по способу Белоконева В.И., в модификации Никольского В.И., 2 комбинированные пластики с реконструкцией белой линии живота и 2 inlay-пластики при боковых грыжах. Среди оперированных 17 пациентов были лица пенсионного возраста (от 60 до 74 лет), 6 – работающие (от 32 до 55 лет). Тяжелым физическим трудом заняты 5 пациентов, ведут домашнее хозяйство – 15, не заняты физическим трудом в силу возраста – 3. Пациенты осмотрены в сроки от 10 дней до 18 месяцев после операции. Все пациенты вернулись к привычной деятельности в сроки от 14 дней до 3 месяцев. Рецидивов за время наблюдения не выявлено. У одной пациентки после пластики по Белоконеву В.И. по поводу послеоперационной вентральной грыжи M3-4W2, в послеоперационном периоде отмечено образование серомы, потребовавшей длительного дренирования. Пациентка выписана на 18-е сутки после операции с наличием раны в нижней трети рубца около 1 см диаметром и скудным серозным отделяемым, для дальнейшего лечения и наблюдения амбулаторно. Однако через 1 месяц пациентка госпитализирована повторно с клиникой абсцесса в области нижней трети операционного рубца. Ожидалось отторжение ксеноперикардиального имплантата, однако после вскрытия абсцесса по рубцу и отхождения около 200 мл сливкообразного гноя без особого запаха оказалось, что дном раны является ксеноперикардиальная пластина, покрытая грануляциями розового цвета, плотно сросшаяся с подлежащими тканями. На фоне местной терапии отмечено заживление раны.
Мы уделяем особое внимание изучению чувства инородного тела в зоне пластики, которое в той или иной степени отмечается у лиц, перенесших протезирующую пластику с использованием синтетических эндопротезов. По нашему мнению отсутствие дискомфорта и чувства инородного тела в зоне имплантации у пациентов, перенесших ксеноперикардиальную пластику в течение ближайших 18 месяцев, обусловлено особенностями формирующегося в области ксенопротеза рубца, отмеченными в эксперименте.
Заключение. Исследование продолжается. К настоящему времени в анатомо-хирургическом эксперименте разработан новый способ фиксации ксеноперикардиального эндопротеза при inlay-пластике, позволяющий произвести надежное укрепление дефекта брюшной стенки. Изучаются возможности применения ксеноперикардиальной пластины для пластики грыж пищеводного отверстия диафрагмы.
Выводы.
1. В результате экспериментальной работы доказана высокая степень биоинтеграции ксеноперикардиальной пластины производства ООО «Кардиоплант», г. Пенза, что позволило применить материал в клинической практике.
2. Использование ксеноперикардиальной пластины в эксперименте с межмышечным и интраабдоминальным размещением, а так же для закрытия дефектов брюшной стенки в клинике не приводит к реакции отторжения и протез-ассоциированным ГВО.
3. Разработанные способы ксеноперикардиальной герниопластики могут быть рекомендованы для клинического применения.
4. Ксеноперикардиальная пластина может быть рекомендована в качестве альтернативы как простым, так и многокомпонентным синтетическим эндопротезам в герниологии.
Литература
1. Малиновский Н.Н., Золотов В.П., Сацукевич В.Н., Сурков Н.А., Кирпичёв А.Г., Ложкевич А.А., Дунаев В.С. Результаты хирургического лечения пациентов с наружными грыжами передней брюшной стенки. // Материалы симпозиума «Актуальные вопросы герниологии». М., 2001.- с.6-8.
2. Митрошин А.Н., Баулин А.В., Нестеров А.В., Зюлькин Г.А., Мозеров С.А., Никишин Д.В. Результаты применения эндопротезов из полиэфира в эксперименте и клиническое их использование при герниовентропластике. // Известия высших учебных заведений. Поволжский регион. Медицинские науки. 2008.- № 1(5).- с.74-86.
3. Amid P.K. A 1-stage surgical treatment for postherniorrhaphy neuropathic pain: triple neurectomy and proximal end implantation without mobilization of the cord. // Arch Surg 2002.- Vol 137.-pp.100-104.
4. Amid P.K. Surgical Treatment for postherniorrhaphy neuropathic inguinodynia: Triple neurectomy with proximal end implantation. // Contemporary Surgery 2003.- Vol 59.- №6.- pp. 276-280.
5. Amid P.K. The Lichtenstein repair in 2002: an overview of causes of recurrence after Lichtenstein tension-free hernioplasty. // Hernia 2003.- Vol 7.-pp.13-16.
6. Cunningham J., Temple W.J., Mitchell P., et al. Cooperative hernia study. Pain in the postrepair patient. // Ann Surg. 1996.- Vol. 224.- pp. 598-602.
7. Delikoukos S., Tzovaras G. and all. Late-onset deep mesh infection after inguinal hernia repair. // Hernia 2007.- Vol. 11(1).- pp. 58-62.
8. Dorairajan N. Inguinal hernia-yesterday, today and tomorrow. // Indian J Surg. 2004.- Vol. 66.- pp. 137-139.
9. Dukhno O., Pinsk I., Hertzano Y., Levy I., Ovnat A. An unusual presentation of a huge seroma following ventral hernia repair. // Annals of the College of Surgeons of Hong Kong 2005.- Vol 9.- Issue 2.- p. 53.
Пластина ксеноперикардиальная что это
Неспособность сухожилий и связок к полноценному закрытию формирующихся в результате травмы дефектов послужила толчком для поиска материалов, которые могли бы выполнить эту задачу. Использование в качестве пластического материала с целью замещения имеющихся дефектов сухожильно-связочного аппарата аутотрансплантатами приводит к снижению или полному выключению из функции донорской мышцы [GroutsA. et. al., 2000; VictrupL. et. al., 2005].
Общепризнанным является мнение о том, что наилучшими трансплантатами соответствующих тканей являются ткани, взятые из локусов организма реципиента – аутотрансплантаты. При застарелых повреждениях, когда выполнение шва затруднительно, сухожильная пластика остается порой единственным способом восстановления функции сухожилия. Ограниченность в количестве аутотрансплантатов побуждает к поиску новых материалов с качествами, наиболее приближенными к пласцируемым участкам сухожильно-свя зочного аппарата.
Перикард животных (телят) успешно применяется в клинической практике с 1960 года. В последнее время ксеноперикард как биологический материал находит все более широкое применение в клинических и экспериментальных разработках в кардиохирургии [Gupta M. etal., 2002; Manukyan H., 2007]. Несмотря на впечатляющие успехи экспериментальных и клинических исследований по применению ксеноперикарда как биопротеза, ряд принципиальных вопросов нуждается в дальнейшем изучении [Барсегян А.А., 2005].
Целью настоящего исследования являлась оценка возможности применения модифицированного ксеноперикарда для пластики сухожилий и связок человека.
Задачи исследования. Исследовать механические и биологические и морфологические изменения предлагаемого пластического биоматериал на основе модифицированного ксеноперикарда для пластики поврежденных сухожилий и связок.
Внедрить в клиническую практику методики хирургических вмешательств, применяемых при лечении повреждений сухожильно-связочного аппарата.
Материалы и методы исследования
В исследованиях использовались ксеноперикардиальные пластины ООО «КАРДИОПЛАНТ» (г. Пенза). Перикард телят. Модифицированный ксеноперикард представляет собой пластины различного, заданного размера и формы, ограниченные только предельными размерами исходного биологического материала. Пластины имеют гладкую (серозную) и ворсинчатую (фиброзную) поверхности. Серозная поверхность ксеноперикарда макроскопически выглядит гладкой и скользящей наощупь. Фиброзная поверхность ксеноперикарда – шероховатая ворсистая. Толщина пластин варьировалась от 0,5 до 1,5 мм. Пластины представлены волокнитым компонентом, лишенным антигенной структуры (рис. 1).
Рис. 1. Ксеноперикадиальная пластина производства ООО «Кардиоплант»
В эксперименте по замещению дефекта ахиллова сухожилия выполнено 16 имплантаций у 8-ми кроликов. Выведение животных из опыта на 1, 2, 3, 6 и 12 месяц. Морфологическое исследование материала, полученного в эксперименте, производилось посредством программ «Axiovision» и «ImageTool v.3.0» на микрофотографиях проводили подсчет следующих элементов:
– количество нейтрофильных лейкоцитов; лимфоцитов; фибробластов; фиброцитов;
– относительную площадь соединительной ткани;
– относительную площадь новообразованных сосудов микроциркуляторного русла.
Был проведен ряд экспериментов по исследованию сравнительной механической прочности на разрыв сухожилия человека и ксеноперикарда. Из образцов сформированы две группы: в первой группе сравнивались механическая прочность на разрыв с сухожилиями мышц сгибателей пальцев кисти, во второй – на прорезывание с шовным материалом – по 10 шт.
В отделении биомеханики на базе образовательно-научного института наноструктур и биосистем Саратовского государственного университет имени Н.Г. Чернышевского были проведены экспериментальные сравнительные полициклические испытания прочностных характеристик нового биоматериала. Исследовались: предельные прочность и удлинение (растяжимость), модуль упругости, жесткость (модуль Юнга). Все определяемые количественные показатели, а также паспортная часть собирались в виде базы данных с использованием прикладных программ. Статистическая обработка данных проводилась с помощью пакета прикладных компьютерных программ BLUEHILL-3 INSTRON.
Проведены эксперименты по исследованию сравнительной механической прочности человеческого сухожилия и ксеноперикарда.
Исследование проводили на разрывных машинах INSTRON-3342 и INSTRON-5944 BIO PULS с заданной постоянной скоростью 50 мм/мин (рис. 2)
По окончании испытаний машина высчитывала окончательный график средних значений «нагрузки – растяжения» и средние значения измеряемых параметров (разрывная нагрузка, предел прочности, растяжимость и модуль Юнга) (табл. 1). В первой серии сравнивались механические свойства сухожилия и ксеноперикарда.
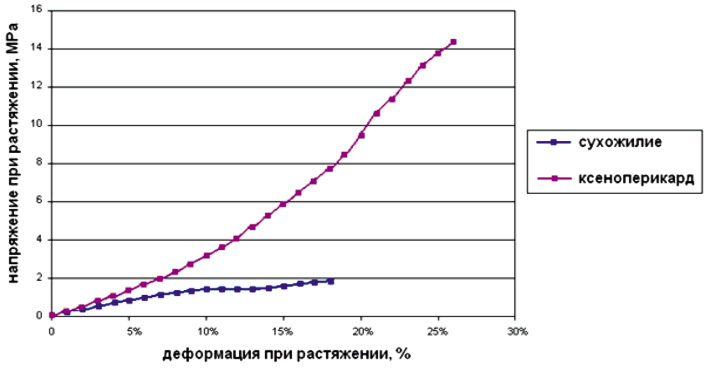
Образцы ксеноперикарда в 5 раз превосходят показатели по механической прочности образцов сухожилий 31.07/155,3 Н. Это явление может быть объяснено различием структуры расположения колагеновых волокон в сухожилии и ксеноперикарде. Таким образом, исходя из принципов доказательной медицины, полученные результаты позволяют считать обоснованным возможность использования модифицированного ксеноперикарда для пластики сухожильно-связочного аппарата.
Результаты исследования и их обсуждение
Результаты исследования гистологических срезов препарата выявили следующее.
К концу первого месяца эксперимента в тканевом ложе трансплантата отмечаются выраженные пролиферативные процессы. Биоматериал трансплантата имеет однородную структуру, по наружной поверхностиинфильтрирован лимфоцитами и гистиоцитами (рис. 4).
Рис. 3. Результаты исследования образцов сухожилия кисти человека и ксеноперикарда при максимальной нагрузке
Сравнительные данные механических свойств сухожилия и ксеноперикарда. Напряжение при растяжении, мах нагрузка
Напряжение при растяжении мах нагрузка, МПа
Пластина ксеноперикардиальная что это
РНЦХ им. акад. Б.В. Петровского РАМН
Первый МГМУ им. И.М. Сеченова; Московский НИИ педиатрии и детской хирургии
Отделение кардиохирургии клиники аортальной и сердечно-сосудистой хирургии Первого МГМУ им. И.М. Сеченова
Кафедра сердечно-сосудистой хирургии и инвазивной кардиологии Первого МГМУ им. И.М. Сеченова (зав. — д.м.н. Р.Н. Комаров), Российский научный центр хирургии им. акад. Б.В. Петровского (дир. — акад. РАН Ю.В. Белов), Москва, Россия
Применение заплаты из децеллюляризированного ксеноперикарда в хирургии брахиоцефальных артерий
Журнал: Кардиология и сердечно-сосудистая хирургия. 2018;11(2): 31-34
Белов Ю. В., Лысенко А. В., Леднев П. В., Салагаев Г. И. Применение заплаты из децеллюляризированного ксеноперикарда в хирургии брахиоцефальных артерий. Кардиология и сердечно-сосудистая хирургия. 2018;11(2):31-34.
Belov Iu V, Lysenko A V, Lednev P V, Salagaev G I. Decellularized xenopericardial patch in supra-aortic vessels repair. Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2018;11(2):31-34.
https://doi.org/10.17116/kardio201811231-34
РНЦХ им. акад. Б.В. Петровского РАМН
Цель исследования — представить результаты применения пластического материала из децеллюляризированного ксеноперикарда в хирургии брахиоцефальных артерий. Материал и методы. Каротидная эндартерэктомия с пластикой заплатой из децеллюляризированного ксеноперикарда MatrixPatch (Auto Tissue, «Berlin Gmbh.») была выполнена 5 пациентам с симптомными унилатеральными стенозами внутренних сонных артерий (ВСА) до 75—90%. Для оценки коллатерального кровотока по системе контралатеральной ВСА и вертебробазилярного бассейна применяли транскраниальную допплерографию. Результаты. Госпитальная летальность и случаи острого нарушения мозгового кровообращения отсутствовали. Три пациента были переведены на самостоятельное дыхание и экстубированы на операционном столе, 2 больных экстубированы в течение 2 ч после операции в отделении реанимации. Длительность операции составила от 48 до 65 мин (в среднем 56,5 мин), время ишемии головного мозга — от 23 до 28 мин. Выводы. Заплаты из децеллюляризированного материала удобны в работе, обладают большей пластичностью и мягкостью по сравнению с ксеноперикардом, обработанным глутаровым альдегидом, и могут быть рекомендованы для применения в сосудистой хирургии.
РНЦХ им. акад. Б.В. Петровского РАМН
Первый МГМУ им. И.М. Сеченова; Московский НИИ педиатрии и детской хирургии
Отделение кардиохирургии клиники аортальной и сердечно-сосудистой хирургии Первого МГМУ им. И.М. Сеченова
Кафедра сердечно-сосудистой хирургии и инвазивной кардиологии Первого МГМУ им. И.М. Сеченова (зав. — д.м.н. Р.Н. Комаров), Российский научный центр хирургии им. акад. Б.В. Петровского (дир. — акад. РАН Ю.В. Белов), Москва, Россия
Одной из наиболее часто выполняемых операций в сосудистой хирургии является каротидная эндартерэктомия [1].
В настоящее время предложено несколько вариантов каротидной эндартерэктомии, и хирург в зависимости от своего опыта, клинической ситуации или предпочтений клинического подразделения может выполнить каротидную эндартерэктомию с первичным ушиванием артериотомического отверстия, пластику заплатой из различных материалов или эверсионную эндартерэктомию [2—4].
При использовании заплаты для пластики артериотомического отверстия хирург всегда стоит перед выбором — какой материал выбрать?
Аутовенозные заплаты имеют хороший непосредственный результат, но в отдаленном периоде склонны к аневризматической трансформации. Синтетическая заплата (дакрон или политетрафторэтилен) имеет хорошие отдаленные результаты, но может потребовать применения биологических гемостатиков и специального шовного материала, что может сопровождаться увеличением стоимости операции или приводить к значительному кровотечению по краю шва артерия-заплата. В этой ситуации настоящей находкой стали заплаты из обработанного глутаровым альдегидом ксеноперикарда крупного рогатого скота. Эти трансплантаты практически не имеют недостатков, но сама по себе обработка высокотоксичным веществом (глутаровым альдегидом) сопряжена с определенными рисками, избежать которых невозможно [5—7]. Для минимизации проникновения глутарового альдегида в организм пациента заплату из ксеноперикарда промывают в течение нескольких минут с обязательной многократной сменой раствора, что, безусловно, требует времени и тщательного соблюдения протокола. Даже полное следование инструкциям производителя не исключает попадания глутарового альдегида в организм пациента, следовательно, применение таких заплат нельзя считать полностью безопасным.
В последние годы в связи с прогрессом биотехнологических наук в области биоматериалов и способах их обработки получено большое количество низко- и неиммуногенных ксенотрансплантатов без применения токсичных соединений, в том числе с использованием технологии децеллюляризации [8—10].
Децеллюляризация — процесс обработки биологических тканей, обеспечивающий минимальную реактивность организма реципиента, что достигается разрушением и удалением всех структур, несущих генетическую информацию (ядро клетки) донора. Последнее может быть достигнуто с применением физических, химических методов или их сочетанием. В результате децеллюляризации можно полностью удалить РНК и практически всю ДНК из тканей донора, что делает невозможной передачу любых вирусов и бактерий от донора и обеспечивает полную ареактивность иммунной системы организма реципиента на применение ксенотрансплантата [11—15].
Мы представляем результаты первого в России использования заплат из децеллюляризированного ксеноперикарда MatrixPatch (Auto Tissue, Berlin Gmbh) в хирургии брахиоцефальных артерий.
Материал и методы
Каротидная эндартерэктомия с пластикой заплатой из децеллюляризированного ксеноперикарда MatrixPatch (Auto Tissue, Berlin Gmbh) была выполнена 5 пациентам с симптомными унилатеральными стенозами внутренних сонных артерий (ВСА).
Все пациенты имели унилатеральный стеноз ВСА до 75—90%, что было подтверждено данными ультразвукового исследования и ангиографии брахиоцефальных артерий (рис. 1). 
В предоперационном периоде всем пациентам выполнено комплексное обследование в соответствии с принятым в клинике протоколом, включающим, помимо госпитального скрининга (ЭхоКГ, ЭКГ), обязательную оценку коронарного русла (коронарография) и артерий нижних конечностей (УЗДГ или МСКТ), эзофагогастродуоденоскопию и осмотр невролога.
Все операции выполнены по единой схеме. Пациента укладываем на спину с валиком под плечами, голову поворачиваем в контралатеральную от хирурга сторону.
Доступ к сонным артериям осуществляем разрезом параллельно переднему краю грудиноключично-сосцевидной мышцы.
После рассечения кожи, подкожной жировой клетчатки и m. platisma мобилизуем и пересекаем лицевую вену, которая обычно лежит на уровне бифуркации общей сонной артерии (ОСА). Далее визуализируем сосудисто-нервный пучок и последовательно выделяем наружную сонную артерию (НСА), ОСА и ВСА. Для уверенной и безопасной работы на ВСА мобилизуем артерию на 2,0—3,0 см выше места предполагаемого окончания атеросклеротической бляшки.
Рефлексогенную зону в области бифуркации ОСА (каротидный гломус) блокируем 1% раствором лидокаина гидрохлорида. Особое внимание при выделении сонных артерий уделяем сохранению всех нервов, сопровождающих сосуды. С целью отведения нервных стволов из зоны операции мы берем их на резиновые держалки, за которые осуществляем минимально необходимые тракции.
После мобилизации ОСА, НСА и ВСА вводим гепарин из расчета 100 ЕД на 1 кг массы тела пациента и через 5—7 мин проводим контроль активированного времени свертывания (целевой показатель — от 250 с).
Для оценки коллатерального кровотока по системе контралатеральной ВСА и вертебробазилярного бассейна и толерантности головного мозга к пережатию ВСА мы применяем транскраниальную допплерографию. Пробу с пережатием проводим в условиях управляемой гипертензии при АД 150—170 мм рт.ст. Снижение средней скорости кровотока по средней мозговой артерии (СМА) на 50% и более от исходной и/или отсутствие пульсового характера кровотока могут свидетельствовать о низкой толерантности головного мозга к пережатию ВСА и необходимости использования временного внутрипросветного шунтирования (ВВШ). Ни один из наших пациентов не потребовал применения ВВШ.
Мы выполняли классическую каротидную эндартерэктомию с пластикой сосудистого дефекта децеллюляризированной ксеноперикардиальной заплатой MatrixPatch (Auto Tissue, Berlin Gmbh).
Артериотомию выполняли скальпелем со стороны ОСА, в просвет артерии вводили ножницы и продолжали разрез в направлении ВСА до неизмененного участка. Циркулярно отделяли атеросклеротическую бляшку от стенки артерии в пределах наружной эластической мембраны, после чего отсекали бляшку в проксимальном направлении. В дистальном отделе бляшку сводили «на нет», используя принятую в клинике технику. Обычно мы не удаляли атеросклеротическую бляшку из НСА, а лишь освобождали ее начальный отдел на протяжении 5—10 мм и срезали бляшку в дистальном направлении.
После удаления атеросклеротической бляшки из ВСА, ОСА и НСА просвет артерии промывали раствором хлорида натрия и тщательно удаляли любые фрагменты и детрит. Обязательно приоткрывали зажим на ВСА и промывали ВСА ретроградным кровотоком. Для закрытия артериотомического отверстия мы использовали децеллюляризированную ксеноперикардиальную заплату MatrixPatch (Auto Tissue, Berlin Gmbh) шириной около 5,0 мм. Перед пуском кровотока еще раз тщательно промывали просвет артерии сначала физиологическим раствором и затем ретроградным кровотоком из ВСА. Швы на протяжении последних 5 мм накладывали при снятом зажиме с ВСА, что позволяло эвакуировать воздух и возможные микроэмболы из зоны реконструкции. Далее пинцетом пережимали ВСА в области устья и снимали зажимы с НСА, верхней щитовидной артерии и ОСА. После 7—9 сокращений сердца убирали пинцет и пускали кровоток во ВСА (рис. 2). 
В зону реконструкции устанавливали трубчатый дренаж через контрапертуру и выполняли послойное ушивание раны: подкожная жировая клетчатка, m. platisma и кожа. Дренаж подключали на активную аспирацию.
В послеоперационном периоде пациентам проводили антикоагулянтную терапию гепарином 2500 ЕД 6 раз в сутки под контролем времени свертывания крови (целевое значение 10—14 мин). После экстубации трахеи назначали двойную антиагрегантную терапию — клопидогрель 150 мг и ацетилсалициловая кислота 200 мг.
Результаты
Все пациенты удовлетворительно перенесли периоперационный период, 3 из них переведены на самостоятельное дыхание и экстубированы на операционном столе. Два пациента переведены в отделение реанимации в сознании на ИВЛ и экстубированы в течение 2 ч после операции.
Длительность операции составила от 48 до 65 мин (в среднем 56,5 мин).
Время ишемии головного мозга колебалось от 23 до 28 мин.
Неврологических осложнений зарегистрировано не было. У одного пациента имела место выраженная артериальная гипертензия, что потребовало мультимодального подхода (обезболивание + антигипертензивная терапия).
Раны на шее зажили первичным натяжением у всех пациентов.
Реакции на трансплантат в виде провоспалительных сдвигов в анализе крови, местных проявлений и температуры не отмечено ни в одном случае.
Согласно УЗДГ брахиоцефальных артерий в раннем послеоперационном периоде, у все пациентов отмечен ламинарный кровоток в зоне реконструкции без локального ускорения, признаков тромбоза и резидуального сужения.
На 5—7-е сутки все пациенты были выписаны на амбулаторный этап лечения в удовлетворительном состоянии.
Обсуждение
Мы впервые в своей практике применили заплату из децеллюляризированного ксеноперикарда в хирургии брахиоцефальных артерий.
К преимуществам данных заплат можно отнести следующее:
— быстрая подготовка (однократное промывание в течение 60 с в 0,9% растворе NaCl);
— толщина материала (0,3 мм) оптимально подходит для хирургии брахиоцефальных артерий;
— отличные манипуляционные свойства;
— герметичность мест проколов;
— отсутствие токсичности и ареактивность материала для реципиента.
В сравнении с ксеноперикардиальными заплатами, обработанными глутаровым альдегидом, можно отметить большую пластичность и мягкость децеллюляризированного материала, что, несомненно, важно для работы и может обеспечить лучшие результаты в послеоперационном периоде.
Заплаты из децеллюляризированного ксеноперикарда очень удобны в работе, полное отмывание проводим всего за 60 с в физиологическом растворе.
Опыт использования децеллюляризированной ксеноперикардиальной заплаты MatrixPatch (Auto Tissue, Berlin Gmbh) мы считаем положительным и можем рекомендовать данный материал для применения в сосудистой хирургии, в частности для реконструкции брахиоцефальных артерий.
Авторы заявляют об отсутствии конфликта интересов.