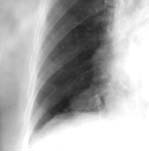
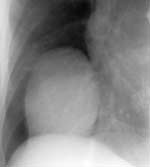
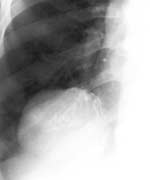
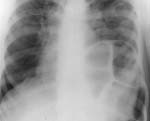
Плевральные синусы затемнены клиническое описание передние кардиодиафрагмальные что это значит
Метод КТ-диагностики для выявления фиброза легких
Фиброз — это разрастание соединительной ткани с появлением рубцов из-за нарушения механизмов заживления раневой поверхности.
Когда заживление протекает неправильно, могут возникать рубцовые изменения, приводящие к тому, что орган не может функционировать в полном объеме.
Соответственно, фиброз легких представляет собой рубцовые изменения ткани легких. Количество клеток, способных насыщать кровь кислородом, уменьшается. Следовательно, снижается дыхательная эффективность — развивается дыхательная недостаточность, приводящая к интоксикации, сначала при нагрузке, при усугублении течения заболевания — в покое, а далее — даже во сне. Рубцовая ткань в легких не только обладает пониженными функциональными свойствами, но и служит прекрасной средой для развития присоединенных инфекций, например, таких как бактериальная (пневмококковая или стафилококковая) пневмония.
Фиброз легких — это исход воспаления тканей во время интерстициального (то есть с поражением межклеточной соединительной ткани) заболевания легких. К причинам развития подобного заболевания могут относиться травмы легких, высокая загрязненность окружающей среды, курение, вдыхание наркотических веществ, плесени, органической, асбестовой, кварцевой и угольной пыли, инфекционные, аутоиммунные, вирусные заболевания и их осложнения — бронхит, туберкулез, пневмония, COVID-19 и многое другое.
Еще недавно синонимом самих интерстициальных заболеваний был пневмофиброз, но, к счастью, было установлено, что не все варианты таких заболеваний легких являются фиброзирующими.
Самый сложный и практически не поддающийся лечению — первичный, или идиопатический фиброз легких — быстро прогрессирующее фиброзирующее заболевание легких, причина которого неизвестна.
Симптомы фиброза легких
Легочный фиброз характеризуется симптомами одышки и сухого кашля (редко продуктивного — с мокротой) при физической нагрузке, непрекращающейся болью в области грудной клетки, быстрой утомляемостью на фоне затрудненного дыхания, похудением без изменения диеты. При аускультации легких (выслушивании с помощью фонендоскопа) выявляются ранние (в фазе вдоха) инспираторные, то есть дыхательные хрипы, чаще всего локализующиеся в нижних задних зонах легких.
Фиброз может развиваться как в одном легком, так и в двух одновременно. Также возможны очаговая и тотальная формы фиброза. При тотальной форме зачастую требуется оперативное вмешательство, так как поражена большая часть легких. При очаговой форме изменения носят локальный характер.
КТ-диагностика фиброза легких
Золотой стандарт диагностики фиброза легких — компьютерная томография высокого разрешения. КТ-диагностика легочного фиброза позволяет достоверно выявить степень поражения легких, определить локализацию рубцовой ткани. Этот метод диагностики признан одним из самых чувствительных неинвазивных методов выявления легочного фиброза. Так, проведенные сравнительные исследования уже в 1990 году показали, что фиброз легких с помощью компьютерной томографии в режиме высокого разрешения (КТВР) был обнаружен в 91% случаев и только в 39% — с использованием рентгенографии органов грудной клетки.
При наличии фиброза легких в серьезной стадии на КТ виден паттерн (термин, принятый для обозначения патологических признаков в медицине) так называемого «сотового» легкого — это состояние видно на сканах как однотипные, расположенные в несколько рядов кисты, содержащие воздух, в пораженных частях одного или обоих легких. На ранних стадиях легочного фиброза подобная картина не наблюдается, поэтому потребовался поиск признаков на КТ, позволяющих выявить болезнь в ее начале. Одним из таких признаков оказалось наличие на снимках картины «матового стекла» — очагов незначительного уплотнения легочной ткани. Также специфические признаки фиброза у пациента можно обнаружить при проведении КТ легких с функциональными пробами. Так, один из признаков — субплевральное усиление периферического легочного интерстиция — ранее считался признаком отсутствия патологии. Подобные изменения практически невозможно отследить при помощи других методов аппаратной диагностики.
На данный момент точность методов КТ-диагностики растет благодаря введению новых протоколов исследований и тщательного изучения результатов многочисленных исследований. При этом ведущая роль в диагностическом процессе отводится врачу-рентгенологу, который трактует видимые изменения как легочный фиброз или его отсутствие. Поиск ранних лучевых признаков фиброзирующей болезни легких — ключевой момент для своевременного назначения противофибротической терапии.
Также именно мультисрезовая КТ при поставленном диагнозе используется для оценки скорости прогрессирования заболевания, выявления благоприятного и неблагоприятного типов фиброзных изменений, успеха лечения и правильности подбора терапевтический препаратов.
Текст подготовил
Котов Максим Анатольевич, главный врач центра КТ «Ами», кандидат медицинских наук, доцент. Стаж 19 лет
Если вы оставили ее с 8:00 до 22:00, мы перезвоним вам для уточнения деталей в течение 15 минут.
Если вы оставили заявку после 22:00, мы перезвоним вам после 8:00.
Диагностика образований, расположенных в проекции кардио-диафрагмальных углов.
Гренков Г.И., Медведский В.Е.
Витебский медицинский институт.
В проекции кардиодиафрагмальных углов может локализоваться достаточно большое количество патологических образований. Диагностическая значимость клинических проявлений этих образований, особенно на начальном этапе, незначительна. Только при увеличении их размеров появляются симптомы компрессионного медиастинального синдрома.
Среди разнообразных методов лучевой диагностики рентгенологический метод является ведущим в выявлении новообразований этой области. Он позволяет уточнить локализацию, форму и размеры образования, выявить взаимосвязь с окружающими органами. Однако детальный анализ патологии кардиодиафрагмального угла при обычной рентгенографии затруднителен. Это связано со своеобразием анатомо-топографических взаимоотношений органов этой области и большим числом заболеваний, локализующихся здесь. Применение дополнительных специальных методик рентгенологического исследования позволяет в большинстве случаев поставить правильный диагноз. Наибольшую диагностическую значимость имеет пневмомедиастинография, выполняемая в различные фазы дыхания. В отдельных случаях показана томография. Заслуживает интерес применение методики встречного контрастирования, когда газ вводится в средостение и брюшную полость одновременно. Определенный успех в диагностике опухолей и опухолевидных образований кардиодиафрагмального угла связан с внедрением в практику рентгеновской компьютерной томографии. Она значительно расширяет объем диагностической информации и у отдельных больных отпадает надобность в проведении сложных методов исследования, связанных с наложением пневмоперитонеума и пневмомедиастинума. Однако отсутствие достаточного количества подобной аппаратуры ограничивают широкое использование этой методики.
В проекции кардиодиафрагмального угла встречаются медиастинальные и абдоминомедиастинальные липомы, целомические кисты перикарда, парастернальные грыжи, лейомиомы пищеводно-желудочного соустья. Значительно реже находят гигантские опухоли вилочковой железы, тератодермоидные кисты. Симулировать опухолевые процессы кардиодиафрагмального угла могут кардиодиафрагмальные грыжи, ограниченная релаксация диафрагмы. С наибольшей частотой встречается правосторонняя локализация патологического процесса в области переднего кардиодиафрагмального угла.
Рентгенологическая семиотика липом разнообразна и зависит от их размеров Медиастинальные липомы чаще встречаются в проекции правого кардиодиафрагмального угла. Они имеют грушевидную форму, однородную структуру, четкие контуры. Газ, введенный в средостение, смещает патологическое образование и позволяет увидеть его дольчатую структуру, уточнить взаимоотношение с окружающими органами и тканями.
Абдоминомедиастинальные липомы (Рис. 1), проникая через щель Ларрея, располагаются в правом сердечно-диафрагмальном синусе. Это наиболее распространенная опухоль средостения. При рентгенологическом обследовании определяется тень полукруглой формы, средней интенсивности с ровным и четким краем. В боковой проекции тень прилежит к контуру передней грудной стенки. На пневмомедиастинограммах газ расслаивает опухоль на дольки. У отдельных больных может быть видна ножка опухоли, соединяющая медиастинальное и абдоминальное пространства. При дополнительном введении газа в брюшную полость наблюдается симптом «погружения», когда расположенная выше медиастинальная часть липомы вследствие высокого стояния купола диафрагмы, как бы смещается в брюшную полость.
Злокачественные жировые опухоли этой локализации встречаются редко и их симптоматика мало отличается от доброкачественных липом.
Целомические кисты перикарда (Рис. 2) тонкостенные образования, развившиеся от отшнуровавшегося дивертикула. Содержанием кист является жидкость, подобная перикардиальной. Диаметр кист колеблется от 3נ см до 10㪧 см. Типичным признаком является тень полукруглой или полуовальной формы, связанная с куполом диафрагмы, сердцем или передней грудной стенкой. При многопроекционном исследовании они не отделяются от тени сердца. Контуры кист всегда четкие. Только наличие жировых включений, спаек приводит к неровности и угловатости контура. Для них характерна передаточная пульсация сердца. Они часто меняют форму при дыхании: удлиняются при вдохе, уплощаются при выдохе. В условиях пневмомедиастинума эти образования отчетливо отделяются от всех окружающих органов и тканей полоской газа. Серьезные дифференциально-диагностические трудности возникают в случаях, когда кисты достигают больших размеров. Их дифференцируют с липомами, диафрагмальной грыжей, осумкованным плевритом, релаксацией купола диафрагмы.
В парастернальных грыжах находят фрагменты тонкой или толстой кишок, желудка, сальника, печени. В тех случаях, когда грыжевой мешок содержит полые органы, основным признаком грыжи становится появление тени ячеистого, неоднородного образования, связанного с передней грудной стенкой. Исследование желудочно-кишечного тракта в таких случаях дает возможность увидеть контрастированные кишечник или желудок, расположенные в грыжевом мешке. Газ, введенный в брюшную полость, проникает в грыжевой мешок и на его фоне становится хорошо видимой тень сальника или фрагмент печени.
Лейомиомы пищеводно-желудочного соустья, достигнув больших размеров, могут быть видимыми в проекции кардиодиафрагмальных углов. Контрастное исследование пищевода разрешает диагностические трудности. Лейомиомы дают овальной формы дефект наполнения с неровными, но четкими контурами на фоне сохраненного рельефа слизистой оболочки.
Тимомы больших размеров могут занимать все средостение и выходить в проекцию кардиодиафрагмальных углов. При этом находят затемнение сравнительно однородной структуры с волнистыми с волнистыми очертаниями, что отражает дольчатое строение опухоли. На пневмомедиастинограммах уточняют форму и размеры опухоли и ее загрудинную локализацию. Определенное значение имеет своеобразная клиническая картина течения заболевания.
Тератодермоидные образования (Рис. 3) содержат разнообразные ткани. Очень важным признаком, позволяющим установить правильный диагноз, является наличие в толще опухоли плотных включений и краевых обызвествлений. Эти новообразования часто инфицируются и нагнаиваются, в связи с чем формируются спайки, которые связывают опухоль с окружающими тканями.
Рентгенологическая картина затемнений, обусловленных диафрагмальными грыжами, зависит от того, какие органы содержатся в грыжевом мешке. Патологическая тень при диафрагмальных грыжах прилежит к диафрагме и смещается вместе с ней. При этом возможно изменение формы тени. Выпадение кишечника (Рис. 4) или желудка позволяют увидеть на фоне неравномерного затемнения участки просветлений, горизонтальные уровни жидкости. Контрастное исследование желудка и кишечника обнаруживает эти органы в грудной полости. Наличие в грыжевом мешке паренхиматозных органов дает гомогенное затемнение. Решающее диагностическое значение в таких случаях имеет наложение диагностического пневмоперитонеума. Введенный газ проникает в грыжевой мешок и располагается между диафрагмой и паренхиматозным органом.
При ограниченных релаксациях купола диафрагмы определяется ее полуовальное выпячивание с ровным и четким контуром, нередко можно обнаружить так называемый симптом «пересекающихся дуг» различных мышечных групп диафрагмы. Возможно наблюдать парадоксальное движение релаксированного участка диафрагмы по отношению к остальному.
Таким образом, при диагностике заболеваний, локализующихся в проекции кардиодиафрагмальных углов, простое рентгенологическое исследование позволяет во многих случаях поставить правильный диагноз. Методика рентгенологического исследования в условиях пневмомедиастинума или пневмомедиастинума с пневмоперитонеумом расширяют диагностические возможности. В затруднительных случаях следует прибегать к методам биопсии и компьютерной томографии.
Поражение легких по типу матового стекла на КТ
Благодаря мультиспиральной компьютерной томографии грудной клетки, или МСКТ, которая считается наиболее информативным методом обследования легких, врачи могут диагностировать инфекционно-воспалительные и онкологические заболевания на ранних стадиях.
«Матовые стекла» характерны для пневмонии, туберкулеза, рака легких и других опасных состояний. Какие именно и по каким признакам их различают? Рассмотрим подробнее в этой статье.
Что такое «матовое стекло»?
«Матовые стекла» — это участки уплотнения легочной ткани, которые хуже пропускают X-Ray лучи. По-другому их называют очагами уплотнения ткани легких. На томограммах такие области напоминают светлые пятна или мутноватый налет. Очаги по типу «матового стекла» свидетельствуют о том, что альвеолы легких заполнены жидкостью (транссудатом, кровью), а не воздухом. Также они могут свидетельствовать о снижении пневматизации легких из-за фиброзных изменений. Альвеолы участвуют в газообмене, снабжают клетки кислородом и выводят углекислый газ, поэтому заполнение их полости жидким веществом или клетками соединительной ткани недопустимо.
Если общая площадь «матовых стекол» увеличивается, это свидетельствует о прогрессирующем инфекционно-воспалительном заболевании. Пациента начинает беспокоить нехватка воздуха, одышка, кашель.
При каких заболеваниях «матовое стекло» проявляется на томограммах?
По данным кафедры лучевой диагностики ММА им. Сеченова, картину «матовости» чаще всего дают пневмонии (вирусные, бактериальные, грибковые), однако инфильтрация легких характерна и для других патологических состояний. Вот только некоторые из них:
Оценивая данные КТ легких, врач-рентгенолог дифференцирует заболевания по специфической картине «матовых стекол»: их количеству, локализации, наличию других признаков, по которым возможно определить причину патологических изменений ткани легких. Например, для двусторонней вирусной пневмонии характерно наличие «матовых стекол», расположенных периферически в нижних и задних отделах легких. В более поздней стадии наблюдается консолидация очагов инфильтрации с утолщением перегородок альвеол.
«Матовые стекла» при туберкулезе могут быть расположены рядом с бронхами или диссеминированы — в этом случае наблюдается множество маленьких светлых участков (инфильтратов), хаотично расположенных во всей полости легких. Также при туберкулезе на КТ легких можно обнаружить характерные фиброзные тяжи, ведущие к корню легкого — это перибронхиальное воспаление, признаки лимфостаза с увеличением лимфатических узлов. Единичные участки «матового стекла» малого размера без четкого паттерна какого-либо заболевания могут указывать на новообразование, развивающийся фиброз, аденокарциному (рак) легких.
Иногда «матовые стекла» указывают на сосудистые патологии, которые приводят к сдавливанию альвеолярного пространства. У пациентов с ожирением могут появится в гравитационно-зависимых (нижних) областях легких под воздействием лишнего веса. У здоровых пациентов эффект «матового стекла» может проявиться на томограммах в случае, если сканирование грудной клетки проведено на выдохе (правильно — на глубоком вдохе).
Не принимая в расчет эти погрешности и говоря об истинном синдроме «матового стекла» на КТ легких, отметим, что это признак нефункциональных участков легких. В норме уплотнений и препятствий для дыхания быть не должно, а легочная ткань представлена на томограммах однородным темным цветом. Очень редко «матовые стекла» указывают на индивидуальные особенности организма пациента, например, на нетипичное расположение диафрагмы у новорожденных. Но это единичные случаи, поэтому давайте рассмотрим наиболее распространенные паттерны заболеваний, при которых на томографии встречаются «матовые стекла».
«Матовые стекла» на КТ при пневмонии
Чаще всего «матовое стекло» на КТ проявляется при воспалении легких, причем это может быть абсолютно любая пневмония: вирусная, бактериальная, с атипичным развитием симптомокомплекса, очень редкая интерстициальная и так далее. Поскольку спектр возбудителей пневмонии чрезвычайно широк, а дифференцировать заболевания легких по одному эффекту «матового стекла» не всегда представляется возможным, пациенту рекомендуется лабораторная диагностика — анализ крови или отделяемого из дыхательных путей на предмет микоплазм, пневмококков, коронавируса и других возбудителей.
Общим признаком острых пневмоний на КТ является наличие инфильтратов («матовых стекол») разной формы и протяженности. «Матовые стекла» расположены вокруг очагов или диффузно, как при туберкулезе. Однако в отличие от туберкулеза, их размер обычно больше, есть тенденция к консолидации инфильтратов и образованию рисунка по типу «булыжной мостовой». В отдельных случаях визуализируются просветы бронхов, содержащих газ. Это называется синдромом «воздушной бронхографии». В сочетании с эффектом «матового стекла», он также относится к явным признакам пневмонии.
Для пневмонии, вызванной коронавирусом COVID-19, характерно периферическое расположение очагов поражения под плеврой. Наиболее уязвимы билатеральные нижние доли и задние отделы легких. Отмечается тенденция к консолидации «матовых стекол» и утолщению перегородок альвеол, иногда — признаки фиброза легких.
Тяжелым формам коронавирусной пневмонии сопутствует острый респираторный дистресс-синдром. ОРДС — это обширное двухстороннее воспаление, при котором наблюдается множество инфильтратов и отек легких. На томограммах фрагментарные участки «матового стекла» кортикальной формы присутствуют с двух сторон и имеют вид «лоскутного одеяла».
При пневмоцистной пневмонии, вызванной дрожжеподобным грибом Pneumocystis Jirovecii, наблюдается несколько иная картина. Участки уплотнения легких по типу «матового стекла» обычно расположены с двух сторон симметрично (но иногда диффузно и неравномерно). Уплотнения преобладают в прикорневых областях легких, а диффузные изменения — в верхних и нижних отделах. Для пневмоцистной пневмонии, как и для вирусной, ассоциированной с COVID-19, характерны эффект консолидации и симптом «лоскутного одеяла», но на томограммах легких видны и другие признаки: воздушные кисты, пневмоторакс.
Отдельную группу заболеваний представляют идиопатические интерстициальные пневмонии, причину которых не удается установить. Помимо «матового стекла» на сканах КТ легких можно обнаружить симптом «сотового легкого», бронхоэктазы, ретикулярные изменения. Идиопатические пневмонии требуют гистологического обследования.
На основании данных компьютерной томографии легких и анамнеза пациента врач-рентгенолог сможет определить поражение легких, характерное для пневмонии. В рамках дифференциальной диагностики учитывается плотность и форма «матовых стекол», их количество, в целом оценивается рисунок. Однако определить возбудителя пневмонии и тактику лечения можно после дополнительной лабораторной диагностики.
«Матовое стекло» на КТ при туберкулезе
Очаги инфильтрации по типу «матового стекла» встречаются и при туберкулезе. Его вызывает бактерия Mycobacterium tuberculosis. Считается, что все взрослые люди, достигшие возраста 30 лет, являются носителями микобактерии в «спящем» виде. Когда иммунитет подавлен, бактерии туберкулеза могут активизироваться, и человек заболеет.
При туберкулезе на КТ легких обычно видны множественные мелкие (милиарные) очаги, диссеминированные по легким. Возможна их концентрация в определенной доле. Часто присутствует инфильтрат в форме «дорожки», ведущей к корню легкого. Отмечается увеличение лимфатических узлов. Окончательно отличить туберкулез от пневмонии возможно по результатам ПЦР-диагностики — анализа крови на предмет возбудителя инфекционного воспаления легких.
«Матовое стекло» на КТ при отеке легких
Отёк легких — это осложнение массивного воспаления, сепсиса, токсического отравления. Отек часто возникает как осложнение хронических и острых заболеваний легких, следствие коронарной ишемии, сердечной недостаточности, патологических сбоев в работе других органов и их систем.
При кардиогенном отеке легких наряду с «матовыми стеклами» наблюдается утолщение междолевой плевры, сетчатая деформация легочного рисунка, а контуры корней легких расширенные и нечеткие.
К дополнительным признакам отека легких на КТ относится увеличение диаметра легочных сосудов, расширение камер сердца и жидкость в плевральной полости.
«Матовое стекло» при аденокарциноме (раке) легкого
По эффекту «матового стекла» на КТ легких определяют злокачественные новообразования — рак легких. Аденокарцинома — самый распространенный вид опухоли; существенным «спусковым механизмом» для ее образования является курение, наследственность, возраст (старше 40 лет).
Опухоль аденокарцинома формируется из клеток железистого эпителия. На томограмме представлена единичным обычно небольшим (от 2 мм) участком уплотнения по типу «матового стекла». В отдельных случаях у пациента наблюдается несколько «матовых стекол» диффузного или диффузно-мозаичного типа. Аденокарцинома представлена различными морфологическими подтипами и требует динамического наблюдения.
Не пытайтесь самостоятельно интерпретировать изображения. Выявить «матовые стекла» и дать им дифференцированную оценку может только профильный врач специалист, прошедший обучение и имеющий соответствующий сертификат.
Текст подготовил
Котов Максим Анатольевич, главный врач центра КТ «Ами», кандидат медицинских наук, доцент. Стаж 19 лет
Если вы оставили ее с 8:00 до 22:00, мы перезвоним вам для уточнения деталей в течение 15 минут.
Если вы оставили заявку после 22:00, мы перезвоним вам после 8:00.
Ультразвуковая дифференциальная диагностика патологии правого кардиодиафрагмального угла
1 Нижегородская государственная медицинская академия, 603005, г. Нижний Новгород, пл. Минина, д. 10/1
2 Приволжский окружной медицинский центр ФМБА России, 603109, г. Нижний Новгород, ул. Ильинская, д. 14
Сафонов Дмитрий Владимирович — доктор медицинских наук, профессор кафедры лучевой диагностики, тел. +7-910-795-59-25, e-mail: safonovdv@inbox.ru 1
Павлунин Александр Васильевич — доктор медицинских наук, профессор, заведующий кафедрой фтизиатрии, тел.+7-903-605-03-49, e-mail:pavluninav@jandex.ru 1
Сафонова Татьяна Дмитриевна — студентка лечебного факультета, тел.+7-910-395-50-44, e-mail:tanja-94@inbox.ru 1
Муртазалиева Марина Саидовна — кандидат медицинских наук, заведующая амбулаторным центром трансплантологии и гепатологии, тел.+7-910-891-53-73, e-mail:mar93832607@jandex.ru 2
С цельюразработки дифференциальной ультразвуковой диагностики патологических образований правого кардиодиафрагмального угла обследованы 156 больных. Проведен сравнительный анализ эхокартины абдомино-медиастинальных липом (АМЛ) и целомических кист перикарда (ЦКП). Предложена оригинальная методика их дифференциальной ультразвуковой диагностики. АМЛ имела вид дополнительного образования треугольной формы с неоднородной эхоструктурой за счет множественных коротких линейных сигналов на гипоэхогенном фоне, при продольном сканировании прослеживался ее переход в предбрюшинную клетчатку в виде узкой ножки. ЦКП лоцировалась как овальное образование с однородным анэхогенным содержимым, ограниченным тонкой эхогенной капсулой и без связи с передней брюшной стенкой. Ультразвуковая дифференцировка АМЛ и ЦКП предоставляет хирургу возможность целенаправленно выбирать тактику лечения и определять способ оперативного лечения.
Ключевые слова: ультразвуковое исследование, правый кардиодиафрагмальный угол, абдоминомедиастинальная липома, целомическая киста перикарда, грыжа щели Ларрея.
1 Nizhny Novgorod State Medical Academy, 10/1 Minina square, Nizhny Novgorod, Russian Federation 603005
2 The Volga District Medical Center of Federal Medical and Biological Agency of Russia, 14 Ilyinskaya St., Nizhny Novgorod, Russian Federation 603109
Ultrasonic differential diagnosis of pathology of the right cardiodiaphragmatic angle
SaphonovD.V. — D. Med. Sc., Professor of the Department ofX-ray Diagnostics, tel. +7-910-795-59-25, e-mail: safonovdv@inbox.ru 1
Pavlunin A.V. — D. Med. Sc., Professor, Head of the Department of Phthisiatry, tel.+7-903-605-03-49, e-mail:pavluninav@jandex.ru 1
Saphonova T.D. — Studentof Medical Faculty, tel.+7-910-395-50-44, e-mail:tanja-94@inbox.ru 1
Murtazalieva M.S. — Candidate of Medical Science, HeadoftheOutpatientCenterofTransplantationandHepatology, tel.+7-910-891-53-73, e-mail:mar93832607@jandex.ru 2
In order to develop the differential ultrasound diagnosis of pathologic formations of the right cardiodiaphragmatic angle were examined 156 patients. The comparative analysis of echopicture of abdomino-mediastinal lipoma and coelomic pericardial cysts was made. An original method of differential ultrasound diagnosis was offered. AML had an appearance of a formation of triangular shape with heterogeneous echostructure due to multiple short linear signals at the hypoechoic background, in the course of longitudinal scanning is traced its transition into the preperitoneal tissue in the form of a narrow peduncle. Coelomic pericardial cyst is an oval formation with uniform anechoic content, limited by thin echogenic capsule and with no relation to the anterior abdominal wall. Ultrasound differentiation of abdomino-mediastinal lipoma and coelomic pericardial cyst allows the surgeon to choose the therapeutic approach and to determine the manner of surgical treatment.
Key words: ultrasound investigation, right cardiodiaphragmatic angle, abdominomediastinal lipoma, coelomic pericardial cyst, hernia, Larrey’s cleft.
Под кардиодиафрагмальным углом понимают пространство в переднем нижнем средостении, ограниченное спереди грудной стенкой, медиально — перикардом, снизу — мышечной частью купола диафрагмы, в которой выделяют грудино-реберный треугольник, или треугольник Ларрея. Он представляет собой слабое место диафрагмы, где мышечные пучки выражены слабо, а париетальную брюшину от диафрагмальной плевры отделяет лишь тонкий слой жировой клетчатки [1]. Задней границей условно считают диафрагмальный нерв и перикардодиафрагмальные сосуды, проходящие вдоль перикарда. В норме правый кардиодиафрагмальный угол занимает воздушная легочная ткань. Каудальнее нижнего края легкого распространяется передний ребернодиафрагмальный плевральный синус с незначительным количеством субплевральной жировой клетчатки.
Топографо-анатомические особенности правого кардиодиафрагмального угла определяют разнообразие патологических образований, возникающих в этой зоне, которые по структуре можно разделить на тканевые и жидкостные. К первым относятся абдоминомедиастинальные липомы (АМЛ) и встречающиеся значительно реже грыжи щели Ларрея (ГЩЛ); ко вторым — целомические кисты перикарда (ЦКП).
Патоморфологически ЦКП представляет собой тонкостенную полость с жидкостью, расположенную вплотную к сердцу обособленно от полости перикарда или сообщающуюся с ней. АМЛ по существу является ложной грыжей, состоящей только из предбрюшинной клетчатки, проникшей через щель Ларрея — Морганьи в правый кардиодиафрагмальный угол (рис. 1).
Рисунок 1.
Образование абдоминомедиастинальной липомы (схема)
1 — сердце; 2 — легочная ткань; 3 — диафрагма; 4 — абдоминомедиастинальная грыжа; 5 — плевральная складка; 6 — грудина; 7 — печень; 8 — белая линия живота; 9 — брюшина [Таgliacozzo S., 1964, цит. по Розенштраух Л.С., Виннер М.Г. Дифференциальная рентгенодиагностика заболеваний органов дыхания и средостения. Руководство для врачей: В 2 т. — Т. 2. — М.: Медицина, 1991. — С. 173].
По мнению Е.А. Немиро и Н.А. Балыня [2], ее можно расценивать как провоцирующий фактор в развитии истинной грыжи щели Ларрея — Морганьи или ретрокостостернальной диафрагмальной грыжи по классификации Б.В. Петровского [3]. Проникая через расширенную грудино-реберную щель, АМЛ расширяет ее и тянет за собой брюшину в виде конуса, который в последующем становится грыжевым мешком. При повышении внутрибрюшного давления грудино-реберный треугольник постепенно расширяется, что ведет к местному истончению мышц диафрагмы и их атрофии, а в дальнейшем к увеличению отверстия в диафрагме, через которое проникает большой сальник. Реже вместе с ним в грыжевой мешок вовлекаются петли тонкой кишки или часть поперечной ободочной кишки [4]. Парастернальные грыжи в большинстве случаев располагаются справа от грудины, так как слева бóльшая часть треугольника Ларрея прикрыта перикардом и сердцем, образуя своего рода защиту.
Основным методом диагностики патологии переднего правого кардиодиафрагмального угла традиционно является рентгенография грудной клетки в двух проекциях, позволяющая выявить тенеобразующий объект у правого контура сердца непосредственно позади грудной стенки [5, 6]. При необходимости выполняется рентгеноскопия с контрастированием пищевода и желудка. Диагностика основана на оценке характера тени, что не всегда позволяет правильно решить вопрос о причине ее возникновения (рис. 2).
Рисунок 2.
Рентгенография грудной клетки в двух проекциях: а — АМЛ; б — ЦКП
Патологическая тень в правом кардиодиафрагмальном углу. Схожая рентгенологическая картина тени (стрелки) не позволяет уверенно дифференцировать АМЛ и ЦКП
В качестве дополнительного диагностического метода рекомендуется использовать компьютерную томографию. Эхография даже не упоминается как способ визуализации образований данной локализации, хотя пристеночное расположение объекта исследования с возможностью сканирования как из межреберных промежутков, так и субкостально предоставляет хорошие условия для использования ультразвукового метода в качестве информативной, радиологически безопасной альтернативы рентгенологическому методу [7].
Цель исследования — разработка дифференциальной ультразвуковой диагностики патологических образований правого кардиодиафрагмального угла с определением структуры тенеобразующего объекта.
Материал и методы
С 2000 года на базе отделения торакальной хирургии городской клинической больницы № 5 г. Нижнего Новгорода с помощью УЗИ грудной клетки диагностировано 120 АМЛ, 28 ЦКП, 6 ГЩЛ, обусловивших затемнение правого кардиодиафрагмального угла. Верификация осуществлялась при хирургическом лечении, а при отсутствии показаний к нему при длительном динамическом наблюдении.
Рентгенография грудной клетки в двух проекциях выполнялась на аппаратах Chirodur 125C (Чехия) и EDR-750 (Германия). УЗИ проводилось на сканере SIM7000 Chellenge(Esaote, Италия) секторными датчиками 3,5 и 7,5 МГц по разработанной нами методике [8]. УЗИ грудной клетки не требовало специальной подготовки больного и выполнялось в вертикальном положении пациента на свободном дыхании и при задержке дыхания на вдохе или выдохе. Для сканирования в межреберьях предпочтительнее датчики с небольшой апертурой — секторные или микроконвексные, но исследование можно проводить и обычным конвексным датчиком.
Предложенная методика дифференциальной ультразвуковой диагностики патологии правого кардиодиафрагмального угла, в первую очередь абдомино-медиастинальной липомы, складывалась из двух последовательных этапов. Для удобства сканирования пациент вставал перед врачом лицом или с небольшим поворотом вправо, при необходимости пациентки отводили молочную железу вверх и латерально так, чтобы обеспечить доступ датчика к межреберьям по правой парастернальной линии.
Первым этапом являлось выявление патологического образования в правом кардиодиафрагмальном углу и оценка его ультразвукового изображения. Сначала проводили горизонтальное сканирование кардиодиафрагмального угла и расположенного в нем патологического объекта, для чего датчик устанавливался по правой парастернальной линии над реберной дугой перпендикулярно к поверхности грудной клетки. В такой плоскости получалось наиболее четкое изображение контуров сердца и диафрагмы. Покачивая датчик вверх-вниз, проводили поперечное сканирование кардиодиафрагмального угла, при необходимости слегка поворачивая датчик вокруг горизонтальной оси для получения максимального по площади изображения объекта, и производили измерение его поперечного (ширина) и переднезаднего (толщина) размера.
АМЛ в такой плоскости имела треугольную форму, поскольку принимала форму занятого пространства кардиодиафрагмального угла. Ее поперечный размер определяли на уровне наибольшей ширины жировой ткани как расстояние от диафрагмы до контура сердца. На этом же уровне измеряли толщину АМЛ как расстояние от ее костальной поверхности до наиболее удаленной вглубь средостения точки. При необходимости более полного осмотра наружной границы кардиодиафрагмального угла датчик по межреберью смещался латеральнее правой парастернальной линии либо ось сканирования направлялась вправо.
После осмотра в горизонтальной плоскости датчик в межреберье поворачивали на 90° по часовой стрелке для получения сагиттального сечения патологического объекта и измерения его вертикального размера. Применительно к АМЛ в этой плоскости оценивалась толщина жировой ткани на разных уровнях и определялась верхняя граница с воздушной легочной тканью.
Затем датчик устанавливался на переднюю брюшную стенку под местом прикрепления правой реберной дуги к грудине со значительным краниальным наклоном, при этом ось сканирования направлялась вверх и немного вправо к середине ключице. Тем самым получали продольное косое сечение кардиодиафрагмального угла, ориентированное снизу вверх, соответственно распространению АМЛ в средостение. Покачивая датчик вокруг горизонтальной оси, выбирали наибольший вертикальный размер АМЛ в виде пространства, заполненного жировой тканью и ограниченного медиально правым контуром сердца, латерально — куполом диафрагмы, сверху — поверхностью воздушного легкого. В этой плоскости определяли высоту АМЛ как расстояние от ее нижней до верхней границы, понимая под этим максимальное распространение предбрюшинной клетчатки в переднее средостение. Информативность исследования из субкостальной позиции датчика снижалась при значительно выраженной подкожно-жировой клетчатке, когда не представлялось возможным ориентировать плоскость сканирования под необходимым углом наклона.
На втором этапе исследования выявлялась взаимосвязь патологического образования в правом кардиодиафрагмальном углу с передней брюшной стенкой или органами брюшной полости. Тем самым у АМЛ подтверждалось наличие ножки в виде сообщения избыточной жировой ткани в средостении с предбрюшинной клетчаткой, а при ГЩЛ — переход жировой клетчатки большого сальника, а при больших грыжах и петли кишки, из брюшной полости в грудную клетку через грыжевые ворота в диафрагме. Для этого датчик в сагиттальной плоскости из межреберья или субкостальной позиции под визуальным контролем направляли каудально, при необходимости смещая его далее вниз вдоль передней брюшной стенки. Подобным образом при АМЛ на уровне щели Ларрея в диафрагме прослеживалась жировая ткань, а ниже ее переход в предбрюшинную клетчатку, расположенную перед печенью. Для лучшей визуализации ножки на уровне диафрагмы в ряде случаев требовалось небольшое вращение датчика вокруг горизонтальной оси до четкого выявления места проникновения жировой ткани через щель Ларрея. Возможен и обратный способ визуализации ножки АМЛ путем смещения датчика вверх вдоль передней брюшной стенки в межреберье, прослеживая снизу вверх переход предбрюшинной клетчатки в жировую ткань в кардиодиафрагмальном углу.
Результаты
Трансторакальное УЗИ проводилось без предварительного изучения рентгенографической картины грудной клетки. Во всех случаях ультразвуковое определение тенеобразующей структуры в правом кардиодиафрагмальном углу было выполнено верно, точность дифференциальной диагностики АМЛ и ЦКП составила 100%. Это обусловлено значительной разницей акустических свойств жировой ткани и жидкости, а также связано с оценкой взаимосвязи патологического объекта с предбрюшинной клетчаткой, что невозможно сделать рентгенологически.
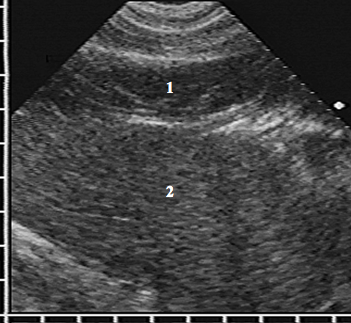
Эхокартина АМЛ складывалась из двух компонентов — избыточного количества жировой ткани в правом кардиодиафрагмальном углу и ножки, соединяющей ее с предбрюшинной клетчаткой. Жировая ткань занимала пространство между печенью и сердцем и имела вид дополнительного образования примерно треугольной формы с неоднородной эхоструктурой за счет множественных мелких гиперэхогенных сигналов на гипоэхогенном фоне (рис. 3).
Рисунок 3.
Эхограмма правого кардиодиафрагмального угла в поперечной плоскости сканирования.
АМЛ в горизонтальном сечении имеет вид гипоэхогенного образования (1) треугольной формы с неоднородной эхоструктурой за счет множественных мелких гиперэхогенных сигналов, заполняющего пространство между печенью (2) и сердцем (3)
Она не имела эхоскопически видимой капсулы и ограничивалась непосредственно диафрагмой и сердцем, а ее эхоструктура идентична ультразвуковому изображению предбрюшинной клетчатки (рис. 4 клетчатка).
Рисунок 4.
Эхограмма передней брюшной стенки по средней линии тела, продольное сканирование
Предбрюшинная клетчатка (1) в виде гипоэхогенного слоя с неоднородной эхоструктурой за счет множественных мелких гиперэхогенных сигналов, печень (2)
На глубоком вдохе при смещении купола диафрагмы вниз АМЛ слегка изменяла свою форму, а реверберации от воздушной легочной ткани частично перекрывали ее верхний край. В горизонтальной плоскости сканирования ширина и глубина выявленных липом колебались от 4,0х3,5 см до 8,0х7,0 см, но чаще их размеры не превышали 6,0х5,0 см.
Важным диагностическим признаком АМЛ являлась визуализация ножки в виде узкого гипоэхогенного участка на уровне диафрагмы, без какой-либо границы переходившего каудально в предбрюшинную клетчатку, а краниально — в саму липому. Иногда на протяжении ножки наблюдалось небольшое локальное сужение в виде «зарубки» непосредственно в месте проникновения сквозь щель Ларрея (рис. 5, ножка). Частота обнаружения зависела от толщины ножки, которая составила в среднем 8,2±1,5 мм, и была видна у 85 (70,8%) больных.
Рисунок 5.
Эхограмма правого кардиодиафрагмального угла в продольной плоскости сканирования
Ножка АМЛ (1) в виде узкого гипоэхогенного участка с «зарубкой», переходящего краниально в АМЛ (2), а каудально — в предбрюшинную клетчатку (3), печень (4)
Отмечено, что у пациентов со значительно повышенной массой тела хорошо выраженная паракардиальная клетчатка средостения могла имитировать АМЛ вследствие типичной для жировой ткани эхоструктуры. Но в отличие от последней медиастинальная клетчатка не имела ножки и не распространялась ниже уровня диафрагмы, кроме того, она лоцировалась по обе стороны сердца и ее размеры не превышали 3,0х2,5 см.
УЗИ при грыже щели Ларрея имело разную информативность в зависимости от содержимого грыжевого мешка. Небольшое количество наблюдений пока не позволяет создать обобщенную эхокартину данного заболевания, но следует отметить, что наибольшие диагностические сложности возникали при наличии в грыжевом выпячивании пряди большого сальника, который по акустическим свойствам не отличался от предбрюшинной жировой клетчатки. У 3 больных такая грыжа эхоскопически была расценена как АМЛ и не диагностирована до операции. Для дифференцирования этих заболеваний необходимо более внимательно оценивать ту структуру, в которую переходила ножка дополнительной жировой ткани: в предбрюшинную клетчатку, расположенную поверхностно от непрерывной гиперэхогенной линии брюшины, или в большой сальник глубже нее, в который клетчатка из правого кардиодиафрагмального угла переходила с наличием участка перерыва гиперэхогенной линии брюшины.
Однако петли тонкой кишки отчетливо визуализировались в грыжевом мешке, особенно при ущемлении с развитием острой тонкокишечной непроходимости. В таких случаях выше печени и диафрагмы в кардиодиафрагмальном углу лоцировалась изогнутая трубчатая структура с жидким содержимым и неоднородной малоподвижной взвесью, отграниченная эхогенной стенкой, а в брюшной полости наблюдалась типичная эхокартина острой тонкокишечной непроходимости. При неущемленной грыже о присутствии в ней петли тонкой кишки можно судить по наличию в грыжевом содержимом подвижных гиперэхогенных сигналов с акустической тенью и реверберациями «хвоста кометы», обусловленных отражением ультразвука от скоплений газа, смещавшихся при перистальтических сокращениях.
Целомические кисты перикарда располагались паракардиально чаще вдоль правого, реже вдоль левого контура сердца, преимущественно на уровне желудочков и только при крупных размерах достигали предсердий. Вследствие такого вариабельного расположения при их диагностике необходимо использовать не только предложенные доступы для визуализации правого кардиодиафрагмального угла, но и стандартные эхокардиографические позиции. Методически исследование практически не отличалось от ультразвукового способа диагностики АМЛ, только большее внимание уделялось осмотру паракардиального пространства вдоль левых отделов сердца [9].
Для ультразвукового изображения ЦКП характерно непосредственное соприкосновение с контуром сердца на достаточном протяжении и овальная или каплевидная форма, при которой продольная ось образования располагалась вертикально или параллельно длинной оси сердца (рис. 6).
Рисунок 6.
Эхограмма правого кардиодиафрагмального угла в поперечной плоскости сканирования
Целомическая киста перикарда (1) в виде анэхогенного овального образования вдоль стенки правого желудочка (2), паракардиальная жировая клетчатка (3)
Однако при локализации в правом кардиодиафрагмальном углу киста часто принимала форму того пространства, которое она занимала между сердцем и диафрагмой, то есть примерно треугольную со сглаженными углами. Размеры ЦКП колебались в более широких пределах, чем размеры АМЛ, и составляли от 4 до 20 см в наибольшем измерении. При импульсноволновой допплерографии в полости ЦКП наблюдалась неспецифическая передаточная пульсация за счет сократительных движений сердца.
Поскольку в кисте содержалась прозрачная жидкость, то она имела однородную анэхогенную структуру, что принципиально отличало ее от гипо- или среднеэхогенных тканевых образований. Только у 3 (10,7%) больных отмечена рыхлая мелко- или среднезернистая взвесь на анэхогенном фоне, что соответствовало мутной жидкости в полости кисты. Подавляющее большинство ЦКП представляли собой анэхогенные замкнутые полости без сообщения с перикардиальной или плевральной полостью. Установить связь полости кисты с полостью перикарда удалось только у двух пациентов, что не позволяет рассматривать этот признак как обязательный компонент эхосемиотики. Естественно, отсутствовала и связь с предбрюшинной клетчаткой.
Важным диагностическим признаком являлось наличие у кисты тонкой и четкой эхогенной стенки. Она лучше прослеживалась на тех участках, где не соприкасалась с интенсивно отражавшими ультразвук структурами, то есть с воздушной легочной тканью, перикардом или диафрагмой. Обычно это был переход от поверхности сердца к передней грудной стенке или диафрагме, где стенка кисты отходила от поверхности этих органов и отграничивала анэхогенную жидкость в полости кисты от паракардиальной жировой клетчатки (рис. 7).
Рисунок 7.
Эхограмма правого кардиодиафрагмального угла в поперечной плоскости сканирования
Тонкая эхогенная стенка (1) отграничивает паракардиальную жировую клетчатку (2) от полости целомической кисты перикарда (3) на участке между сердцем (4) и грудной стенкой (5)
Эхографическое исследование правого кардиодиафрагмального угла, несмотря на высокую информативность в дифференцировке находящихся в нем образований, является дополнительным методом лучевой диагностики патологии данного отдела средостения. Ведущим диагностическим скрининговым методом обоснованно остается рентгенография грудной клетки в двух проекциях. Однако на этапе уточняющей диагностики следующим исследованием предпочтительнее использовать эхографию грудной клетки в качестве более простого, доступного и радиологически безопасного метода по сравнению с компьютерной томографией [10]. Обследование поддиафрагмального пространства входит в компетенцию врачей ультразвуковой диагностики, проводящих исследование органов брюшной полости. Технически овладеть сканированием парастернальной наддиафрагмальной зоны не сложно, поэтому оценку состояния правого кардиодиафрагмального угла следует шире вводить в клиническую практику.
Заключение
Ультразвуковое исследование переднего правого кардиодиафрагмального угла предоставляет новые возможности для дифференциальной диагностики расположенных в нем патологических процессов. Уверенная ультразвуковая дифференцировка АМЛ и ЦКП предоставляет хирургу возможность целенаправленно выбирать тактику лечения и определять способ оперативного лечения, а также обусловливает оптимальное применение торакоскопических вмешательств и трансмиоректального доступа как наиболее эффективного и наименее травматичного способа лечения в каждой конкретной ситуации. Сочетание трансторакальной ультразвуковой диагностики и современных оперативных возможностей создает единый лечебно-диагностический комплекс, оптимизирующий хирургическое лечение патологии правого кардиодиафрагмального угла.
1. Синельников Р.Д., Синельников Я.Р. Атлас анатомии человека: Учеб. пособие. — В 4 т. — Т. 1. — М.: Медицина, 1996. — С. 216-218.
2. Немиро Е.А., Балыня Н.А. Парастернальные (абдомино-медиастинальные) липомы и диафрагмальные грыжи // Вестник рентгенологии и радиологии. — 1970. — № 2. — С. 3-9.
3. Петровский Б.В., Каншин Н.Н., Николаев Н.О. Хирургия диафрагмы. — Л.: Медицина, 1966. — 547 с.
4. Муртазалиева М.С. Диагностика и хирургическое лечение патологических образований переднего правого кардиодиафрагмального угла с использованием трансмиоректального доступа: автореф. дис. … канд. мед. наук: 14.01.17, 14.01.13. — Н. Новгород, 2010. — 21 с.
5. Розенштраух Л.С., Виннер М.Г. Дифференциальная рентгенодиагностика заболеваний органов дыхания и средостения. Руководство для врачей: В 2 т. — Т. 2. — М.: Медицина, 1991. — 384 с.
6. Власов П.С. Лучевая диагностика заболеваний органов грудной полости. — М.: Видар-М, 2006. — 312 с.
7. Королев Б.А., Сафонов Д.В., Павлунин А.В., Муртазалиева М.С. Парастернальные диафрагмальные грыжи: особенности диагностики и выбора оперативного доступа // Анналы хирургии. — 2010. — № 1. — С. 26-30.
8. Способ диагностики абдоминомедиастинальной липомы: пат. 2317775 Рос. Федерация: МПК 51 А61В 8/00 / Сафонов Д.В., Павлунин А.В., Муртазалиева М.С.; заявитель и патентообладатель Нижегородская гос. медицинская академия. — № 2006102031/14; заявл. 27.07.2007; опубл. 27.02.2008. Бюл. № 6.
9. Способ дифференциальной диагностики абдоминомедиастинальной липомы и целомической кисты перикарда: пат. 2317776 Рос. Федерация: МПК 51 А61В 8/00 / Сафонов Д.В., Павлунин А.В., Муртазалиева М.С.; заявитель и патентообладатель Нижегородская гос. медицинская академия. — № 2006102032/14; заявл. 27.07.2007; опубл. 27.02.2008. Бюл. № 6.
10. Wernecke K. Mediastinale Sonographie: Untersuchungstechnik, diagnostische Effizienz und Stellenwert in der bildgebenden Diagnostik des Mediastinums. — Berlin; Heidelberg; New York: Springer-Verlag, 1991. — 111 s.
1. Sinel’nikov R.D., Sinel’nikov Ya.R. Atlas anatomii cheloveka: ucheb. posobie [Atlas of Human Anatomy: Textbook. allowance]. In 4 vol. Vol. 1. Moscow: Meditsina, 1996. Pp. 216-218.
2. Nemiro E.A., Balynya N.A. Parasternal (abdomino-mediastinal) lipomas and diaphragmatic hernia. Vestnik rentgenologii i radiologii, 1970, no. 2, pp. 3-9 (in Russ.).
3. Petrovskiy B.V., Kanshin N.N., Nikolaev N.O. Khirurgiya diafragmy [Surgery of the diaphragm]. Leningrad: Meditsina, 1966. 547 p.
4. Murtazalieva M.S. Diagnostika i khirurgicheskoe lechenie patologicheskikh obrazovaniy perednego pravogo kardiodiafragmal’nogo ugla s ispol’zovaniem transmiorektal’nogo dostupa: avtoref. dis. … kand. med. nauk [Diagnosis and surgical treatment of pathological formations front right corner kardiodiafragmal using transmiorektal access. Synopsis of diss. of PhD med. sci]. Nizhnii Novgorod, 2010. 21 p.
5. Rozenshtraukh L.S., Vinner M.G. Differentsial’naya rentgenodiagnostika zabolevaniy organov dykhaniya i sredosteniya. Rukovodstvo dlya vrachey: V 2 t. [Differential x-ray diagnosis of diseases of the respiratory system and mediastinum. Guide for Physicians: In 2 volumes]. Vol. 2. Moscow: Meditsina, 1991. 384 p.
6. Vlasov P.S. Luchevaya diagnostika zabolevaniy organov grudnoy polosti [Ray diagnosis of diseases of the chest cavity]. Moscow: Vidar-M, 2006. 312 p.
7. Korolev B.A., Safonov D.V., Pavlunin A.V., Murtazalieva M.S. Parasternal diaphragmatic hernia : diagnostic features and a choice of operative access. Annaly khirurgii, 2010, no. 1, pp. 26-30 (in Russ.).
8. Safonov D.V., Pavlunin A.V., Murtazalieva M.S. Abdominomediastinalnoy method for diagnosing lipomas: pat. 2317775 Ros. Federatsiya: MPK51 A61V 8/00; zayavitel’ i patentoobladatel’ Nizhegorodskaya gos. meditsinskaya akademiya. № 2006102031/14; zayavl. 27.07.2007; opubl. 27.02.2008. Byul. no. 6 (in Russ.).
9. Safonov D.V., Pavlunin A.V., Murtazalieva M.S. A method of differential diagnosis of lipoma and abdominomediastinalnoy coelomic pericardial cyst: pat. 2317776 Ros. Federatsiya: MPK51 A61V 8/00; zayavitel’ i patentoobladatel’ Nizhegorodskaya gos. meditsinskaya akademiya. No. 2006102032/14; zayavl. 27.07.2007; opubl. 27.02.2008. Byul. no. 6 (in Russ.).
10. Wernecke K. Mediastinale Sonographie: Untersuchungstechnik, diagnostische Effizienz und Stellenwert in der bildgebenden Diagnostik des Mediastinums. Berlin; Heidelberg; New York: Springer-Verlag, 1991. 111 p.