Поддерживающая химиотерапия при онкологии что
Правила проведения химиотерапии: что нужно знать пациенту
Лекарственную противоопухолевую терапию получают практически все пациенты, болеющие злокачественными новообразованиями. Особенностью этого лечения является его длительность и повторяемость. Отдельные курсы введения препарата проводятся на протяжении нескольких лет, иногда в течение всей жизни больного. Какие правила необходимо соблюдать при получении этого вида лечения, чтобы сохранить качество жизни, рассказала кандидат медицинских наук Елена Викторовна Ткаченко – онколог, химиотерапевт, заведующая отделением краткосрочной химиотерапии НМИЦ онкологии имени Н.Н. Петрова.
– Елена Викторовна, когда применяют химиотерапевтическое лечение?
– Химиотерапию применяют на разных стадиях онкологического заболевания: на начальной стадии проводят предоперационную (неоадъювантную) и послеоперационную (адъювантную) терапию, также на более поздних стадиях, когда оперативное вмешательство по каким-то причинам уже невозможно. Противоопухолевая лекарственная терапия проводится и тогда, когда заболевание вернулось после радикального лечения. Поэтому многие наши пациенты получают это лечение и месяцы, и годы. И в этом нет ничего страшного или удивительного. Например, пациенты с сахарным диабетом, гипертонической или ишемической болезнями постоянно соблюдают определенные условия жизни и принимают специальные препараты. Так и онкологическое заболевание является хроническим, и, к сожалению, нередко даже после завершения лечения, через некоторое время вновь приходится его возобновлять.
– Какие побочные действия у химиотерапии?
– Побочные действия свойственны всем видам противоопухолевого лечения, даже если оно проводится по современным стандартам. Это связано с механизмом действия противоопухолевых препаратов. Осложнения бывают четырех степеней: побочные эффекты первой и второй степени больше тревожат самих пациентов, но врачи к ним относятся спокойно, потому что эти осложнения часто неизбежны и угрозы для жизни не представляют. В основном это изменения самочувствия пациента и лабораторных показателей, нетребующие лечения, например, выпадение волос или некоторое снижение лейкоцитов по результатам анализов. К третьей и четвертой степеням относятся так называемые жизнеугрожающие осложнения, они требуют серьезного внимания со стороны лечащего врача.
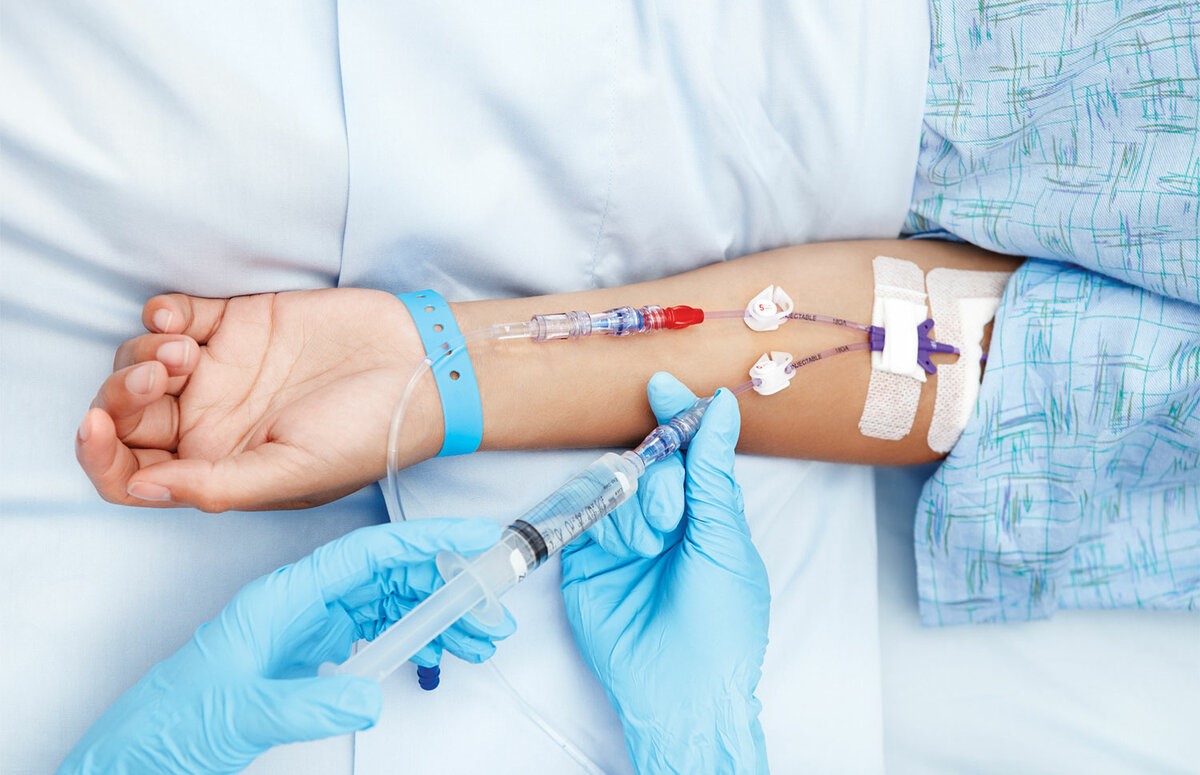
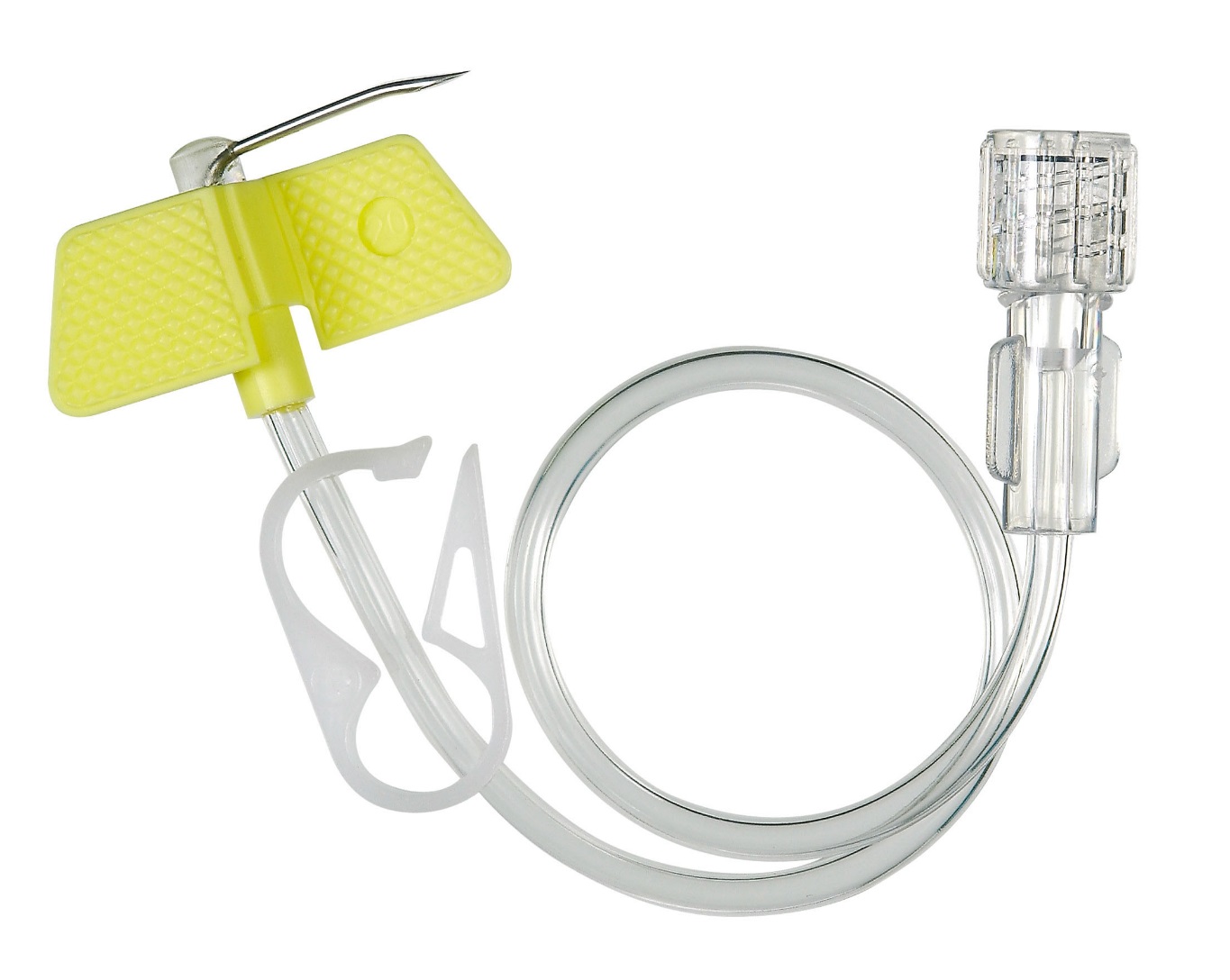
– Лекарственное противоопухолевое лечение пациент в основном получает через вену. Есть ли способы подготовить вены, чтобы избежать возможных побочных эффектов?
– Да, существует ряд рекомендаций, выполняя которые пациент может научиться тренировать свои вены перед введением препаратов.
– Какие побочные эффекты от введения препаратов бывают?
– При внутривенном введении цитостатиков нередко развиваются воспалительно– склеротические реакции со стороны вен. Они проявляются разнообразно: от выраженной боли по ходу сосудов уже во время инъекции до подострых флебитов, тромбофлебитов, флеботромбозов с исходом в облитерацию вен, иначе говоря, зарастание вены. При длительном введении фторурацила стенки сосудов пропитываются препаратом. Этот побочный эффект возникает практически в 100% случаев при применении некоторых препаратов. Зуд и эритема кожи по ходу вены во время введения цитостатиков отмечаются примерно в 3% инфузий, они проходят в течение 30 минут без осложнений и не свидетельствуют о подтекании препарата. Попадание под кожу раздражающих препаратов (цисплатин, дакарбазин, этопозид, фторурацил, паклитаксел, винорельбин) может вызвать жгучую боль и покраснение в месте инъекции, но если принять правильные меры, то к некрозу это не приведет.
– Существуют способы избежать осложнений или их облегчить?
– Медицинский персонал знает, как профилактировать осложнения со стороны вен. Полезно это знать и пациентам. Дело в том, что инъекции растворов цитостатиков вводятся только в минимально допустимых концентрациях. Капельные инфузии с большим количеством жидкости служат лучшим способом предупреждения повреждений стенки вен (только в случаях, когда это рекомендовано как способ введения цитостатика). Если препарат необходимо вводить струйно, то его разводят в 20-30 мл рекомендуемого растворителя, а после инъекции промывают вены изотоническим раствором NaCl. При попадании некоторых препаратов под кожу возникает гиперемия, воспаление. В трети случаев может возникнуть некроз, который без вмешательства не заживет. В этом случае необходимо обратиться за хирургической помощью.
– Что нужно делать, если химиопрепарат всё-таки попал под кожу?
– Подачу препарата необходимо остановить, но иглу или катетер вытаскивать из вены не нужно, через них медсестра извлечет попавший под кожу препарат. Для некоторых химиопрепаратов существуют антидоты (противоядия), но, к сожалению, есть они не для всех препаратов. Антидотом медсестра обколет место инъекции, а затем уже удалит из вены иглу или катетер. Пораженной конечности следует придать приподнятое положение на 48 часов, чтобы уменьшить риск воспаления и отека. Для этого достаточно закрепить руку в согнутом положении с помощью перевязки или косынки.
При попадании под кожу таких препаратов как винкристин, винбластин, винорельбин, этопозид прикладывают теплый компресс на 15-20 минут не менее четырех раз в сутки в течение 24- 48 часов. При воспалительной реакции возможна аппликация гидрокортизоновой мази.
Если развился флебит (т.е. воспаление вены), то он лечится по таким же принципам, как и обычные флебиты вне химических ожогов: применяются низкомолекулярные гепарины, антикоагулянты непрямого действия, антиагреганты.
– Почему лекарственное противоопухолевое лечение можно получать только в специализированных клиниках?
– Дело в том, что у каждого препарата свой срок и скорость введения, и для дробного и длительного введения применяется специальное оборудование. Именно поэтому ни в коем случае нельзя капать химиотерапию дома или в поликлинике, где не знают, что такое противоопухолевая лекарственная терапия. Давно уже, по крайней мере, в Санкт-Петербурге, комитетом по здравоохранению врачам, медсестрам запрещено капать противоопухолевые препараты на дому после смерти нескольких пациентов. Вы можете проводить химиотерапию только в специализированной клинике, где можно быть уверенным, что врач и медсестра понимают, что делают. Препараты должны определенным образом разводиться, капаться, храниться, их нельзя смешивать. Есть только пара препаратов, которые смешивают в одном флаконе. Все остальные должны капаться поочередно, да еще и между препаратами необходимо промывать систему физраствором. Каждый препарат должен разводиться определенным раствором: глюкозой, раствором Рингера, водой для инъекций или физраствором. Это сложная наука.
– Какое оборудование для введения препаратов сегодня используется?
– Существует несколько типов медицинского оборудования для длительного и дробного введения препаратов. Например, перфузоры – это устройства, позволяющие вводить медикаментозные препараты и растворы с исключительно высокой точностью. Порой счёт идет на десятые доли миллилитров в час (особенно часто это применяется в отделении реанимации, где скорости введения медикаментов, как правило, 1 мл/час, 5.6 мл/час и т.д.). Перфузоры могут быть механическими или электронными. Они имеют несколько названий: инфузоматы, линеаматы, шприцевые насосы, шприцевые дозаторы и др. Есть микроинфузионная помпа (инфузор) – безопасное и эффективное медицинское изделие, предназначенное для длительного, дозированного, контролируемого введения лекарственных препаратов, используемых в медикаментозной терапии (в том числе и химиотерапии). Как правило, такие помпы называют инфузор или инфузомат. Так же можно встретить названия: шприцевой насос, дозатор медицинский, инфузионный насос и др.
При использовании микроинфузионной помпы обеспечивается постепенное поступление препарата в организм за счет механизма сокращения резервуара и трубки инфузора.
– Какие правила введения противоопухолевых препаратов должен знать пациент?
– Введение противоопухолевых препаратов должно выполняться только в отделениях, специализирующихся на цитотоксической химиотерапии исключительно под наблюдением компетентного врача. Этот метод лечения требует специальной подготовки, тщательности при приготовлении растворов препаратов и соблюдения всех правил их введения, указанных в инструкциях. Поэтому к выполнению работ с цитостатиками должны допускаться медицинские сестры, прошедшие специальную подготовку, обученные безопасным методам и приемам работы. Также необходимо соблюдать последовательность и скорость введения препаратов, учитывать химические свойства при использовании оборудования для их введения. Соблюдать правила и сроки хранения препаратов как в аптечной упаковке, так и после их приготовления. Ни в коем случае нельзя смешивать препараты «в одном флаконе», если в инструкции по применению данных препаратов нет для этого особых указаний. Необходимо знать и соблюдать все условия хранения препарата и его транспортировки, если он приобретается и доставляется в клинику самим пациентом. Это очень важно. Потому что многие пациенты говорят: «Я куплю, привезу, а вы мне прокапайте!» Если вы купите, например, герцептин в аптеке и привезете его к нам не в холодильнике, а в обычной упаковке, что мы получим? В лучшем случае – воду. В случае личного приобретения препаратов уточните правила хранения и транспортировки у своего врача.
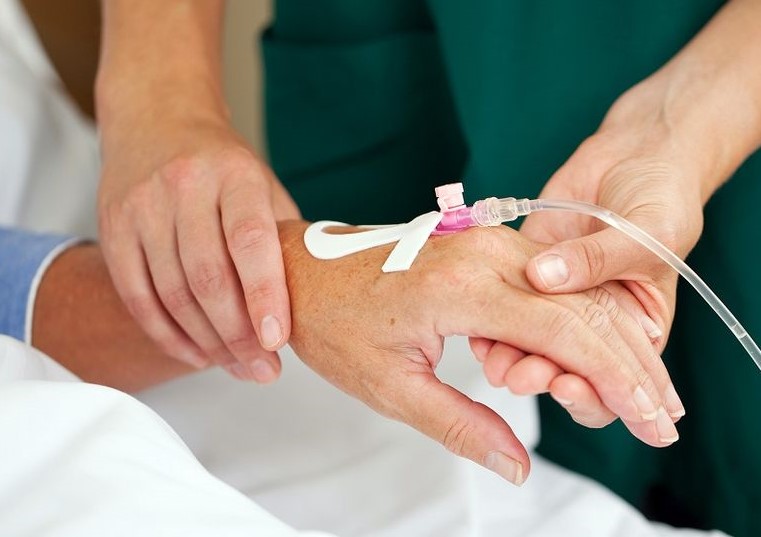
– Какие способы внутривенной доставки препаратов сегодня используются?
– На сегодняшний день существует несколько способов: через иглу, переферический венозный катетер, центральный венозный катетер и имплантируемый порт. Вы знаете, когда я начала работать в медицине, мы работали еще многоразовыми иглами. Они были тупые, поэтому могли долго стоять в вене. А как только появились одноразовые иглы, стали возникать сложности. Они же острые, чуть пациент шевельнулся, она прокалывает вену моментально. Поэтому если необходимо вводить препарат долго, то делать это лучше через переферический венозный катетер. Если его устанавливать в асептических условиях, правильно ухаживать, то до 10 дней им можно пользоваться.
Для более длительного венозного доступа используют центральный венозный катетер, особенно в тех случаях, когда необходимо обеспечить полное парентеральное питание у хронических больных. Край центрального венозного катетера вводится в пустотелую вену. У этих катетеров много преимуществ. Но неправильный уход за ними может привести и к серьезным осложнениям. Поскольку если возникнет воспаление, то оно будет не местным, а общим. Поэтому центральный венозный катетер требует профессионального использования и тщательного ухода.
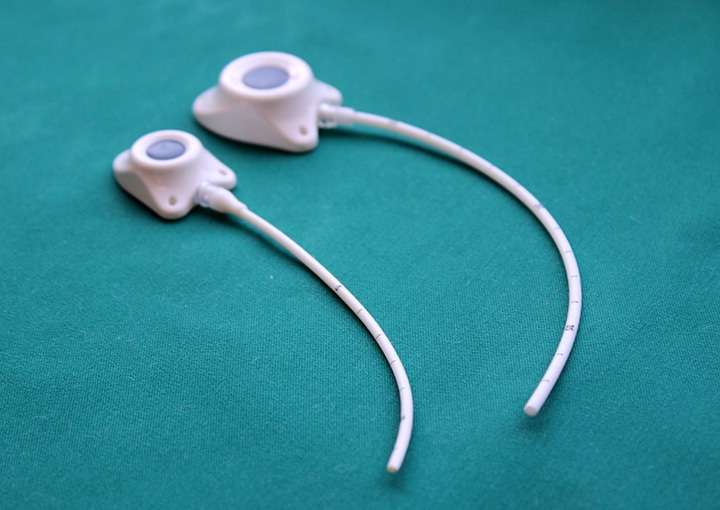
Еще существует порт-система. Это инвазионный порт, который представляет собой титановый резервуар в виде толстой монеты диаметром около 4-4,5 см и толщиной около 1 см, который покрыт изнутри биоинертным полимером. На верхней плоской части установлена мембрана из многослойного силикона, через которую вводят лекарственные препараты. Порт имеет тонкую трубочку-катетер длиной до 10-15 см, которая пропускается в яремную вену и реже в артерию.
Показания к применению порт-системы:
Есть свои противопоказания, но они все относительны, и доктора сами принимают решение, учитывать их или нет.
– Какие очевидные преимущества у порт-системы?
– Их много. Главное, что человек может вести привычный образ жизни. Венозный порт имплантируется под кожу пациента, он не виден снаружи, поэтому не может быть задет одеждой, инфицироваться при приеме ванны, «выскочить» из вены. Люди с установленными портами могут заниматься спортом, выполнять физическую нагрузку, плавать, путешествовать, отдыхать заграницей и т.д. Им можно проходить МРТ и КТ исследования, он совместим с магнитным полем. При правильной эксплуатации порт-система может работать 5-7 лет. Существуют наблюдения, что если за порт-системой правильно ухаживать, то фактически она может использоваться пожизненно. В некоторых странах установка порт-системы является неотъемлемой частью «золотого стандарта» лечения. В Западной Европе порты широко применяются у пациентов с впервые выявленным онкологическим заболеванием, которым планируется проведение множественных сеансов химиотерапии, особенно цитостастическими препаратами, которые вызывают повреждение периферических вен. Кроме того, инфузионные порты устанавливаются пациентам с тонкими периферическими венами на верхних и нижних конечностях. В отечественной онкологической практике порты пока используются редко.
– Как происходит установка инфузионного порта?
– Процедура имплантации порта проводится под местной анестезией и абсолютно безболезненна. Порт, как правило, имплантируется в правую подключичную область, хотя место может быть любым, главное, чтобы рядом была проходимая вена. Процедура занимает от 10 до 30 минут и не требует длительной госпитализации. Пациент находится в стационаре около часа после установки, а потом самостоятельно может ехать домой. Врач предоставляет ему необходимую информацию о правилах поведения после операции и о лекарствах, которые необходимо принимать в течение нескольких дней после процедуры.
– Как ухаживать за порт-системой?
– О каких «сигналах тревоги» должен знать пациент с установленным портом?
– Надо понимать, что при использовании порт-системы бывают и осложнения. Пациент должен насторожиться и обратиться к врачу в случае:
Источники
Материал подготовила:
НАТАЛЬЯ СУББОТИНА
специалист по связям с общественностью
НМИЦ онкологии им Н.Н. Петрова,
Кемеровский государственный университет, факультет филологии и журналистики, отделение журналистики
Материал подготовила:
ЮЛИЯ КОБЛЯКОВА
специалист по связям с общественностью
НМИЦ онкологии им Н.Н. Петрова,
Санкт-Петербургский политехнический университет Петра Великого
Кафедра рекламы и связей с общественностью
Поддерживающая терапия и ее значение в современной онкологии
Об эффективности лечения злокачественных новообразований и улучшении качества жизни онкологических больных трудно говорить в ситуации, когда противоопухолевая терапия проводится препаратами, вызывающими тяжелые побочные эффекты. Поэтому тема поддерживающей терапии онкологических больных выходит на первый план.
История вопроса
Термин «поддерживающая терапия» был предложен Международной ассоциацией по поддерживающей терапии в онкологии в 2008 г. А уже в 2009 г. в России состоялся первый семинар по этой теме. В этом году можно отметить десятилетие внедрения этого направления в нашей стране.
Чуть больше десяти лет назад на нашем рынке появились биосимиляры – препараты, позволяющие корректировать побочные эффекты химиотерапии. В частности филграстим, который применяется против одного из самых тяжелых побочных эффектов – фебрильной нейтропении.
Когда в 80–90-х гг. прошлого века химиотерапия стала основным методом противоопухолевого лечения, многие пациенты вообще отказывались от ее проведения самыми современными на тот момент препаратами, так как не могли перенести невыносимые тошноту и рвоту. Кратность тошноты и рвоты могла доходить до 30–40 раз в день. Пациент, который испытывал такие ощущения, на второй-третий раз отказывался от курса химиотерапии. Поэтому у медиков и зародилась идея создавать не только препараты для терапии онкологических заболеваний, но и лекарства и методики для облегчения осложнений, рассказывает один из основоположников направления поддерживающей терапии профессор А.В. Снеговой.
Осложнения повышают риск смертности. И если вероятность летального исхода от тошноты у пациента минимальная, то от инфекционных осложнений – большая. Поэтому одним из факторов необходимости применять поддерживающую терапию является возможность профилактики фебрильной нейтропении с помощью специализированных препаратов, которые восстанавливают функцию костного мозга после лекарственного противоопухолевого лечения и таким образом защищают пациента от инфекционных осложнений.
В конце 80-х и начале 90-х гг. впервые было показано, что те пациенты с диагнозом «рак поджелудочной железы», которые получали вместе с химиотерапией еще и поддерживающую терапию, продемонстрировали значительно лучшие показатели общей выживаемости.
Концепция качества жизни
Концепция качества жизни во время заболевания – того, что пациент не должен испытывать страданий во время лечения, – пришла в Россию в 90-е гг. Ее активно развивали наши врачи в Санкт-Петербурге под руководством профессора А.А. Новика. Они дали определение понятию «качество жизни», разработали методологию исследования этого понятия, основные направления применения этого определения в медицине. Теперь онкологических пациентов распределяют по группам в зависимости от их диагноза и состояния и определяют степень необходимой им помощи, рассказывает д.м.н. Л.М. Когония.
Начиная с 90-х гг. врачи ставят качество жизни пациентов по важности на второе место после показателей общей выживаемости при любой лекарственной терапии, и противоопухолевой в том числе. Такого принципа придерживается ВОЗ. А сегодня можно не только бороться с осложнениями противоопухолевого лечения, но и предотвращать их развитие. Использование препаратов поддерживающей терапии позволяет значительно ускорить восстановление иммунной защиты после проведения химиотерапии. И растущая доступность этих препаратов позволяет обеспечить ими все большее число нуждающихся.
Фебрильная нейтропения, которая развивается после химиотерапии, может вызвать у пациента септическое состояние и угрожать его жизни. Поэтому назначение препаратов гранулоцитарного колониестимулирующего фактора (Г-КСФ) – средств лечения иммунных осложнений и идиопатической нейтропении – крайне важно. Дополнительная поддерживающая терапия должна назначаться всем пациентам, которые получают противоопухолевое лечение, и прямо с момента постановки диагноза, считает профессор А.В. Снеговой. Объем и варианты поддерживающего лечения будут отличаться у разных пациентов. Но с помощью сопроводительного лечения онкологи должны не только бороться с возникшими осложнениями, но и профилактировать их. На заре развития противоопухолевого лечения многие пациенты погибали от инфекционных осложнений. И тогда европейские врачи, которые были первопроходцами этого направления медицины, поняли: для того чтобы улучшить результаты лечения, недостаточно создать новые мощные препараты, надо еще создать методологию, чтобы пациент смог перенести это мощное лечение.
Можно ли поставить знак равенства?
Можно ли поставить знак равенства между поддерживающей терапией и паллиативной помощью? Этот вопрос часто возникает у пациентов. И врач должен объяснить больному разницу.

Задача паллиативной помощи иная: улучшить качество оставшейся жизни, когда противоопухолевое лечение уже не помогает. И здесь самое важное – борьба с хроническим болевым синдромом.
Паллиативная помощь предназначена пациентам с четвертой стадией заболевания. Ее основная цель – облегчить симптомы. Вылечить пациента уже нельзя, так как болезнь достигла слишком больших размеров. Но если врачи не могут вылечить пациента, это не значит, что они не могут ему помочь.
В приказе Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. № 915н «Об утверждении Порядка оказания медицинской помощи населению по профилю „онкология“» (редакция от 04.07.2017) есть раздел «паллиативная медицинская помощь», где дается определение этому понятию. Вычленение понятия «паллиативная медицинская помощь в клинической онкологии» позволяет начать подготовку кадров этого профиля. Онколог не в состоянии решать все вопросы, касающиеся и методов лечения, и поддерживающей терапии, и паллиативной помощи. Теперь паллиативной помощью будут заниматься отдельные специалисты.
В России у истоков этой области медицины стоит заведующий кафедрой паллиативной медицины МГМСУ им. А.И. Евдокимова профессор Г.А. Новиков. Он разрабатывает паллиативную помощь на протяжении последних 30 лет, и благодаря его усилиям и работе его кафедры был принят этот закон. Первая в России кафедра паллиативной медицины была организована в 2013 г., а к марту 2018 г. ее сотрудниками было подготовлено около 2000 специалистов этого профиля. Но если поддерживающая терапия уже присутствует в клинических рекомендациях на протяжении шести лет, то рекомендации по паллиативной помощи еще только предстоит разработать.
Положение дел в Москве
Как поддерживающая терапия применяется сейчас в Москве, рассказала профессор Л.Г. Жукова.
За последние несколько лет закупка препаратов Г-КСФ для поддерживающей или, как ее еще называют, сопроводительной терапии увеличилась в полтора раза. После консультации в крупном онкологическом учреждении пациент получает рекомендации не только по тактике лечения, схеме химиотерапии, но и рекомендации по поддерживающей терапии.
У онкологов на местах есть возможность проводить коррекцию осложнений, которые возникают у пациентов. Изменилась и сама процедура применения препаратов, что позволило избавить пациентов от ежедневных визитов в клинику для их введения.
При поддержке Департамента здравоохранения г. Москвы недавно было достигнуто предварительное соглашение с Фондом обязательного медицинского страхования города Москвы о введении нового тарифа ОМС по коррекции осложнений после фебрильной нейтропении. Это очень важное достижение, поскольку пациенты, у которых развивается фебрильная нейтропения, к сожалению, оказываются самыми незащищенными. Теперь появится возможность оказывать этим пациентам качественную и своевременную помощь в рамках ОМС.
Улучшается маршрутизация больных с развившимися осложнениями. Это позволяет экстренно оказывать им неотложную помощь в случае возникновения серьезных осложнений при проведении лечения.
«Достигнуто предварительное соглашение с Фондом обязательного медицинского страхования города Москвы о введении нового тарифа ОМС по коррекции осложнений после фебрильной нейтропении».
Большое внимание уделяется и просветительской работе: пациентов обучают обращать внимание на ранние тревожные симптомы, свидетельствующие о развитии тяжелых осложнений. И инструктируют, как действовать в случае возникновения этих осложнений. Эта работа крайне важна, потому что в профилактике осложнений пациент является полноценным членом команды, которая борется за его жизнь и здоровье. Немотивированный и неподготовленный пациент может пропустить тревожные симптомы. А именно благодаря поддерживающей терапии удается «отвязать» многих пациентов от больничной койки и позволить им вести полноценную жизнь.
Возможности регионов
Но одно дело столица с ее возможностями, другое дело – регионы. Знают ли там, что такое поддерживающая терапия, и применяют ли ее? С этого года на лекарственное обеспечение онкологических пациентов государство выделило практически в два раза больше денег по сравнению с прошлым годом. Врачи имеют возможность назначать поддерживающую терапию, главное не забывать это делать.
Конечно, регионы различаются по своим возможностям. Когда в 2008–2009 гг. направление поддерживающей терапии только начинало развиваться, разница в возможностях между регионами и Москвой была колоссальной. Если в столице онкологи знали о поддерживающей терапии, то в провинции знания врачей о том, как проводить профилактику тех или иных осложнений, были практически нулевые. Но сегодня ситуация изменилась кардинально, были предприняты большие усилия по образованию врачей. Сегодня онколог может посмотреть рекомендации, что можно сделать для пациента, чтобы провести адекватную поддерживающую терапию или профилактику либо скорректировать осложнение. Все информационные возможности у регионов есть. Современные методики уже применяют врачи Санкт-Петербурга, Северо-Западного региона, ЦФО, Томска, Тюмени.
Что касается соответствия международному уровню, то те технологии и препараты, которые применяются в развитых странах, зарегистрированы и в России, говорит профессор А.В. Снеговой. И мы можем ими пользоваться. Сейчас мы являемся равноправными партнерами наших итальянских и французских коллег, у нас есть какие-то разработки, интересные для них, у них – интересные для нас. Флагмана выделить невозможно. Российская концепция поддерживающей терапии принята международным сообществом. Наша концепция – это не просто заимствованный опыт североамериканских и европейских онкологов. У нас свой большой опыт, мы одни из первых получили положительные результаты этого вида лечения. У нас есть очень интересные популяционные исследования, которых нет у зарубежных онкологов, но мы активно обмениваемся опытом и работаем вместе, то есть являемся равноправными партнерами.