Что лучше масло или семена расторопши
Что лучше масло или семена расторопши
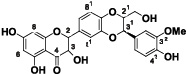
Семена расторопши пятнистой, дикорастущего, а также возделываемого в некоторых странах одно(дву)летнего травянистого растения семейства Астровых, являются сырьем для приготовления ценных гепатопротекторных препаратов (Карсил, Легалон, Силибор, Силимар, и др.) [6] и целебного жирного масла (Масло расторопши) [5]. Изучение семян растения, произрастающего в окрестности села Ннги (НКР), ранее показало его принадлежность к силидианиновой хеморасе лиловоцветковой расторопши, судя по соотношению содержания во флаволигнановом экстракте – «Силимарине» главных компонентов – силибина и силидианина (рис. 1.) [1].
Представлялось интересным изучить возможность и целесообразность получения полноценного лекарственного сырья – семян расторопши, посредством гидропонической фитотехнологии.
Материалы и методы исследования
С этой целью образцы семян силидианиновой хеморасы лиловоцветковой расторопши высеивали ранней весной на глубину 2–3 см в наполнитель (красный вулканический шлак), находящийся в делянках на открытой гидропонике. Для роста и развития растений использовали питательный раствор Давтяна [3], подаваемый периодически, в соответствии с гидропонической фитотехнологией [2, 4].
Первые всходы расторопши появились в конце апреля – начале мая, а зрелые плодоносящие корзинки в конце июля – начале августа (рис. 2).
Рис. 1. Главные флаволигнаны «Силимарина». а – силибин; б – силидианин
Визуальная оценка среднего количества корзинок, зрелых семян расторопши первого и второго года в течение вегетации свелась к следующему: у растений первого года количество плодоносящих корзинок составляет 6–8 ± 2, а у растений второго года: 19–23 ± 2; количество семян в корзинках и средняя масса семени у растений первого и второго годов одинаковы: 60 ± 10 штук и 18 ± 2 мг.
Полученные семена, после подсушивания при комнатной температуре в тонком слое, подверглись измельчению и экстрагированию по описанному методу [1] гексаном, затем этанолом,с целью выделения отдельно жирного масла и »силимарина». В качестве контроля такой же обработке подвергли образцы семян дикорастущей расторопши из трех районов Арцаха (Агдама, Гюлиджана и Храморда). Проведены и представлены сравнения количественного содержания масла и »силимарина» (табл. 1), качественные характеристики 1Н-ЯМР (спектров протонномагнитного резонанса) жирных масел (табл. 2) и сравнение методом тонкослойной хроматографии (ТСХ) выделенных «силимаринов» (рис. 3).
Содержание жирного масла и »силимарина» в семенах
Как правильно пить расторопшу для печени
[СРЕДНЕЕ ВРЕМЯ ЧТЕНИЯ: 5 МИНУТ]
Расторопша – природный гепатопротектор. Натуральные биофлавоноиды. содержащиеся в этом растении, стабилизируют мембраны печеночных клеток и защищают их от токсического действия активных форм кислорода, возникающих при воспалении или взаимодействии с тяжелыми металлами и некоторыми ядами.
В официальной медицине препараты на основе расторопши применяют с конца 60-х годов прошлого века. Помимо аптечных форм, активно используется масло расторопши и шрот – субстанция, оставшаяся после выжимки масла из семян растений. О том, как пить расторопшу, написано много, также как и о пользе её.
Когда полезна расторопша
Вот некоторые состояния, при которых полезны гепатопротекторы и, в частности, продукты из расторопши. О том же, как пить расторопшу, читайте чуть ниже.
Алкогольные эксцессы. Не обязательно быть запойным пьяницей, чтобы столкнуться с последствиями передозировки «праздничных напитков». Особенно остро проблема встает в длинные новогодние каникулы, перед майско-шашлыковыми днями. Есть смысл заблаговременно защитить печень от воздействия алкоголя в сочетании с перееданием.
Регулярный прием лекарств: нестероидных противовоспалительных (парацетамол), гормональных препаратов, антибиотиков.
Профессиональный контакт с тяжелыми металлами, продуктами переработки нефти, пластмассами. Все эти «профвредности» отражаются, в том числе, и на здоровье печени.
Вирусные гепатиты. В этом случае расторопша, не основное, а вспомогательное средство поддерживающей терапии. Отменять рекомендованное врачом лечение и самостоятельно назначать себе расторопшу недопустимо!
Масло или шрот?

Масло расторопши содержит витамины А и Е, обладающие антиоксидантными свойствами, омега-6 и омега-3 жирные кислоты, защищающие сосуды. Шрот расторопши богат незаменимыми аминокислотами, витаминами группы В, необходимыми для нормальной работы нервной системы, железом, цинком, магнием, кальцием и фосфором. В составе обоих этих продуктов достаточно биофлавоноидов, обладающих гепатопротекторными свойствами.
Шрот и масло прекрасно сочетаются: маслом можно заправлять салаты, шрот добавлять в выпечку, мясной фарш и другие блюда (не более 1,5 г. на 100 г. общего веса продуктов). Это обогатит рацион, и принесет пользу здоровью. Тем не менее, состояние организма может накладывать ограничения на диету, и это нужно учитывать, выбирая, как принимать расторопшу.
Например, любые масла (и вообще жирные блюда) противопоказаны при желчекаменной болезни, в этом случае лучше предпочесть шрот. Также масло не рекомендуется при обострении холецистита – воспалении желчного пузыря, так как оно обладает активным желчегонным действием.
[1] Л. П. Пащенко, В. Л. Пащенко. Вторичное растительное сырье – биологически активная составляющая для создания продуктов питания нового поколения. Вестник ВГУИТ, 2012.
Как правильно принимать расторопшу

Если же в подобном действии нет необходимости, масло можно добавить в салат или приготовленную кашу перед подачей на стол. Добавлять масло до полной готовности нежелательно: термообработка разрушает омега-6 жирные кислоты, которыми богато масло расторопши.
Как пить шрот расторопши. Строго говоря, именно «пить», то есть принимать ложкой и запивать водой его совершенно необязательно. Тем более, что основное действующее вещество – силибинин – жирорастворим. Поэтому оптимальней всего добавить его в продукты, уже содержащие некоторое количество жиров: те же салаты, каши, супы. Если все же хочется принимать сухой шрот, запивать лучше йогуртом, кефиром или молоком. Достаточно 1 чайной ложки в сутки.
Плоды (семена) расторопши. 1 чайную ложку измельченных семян залить стаканом горячего молока, вскипятить, дать настояться ночь, снова вскипятить, процедить. Принимать через час после еды по ¼ стакана. Или просто добавить полчайной ложки измельченных семян в любое блюдо.
Таблетки расторопши. Принимать по 2 – 3 штуки 2 – 3 раза в день во время еды.
Стоит почитать
Как выбрать интернет-магазин здорового питания среди всего их разнообразия
Флавоноиды расторопши пятнистой в лечении заболеваний печени
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
ММА имени И.М. Сеченова
П репараты расторопши пятнистой затруднительно классифицировать в какой–либо конкретной группе лекарственных средств.
Упоминая о расторопше, нередко говорят, что она обладает «гепатопротекторными» свойствами.
Однако правомерность выделения отдельного фармакологического класса «гепатопротекторов» вызывает сомнения. Само понятие «гепатопротекторы» по определению является нестрогим и достаточно произвольно трактуется разными специалистами. В наиболее распространенном понимании это класс препаратов, которые независимо от механизма действия повышают функциональную способность клеток печени к синтезу, дезинтоксикации и выведению различных биологических продуктов, поддерживают устойчивость гепатоцитов к различным патогенным воздействиям.
Общий характер названия «гепатопротекторы», по–видимому, отражает недостаточную глубину наших знаний о патогенезе болезней печени, о механизмах повреждения, регенерации, фиброза и злокачественной трансформации гепатоцитов.
Во многих справочниках и руководствах к классу «гепатопротекторов» относят активаторы синтеза белков (бемитил), витамины, предшественники нуклеиновых кислот, препараты, стимулирующие реакции детоксикации в печени (аспарагин, глутамин, цитруллин), метаболиты митохондриального дыхания (яблочная кислота, сукцинат натрия, цитохром, карнитин, аминалон), препараты, снижающие проапоптотическое воздействие желчных кислот (урсодезоксихолевая кислота), донаторы сульфгидрильных групп (S–аденозил–L–метионин), препараты эссенциальных фосфолипидов, липоевую кислоту.
В то же время уместно напомнить, что ряд препаратов этого типа (преимущественно растительного происхождения) исторически прочно заняли свое место в терапии внутренних болезней.
Среди «гепатопротекторов» весьма заметную долю занимают препараты, содержащие естественные или полусинтетические флавоноиды расторопши пятнистой (Silybum marianum). Главным действующим компонентом в них является силимарин.
Силимарин представляет собой смесь трех основных изомерных соединений – силикристина, силидианина и силибинина. Последний превалирует по количественному содержанию и обладает наиболее высокой биологической активностью.
Действительно ли препараты расторопши пятнистой способны оказывать лечебное воздействие при заболеваниях печени?
Положительное воздействие силимарина при болезнях печени традиционно связывают с выраженным антиоксидантным потенциалом, а также так называемым «мембраностабилизирующим» действием.
Роль окислительного стресса в патогенезе заболеваний печени интенсивно изучается в последние годы. Выработка активных форм кислорода (перекисей, супероксид–анион–радикалов) – обычное явление в процессе клеточного дыхания, однако содержание их чрезмерно возрастает в условиях алкогольной интоксикации, при повреждении печени и воспалении, дефиците антиоксидантов, гипоксии, воздействии некоторых лекарств. Повышенная выработка свободных радикалов сопровождается повреждением клеточных органелл и макромолекул (ДНК, белков и липидов, антиоксидантных систем). При окислительном стрессе продукты перекисного окисления играют важную роль в фиброгенезе, активируя звездчатые клетки печени и повышая продукцию внеклеточного матрикса.
К внутриклеточным «защитным молекулам», препятствующим развитию реакций перекисного окисления, относятся ферменты супероксиддисмутаза, каталазы, глутатионпероксидаза, металлосвязывающие белки, молекулы – «уборщики свободных радикалов» (глутатион, убихиноны, мочевая кислота, аскорбиновая кислота и токоферол, липоевая кислота, селен, рибофлавин, цинк, каротиноиды). Обмен различных антиоксидантов тесно взаимосвязан.
В условиях воспаления печени источником выработки активных форм кислорода служат клетки воспалительного инфильтрата.
Кроме того, одним из универсальных механизмов повреждения клеток при заболеваниях печени служит нарушение функции митохондрий.
При воздействии на клетку некоторых веществ, таких как фактор некроза опухоли–a (TNFa), этанол, а также в условиях избыточного накопления железа и меди происходит нарушение процесса окислительного фосфорилирования в митохондриях, что сопровождается развитием энергетического дефицита и гибелью клеток.
Дезорганизация мембран митохондрий в условиях перекисного окисления может сопровождаться «утечкой» цитохрома С в цитоплазму, активацией процесса программированной гибели клеток.
Несмотря на то, что современные научные данные, касающиеся значения свободнорадикальных процессов в патогенезе заболеваний печени, нередко оказываются противоречивыми, все же в определенных клинических ситуациях отрицательная патогенетическая роль нарушения функции митохондрий, клеточного дыхания и развития перекисного окисления липидов не вызывает сомнений. Это прежде всего алкогольная болезнь печени, неалкогольный стеатогепатит, внутрипеченочный холестаз беременных, некоторые случаи токсического поражения печени.
Антиоксидантный эффект силимарина обусловлен его взаимодействием со свободными радикалами в печени и превращением их в менее агрессивные соединения. Тем самым прерывается процесс перекисного окисления липидов и не происходит дальнейшего разрушения клеточных структур. Способность взаимодействия с активными формами кислорода обусловлена наличием фенольной структуры в молекуле силибинина.
Антиоксидантное действие силимарина и торможение реакций перекисного окисления отчетливо продемонстрировано in vitro. Флавоноиды расторопши проявляют в 10 раз более высокую антиоксидантную активность, чем токоферол.
Благодаря наличию антиоксидантных свойств препараты расторопши проявляют противовоспалительную активность. Лечебное действие силибинина продемонстрировано в моделях токсического поражения печени у крыс, вызванного введением тетрахлорметана. В остром эксперименте при разовом введении тетрахлорметана назначение флавоноидов расторопши сопровождалось отчетливым снижением степени выраженности цитолиза и холестаза. В хроническом эксперименте с тетрахлорметаном введение силибинина также способствовало значительному снижению выраженности цитолиза и холестаза.
Отнюдь не случайно рабочим вредных химических производств рекомендуется профилактический прием силимарина 1 раз в день.
Наиболее разительное лечебное действие оказывают флавоноиды расторопши при алкогольной болезни печени.
Венгерский исследователь Muzes G. и соавт. в двойном слепом исследовании показали, что силимарин оказывает положительный клинический эффект при алкогольной болезни печени, по–видимому, обусловленный антиоксидантным действием данного вещества. Назначение силимарина в суточной дозе 420 мг в сутки в течение 6 мес. сопровождалось биохимическими изменениями в организме, которые косвенно свидетельствуют о нарастании антиоксидантного потенциала клеток и сыворотки крови. Так, отмечалось значительное возрастание активности супероксиддисмутазы в энтероцитах и лимфоцитах (при исходно сниженных значениях), повышение активности глутатионпероксидазы и содержания веществ с сульфгидрильными группами в сыворотке. Одновременно имело место существенно снижение концентрации веществ, проявляющих свойства окислителей (малондиальдегида и др.), в сыворотке крови.
При вирусном гепатите С, по мнению Berkson B.M., назначение «тройной антиоксидантной схемы» (тиоктовая кислота, силимарин, селен) представляет собой достаточно дешевый и безопасный метод патогенетического лечения вирусного гепатита С и торможения прогрессирования поражения печени до стадии цирроза. Антиоксидантный эффект терапии способствует подавлению воспалительно–некротической реакции в печени, торможению развития фиброза и снижает риск злокачественной трансформации гепатоцитов.
Ряд авторов считает целесообразным назначение силимарина пациентам, страдающим гепатитом С, при необходимости приема препаратов, способных снижать антиоксидантный потенциал гепатоцитов (например, ацетаминофена).
При внутрипеченочном холестазе беременных применение силимарина позволяет добиться уменьшения выраженности кожного зуда.
Силимарин «стабилизирует» мембраны гепатоцитов, снижая восприимчивость клеток к некоторым патогенным воздействиям.
Блокада фосфодиэстеразы под действием флавоноидов расторопши способствует замедлению распада циклического аденозинмонофосфата (цАМФ), и, как следствие, понижению содержания кальция внутри клеток, угнетению кальций–зависимого процесса активации фосфолипаз.
Важной направленностью метаболического действия флавоноидов расторопши также является способность стимулировать синтез белков и поддерживать процесс регенерации гепатоцитов. Силибинин стимулирует РНК–полимеразу I в ядре клетки, активирует транскрипцию и скорость синтеза РНК.
При этом скорость транскрипции ДНК в малигнизированных клетках, а также скорость их деления не повышается, что исключает возможность стимуляции опухолевого роста при назначении препаратов расторопши.
Имеются данные о замедлении темпов прогрессирования фиброза печени на фоне длительного приема силибинина.
К сожалению, противовоспалительное и антифибротическое действие препаратов расторопши в настоящее время не подтверждены результатами мультицентровых рандомизированных контролируемых исследований, а имеющиеся данные получены по результатам отдельных наблюдений. Эффективность силимарина должна быть оценена согласно принципам медицины, основанной на доказательствах.
Производные расторопши пятнистой целесообразно назначать пациентам, страдающим заболеваниями печени (преимущественно хроническими): стеатозом печени, острым или хроническим гепатитом, циррозом различной этиологии. Следует соблюдать осторожность при их назначении больным с отчетливо выраженным внутрипеченочным холестазом: имеются сведения о возможности нарастания застоя желчи под действием препаратов.
Отмечено, что как острые, так и хронические заболевания печени достаточно часто сопровождаются развитием сопутствующей дискинезии желчевыводящих путей. Дискинезия желчевыводящих путей и является ведущей причиной появления болевых ощущений в эпигастральной области и правом подреберье при стеатозе, гепатите и циррозе печени, нередко с характерной иррадиацией в правую половину грудной клетки, правую лопатку и отчетливой связью с приемом жирной, жареной пищи.
Развитие нарушений моторики желчных путей нередко диктует необходимость назначения пациенту препаратов, обладающих мягким спазмолитическим действием на гладкомышечные клетки билиарной системы.
Силимарин непосредственно обладает желчегонными свойствами благодаря наличию у него одновременно холеретического и холекинетического действия. Холерез развивается благодаря повышению секреции желчных кислот и электролитов гепатоцитами. Холекинетический эффект связан со снижением тонуса сфинктеров желчевыводящих путей.
Однако многие из препаратов, главным действующим началом которых являются флавоноиды расторопши, содержат в своем составе компоненты других лекарственных растений, обладающие комбинированным воздействием на состав и отток желчи: умеренным желчегонным, спазмолитическим, противовоспалительным и антисептическим действием.
Главное действующее вещество из семейства лекарственных флавоноидов расторопши – силибинин – входит в состав различных препаратов: Сибектан, Легалон, Сиромин и др. Различия между этими препаратами состоят в количественных соотношениях флавоноидов, а также в сочетаниях расторопши с другими средствами, как правило, обладающими желчегонным или антисептическим эффектом.
Препарат Сибектан содержит в своем составе сухой экстракт из пижмы, плодов расторопши пятнистой, зверобоя и березы.
Трава зверобоя содержит дубильные вещества группы катехинов (танины, флавоноиды, эфирные масла), которые оказывают вяжущее и противовоспалительное действие на слизистую оболочку желудочно–кишечного тракта.
Цветки пижмы также содержат различные флавоноиды, эфирные масла и органические кислоты, которые оказывают желчегонное действие (повышают сократительную активность желчного пузыря).
Экстракт листьев березы также оказывает антисептическое, мягкое желчегонное и отчетливое мочегонное действие.
Сибектан успешно применяется в терапии хронического холецистита, гипотонической дискинезии желчного пузыря. Его назначают при гепатитах и циррозах печени с целью профилактики прогрессирования процесса.
Учитывая наличие в составе препарата веществ с достаточно выраженной холекинетической активностью, способных усиливать моторную функцию желчного пузыря, Сибектан следует назначать с осторожностью при желчно–каменной болезни.
Препараты флавоноидов расторопши пятнистой назначают главным образом перорально, за полчаса до приема пищи. Они быстро и полно всасываются из желудочно–кишечного тракта. Связывание с белками плазмы слабое. Выводятся преимущественно с желчью, в меньшей степени – с мочой; период полувыведения составляет около 6 ч. Активно включаются в энтерогепатическую циркуляцию, что представляется выгодным фармакокинетическим параметром.
Продолжительность курсов лечения – от 25 дней до 1,5 месяцев. Возможны повторные курсы.
В многочисленных исследованиях установлено, что препараты расторопши относятся к категории малотоксичных веществ и в терапевтических дозах не оказывают повреждающего действия на основные органы и системы организма животных и человека.
При назначении следует учитывать возможность развития аллергических реакций на растительные компоненты.
1. ФАРМиндекс: ПРАКТИК, выпуск 3 – СПб.: ООО «ФАРМиндекс», 2002 –136 с.
2. Berkson BM. A conservative triple antioxidant approach to the treatment of hepatitis C. Combination of alpha lipoic acid (thioctic acid), silymarin, and selenium: three case histories. Med Klin 1999 Oct 15;94 Suppl 3:84–9.
3. Deak G, Muzes G, Lang I, et al. Immunomodulator effect of silymarin therapy in chronic alcoholic liver diseases. Orv Hetil 131:1291–1292;1990.
4. Feher J, Deak G, Muzes G, et al. Liver–protective action of silymarin therapy in chronic alcoholic liver diseases. Orv Hetil 130:2723–2727; 1989.
5. Ferenci P, Dragosics B, Dittrich H, Frank H, et al. Randomized controlled trial of silymarin treatment in patients with cirrhosis of the liver. J Hepatol 9:105–113; 1989.
6. Lang I, Nekam K, Deak G, et al. Immunomodulatory and hepatoprotective effects of in vivo treatment with free radical scavengers. Ital J Gastroenterol 22:283–7; 1990.
7. Magliulo E, Gagliardi B, Fiori GP. Results of a double blind study on the effect of silymarin in the treatment of acute viral hepatitis, carried out at two medical centres. Med Klin 73:1060–1065; 1978.
8. Muzes G, Deak G, Lang I, et al. Effect of silimarin (Legalon) therapy on the antioxidant defense mechanism and lipid peroxidation in alcoholic liver disease (double blind protocol). Orv Hetil 131:863–866; 1990.
9. Reyes H, Simon FR. Intrahepatic cholestasis of pregnancy: an estrogen–related disease. Semin Liver Dis 13:289–301; 1993.
10. Salmi HA, Sarna S. Effect of silymarin on chemical, functional, and morphological alterations of the liver. A double–blind controlled study. Scand J Gastroenterol 17:517–521; 1982.
Принципы выбора гепатопротекторов в практике терапевта
Предложен подход этапного применения гепатопротекторов, основанный на собственном клиническом опыте, данных доказательной медицины и знаниях об универсальной этапности течения хронических заболеваний печени, что дает реальную возможность повысить эффектив
Approach of phased application of hepatoprotectors was suggested basing on personal clinical experience, data of evidence based medicine and knowledge about universal sequence of clinical course of chronic liver diseases, which makes it really possible to increase efficiency of their treatment, especially in terms of fibrous changes of this organ.
На сегодняшний день заболевания печени широко распространены среди населения Земли. Данный факт обусловлен сохраняющимся ростом вирусных, токсических, лекарственных, аутоиммунных воздействий на орган и, что особенно актуально в последнее время, метаболических расстройств на фоне ожирения и сахарного диабета [1, 2].
В своей клинической практике врач-терапевт часто соприкасается с проблемой поражения печени у пациента как в рамках основной патологии, так и в качестве сопутствующего заболевания. При этом у больного может не быть специфических жалоб и болезнь печени диагностируется случайно при выявлении гепатомегалии и/или изменений биохимических печеночных проб.
Нередко, еще на этапе нозологической диагностики заболевания печени, таким пациентам назначаются гепатотропные препараты, часто называемые гепатопротекторами, выбор которых осуществляется, как правило, эмпирически или, в лучшем случае, с учетом синдромального подхода.
По имеющемуся определению, гепатопротекторы — это лекарственные средства, чье воздействие направлено на восстановление гомеостаза в гепатоцитах, способствующее повышению устойчивости органа к влиянию патогенных факторов, нормализации функциональной активности и стимуляции репаративно-регенераторных процессов в печени [3]. К сожалению, до настоящего времени не сформировано окончательное суждение о границах применения, эффективности и безопасности этих препаратов, что обусловлено недостаточным числом контролируемых клинических исследований (КИ), отвечающих современным принципам доказательной медицины.
В клинической практике в большинстве случаев гепатопротекторы используются:
Механизмы действия гепатопротекторов хотя отличаются большим разнообразием, однако могут быть сведены к нескольким ключевым, определяющим развитие фармакологических и клинических эффектов (табл. 1).
Заметим, что единой общепринятой классификации гепатопротекторов на сегодняшний день не существует. Наиболее часто их разделяют в зависимости от происхождения, состава и механизма действия. С. В. Оковитым была предложена классификация гепатопротекторов, в нее вошли препараты, для которых гепатотропное действие является основным, преобладающим или имеющим самостоятельное клиническое значение (рис. 1) [3, 4].
Применение препаратов этой группы в клинической практике крайне широко, поэтому ниже будет дана характеристика только наиболее часто используемых из них.
1. Препараты растительного происхождения
1.1. Препараты, содержащие извлечения из расторопши (Легалон, Силимар, Карсил, Гепабене), в качестве действующего вещества имеют флавоноид силимарин, представляющий собой смесь трех основных изомерных соединений: силибинина, силикристина и силидианина. Силибинин является основным компонентом не только по содержанию, но и по клиническому действию. Учитывая, что семена расторопши отличаются по накоплению основных биологически активных веществ в зависимости от условий произрастания и принадлежности к одной из хеморас (силибининовой или силидианиновой) [5], в клинике целесообразно применять только стандартизированные по силибинину препараты.
Основные КИ по силибинину проводились с использованием его лекарственной формы для внутривенного введения (дигидросукцината натриевая соль). Наиболее изучен данный препарат был при лечении хронического вирусного гепатита С (ХГС) у пациентов, не ответивших на стандартную терапию интерфероном/рибавирином. В этом случае он оказывал антицитолитический эффект и иногда позволял снизить вирусную нагрузку [6]. Однако, учитывая появление новых средств для безинтерфероновой терапии ХГС, перспективы применения препарата по этому направлению сомнительны.
При алкогольном и неалкогольном циррозе печени (ЦП) в одном исследовании внутривенное введение этого лекарственного средства также продемонстрировало увеличение выживаемости [7], тогда как в другом этот показатель не достиг статистической значимости [8].
Пероральные формы силибинина изучались при алкогольной жировой болезни печени (АЖБП), однако значимого влияния на смертность, гистологическую картину и лабораторные тесты получено не было [9, 10]. При неалкогольной жировой болезни печени (НЖБП) применение препарата в комбинации с эссенциальными фосфолипидами (ЭФЛ) и токоферолом (ВитЕ) позволило достичь уменьшения цитолиза, нормализации индекса НОМА, уменьшения выраженности стеатоза печени (по данным ультразвукового исследования (УЗИ)) [11].
Вероятно, окончательное суждение о возможностях применения силибинина при различной патологии печени можно будет сделать после проведения дополнительных КИ.
1.2. Препараты, содержащие извлечения из солодки (Фосфоглив), продемонстрировали в различных КИ антифибротическую, противовоспалительную и антистеатозную активность, в первую очередь, благодаря содержанию в них глицирризиновой кислоты (ГК).
При ХГС как внутривенное применение, так и комбинированное внутривенное и пероральное применение ГК позволяло добиться более выраженного снижения индекса гистологической активности у пациентов со 2-м и 3-м генотипом ХГС при более быстрой положительной динамике биохимических и гистологических параметров без влияния на вирусную нагрузку [12, 13]. Эти данные позволили включить Фосфоглив в национальные рекомендации по лечению ХГС в качестве адъювантного средства для пациентов, не ответивших на стандартную терапию интерфероном/рибавирином [14]. Исследования, проведенные в азиатской популяции, свидетельствуют, что длительное применение глицирризината способствовало снижению вероятности развития гепатоцеллюлярной карциномы (ГЦК) у пациентов с ХГС, особенно не отвечающих на лечение интерферонами [15].
Недавно получены данные по эффективности последовательного (в/в, затем перорально) применения глицирризин-содержащих препаратов при НЖБП и АЖБП. При НЖБП 12-недельное применение Фосфоглива позволило достичь антицитолитического эффекта и снижения индекса NAFLD fibrosis score [16]. У больных с АЖБП использование препарата в течение не менее 24 недель приводило к снижению уровня аспартатаминотрансферазы (АСТ) в крови, уменьшению индекса гистологической активности и фиброза в печени (ФП), а также поддержанию абстиненции [17, 18].
1.3. Препараты, содержащие извлечения из других растений (экстракт листьев артишока, Лив.52 и др.), широко применяются в клинической практике как гепатотропные препараты с плейотропными эффектами.
Анализ применения препаратов этой группы у пациентов с различной патологией печени и желчевыводящих путей свидетельствует об их эффективности (по влиянию на суррогатные точки терапии), в первую очередь при наличии сопутствующей моторной дискинезии желчевыводящих путей. Это обусловлено тем, что для многих растительных препаратов характерно сочетание свойств холагога (увеличение продукции желчи), холеретика (повышение текучести желчи) и холекинетика (стимулирует сократимость желчевыводящих путей). При АЖБП и НЖБП, а также при ЦП препараты не продемонстрировали высокой эффективности [19, 20].
Экстракт листьев артишока (Хофитол) обладает дополнительным детоксицирующим и диуретическим действием и может назначаться в период беременности.
2. Препараты животного происхождения (Гепатосан, Прогепар) в настоящее время используются значительно реже, чем другие гепатотропные препараты, из-за ограниченного числа КИ, позволяющих оценить их клиническую эффективность. По данным небольших исследований, Гепатосан способен ограничивать цитолиз, усиливать протеинсинтетическую способность печени [21]. Прогепар при НЖБП (60 дней лечения) может несколько уменьшать выраженность цитолиза и холестаза, повышать качество жизни и уменьшать размеры печени [22].
3. Препараты, содержащие эссенциальные фосфолипиды (ЭФЛ) (Эссенциале Н, Эссливер, Резалют Про) являются одной из наиболее часто назначаемых в России групп гепатопротекторов. Несмотря на то, что по ЭФЛ проведено огромное число КИ, различия в дизайне их проведения и качестве исследований не позволяют сделать однозначный вывод об их эффективности.
ЭФЛ обладают преимущественно антицитолитическим действием. Обязательным условием их эффективного применения является использование адекватно высоких доз (1,8 г/сут перорально или 1,0 г/сут в/в) при достаточной длительности курсов лечения [23, 24]. Следует помнить, что внутривенная форма Эссенциале Н содержит дезоксихолевую кислоту как солюбилизатор (115 мг/5 мл), поэтому парентеральное применение препарата больше 2–4 недель нежелательно. В некоторых исследованиях показано негативное влияние парентеральных форм данных гепатопротекторов на синдром холестаза. В связи с этим авторами рекомендуется взвешенное отношение к применению ЭФЛ.
Обнадеживающие данные по применению ЭФЛ получены при НЖБП. Показано, что прием препарата в дозе 1,8 г/сут 24 недели, затем 900 мг в течение 48 недель дает удовлетворительный клинический ответ у 81% пациентов, способствует снижению цитолиза, выраженности стеатоза и фиброза у 29,2% больных. Однако прекращение лечения приводит к рецидиву заболевания [24, 25].
Клинические исследования ЭФЛ при АЖБП с длительным приемом (2 года) не показали их влияния на процессы фиброзирования в печени, хотя благоприятное влияние на уровни трансаминаз и билирубина сохранялось [26, 27].
4. Препараты с преимущественным детоксицирующим действием не являются классическими гепатопротекторами, но обладают способностью уменьшать токсемию, связанную с ПКН, за счет снижения образования или увеличения утилизации эндогенных токсикантов.
4.1. Препараты с прямым детоксицирующим действием (Орнитин-аспартат, Глутамин-аргинин) усиливают метаболизм аммиака в печени и головном мозге и тем самым уменьшают проявления печеночной энцефалопатии (ПЭ). Эффективность различных лекарственных форм орнитин-аспартата при ПЭ зависит от тяжести состояния больного и составляет от 40% при тяжелой энцефалопатии до 70–90% при легкой [28]. Собственно гепатопротекторное действие препарата (антицитолитический и антихолестатический эффекты, нормализация белковосинтетической функции печени) уступает по выраженности детоксикационному эффекту.
4.2. Препараты с непрямым детоксицирующим действием уменьшают образование эндогенных токсинов (лактулоза, лактитол), активируют образование метаболитов, оказывающих детоксицирующее действие (адеметионин, Ремаксол) или ускоряют метаболизм токсикантов (метадоксин, фенобарбитал).
Лактулоза и лактитол, оказывая гипоаммониемическое действие за счет подавления образования аммиака кишечными бактериями, нашли свое применение у больных с ПЭ. При их использовании снижение концентрации аммиака в крови достигает 25–50%, что сопровождается уменьшением выраженности ПЭ, улучшением психического состояния и нормализацией электроэнцефалограммы примерно у 60–70% больных.
Адеметионин (SAM) также является одним из наиболее часто применяемых гепатопротекторов, благодаря наличию у него детоксицирующего, антихолестатического, умеренного холеретического (холагога) и антидепрессивного действия. По антихолестатическому и антицитолитическому эффекту препарат уступает урсодезоксихолевой кислоте (УДХК), хотя может уменьшать зуд с такой же эффективностью, как и УДХК.
В нашей стране применение препарата одобрено при ХГС в качестве препарата с антидепрессивным действием при комбинированной интерферон/рибавириновой терапии. Кроме того, он представляет интерес как средство базисной терапии при лекарственных поражениях печени.
Наибольшую эффективность адеметионин продемонстрировал при алкогольном ЦП (класс А-В по классификации Чайлда-Пью), позволив добиться снижения комбинированного показателя по смертности и частоте трансплантации печени за 2 года (16% vs 30%) [29]. При НЖБП эффективность препарата оказалась не так высока, как ожидалось [30–33, 55].
Ремаксол — инфузионный гепатотропный препарат, сочетающий свойства сукцинатсодержащего корректора митохондриальной дисфункции и сбалансированного полиионного раствора (в состав которого дополнительно введены метионин, инозин и никотинамид). Наиболее заметное действие он оказывает на проявления токсемии, а также цитолиза и холестаза, что позволяет его использовать в качестве универсального гепатотропного препарата при различных поражениях печени как в лечебных, так и в лечебно-профилактических схемах. Его эффективность установлена при ХГС, лекарственных (противотуберкулезными агентами) и токсических (этанолом) поражениях печени [34, 35]. Подобно экзогенно вводимому SAM, Ремаксол обладает мягким антидепрессивным и антиастеническим эффектом.
Метадоксин (Метадоксил) обладает направленным спектром действия, оказывая эффект при алкогольных поражениях печени за счет ускорения метаболизма и выведения продуктов распада алкоголя. При АЖБП применение метадоксина (перорально 1500 мг/сут) приводило к небольшому, но достоверному антицитолитическому и антихолестатическому эффектам, уменьшению выраженности жировой инфильтрации печени (по данным УЗИ) [36]. Обнадеживающие результаты метадоксин показал при лечении алкогольных гепатитов [37].
Фенобарбитал используется преимущественно при функциональных гипербилирубинемиях в качестве индуктора ферментов микросомального окисления в печени.
5. Препараты желчных кислот (урсодезоксихолевая кислота (УДХК), обетихолевая кислота) в настоящее время выделены в отдельную группу гепатопротекторов, благодаря их широкому спектру действия и наличию важных плейотропных эффектов. У этих препаратов описаны цитопротективное, антиапоптотическое, антихолестатическое, холеретическое, антифибротическое, иммуномодулирующее, литолитическое действие. УДХК является единственным препаратом, показавшим эффективность при тяжелых холестатических заболеваниях печени (первичный билиарный цирроз, первичный склерозирующий холангит) [38, 39]. В собственных исследованиях мы использовали препарат Урдокса, представляющий собой качественный препарат УДХК с биэквивалентностью, адекватной оригинальному препарату.
При НЖБП применение УДХК (а) снижает выраженность цитолиза и холестаза, уменьшает степень стеатоза (по данным гистологического исследования в некоторых КИ). При этом достичь такого результата удалось не во всех исследованиях, что не позволяет однозначно рекомендовать препарат при этой патологии [40]. УДХК (Урдокса) также рекомендуется в качестве терапии сопровождения при профилактике и лечении поражений печени на фоне терапии статинами [41].
Большие надежды возлагаются на селективный агонист фарнезоидных (FXR) рецепторов с антихолестатическими и гепатопротективными свойствами — обетихолевую кислоту, показавшую лучшие результаты в лечении больных с НЖБП и сахарным диабетом второго типа [42].
6. Препараты разных групп (тиоктовая (альфа-липоевая) кислота, Тиотриазолин) пока не имеют достаточной доказательной базы в КИ для того, чтобы сформировать мнение об их эффективности и безопасности при различной патологии печени.
Завершая краткую характеристику отдельных групп и препаратов, следует подчеркнуть, что для них характерны различные механизмы действия и фармакологические эффекты, что накладывает отпечаток на их влияние на основные клинико-биохимические синдромы поражения печени (табл. 2).
Обращает на себя внимание, что большинство гепатопротекторов обладает множественными эффектами, что дает возможность их назначения при сочетании клинико-морфологических синдромов поражения печени. К лекарственным средствам с наиболее широким спектром доказанного действия относятся Фосфоглив, УДХК, адеметионин и Ремаксол.
Учитывая, что гепатопротекторы обладают зачастую одновременно несколькими фармакологическими эффектами, у практикующих специалистов нередко возникают вопросы, ответы на которые являются принципиальными при выборе терапии:
1) В каких клинических ситуациях обязательно должны применяться гепатопротекторы?
2) Что представляют собой по составу конкретные гепатопротекторы, какова их доказанная эффективность и безопасность при поражениях печени различной этиологии?
3) Как сориентироваться в имеющемся арсенале данных лекарственных средств, а также их дженериках и каковы наиболее оптимальные схемы их применения?
4) Существуют ли универсальные гепатопротекторы?
5) Какой препарат можно безопасно назначить пациенту с полиморбидным фоном?
6) Надо ли назначать гепатопротекторы с различными механизмами действия одновременно и какие комбинации данных средств целесообразны?
7) Какова этапность лечения гепатопротекторами и какова длительность их применения?
Чтобы ответить на все эти вопросы, прежде всего следует определиться в приоритетности терапии заболеваний печени в целом.
Как известно, феноменология болезней печени включает последовательные этапы прогрессирования в зависимости от стадии фиброзных изменений и, что важно, вне прямой связи с этиологией.
Т. е. все варианты хронических поражений печени развиваются по «универсальным» стадиям, проходя в начале этапы повреждения, далее различных стадий ФП и последующего ЦП (рис. 2).
Таким образом, общая цель при лечении всех заболеваний печени — предотвратить развитие и прогрессирование фиброгенеза, в том числе и на этапе ЦП, так как на этой стадии значимо возрастают риски трансформации в ГЦК.
Соответствующими точками приложения гепатопротекторов при этом являются как отдельные синдромы поражения органа в виде жирового гепатоза (ЖГ), воспаления (гепатита), нарушения оттока желчи (холестаза), так и базисные процессы в виде торможения прогрессирования ФП и ЦП, с последующим снижением риска формирования ГЦК.
Принципиальной точкой зрения авторов является определение этапного подхода гепатопротективной терапии с формированием приоритетности выбора конкретного лекарственного средства в зависимости от стадии хронического заболевания печени.
Исходя из этого можно выделить следующие этапы гепатопротективной терапии:
I. Инициальный этап — направлен на экстренное «протезирование» метаболических процессов печени и купирование основных клинико-биохимических синдромов (см. табл. 2). Во время этого этапа осуществляются коррекция митохондриальной дисфункции и системы эндогенной детоксикации, восстановление мембран гепатоцитов, подавление ПОЛ, разрешение холестаза и ПКН. Данный этап служит подготовкой к базисной терапии заболевания печени и может продолжаться примерно от 2 до 8 и более недель.
II. Базисный этап — предусматривает прежде всего профилактику развития и лечение ФП и ЦП.
III. Поддерживающий этап — определен основным патогенетическим синдромом, не купированным на предыдущих этапах, и ассоциированными клиническими состояниями (АКС). Примерами АКС могут служить эндотелиальная дисфункция (ЭД) и дислипидемия при НЖБП, иммунопатологический синдром при вирусных гепатитах, депрессивные расстройства при любых заболеваниях печени. Цель данного этапа — селективное «протезирование» не восстановившихся метаболических функций гепатоцитов. Данный этап проводится пролонгированно (иногда неопределенно долго) или по требованию.
Исходя из концепции ФП как базового процесса прогрессирования всех хронических поражений печени, при выборе приоритетных направлений на первом, инициальном, этапе терапии все основные клинико-биохимические синдромы следует рассмотреть с точки зрения их влияния на фиброгенез.
Как известно, наиболее значимым, независимым фактором прогрессирования ФП, кроме синдрома цитолиза, является внутрипеченочный холестаз. При этом большинство имеющихся шкал прогноза пациентов с ЦП (Мэддрей, МЭЛД, Глазго) для оценки риска декомпенсации включают показатели холестаза.
Т. е. все заболевания печени, сопровождаемые внутрипеченочным холестазом (гепатиты вирусной, алкогольной, лекарственной, аутоиммунной этиологии, первичные билиарный цирроз и склерозирующий холангит), требуют особого внимания, поскольку именно холестаз является крайне неблагоприятным прогностическим фактором, приводящим к быстрому развитию ФП, а иногда и ЦП уже через 3–5 лет при отсутствии его лечения. На фоне холестаза в печени возникает повреждение мембран митохондрий, микротрубочек, каналикул, активация гидролаз, некроз гепатоцитов, происходит ингибирование регенерации, cтимуляция апоптоза гепатоцитов и их иммунное повреждение за счет активации экспрессии антигенов класса II HLA [43].
Поэтому гепатопротекторами для первого этапа, при наличии внутрипеченочного холестаза, являются лекарственные средства, имеющие доказанную эффективность при этом синдроме, а именно УДХК (Урдокса), адеметионин и Ремаксол. Причем в случае внутриклеточного холестаза могут применяться все три препарата как средства, улучшающие функционирование транспортных систем желчных кислот на уровне микротрубочек гепатоцитов. При дуктулярном холестазе наиболее предпочтительно применение УДХК (Урдокса). По сути, она является единственным лекарственным средством, устраняющим любые виды внутрипеченочного холестаза, за счет активации кальцийзависимой альфа-протеинкиназы, стимуляции экзоцитоза в гепатоцитах и индукции холереза, богатого бикарбонатами, что приводит к увеличению пассажа желчи и выведению токсичных желчных кислот через кишечник.
Для второго, базисного, этапа наиболее перспективным гепатопротектором, обладающим прямым антифибротическим и антипролиферативным действием, на сегодняшний день представляется Фосфоглив. Благодаря содержанию в нем оптимальной комбинации основного антифибротического агента — ГК и антицитолитической составляющей — фосфатидилхолина.
* ГБОУ ВПО СПбГМУ им. И. П. Павлова МЗ РФ, Санкт-Петербург
** ГБОУ ВПО Санкт-Петербургская ГХФА МЗ РФ, Санкт-Петербург




_575.gif)
_575.gif)
_575.gif)
.gif)