Что может растворяться в воде
Растворимость
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Растворимость веществ в различных растворителях меняется в широких пределах.
В таблице приведена растворимость некоторых веществ в воде при 20 o С:
Растворимость, г на 100 г H2O
Растворимость, г на 100 г H2O
От чего же зависит растворимость веществ? От ряда факторов: от природы растворенного вещества и растворителя, от температуры и давления. В справочных таблицах предлагается вещества делят на хорошо растворимые, малорастворимые и нерастворимые. Такое деление очень условное, поскольку абсолютно нерастворимых веществ нет. Даже серебро и золото растворимы в воде, однако их растворимость настолько мала, что можно пренебречь ей.
Зависимость растворимости от природы растворенного вещества и растворителя*
Большинство солей щелочных металлов и аммония хорошо растворимы в воде. Хорошо растворимы почти все нитраты, нитриты и многие галогениды (кроме галогенидов серебра, ртути, свинца и таллия) и сульфаты (кроме сульфатов щелочноземельных металлов, серебра и свинца). Для переходных металлов характерна небольшая растворимость их сульфидов, фосфатов, карбонатов и некоторых других солей.
Растворимость газов в жидкостях также зависит от их природы. Например, в 100 объемах воды при 20 o С растворяется 2 объема водорода, 3 объема кислорода. В тех же условиях в 1 объеме Н2О растворяется 700 объемов аммиака.
Влияние температуры на растворимость газов, твердых веществ и жидкостей*
Растворение газов в воде вследствие гидратации молекул растворяемого газа сопровождается выделением теплоты. Поэтому при повышении температуры растворимость газов понижается.
Влияние давления на растворимость газов, твердых веществ и жидкостей*
На растворимость твердых и жидких веществ в жидкостях давление практически не оказывает влияния, так как изменение объема при растворении невелико. При растворении газообразных веществ в жидкости происходит уменьшение объема системы, поэтому повышение давления приводит к увеличению растворимости газов. В общем виде зависимость растворимости газов от давления подчиняется закону У. Генри (Англия, 1803 г.): растворимость газа при постоянной температуре прямо пропорциональна его давлению над жидкостью.
Закон Генри справедлив лишь при небольших давлениях для газов, растворимость которых сравнительно невелика и при условии отсутствия химического взаимодействия между молекулами растворяемого газа и растворителем.
Влияние посторонних веществ на растворимость*
В присутствии в воде других веществ (солей, кислот и щелочей) растворимость газов уменьшается. Растворимость газообразного хлора в насыщенном водном растворе поваренной соли в 10 раз меньше. Чем в чистой воде.
Эффект понижения растворимости в присутствии солей называется высаливанием. Понижение растворимости обусловлено гидратацией солей, что вызывает уменьшение числа свободных молекул воды. Молекулы воды, связанные с ионами электролита, уже не являются растворителем для других веществ.
Примеры задач на растворимость
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9г соли в 100г воды?
Ответ: 194,95 г
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36г соли в 100г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
Вода как растворитель играет предельно важную роль далеко не только в плане нашего быта. Исследователи давно говорят, что данное волшебное соединение является основой для образования жизни вообще. И именно поэтому его наличие выступает обязательным условием для существования чего-то более сложного, нежели неживая природа.
Растворимость тех или иных химических элементов напрямую связана с существованием воды, так как она чаще всего выступает той средой, которая преобразует все вокруг себя и создает новые формы органической и неорганической материи.
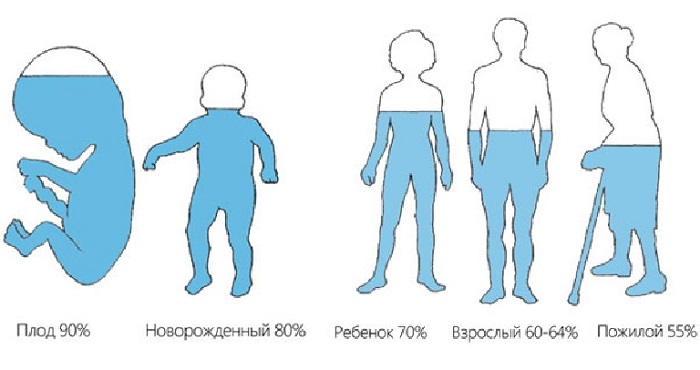
Человек примерно на 70% состоит из воды (имеется ввиду кровь, межклеточная жидкость, плазма крови и прочие вещества), у большинства других существ этот показатель колеблется от 50 до 95%. Очевидно, что свойства данного соединения оказывают решающую роль на происходящие вокруг нас и внутри нас процессы синтеза, регенерации и многие другие.
Это универсальный растворитель, который буквально формирует окружающий мир, постоянно преображает и обновляет его!
Свойства воды как растворителя
Вода – сложное вещество, отличающееся многими уникальными характеристиками, которые нельзя встретить больше нигде.
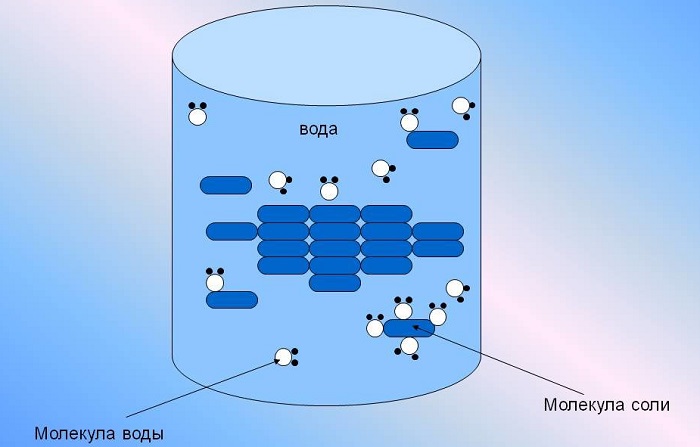
Она способна растворить большую часть существующих в природе комплексных соединений, содержащих в своей структуре молекулы как с положительными, так и отрицательными ионами одновременно.
При проведении так называемых кинетических исследований все растворы также изготавливаются на основе H2O.
Яркий пример особенности воды – при схожести по своей структуре с метаном CH4, она имеет температуру кипения выше на целых 250 0 С!
Важную роль играет также ее способность выступать одновременно либо донором, либо акцептором частиц водорода, благодаря чему проходят многие химические процессы. Химия говорит нам еще и о том, что вода выступает идеальным растворителем для диссоциирующих соединений.
Интересно отметить, что по причине высокого уровня диэлектрической проницаемости, вода отлично экранирует электрические поля ионов друг от друга. Благодаря этому притяжение противоположно заряженных частиц в воде снижается примерно в 80 раз.
Какие вещества растворяются в воде
Даже если школьник ходит только в 3 класс, он наверняка может привести примеры материалов, которые боятся контакта с водой, или, другими словами, растворяются в ней и теряют свои свойства.
Вот перечень только некоторых веществ такого типа:
К хорошо растворимым относятся: соль, сахар, сода, хлориды, щелочные металлы и нитраты, а также бромиды. Воздух также претерпевает изменения при контакте с жидкой средой. Крахмал полностью растворим, спирт тоже.
Есть и такие материалы, которые являются нерастворимыми: сульфид меди, стекло, золото, керосин, серебро, растительный жир и многие другие. Правда, при некоторых условиях даже они не способны устоять от такого мощного воздействия.
В организме человека есть целая группа витаминов (С, В1, 2, 3(РР), В12 и другие), которые способны оказывать свое положительное воздействие на здоровье только в контакте с H2O. Это касается также и фолиевой кислоты, биотина и т. д.
Что не растворяется в воде
Существуют такие химические образования, которые не воспринимают воздействия воды в качестве растворителя совсем.
Хороший пример: углерод С, который находится в простом карандаше, многие металлы и сплавы, типа алюминия, а также золото, серебро, медь.
Такая ситуация складывается благодаря тому, что между молекулами и атомами нерастворимых веществ действуют сильные связи, которые водород разрушить не в состоянии. Полярное состояние молекулы также способствует большей прочности материала, который состоит из таких частиц.
Многие вещи, которые мы видим вокруг себя в быту, также являются нерастворимыми. Очень популярный пример – пластик.
В мировом океане плавает огромное пятно из пластикового мусора, которое ежегодно растет, и количество пластмассы там совершенно не желает уменьшаться естественным путем. Его не могут никак переработать, что очень плохо для всей экосистемы.
Именно поэтому экологи бьют тревогу и в ЕС уже сейчас планируется отказ от целлофановых пакетов, пластиковых стаканчиков и трубочек и тому подобные меры.
Значение воды как растворителя
Как уже упоминалось в начале статьи, рассматриваемые свойства воды являются ключевыми для всей живой и неживой природы нашей планеты.
Если бы она не обладала этими характеристиками, то большинство химических процессов на Земле, в живых организмах, в органической природе бы просто остановилось. Картинка такого мира была бы очень неутешительна – темная пустыня без признаков жизни.
Роль воды настолько огромна, что именно ее определение в далеких планетах и галактиках является для астрономов основным занятием в надежде когда-то отыскать там если не разумное существование, то хотя бы зачатки жизни.
Урок №32. Вода — растворитель. Растворы.
Растворы – это однородные гомогенные системы, состоящие из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Растворенное вещество равномерно распределено в растворителе. Раствор может состоять из двух и более компонентов.
Растворы по агрегатному состоянию бывают жидкие (раствор соли, кровь), твердые (сплавы металлов) и газообразные (воздух).
Растворитель – это то вещество, которое не изменяет агрегатное состояние при растворении. В случае смешения веществ с одинаковым агрегатным состоянием (жидкость-жидкость, газ-газ, твердое-твердое) растворителем считается тот компонент, содержание которого больше.
Образование раствора зависит от характера взаимодействия частиц растворителя и растворенного вещества, и их природы.
В школьном курсе рассматриваются преимущественно растворы электролитов (растворы с электропроводимостью). В курсе ВУЗов рассматриваются также истинные и коллоидные растворы, золи и другие системы.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества, и раствор становится насыщенным.
Насыщенный раствор – это раствор, в котором данное вещество при данной температуре больше не растворяется.
Суспензией называют взвесь, в которой мелкие частицы твёрдого вещества равномерно распределены между молекулами воды.
Эмульсией называют взвесь, в которой мелкие капельки какой-либо жидкости распределены между молекулами другой жидкости.
По способности растворяться вещества условно делят на:
малорастворимые (от 0,001 до 1 грамма растворенного вещества на 100 грамм растворителя);
растворимые (больше 1 г растворенного вещества на 100 г растворителя);
нерастворимые (менее 0,001 г растворенного вещества на 100 г растворителя).
При попадании в воду вещество может:
1. раствориться в воде, то есть перемешаться с ней на атомно-молекулярном уровне;
2. химически прореагировать с водой;
3. не раствориться в воде и химически не прореагировать.
Одни вещества хорошо растворяются в воде, другие мало, а третьи – не растворяются совсем.
Физический – разрушение структуры растворяемого вещества
Химический – образование гидратов (сольватов, если растворитель не вода), вследствие взаимодействия молекул растворителя с частицами растворённого вещества).
Если на разрушение кристаллической решётки затрачивается больше энергии, чем выделяется при образовании гидратов, то растворение сопровождается охлаждением раствора (NH 4 NO 3 ; KNO 3 ), а если меньше – нагреванием (приготовление растворов щелочей, кислот).
Растворение газов и жидкостей не сопровождается разрушением кристаллической решётки, поэтому такие процессы растворения всегда экзотермические.
Тепловые эффекты растворения подавляющего большинства веществ незначительны, потому не заметны.
Растворимость увеличивается с ростом температуры (бывают исключения). Вы прекрасно знаете, что удобнее и быстрее растворять сахар в горячей, а не в холодной воде.
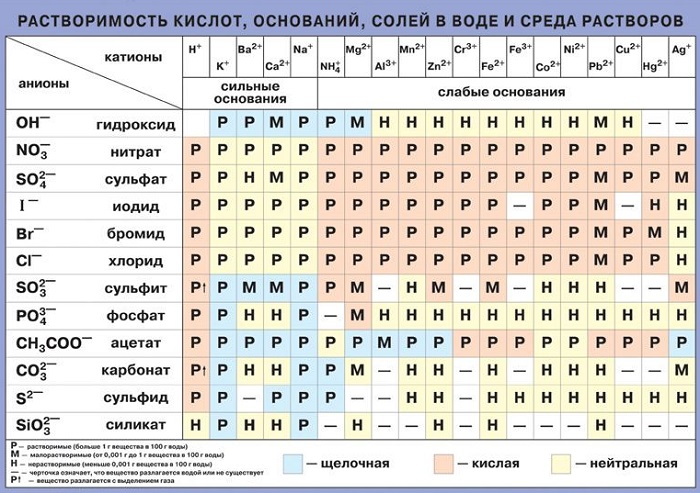
Попробуйте сами определить растворимость веществ (см. Таблица растворимости солей, кислот и оснований в воде).
Растворимость веществ
По растворимости в воде все вещества делятся на три группы:
1) хорошо растворимые, 2) малорастворимые и 3) практически нерастворимые.
Многие вещества в воде растворяются весьма хорошо. Примером таких веществ могут служить сахар, медный купорос, гидроксид натрия (твердые вещества), спирт, ацетон (жидкие вещества), хлороводород, аммиак (газообразные вещества).
Из приведенных примеров следует, что растворимость прежде всего зависит от природы веществ. Кроме того, она зависит также от температуры и давления. Сам процесс растворения обусловлен взаимодействием частиц растворимого вещества и растворителя; это самопроизвольный процесс.
По соотношению преобладания числа частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. С другой стороны, по относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т. е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, — ненасыщенным.
Что может растворяться в воде
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Вода – растворитель. Растворы. Насыщенные и ненасыщенные растворы. Растворимость веществ в воде
Источник жизни, одновременно самое распространенное и загадочное вещество на Земле – это вода. Именно о ней пойдет речь в данном уроке. Казалось, привычное для каждого вещество, а до сих пор все свойства воды до конца не изучены и не объяснены. Из материалов урока вы узнаете, какими свойствами обладает это привычное, но необычное вещество, и в чем же заключается его удивительность.
А видел ли кто-нибудь из вас воду?
Вопрос показался вам нелепым? Но он относится к совершенно чистой воде, в которой нет никаких примесей. Если быть честным и точным в ответе, то придется сознаться, что такую воду ни я, ни вы пока не видели. Именно поэтому на стакане с водой после надписи «Н2О» стоит знак вопроса. Значит, в стакане не чистая вода, а что тогда?
В этой воде растворены газы: N2, O2, CO2, Ar, соли из почвы, катионы железа из водопроводных труб. Кроме того, в ней взвешены мельчайшие частицы пыли. Вот что мы называем ч и с т о й в о д о й! Много ученых работает над решением трудной проблемы – получить абсолютно чистую воду. Но пока получить такую ультрачистую воду не удалось. Однако вы можете возразить, что есть дистиллированная вода. Кстати, что она собой представляет?
На самом деле мы получаем такую воду, когда стерилизуем банки перед консервированием. Переворачиваем банку вверх дном, помещаем ее над кипящей водой. На донышке банки появляются капельки, это и есть дистиллированная вода. Но как только мы перевернем банку, в нее заходят газы из воздуха, и снова в банке – раствор. Поэтому грамотные хозяйки стараются сразу после стерилизации заполнить банки нужным содержимым. Говорят, что продукты в этом случае будут храниться дольше. Возможно, они правы. Можете поэкспериментировать! Именно потому, что вода способна растворять в себе различные вещества, ученые не могут до сих пор получить идеально чистую воду в больших объемах. А она бы так пригодилась, например, в медицине для приготовления лекарств.
Кстати, находясь в стакане, вода «растворяет» стекло. Поэтому чем толще стекло, тем дольше прослужат стаканы. А что такое морская вода?
Это раствор, в котором содержится много веществ. Например, поваренная соль. А как можно выделить поваренную соль из морской воды?
Выпариванием. Кстати, именно так поступали наши предки. В Онеге были солеварни, где из морской воды выпаривали соль. Соль продавали новгородским купцам, покупали своим невестам и женам дорогие украшения, шикарные ткани. Таких нарядов, как у поморок, не было даже у московских модниц. А все лишь благодаря знаниям свойств растворов! Итак, сегодня мы с вами говорим о растворах и растворимости.
При смешивании на стройке песка с цементом и водой строители получают так называемый «цементный раствор». Раствор ли это с химической точки зрения?
1) раствор содержит два или более компонентов,
2) раствор – однородная система, в которой нет границы раздела веществ.
Раствор может образоваться не только при смешивании жидкого и твердого вещества. Некоторые жидкости тоже могут образовать раствор. Например, ацетон и вода – две растворимые друг в друге жидкости, при их перемешивании не видна граница раздела.
А вот бензин и вода раствора не образуют, т.к. нерастворимы друг в друге. Некоторые твердые вещества тоже могут образовывать растворы. Например, сплавы металлов – это однородные смеси, их можно назвать твердыми растворами.
Газообразные вещества также могут растворяться в жидкостях. Например, вы знаете, что рыбы дышат кислородом, растворенным в воде. Границы раздела между водой и содержащимся в ней кислородом нет. Газы смешиваются между собой всегда. Но однородные смеси газов не принято называть растворами.
Цемент и песок не растворяются друг в друге и воде, а значит, между ними существуют границы разделы. Т.е. строители называют эту смесь раствором условно.
II. Классификация растворов
Раствор – однородная система, состоящая из молекул растворителя и растворённого вещества, между которыми происходят физические и химические взаимодействия.
Растворы могут образовать:
— жидкость и твердое вещество;
— два твердых вещества.
Если в определённом объёме раствора содержится мало растворённого вещества, то такой раствор называют разбавленным, если много – концентрированным.
Насыщенный раствор – это раствор, в котором данное вещество при данной температуре больше не растворяется.
Суспензией называют взвесь, в которой мелкие частицы твёрдого вещества равномерно распределены между молекулами воды.
Эмульсией называют взвесь, в которой мелкие капельки какой-либо жидкости распределены между молекулами другой жидкости.
Определите, где какой раствор?
Не следует смешивать понятия «насыщенный» и «концентрированный» раствор, «ненасыщенный» и «разбавленный» раствор.
III. Растворимость веществ в воде
Одни вещества хорошо растворяются в воде, другие мало, а третьи – не растворяются совсем.
Задание:
А можете ли вы сказать о растворимости FeSO4?
Для того чтобы определить растворимость веществ в воде, мы будем пользоваться таблицей растворимости солей, кислот и оснований в воде.
Растворимость увеличивается с ростом температуры (бывают исключения). Вы прекрасно знаете, что удобнее и быстрее растворять сахар в горячей, а не в холодной воде.
Задание
IV. Дополнительный материал
По соотношению преобладания числа частиц, переходящих в раствор или удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества, и раствор становится насыщенным.