Что такое разложение воды под действием постоянного электрического тока
Как происходит процесс разложения воды электрическим током
Чистая, дистиллированная вода почти совершенно не проводит электрического тока.
Она обладает огромным сопротивлением. Например, сопротивление кубического сантиметра дважды перегнанной воды равно сопротивлению медной проволоки сечением в квадратный миллиметр, длина которой равна примерно 200 тысячам километров. Таким количеством проволоки можно больше чем 20 раз соединить между собой Москву и Владивосток. Для электролиза дистиллированная вода не годится. Нужна такая вода, которая бы хорошо проводила электрический ток, то есть была бы электропроводной.
Чтобы сделать воду электропроводной, в ней нужно растворить какую-нибудь соль, кислоту или основание, которые дают ионы.
Большинство химических соединений, растворяясь в воде, распадаются на части, которые приобретают при этом тот или иной заряд. Образующиеся заряженные частицы называются ионами, а разложение вещества на ионы — электролитической диссоциацией.
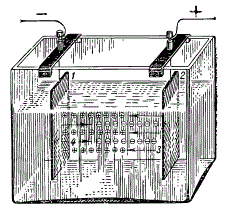
Обыкновенная поваренная соль (NaCl) при растворении в воде распадается на ион натрия (Na + ), заряженный положительно, и ион хлора (Сl — ), заряженный отрицательно. Ионы натрия и хлора, имеющие только по одному заряду, называются одновалентными ионами. Ионы, которые имеют два или три заряда, называются двух- или трехвалентными. В качестве примера двухвалентного иона можно привести ион кальция (Са). Хлористый кальций (СаСl2), диссоциируя на ионы, дает два одновалентных отрицательных иона хлора (2Сl) и один двухвалентный ион кальция (Са), заряженный положительно. Треххлористое железо (FeCl3) при диссоциации на ионы дает три одновалентных отрицательных иона хлора (3Сl — ) и один трехвалентный положительный ион железа (Fe +++ ).
Итак, при электролитической диссоциации соли образуются отрицательно заряженные ионы, которые называются анионами, и положительно заряженные ионы — катионы.
Кислоты при диссоциации образуют положительно заряженный ион водорода и отрицательно заряженный кислотный остаток. Серная кислота (H2SO4) распадается на два положительно заряженных иона водорода (2Н + ) и кислотный остаток — анион (SO4 — ), обладающий двумя отрицательными зарядами.
Щелочи при диссоциации образуют положительный ион металла и отрицательный ион гидроксила. Положительные и отрицательные ионы, образующиеся при растворении в воде солей, кислот и оснований, переносят через раствор электрический ток.
Если в раствор, содержащий ионы, поместить две металлические пластинки и подключить к ним постоянный ток от аккумулятора, то положительные ионы — катионы — сразу же начнут передвигаться к отрицательному электроду, который называется катодом, а отрицательные ионы — анионы — направятся к положительному полюсу — аноду. Находящиеся у электрода анионы отдадут ему свои отрицательные заряды — электроны (е) — и разрядятся. В то же самое время разрядятся и катионы, получив электроны от своего электрода. Их места тут же занимают новые ионы, и через раствор начинает проходить электрический ток. Чем больше ионов в растворе, тем лучше через него будет проходить электрический ток и тем больше электропроводность такого раствора.
Чтобы получить много ионов, недостаточно растворить много вещества. Необходимо, чтобы взятая соль, кислота или основание хорошо распадались на ионы, то есть хорошо диссоциировали. Имеются такие химические соединения, которые диссоциируют очень хорошо, и почти все молекулы растворенного вещества распадаются на ионы. Но есть и такие, которые диссоциируют плохо: только очень незначительная часть всех растворенных молекул распадается на ионы, а остальные остаются в виде недиссоциированных молекул.
Отношение числа распавшихся молекул к общему числу растворенных молекул называется степенью диссоциации. Чем меньше степень диссоциации, тем хуже электропроводность раствора.
К соединениям, обладающим плохой электропроводностью, относится дистиллированная вода. Подсчитано, что из 10 миллионов молекул воды на ионы распадается только одна молекула, образуя один положительно заряженный ион водорода (Н + ) и один отрицательно заряженный ион гидроксила (ОН — ). Понятно, что при такой малой диссоциации электропроводность дистиллированной воды должна быть совершенно ничтожной и она не может быть использована для электролиза. Вот почему для получения из воды кислорода необходимо иметь подкисленную или подщелоченную воду.
Прохождение электрического тока через раствор: 1 — катод; 2 — анод; 3 — положительно заряженные ионы — катионы; 4 — отрицательно заряженные ионы — анионы.
Можно было бы ожидать, что в щелочных растворах ионы натрия (Na + (e) → Na) разрядятся на катоде, переходя в атомы натрия, которые, соединяясь с водой, дадут щелочь и водород (2Na + 2H2O → 2NaOH + H2). На аноде ионы гидроксила, потеряв свои электроны, соединятся попарно, образуя из радикалов воду, освобождая кислород (4OH — — 4(e) → 2H2O + O2).
Однако в действительности в кислых и щелочных растворах процесс образования кислорода и водорода происходит иначе.
Несмотря на то, что в щелочных растворах имеется очень много ионов натрия и мало ионов водорода, на катоде в первую очередь разряжаются ионы водорода.
Таким образом, при электролитическом получении кислорода и водорода расходуется только вода. Литр воды дает примерно 1360 литров водорода и 680 литров кислорода.
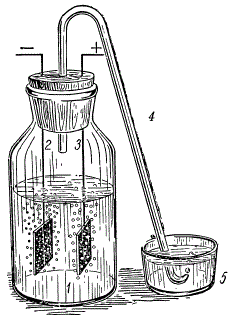
Электролиз воды: 1 — банка с электролитом; 2 — катод, на котором выделяется водород; 3 — анод, на котором выделяется кислород; 4 — трубка для отвода газов; 5 — чашечка с водой.
Под руководством учителя и соблюдая меры предосторожности, можно сделать опыт, показывающий, как разлагается вода.
Возьмите банку с широким горлом и наполните ее на две трети 20-процентным водным раствором щелочи. Плотно закройте банку пробкой, в которую вставлены две никелевые проволочки с небольшими пластинками на концах — электродами. В середину пробки вставьте коротким концом загнутую стеклянную трубку, через которую будут выходить газы. Второй, длинный конец трубки опустите в чашку с водой, чтобы в нее во время опыта не попадал воздух. Подключите к верхним концам электродов постоянный ток от двухвольтового аккумулятора. На электродах под раствором сразу же появятся пузырьки газа. Это кислород и водород, которые, смешиваясь, образуют гремучий газ.
Вспомним свойство этой смеси газов. Если ее поджечь, она легко взрывается.
Поэтому подходить с огнем к банке опасно.
Чтобы убедиться, что в банке образовались кислород и водород, пропустите сначала немного газа через чашечку с чистой водой, а затем поставьте вместо нее чашечку с мыльной водой.
В пузыре была гремучая смесь — смесь одного объема кислорода с двумя объемами водорода.
Мы пока только разложили воду, но не разделили образовавшиеся газы и не получили кислорода.
Источник: В. Медведовский. Кислород. Государственное Издательство Детской литературы Министерства Просвещения РСФСР. Ленинград. Москва. 1953
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Электролиз воды
Электролиз воды и водных растворов
Электролиз воды это процесс разложение воды электрическим током используют различные электролизеры, например аппарат Гофмана и др. Раньше они входили в состав оборудования школьных кабинетов химии. Но эти приборы с платиновыми и серебряными электродами дорогие, хрупкие и недолговечные.
Электроды из благородных металлов заменили свинцовыми и никелевыми. Приборы стали прочнее, но имели существенный недостаток— образование вторичных продуктов электролиза.
Термическое разложение воды
В то время как электролиз воды проходит при обыкновенной температуре, термическое разложение воды требует нагревания до очень высокой температуры (выше 1000 °С), что свидетельст вует о прочности этого соединения.
Так, пары воды частично разлагаются на водород и кислород при сильном нагревании платиновой спирали, которую можно заменить спиралью из других тугоплавких металлов (например, вольфрама).
Установка для термического разложения (диссоциации) воды изображена на рисунке 2.
Меры предосторожности. Перед раскаливанием спирали необходимо удалить из установки воздух, для чего воду в колбе кипятят. Провода подключают к источнику электрического тока (через ВС-24М или В-24). Цилиндр с собранной гремучей смесью обертывают полотенцем и подносят к пламени.
Электролиз водных растворов солей
Прибор для электролиза растворов солей (рис. Б) представляет собой дугообразную трубку с двумя отростками для отвода образующихся газов, например хлора и водорода при электролизе раствора хлорида натрия. Электроды—угольные (графитовые) стержни.
Рис. 2 — А. Установка для термического разложе ния воды.
Рис. 2 — Б. Прибор для электролиза растворов солей.
Для демонстрации электролиза воды в электролизер наливают дистиллированную воду так, чтобы уровень ее на 2— 3 см был выше электродов. В качестве электролита используют 10 %-ный раствор гидроксида натрия. В две демонстрационные пробирки (ПХ-21) также наливают дистиллированную воду с добавлением электролита.
Пробирки поочередно закрывают пробкой с держателем, опрокидывают вверх дном в электролизер; открывают под водой пробку и надевают пробирки на электроды. Прибор подключают к источнику постоянного тока с напряжением 40 В (ИЭПП-1 или ИЭПП —2) при условии, что контакт экспериментатора с электролитом исключен.
Для этого в старых образцах набора следует сделать к электролизеру крышку (из картона, дерева, пластмассы) с отверстиями для пробирок. В противном случае нельзя пользоваться электрическим током с напряжением свыше 12 В.
Аналогично проводят опыт по электролизу водного раствора иодида калия. Электролизер и демонстрационные пробирки заполняют раствором иодида калия. В одну из пробирок, которую надевают на катод, добавляют 1— 2 капли фенолфталеина, а во вторую — 2—3 капли крахмального клейстера.
Подключают прибор к источнику постоянного тока и через 1 —2 мин (U 40В) наблюдают малиновое окрашивание в катодном пространстве (в пробирке с фенолфталеином) и синее — в анодном (в пробирке с крахмалом). Практическое значение имеет электролиз раствора хлорида натрия, дающий три важных продукта: гидроксид натрия, хлор и водород. Из последних двух продуктов может быть получена синтетическая соляная кислота.
Электролиз хлорида натрия
Лабораторные установки для электролиза раствора хлорида натрия рассматриваются в руководствах по химическому эксперименту. Одна из таких установок была предложена М. В. Федякиным (журнал «Химия в школе», 1964, № 5). Она состоит из стеклянной трубки ( 30 мм), закрытой двумя резиновыми пробками.
В прибор через воронку наливают насыщенный раствор хлорида натрия до уровня, показанного на рисунке. Установку подключают к источнику постоянного тока напряжением 15—20 В,
При электролизе на катоде 4 выделяется водород, который собирают над трубкой 6 в пробирку и испытывают на горючесть.
Выделяющийся на аноде хлор выводится по газоотводной трубке в сосуд с иодокрахмальным раствором (на рисунке не показано). Сливают в отдельные стаканы жидкость из анодного про странства и катодного пространства, а в третий стакан — исходный раствор хлорида натрия. Во все три стакана прибавляют раствор лакмуса (фиолетового цвета). Исходный раствор показывает нейтральную реакцию, жидкость при катоде — щелочную, а при аноде —разрушает лакмус (действие растворенного хлора).
Установка для электролиза солей
Установку для электролизера растворов солей (а также воды) можно собрать из специальных деталей набора НДПХ. В качестве электролизера используют Н-образную трубку-реактор 1 ( с кранами 2 и 4), в которую вставляют две пробки с электродами: железным и угольным.
В колбу при закрытом зажиме наливают прозрачный насыщенный раствор хлорида нат рия, заготовленный заранее. К клеммам электродов присоединяют проводники от источника постоянного тока ВС-24М (В-24). Напряжение тока 25—30 В, сила тока 4 А. Через 2—3 мин колбу поднимают на демонстрационный столик.
Водород собирают в пробирку, открывают кран и доказывают наличие газа. В пробирку над краном помещают иодокрахмальную бумажку , с помощью которой доказывают наличие хлора.
Получившийся раствор щелочи берут из электролизера в пробирку через тройник с зажимом . Проводят испытание раствора щелочи фенолфталеином.
Статья на тему Электролиз воды
Похожие страницы:
Понравилась статья поделись ей
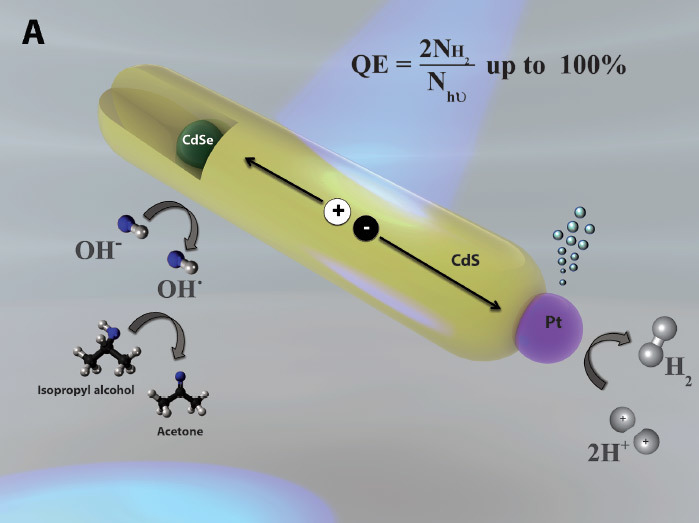
Расщепление воды с эффективностью 100%: полдела сделано
Если найти дешёвый и простой способ электролиза/фотолиза воды, то мы получим невероятно богатый и чистый источник энергии — водородное топливо. Сгорая в кислороде, водород не образует никаких побочных выделений, кроме воды. Теоретически, электролиз — очень простой процесс: достаточно пропустить электрический ток через воду, и она разделяется на водород и кислород. Но сейчас все разработанные техпроцессы требуют такого большого количества энергии, что электролиз становится невыгодным.
Теперь учёные решили часть головоломки. Исследователи из Технион-Израильского технологического института разработали метод проведения второго из двух шагов окислительно-восстановительной реакции — восстановления — в видимом (солнечном) свете с энергетической эффективностью 100%, значительно превзойдя предыдущий рекорд 58,5%.
Осталось усовершенствовать полуреакцию окисления.
Столь высокой эффективности удалось добиться благодаря тому, что в процессе используется только энергия света. Катализаторами (фотокатализаторами) выступают наностержни длиной 50 нм. Они абсорбируют фотоны от источника освещения — и выдают электроны.
В полуреакции окисления производятся четыре отдельных атома водорода и молекула О2 (которая не нужна). В полуреакции восстановления четыре атома водорода спариваются в две молекулы H2, производя полезную форму водорода — газ H2,
Эффективность 100% означает, что все фотоны, поступившие в систему, участвуют в генерации электронов.
На такой эффективности каждый наностержень генерирует около 100 молекул H2 в секунду.
Сейчас учёные работают над оптимизацией техпроцесса, который пока что требует щелочной среды с невероятно высоким pH. Такой уровень никак не приемлем для реальных условий эксплуатации.
К тому же, наностержни подвержены коррозии, что тоже не слишком хорошо.
Тем не менее, сегодня человечество стало на шажок ближе к получению неиссякаемого источника чистой энергии в виде водородного топлива.
Научная работа опубликована в журнале Nano Letters (зеркало).
Электролиз воды
Аннотация
1. Введение
2. Физика и электрохимия
Так как предметом рассмотрения является электролиз воды, а открытие и основные его закономерности изучались в физике, то и начнем с физики. В фундаментальном «Курсе физики» О. Д. Хвольсона [1] читаем: «Явление, которое происходит в электролите, введенном в замкнутую цепь, называется электролизом». Здесь же определяется что такое «электролит», «анион» и «катион». И далее, там же: «С внешней стороны анион и катион представляются продуктами разложения электролита, и притом разложения, произведенного током, проходящим через электролит». При электролизе некоторых кислот и щелочей выделяются кислород и водород. Мы видим, что «ток разлагает воду». Так и считали это как само собой разумеющееся и очевидное до второй половины 19 века.
Главная заслуга Гельмгольца состоит в том, что он точно указал на роль электрического тока, выяснил, откуда берется та энергия, которая очевидно расходуется при электролизе, и которая численно равна энергии, выделяющейся при химическом соединении продуктов электролиза. При электролизе воды это энергия, выделяющееся при сгорании водорода и образовании воды. По Гельмгольцу разложение воды при электролизе осуществляется за счет внутренней энергии электролита, а вовсе не «ток разлагает воду». Именно на этом и основана идея использования водорода как рабочего тела теплового насоса при определенных условиях проведения электролиза воды. Но об этом подробнее чуть ниже, а пока обратимся к электрохимии.
А в электрохимии, где важен практический результат, например, под напряжением разложения при электролизе воды, понимают то напряжение, при котором на нейтральных электродах на катоде появляются пузырьки водорода. Это понятие, конечно, важно в практике, но оно сегодня «. не имеет определенного физического смысла» [2]. Так как этот вопрос важен в практическом отношении при получении водорода при электролизе, то рассмотрим его подробнее.
3. Перенапряжение выделения водорода
Да что говорить об электролизе, когда и о воде мы не знаем всего. Так, «Существует точка зрения, согласно которой вода представляет собой смесь разного рода ассоциированных молекул, например, 8(Н2О), 4(Н2О). и «простых» молекул Н2О.» [4]. Этим пытаются объяснить некоторые аномальные свойства воды. В этом свете наивны рассуждения о механизме движения ионов Н + или Н3О + в электролизе, о процессах в двойном слое между электродом и электролитом. Ясно, что он существует даже между газом и твердым телом, а между жидкостью и твердым телом тем более. Конечно, роль его в процессе электролиза велика. Но точное количественное описание этой роли вряд ли возможно, а может быть и не нужно. «Никчемно» с точки зрения фундаментальной науки, как сказал по другому поводу наш выдающийся теоретик Я. И. Френкель.
Конечно, есть скачок потенциала между электродом и электролитом и без всякого извне приложенного напряжения. А когда оно есть, и появляется даже слабый ток, и мы не видим выделения водорода на катоде, на электродах начинаются изменения в материале электрода, структуре его поверхности, составе электролита вблизи электрода. Все изменяется со временем, и обратно уже не возвращается. По хорошо известным законам физики, все процессы, которые начнутся в первые моменты после подачи напряжения на электроды, будут направлены против причин их вызвавших, т. е. против уже идущего процесса электролиза. Это принцип Ле Шателье. Начнутся сложные процессы поляризации электродов. Так мы описываем этот процесс противодействия процессу электролиза. Возникает ЭДС направленная против приложенного напряжения. Начавшийся процесс электролиза почти остановится. Чтобы он шел стационарно и с нужной нам скоростью, надо повысить внешнее напряжения. А это и есть «перенапряжение». Но его величина не связана с «потенциалом разложения» или «напряжением разложения» воды равном 1.228 вольт. Оно зависит от силы тока, от природы электродов, состояния их поверхности и т. д. Так, для вольфрама, при плотности тока 5 мA на кв. см. это 0.33 вольта [5].
Найти величину энергии, требуемую для разложения молекулы воды на водород и кислород, зная, сколько энергии выделяется при сгорании одного грамм-моля водорода не трудно. Но никакой доказательной силы того, что эта энергия тратится именно током, это не имеет. Если электролиз идет при напряжении на электродах больше чем 1.228 вольт, то это еще не означает, что именно ток расходует энергию 1.228 еВ на разрушение молекул воды. Да нигде, кроме как в неявном виде в [5], это и не утверждается. Но это ведь не научная, а «. производственно- техническая. » монография, как сказано в ее аннотации. Рассмотрим более детально, как же внутренняя энергия электролита расходуется им на разложение молекул воды на кислород и водород в процессе электролиза. Каков механизм этого явления.
4. Механизм диссоциации воды при электролизе
А нейтральный остаток серной кислоты получается из отрицательного иона, который нейтрализуется на аноде. Образовавшаяся молекула серной кислоты тут же распадается на ионы, восполняя их убыль на аноде и на катоде. По этому сценарию в «анолите» действительно концентрация молекул воды уменьшается. Вода разлагается. Но по другой реакции. Разряд отрицательных ионов SO4 2- на аноде представляется вполне естественным. Правда, О. Д. Хвольсон перечисляет целый букет химических реакций, которые идут в электролите. Но нам то важна генеральная линия, а не детали.
А откуда же теперь берется эта минимальная энергия 1.228 еВ, которую все равно надо затратить в одном акте? Физика знает ответ и на этот вопрос. При нормальном давлении, и температуре 2000 градусов, без всякого электролиза, 0.081% всех молекул воды диссоциировано. При 5000 градусах распадается уже 95.4% всех молекул воды [5]. Это происходит в актах неупругого взаимодействия двух нейтральных молекул воды. Такие процессы нам хорошо известны в физике частиц.
Конечно, работа тока в электролите, как и во всяком проводнике, расходуется и на его нагревание. Ионы, приходя в ускоренное движение в направлении электрического поля, упруго взаимодействуют с нейтральными молекулами воды, и передают им часть своей энергии, нагревают электролит. Если это изменение внутренней энергии электролита за счет нагревания его током будет равно, или больше уменьшения внутренней энергии электролита израсходованной им на разложение молекул воды, то температура его будет постоянной, или он будет нагреваться. Это и происходит в промышленных электролизерах. Создается иллюзия «ток разлагает воду». Если на самом деле это не так, не «ток разлагает волу», и не величина «напряжения разложения» препятствует процессу электролиза при низком напряжении, когда электролит должен будет охлаждаться, то как это можно осуществить? Какие причины этому препятствуют на самом деле?
5. Тепловой насос
Самым интересным и результативным из всех, до сих пор попыток осуществления низковольтного электролиза, можно считать электоро-водородный генератор (ЭВГ) В. В. Студенникова [7].Его предложение основано на работе Р. Колли (1873) [8], который открыл новый источник ЭДС. Было показано, что если электроды в электролизере расположить не вертикально, на одной и той же высоте, когда ионы движутся горизонтально, а разнести их по высоте, то за счет разности масс положительного и отрицательного иона, движущихся теперь вверх и вниз в гравитационном поле Земли, возникнет ЭДС. Искусственное гравитационное поле, возникающее при вращении, дает эффект Толмена-Стьюарта [9]. Ссылка на работу Р. Колли у них имеется. В патентах[10,11] этот эффект используется в конструкции электролизеров с вращением электролита. Он запатентован в США в 1929 и 1964 годах. Количественное исследование эффекта снижения анодной и катодной разностей потенциалов, получаемое при вращении электролизера, опубликовано в [12].
6. Перспективы
Исследования в области водородной энергетики только в России ведут 20 институтов РАН. Некоторые из них занимаются этим уже 20 лет. Созданы топливные элементы, использующиеся в космических исследованиях. Но до широкого их производства и внедрения в наш быт, скорее всего дело не дойдет еще долго. Научная ценность вклада институтов РАН в этой области, мягко говоря, не велика. Основная проблема водородной энергетики, о которой говорилось во введении, ими не решается, и решена не будет. Нет заказчика. Усовершенствование промышленных электролизеров, использующих традиционный электролиз, также бесперспективно.
Остаются только нетрадиционные способы ее решения, которые являются уделом изобретателей одиночек. Но среди них есть не мало сомнительных, а часто и просто безграмотных, предложений и утверждений. Примером этого может служить «Вечная энергия Казакова» из Алма-Аты [12]. Так пишет об этой работе корреспондент, который возможно, просто плохо понял работу Казакова. Казаков использует инфразвук, и утверждает, что при этом с огромной скоростью идет «самоэлектролиз воды». Это явление в физике неизвестно. За одну секунду получается 9 кубометров водорода, т. е. «самораспадается» на водород и кислород около 7 литров воды в секунду. Если это правда, то мощность установки 95 МвТ. Если в баке было около 200 литров воды, то через 2-3 секунды она должна была бы замерзнуть. Правда, автору не хватило всего то 100 тыс. долларов, чтобы выпустить промышленный образец и осчастливить человечество. Научные публикаций у такого рода умельцев по этой теме, как правило, отсутствуют. Часто они бранят консервативную «официальную науку». Проверки подобных заявителей всегда обнаруживают, что они по простоте душевной или по невежеству выдают желаемое за действительное.
Литература
1. О. Д. Хвольсон, Курс физики, РСФСР, Госиздат, Берлин, 1923, т. 4.
2. А. И. Левин, Теоретические основы электрохимии, Гос. Научно-техн. Издат., Москва, 1963.
3. А. П. Соколов, ЖРФХО, т. 28, с. 129, 1896.
4. Физ. Энцикл. Слов., изд. «Советская Энциклопедия», Москва, 1960, т.1, с. 288.
5. Л. М. Якименко и др., Электролиз воды, изд. «химия», Москва, 1970.
6. Ячейка Стенли Мейера
7. ЭВГ Студенникова
8. Р. Колли, Журнал Русского Химического Общества и Физического Общества при Санкт- Петербургском Университете, т. 7, Часть Физическая, С-Петербург, 1873, с. 333.
9. R. C. Tolman, T. D. Stsward, Phys. Rev, 8, 97, 1916.
10. E. Thomson, U. S. Pat. 1, 701,346(1929).
11. T. B. Hoover, U. S. Pat. 3, 119, 759(1964).
12. H. Cheng at al., Jorn. Of the Electrochemical Society, 149(11), D172-D177(2002).
13. Вечная энергия Казакова