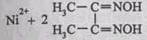Что такое селективные реагенты
Большая Энциклопедия Нефти и Газа
Селективный реагент
Селективные реагенты и реакции позволяют обнаруживать несколько веществ или ионов. Таких реагентов и реакций известно значительно больше, чем специфических. [1]
Применение селективного реагента является основным условием титриметрических методов, использующих визуальные индикаторы. Термометрия расширяет возможности титриметрического метода. [5]
Значительно более селективным реагентом является таннин ( формулу см. на стр. [6]
Групповые или селективные реагенты можно использовать как Специфические при условии предварительного разделения ионов. Например, кадмий можно специфично обнаружить в виде сульфида кадмия при взаимодействии с сероводородом. [7]
В качестве довольно селективных реагентов для осаждения висмута из разбавленных растворов минеральных кислот следует отметить также производные органических арсоновых кислот. [9]
Диалкилалюминийгидриды являются весьма селективными реагентами при восстановлении нитрилов в альдегиды. [10]
Бицинхониновая кислота представляет селективный реагент для фотометрического определения меди. [11]
Хотя специфические или сравнительно селективные реагенты на осмий и рутений отсутствуют, эти элементы удается довольно легко определить, поскольку их можно отделить от других платиновых металлов и друг от друга диистилляцией или экстракцией ( см. также стр. [13]
Пирокатехин-3 5-дисульфокислота представляет недостаточно селективный реагент на шестивалентный молибден [1539], поэтому последний нужно отделять осаждением а-бензоиноксимом. Сарма [1299] рекомендует восстанавливать трехвалентное железо дитионатом H2S2Oe или аскорбиновой кислотой. Шестивалентный хром восстанавливают сернистым газом, подкисленной перекисью водорода или аскорбиновой кислотой. [14]
Типы аналитических реакций и реагентов
Аналитические реакции и аналитические реагенты часто (обычно) подразделяют на специфические (специфичные, характерные), селективные (избирательные) и групповые.
Специфические реагенты и реакции позволяют обнаруживать данное вещество или данный ион в присутствии других веществ или ионов.
Так, например, если в растворе присутствует молекулярный иод I2 , (точнее, более сложное соединение – трииодид-ион I3 – ), то при прибавлении свежеприготовленного водного раствора крахмала исходный раствор окрашивается в синий цвет. Процесс – обратимый; при исчезновении в растворе молекулярного иода (например, при его восстановлении до иодид-ионов I – ) синяя окраска также исчезает и раствор обесцвечивается. Эта реакция широко используется в качественном и количественном химическом анализе. Впервые ее описал в 1815 г. немецкий химик Ф. Штромейер.
Синее окрашивание раствора крахмала в присутствии иода (именно трииодид-ионов, т.к. чистый молекулярный иод I2 даже в отсутствии иодид-ионов I – не окрашивает крахмал) объясняют образованием адсорбционного комплекса между коллоидными макромолекулами крахмала (фракциями неразветвленной амилозы) и трииодид-ионами.
Специфическим реагентом на нитрит-ионы NO2, является реактив Грисса – Илошвая (Илосвая), представляющий собой смесь α-нафтиламина С10H7NH2 и сульфаниловой кислоты НО3SC6Н4NH2), с которым нитрит-ион (обычно в присутствии уксусной кислоты) образует азокраситель НО3SС6Н4N = NС10Н6NН2 красного цвета:
Смесь α-нафтиламина с сульфаниловой кислотой в качестве специфического реагента на нитриты была впервые предложена в 1879 г. немецким химиком П.Гриссом. Позднее эта реакция изучалась венгерским химиком Л. Илошваем (Илосваем). В современной аналитической химии указанную смесь обычно называют «реактив (реагент) Грисса – Илосвая» или просто «реактив Грисса», а соответствующую реакцию – «реакцией Грисса – Илосвая» или «реакцией Грисса». Вместо α-нафтиламина применяют также нафтолы.
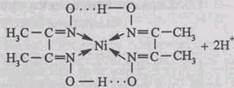
В качестве специфического реагента на ионы никеля Ni 2+ часто используют реактив Чугаева – диметилглиоксим, который в присутствии катионов Ni 2+ в аммиачной среде образует малорастворимый в воде комплекс красного цвета – бисдиметилглиоксимат никеля(П), который традиционно называют никельдиметилглиоксимом:
Диметилглиоксим как специфический и очень чувствительный реагент на ионы никеля Ni 2+ был впервые предложен русским химиком Л.А. Чугаевым в 1905 г. и назван впоследствии его именем («реактив Чугаева»).
Специфических аналитических реагентов и реакций известно довольно мало.
Селективные реагенты и реакции позволяют обнаруживать (одновременно!) несколько веществ или ионов (например, кристаллографические реакции, когда под микроскопом одновременно видны несколько типов кристаллов). Таких реагентов и реакций известно значительно больше, чем специфических.
Групповые реагенты и реакции (частный случай селективных) позволяют обнаруживать все ионы определенной аналитической группы (но при этом их аналитические эффекты суммируются).
Ca 2+ + SO4 2— → CaSO4 ↓
Sr 2+ + SO4 2— → SrSO4 ↓
Ba 2+ + SO4 2— → BaSO4 ↓
Существуют групповые реагенты и для других групп катионов и анионов, а также органических соединений, имеющих в своей структуре одну и ту же функциональную группу (например, амино-группу, гидрокси-группу и др.).
Дата добавления: 2016-01-09 ; просмотров: 7891 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Что такое селективные реагенты
Химические методы обнаружения ионов
(Качественный химический метод анализа)
Химический анализ (определение химического состава) веществ и материалов имеет целью обнаружение, идентификацию, разделение и определение химических элементов и их соединений, а также выяснение химического состава веществ.
Идентификация компонентов и определение качественного состава вещества или смеси веществ является предметом качественного анализа. При этом утверждение об отсутствии данного компонента («не обнаружен») подразумевает, что его содержание ниже некоторого предела. Таким образом, деление на качественный и количественный (определяющий содержание компонента) анализ в определенной степени условно.
Качественный анализ может быть проведен различными методами. Использование физических методов для установления качественного состава объекта будет рассмотрено в соответствующих разделах, посвященных физическим и физико-химическим методам. В данном разделе рассматриваются химические методы качественного атомно-ионного анализа.
В качественном химическом анализе аналитический сигнал получают в результате проведения химической реакции.
Химическое превращение анализируемого вещества при действии аналитического реагента с образованием продуктов с заметными аналитическими признаками (сигналами) называют аналитической реакцией, частной реакцией или реакцией открытия. Вещество, которым действуют на открываемый компонент, называют аналитическим реагентом или реактивом на открываемый ион.
Аналитическим сигналом может быть цвет и его изменение, запах, выделение газообразных продуктов, окрашивание пламени, образование люминесцирующих соединений, выпадение или растворение осадка.
В случае образования осадка, кроме самого факта выпадения, аналитическим сигналом может служить его цвет, форма (кристаллическая или аморфная), а также характерная форма кристаллов.
Аналитические реакции, согласно рекомендации ИЮПАК, подразделяют на специфические и избирательные (селективные) методы, реакции и реагенты.
Специфическими называют те методы, реакции или реагенты, с помощью которых в данных условиях можно обнаружить только одно вещество; избирательными — методы, реакции и реагенты, позволяющие обнаружить небольшое число веществ.
Специфические реагенты и реакции позволяют обнаружить данное вещество или ион в присутствии других веществ или ионов.
Селективные реагенты и реакции позволяют обнаружить несколько веществ или ионов. Таких реагентов и реакций известно существенно больше, чем специфических.
Избирательность достигается правильным выбором и установлением соответствующих условий реакции. К факторам, определяющим условия протекания реакции, относят рН, температуру, концентрации открываемого и посторонних ионов, природу растворителя (вода, органические или водно-органические среды). Реакции или реагент можно сделать более избирательными или даже специфичными варьированием рН, концентраций, маскированием, изменением степени окисления элементов, температуры.
Реагенты по их избирательности можно разделить на три группы:
1. Специфические реагенты — например: крахмал для обнаружения I2; NaOH для открытия
2. Избирательные (селективные) реагенты — например: диметилглиоксим в аммиачной среде реагирует с Fe(II), Co(II), Ni(II), Zr(IV) и Th(IV).
3. Групповые реагенты — например: HCl осаждает нерастворимые хлориды Ag(I), Hg(I), Tl(I), Pb(II).
Групповые и селективные реагенты, образующие малорастворимые соединения с ионами, используют при разделении катионов на аналитические группы. Ионы, осаждаемые данным групповым реагентом, образуют аналитическую группу ионов. Используемый групповой реагент и условия осаждения определяют состав аналитической группы ионов.
Анализ смеси ионов — трудная аналитическая задача, поскольку посторонние ионы могут препятствовать открытию интересующего нас иона. Такие ионы называют мешающими. Помехи со стороны сопутствующих ионов начинают проявляться при определенном соотношении открываемых и мешающих ионов и усиливаются с увеличением концентрации последних. Причинами мешающего влияния при открытии ионов могут быть:
1. Образование (мешающими ионами) при действии реагента соединений, аналогичных аналитической форме открываемого иона, и генерирование ими такого же сигнала, что и аналитический сигнал открываемого иона.
2. Образование (мешающими ионами) соединений, препятствующих наблюдению аналитического сигнала.
3. Вероятность проведения аналитической реакции открытия невелика, например, в результате связывания реагента мешающими ионами.
Для устранения мешающего влияния сопутствующих ионов используют два пути:
избирательное распределение компонентов анализируемой системы между двумя разделяющимися фазами (методы разделения или отделения). В практике качественного анализа наибольшие значения имеют осаждение, экстракция и хроматография;
маскирование мешающих ионов. Для этого используют химические реакции, протекающие в той же фазе, что и реакции обнаружения, и приводящие к уменьшению концентрации мешающего иона или реагента. Для маскирования и демаскирования применяют реакции комплексообразования, кислотно-основные и окислительно-восстановительные.
Реальные объекты всегда многокомпонентны, часто и многофазны. Для открытия каждого иона необходимо:
создать условия протекания частной реакции;
устранить мешающее влияние сопутствующих компонентов;
зарегистрировать аналитический сигнал.
Возможны два пути решения этой задачи: проведение систематического качественного химического анализа или дробное обнаружение ионов.
Последовательное разделение ионов на отдельные аналитические группы методом осаждения групповыми реагентами (или иным образом) называют систематическим ходом анализа.
Метод дробного обнаружения основан на применении специфических и селективных реагентов без разделения на группы. Мешающее влияние сопутствующих ионов устраняют, используя приемы маскирования, а также применяя более селективные или специфические реагенты.
Возможности дробного открытия ионов были существенно расширены благодаря применению органических реагентов, значительная часть которых специально синтезирована для повышения селективности реакций обнаружения. Широкие возможности органических реагентов связаны, во-первых, с их многообразием и, следовательно, возможностью выбора подходящего реагента, а во-вторых, с разнообразием свойств образуемых ими комплексов, таких, как устойчивость, растворимость, летучесть, окраска, окислительно-восстановительные свойства. Метод дробного определения может быть применен к анализу аналитических групп ионов, выделенных групповыми реагентами.
Таким образом, процедура качественного химического анализа представляет собой последовательное отделение аналитических групп с дальнейшим открытием входящих в них ионов систематическим или дробным методами. В ходе выполнения анализа как систематическим, так и дробным методами аналитик управляет поведением ионов в растворе, прежде всего их концентрациями. Такое управление возможно на основе равновесных реакций путем смещения равновесий. В распоряжении аналитика два типа равновесных процессов — гомогенные и гетерогенные равновесия. Гомогенные равновесия — это диссоциация — ассоциация, окисление — восстановление, гидролиз, нейтрализация, комплексообразование. Количественное описание этих равновесий основано на законе действующих масс и уравнении Нернста для окислительно-восстановительного потенциала системы. К гетерогенным равновесиям относятся, прежде всего, растворение и осаждение осадков, экстракционное распределение между двумя жидкими фазами и хроматографические процессы. Расчеты положения гетерогенного равновесия возможны на основе констант межфазных распределений, в первую очередь правила произведения растворимости.
Характеристика чувствительности аналитической реакции выражается в том, что аналитические реагенты и аналитические реакции позволяют обнаруживать определяемое вещество в пробе, если его содержание превышает некоторый минимальный предел. Если концентрация определяемого вещества ниже этого предела, то и концентрация аналитической формы окажется настолько незначительной, что невозможно будет зарегистрировать аналитический сигнал.
Предел обнаружения — минимальная концентрация или минимальное количество вещества, которое может быть обнаружено данным методом с какой-то допустимой погрешностью. Его обозначают сminP, где Р — доверительная вероятность. Чувствительность характеризует изменение сигнала с изменением концентрации и выражается коэффициентом чувствительности, который численно равен тангенсу угла наклона линейной зависимости аналитического сигнала от концентрации.
Предел обнаружения в качественном анализе традиционно называли открываемым минимумом. В настоящее время в качественном анализе используется большое число реагентов и частных реакций с низкими пределами обнаружения. Обычно для открытия ионов применяют реакции с пределом обнаружения 10 –7 г (0,1 мкг) в 1 мл раствора. Физические методы позволяют открыть элементы в твердых образцах с пределом обнаружения менее 10 –15 г.
В химических методах качественного анализа предел обнаружения может быть существенно понижен при использовании органических реагентов, особенно в случае образования открываемым ионом смешано-лигандных комплексов. Для этих же целей используют ряд приемов практического проведения реакции — таких, как микрокристаллоскопический анализ, капельный анализ, флотация, жидкостная экстракция, метод умножения реакций, каталитические и люминесцентные реакции, реакции на носителях.
Предел обнаружения, наряду с избирательностью, является важнейшей характеристикой реакции и метода анализа.
Реакции в пробирке — в полумикрометоде реакции проводят в специальных конических пробирках, отмеряя объемы по каплям и используя центрифугирование для отделения осадков.
Микрокристаллоскопические реакции проводят на предметном стекле и наблюдают образование осадка и форму кристаллов под микроскопом в 75-кратном увеличении (приблизительно). Капли исследуемого раствора и реагента помещают рядом и стеклянной палочкой образуют между ними перемычку. Образование осадка происходит в результате взаимной диффузии реагента и определяемого иона, что обеспечивает формирование правильных относительно крупных кристаллов.
Капельные реакции проводят на полосках фильтровальной бумаги. Сначала концом капилляра с раствором реагента касаются бумаги до образования пятна диаметром около 3 мм. В центр полученного пятна аналогичным образом наносят каплю исследуемого раствора.
Обнаружение с использованием экстракции — в пробирку с притертой пробкой помещают по несколько капель анализируемого раствора, реагента и органического растворителя. Для понижения предела обнаружения соотношение объемов органической и водной фазы обычно берут равным 1:4. В закрытой пробирке смесь взбалтывают 1–2 мин и после расслаивания наблюдают окраску или люминесценцию органический фазы.
Обнаружение с использованием флотации использует ту же методику, что и экстракция. Предел обнаружения можно существенно понизить, если осадок флотируется на поверхности раздела органической и водной фаз. Так, пределы обнаружения Ni 2+ по реакции с диметилглиоксимом составляют при открытии его:
в пробирке — 1,4 мкг
капельным методом — 0,16 мкг
флотацией на границе вода — эфир — 0,002 мкг.
Люминесцентные реакции обычно проводят на фильтровальной бумаге или на предметном стекле, реже — в пробирках. Свечение (флуоресценция или фосфоресцирование) существенно зависит от присутствия примесей, концентрации реагирующих веществ, природы растворителя, температуры, поэтому при выполнении этих реакций необходимо проводить контрольный опыт. Каплю контрольного раствора, содержащего все компоненты, кроме определяемого, наносят на фильтровальную бумагу рядом с анализируемым раствором. Техника нанесения растворов на бумагу обычная. Влажные пятна высушивают на воздухе и наблюдают люминесценцию при освещении ультрафиолетовым светом. Часто люминесцентные капельные реакции проводят при низкой температуре. Для этого пинцетом осторожно погружают бумагу в жидкий азот на 20–30 с, и сразу же после ее извлечения рассматривают в ультрафиолетовом свете.
Каталитические реакции проводят обычно в пробирках, наблюдая резкое увеличение скорости протекания реакции в присутствии определяемого иона
Литература к 10.1 и 10.2
1. Основы аналитической химии. Практическое руководство / Под ред. акад. Ю.А. Золотова. М.: Высшая школа, 2001.
2. Кунце У., Шведт Г. Основы качественного и количественного анализа. М.: Мир, 1997.
3. Скуг Д., Уэст Д. Основы аналитической химии. Т. 1. М.: Мир, 1979.
4. Харитонов Ю.Я. Аналитическая химия (аналитика). Общие теоретические основы. Качественный анализ. Кн. 1. М.: Высшая школа, 2001.
5. Основы аналитической химии. Общие вопросы. Методы разделения / Под ред. акад. Ю.А. Золотова. Кн. 1. М.: Высшая школа, 1996.
6. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. Книга 1. М.: Химия, 1990.
7. Ушакова Н.Н., Николаева Е.Р., Морсанова С.А. Пособие по аналитической химии. Качественный анализ. М: Изд-во МГУ им. М.В. Ломоносова, 1981.
8. Янсон Э.Ю., Путнинь Я.К. Теоретические основы аналитической химии. М.: Высшая школа, 1989.
9. Бончев П.Р. Введение в аналитическую химию / Пер. с болгарского. Л.: Химия, 1978.
10. Ляликов Ю.С., Клячко Ю.А. Теоретические основы современного качественного анализа. М.: Химия, 1978.
11. Керов В.А. Качественный химический анализ полумикрометодом без применения сероводорода. Руководство к лабораторным работам. Л.: Ленинградский ин-т киноинженеров. Л., 1972.
12. Коренман И.М. Органические реагенты в неорганическом анализе: Справочник. М.: Химия, 1980.
13. Крешков А.П. Основы аналитической химии. Кн.1. М.: Химия, 1965.
14. Ганина В.Г. Краткое руководство по качественному бессероводородному методу анализа / В.Г Ганина, З.В. Крайнова, Н.В. Курина и др. Горький: ГГУ, 1959.
15. Коренман И.М. Введение в количественный ультрамикроанализ. М.: Госхимиздат, 1963.
16. Бессероводородные методы качественного полумикроанализа / Под ред. проф. А.П. Крешкова. 2-е изд. М.: Высшая школа, 1979.
17. Тананаев Н.А. Капельный метод. Качественный анализ неорганических соединений капельным методом. М., Л.: Госхимиздат, 1954.
18. Алексеев В.Н. Курс качественного химического полумикроанализа. М.: Химия, 1973.
Аналитическая химия. Качественный и количественный анализ, титр
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
ОСНОВНЫЕ ПОНЯТИЯ АНАЛИТИЧЕСКОЙ ХИМИИ
Виды и методы проведения химического анализа
Аналитическая химия — наука о методах определения химического состава вещества и его структуры. Выделяют качественный и количественный анализ.
Качественный анализ — установление присутствия или отсутствия отдельных компонентов в анализируемом объекте.
Количественный анализ — определение содержания компонентов в анализируемом объекте. Качественный анализ предшествует количественному. Результат его — «да — нет».
В качественном анализе различают:
В зависимости от массы пробы вещества, используемого для проведения анализа, методы анализа классифицируют следующим образом:
Методы анализа подразделяются на химические и физико-химические (инструментальные). Химические методы анализа основаны на способности определяемого компонента вступать в химическую реакцию с последующим определением его количества.
Достоинства химического метода анализа:
Недостатки химического метода анализа
Химические реакции, пригодные для качественного анализа, должны сопровождаться заметным внешним эффектом. Это может быть:
В первых четырех случаях за протеканием реакции наблюдают невооруженным глазом, кристаллы рассматривают под микроскопом. Классификация видов химического анализа по объектам определения приведена в табл. 1.1.
Таблица 1.1 Классификация видов химического анализа по объектам определения
В физико-химических методах анализа конец реакции определяют не визуально, как в химических методах, а при помощи приборов, которые фиксируют изменения физических свойств исследуемого вещества.
Качественный анализ
Для получения достоверных результатов анализа конкретного иона необходимы реакции, выполнению которых не мешает присутствие других ионов. Для этого нужны специфические реагенты (взаимодействующие только с определяемым ионом).
Примером реакции с участием специфического реагента является выделение газообразного аммиака NH 3 при действии щелочей (KOH или NaOH) на вещество, содержащее ион аммония NH4 +. Ни один катион не помешает обнаружению иона NH4+, потому что только он реагирует со щелочами с выделением аммиака:
. Еще один пример — специфические реагенты на ионы железа. Специфический реактив гексацианоферрат (III) калия К3[Fе(СN)6] (красная кровяная соль) образует синий осадок (турнбуллева синь) только с ионами двухвалентного железа Fe 2+. Гексацианоферрат (II) калия K4[Fe(CN)6] (желтая кровяная соль) образует синий осадок (берлинская лазурь) только с ионами трехвалентного железа Fe3+. Специфический реагент на ионы меди (II) — аммиак:
Окрашивание пламени горелки является также способом определения некоторых катионов, т. е. качественной реакцией на их присутствие:
Li + — окрашивание пламени в красный цвет;
Na + — окрашивание пламени в желтый цвет;
K + — окрашивание пламени в фиолетовый цвет.
Селективные реагенты — это реагенты, которые реагируют лишь с немногими веществами. Диметилглиоксим (реагент Чугаева) служит примером селективного реагента в щелочной среде он реагирует с ионами Ni +2, Co +2, Fe +2; в кислой — только с ионами Pd +2.
К сожалению, селективных, а тем более специфических реагентов очень мало. Поэтому смеси катионов и анионов разделяют на части с помощью реактива, который называется групповым реактивом.
Действуя на смесь катионов в строго определенном порядке растворами соляной кислоты HCl, серной кислоты H2SO4, аммиака NH3 и гидроксида натрия NaOH, можно разделить содержащиеся в смеси катионы на шесть аналитических групп. Эти растворы называются групповыми реагентами, а схема — кислотно-щелочной (по используемым групповым реагентам).
В сероводородной схеме групповыми реагентами являются соляная кислота HCl, сероводород H2S и карбонат аммония (NH4)2CO3.
Разделение катионов на пять аналитических групп основано на различии свойств образуемых ими хлоридов, сульфидов и карбонатов:
Общепринятой классификации для разделения анионов, как для разделения катионов, не существует. Используют разделение анионов на три аналитические группы по растворимости солей бария и серебра.
Методы качественного анализа классифицируют следующим образом:
— анализ сложных смесей.
Количественный анализ
Количественный анализ проводят после проведения качественного химического анализа, т. е. после установления компонентов анализируемой пробы.
Например, общие свойства спиртов изучают химики-органики, а способы определения спиртов как класса органических соединений и каждого отдельного спирта (например, этанола) разрабатывают аналитики. Для этого они выявляют те особенности химических и физических свойств спиртов, которые отличают их от других органических соединений. Еще важнее выявить характеристические свойства отдельных спиртов (например, этанола), отличающие их друг от друга.
Изучение характеристических свойств индивидуальных объектов особенно важно в тех случаях, когда изучают материалы сложного состава, содержащие смеси родственных веществ.
Также аналитическая химия воспринимает и развивает знания, полученные в рамках смежных научных дисциплин. Разумеется, знания, полученные одной наукой и используемые другой, всегда существенно перерабатываются, подобно тому, как в организме продукты питания превращаются в новые соединения, а уже из них строятся собственные ткани организма. Эта аналогия подходит и для рассматриваемого случая. На основе творчески переработанных достижений других наук и собственных фундаментальных исследований аналитики выявляют общие закономерности химического анализа, создают новые методы и методики.
К химическим методам количественного анализа относятся:
В ходе количественного анализа можно выделить основные его этапы:
Волюмометрические методы анализа основаны на измерении объема реагента, израсходованного на взаимодействие с веществом.
Кинетические методы анализа заключаются в определении зависимости скорости химической реакции от концентрации реагирующих веществ.
Для решения аналитических задач довольно широко применяют биохимические реакции с участием ферментов, а также исключительно специфические реакции, протекающие по схеме «антиген — антитело» (иммуноанализ). Весьма перспективным способом получения информации о составе веществ оказалось изучение реакции живых клеток, тканей, органов и организмов на изменения в составе окружающей их среды. Естественно, соответствующие методы анализа создают на базе достижений биологических наук.
Методика исследования. Чтобы подобрать оптимальную (лучшую) методику химического анализа, в каждом случае следует учитывать ряд практических требований
1. Точность. Это главное требование. Оно означает, что относительная или абсолютная погрешность анализа не должна превышать некоторого предельного значения. Для разных видов анализа, безусловно, требуется разная точность. В одних случаях достаточно, чтобы результат был получен с относительной погрешностью, не превышающей 10 или даже 20%, в других — чтобы погрешность была менее 2 %. При проведении арбитражных анализов относительная погрешность не должна превышать 0,1 или даже 0,01%. Столь высокую точность могут дать лишь некоторые методы и немногие методики. 15 Не следует добиваться высокой точности, если она не требуется, ведь высокая точность обходится очень дорого.
2. Чувствительность. Этим понятием иногда заменяют более строгие термины «предел определения», «нижняя граница определяемых концентраций». Высокочувствительные методики — это те, по которым мы можем обнаружить и определить компонент даже при низком его содержании в исследуемом материале. Чем ниже ожидаемое содержание, тем более чувствительная методика требуется.
3. Селективность. Важно, чтобы на результат анализа не оказывали влияния другие вещества, входящие в состав пробы. Чем меньше таких веществ, чем слабее выражено влияние каждого из них, тем избирательнее методика. Если посторонние вещества вообще не воздействуют на результат анализа, методику называют специфической. Разработать селективную, а тем более специфическую методику анализа очень трудно. Примером может служить методика обнаружения гемоглобина, «созданная» героем одного из произведений А. Конан Дойля. Основным достижением Шерлока Холмса как химика-аналитика стала специфичность разработанной им методики; некий осадок образовывался только в присутствии гемоглобина, что достоверно указывало на наличие следов крови на одежде подозреваемого. На самом деле специфические и высокочувствительные методики обнаружения следов крови появились лишь в середине XX в. С их помощью теперь можно установить, принадлежит обнаруженная кровь человеку или животному, может она принадлежать подозреваемому или нет и т. п.
4. Экспрессность. Речь идет о продолжительности анализа одной пробы — от пробоотбора до выдачи заключения. Чем быстрее будут получены результаты, тем лучше.
5. Стоимость. Эта характеристика методики не требует комментариев. В массовом масштабе можно применять лишь относительно недорогие анализы. Стоимость аналитического контроля в промышленности обычно не превышает 1 % стоимости продукции. Очень дорого стоят уникальные по сложности и редко выполняемые анализы.
Существуют и другие требования к методике — безопасность выполнения анализа, возможность проводить анализ без непоредственного участия человека, устойчивость результатов к случайным колебаниям условий и т. п.
Для наиболее распространенных и часто выполняемых анализов методики изложены в специальных нормативных документах, например государственных стандартах (ГОСТах). В стандартных методиках используют распространенные приборы, общеизвестные способы расчета, привычные приемы анализа. Периодически (один раз в 5–10 лет) ГОСТы обновляют и утверждают заново.
Отбор средней пробы. Это очень важная стадия анализа. С отбора проб начинается проведение химического анализа. Техника отбора средней пробы описывается в специальных инструкциях, ГОСТах. Нужно найти такую пробу по составу, чтобы она отвечала действительному среднему составу анализируемого вещества. Особенно трудно выбрать среднюю пробу твердого вещества. В этом случае используются следующие действия размалывание, высверливание, распиливание, дробление.
При санитарно-эпидемиологической экспертизе отбор проб пищевых продуктов проводит, как правило, врач по гигиене питания, при его отсутствии — помощник санитарного врача. При производственном контроле его проводит специально обученный работник данного предприятия, имеющий свидетельство о прохождении обучения.
Порядок отбора проб пищевых продуктов при экспертизе партии включает выделение однородной партии, определение числа и отбор точечных проб, составление объединенной пробы и формирование из нее средней, которая направляется на лабораторные исследования. Экспертиза партии проводится в соответствии с действующей инструкцией о порядке проведения гигиенической экспертизы пищевых продуктов в учреждениях госсанэпидслужбы. Пример отбора и хранения проб представлен на рис. 1.1.
Рис. 1.1. Отбор и хранение проб тканей и кормов
Измерения в аналитической химии
Результаты количественного химического анализа оценивают такими метрологическими характеристиками, как правильность, воспроизводимость и точность.
Правильность — качество измерений, отражающее близость к нулю систематических погрешностей.
Воспроизводимость — качество измерений, выполненных в различных условиях, но свидетельствующих о близости результатов друг другу.
Точность — качество измерений, показывающее близость их результатов к истинному значению измеряемой величины. Точность измерения соответствует малым погрешностям всех видов. Количественно она выражается обратной величиной модуля относительной погрешности. Погрешность в расчетах приводит к получению неверных результатов химического анализа. Кроме того, есть еще погрешность (ошибка) измерений (∆). Это отклонение результата измерения (Х) от истинного значения измеряемой величины (μ). Абсолютная погрешность определяется по формуле:
относительная погрешность (%) — по формуле
Истинное значение можно получить путем анализа образца множеством различных независимых методов анализа. Анализ его проводят в форме межлабораторного эксперимента (проводится анализ разными лабораториями). Затем проводят оценку массива данных. Также можно использовать стандартный образец (с известным содержанием компонента) для анализа.
Если погрешность при повторных измерениях остается постоянной, то это систематическая погрешность (имеет знак плюс или минус). Если погрешность изменяется случайным образом, то это случайная погрешность (имеет знак и плюс, и минус). Грубые погрешности, существенно отличающиеся от истинного значения, называются грубой ошибкой.
Все погрешности зависят от класса точности прибора и от профессионализма химика-аналитика. Применение статистической обработки образцов рассмотрим на примере анализа пробы сточной воды. Трижды было определено содержание фенола стандартной методикой (DIN 38 409 H 16). Найдено среднее значение содержания фенола в пробе (0,51 гл). Предельно допустимая концентрация фенола в сточных водах в странах ЕС составляет 0,5 гл. Можно ли сказать, что концентрация превышена Статистические тесты помогут учесть степень разброса данных.
Предел обнаружения — минимальная концентрация вещества, которая может быть обнаружена методом. Возможность обнаружения вещества с помощью любой аналитической методики ограничена. Особенно это важно при определении следовых количеств веществ.
Основной химической величиной является количество вещества (n), а основной единицей измерения — моль. По определению, 1 моль — количество вещества, содержащее столько частиц, сколько атомов содержится в 0,012 кг изотопно чистого простого вещества 12 C. Оно составляет приблизительно 6,02214·10 23 частиц. Таким образом, по смыслу количество вещества есть число частиц, составляющих вещество. Эту величину не следует отождествлять ни с массой, ни с объемом, ни с какими иными физическими характеристиками.
Наряду с количеством вещества в химии широко используют и производные от него величины. Важнейшая из них — концентрация (c), представляющая собой количество вещества (n) в единице объема V:
Единица измерения концентрации — моль/л. В дальнейшем все химические величины, как само количество вещества, так и производные от него, мы будем обозначать собирательным термином «содержание».
При проведении анализа часто компонент переводится в раствор. Состав раствора количественно выражается через относительные величины — доли (массовые, мольные, молярные) и размерные величины — концентрации.
Массовая доля — безразмерная относительная величина, равная отношению массы компонента к общей массе образца, раствора, смеси веществ.
Единицей измерения массовой доли является также процент (сотая доля числа — %), промилле (тысячная доля числа, 110 доля процента — ‰), ppm (миллионная доля числа), ppb (миллиардная доля числа).
1‰ = 0,1 %, 1 ppm = 10 –4 %, 1 ppb = 10 –7 %.
Концентрация показывает отношение массы или количества растворенного вещества к объему раствора или массе растворителя.
Химический эквивалент
Это условная частица, которая может присоединять или высвобождать один ион водорода в кислотно-основных реакциях или один электрон в окислительно-восстановительной реакции. Под частицей понимается молекула, ион, электрон и т. д. Фактор эквивалентности f показывает, какая доля реальной частицы вещества эквивалентна одному иону водорода в реакции или одному электрону в окислительно-восстановительной реакции. Рассмотрим реакцию:
Фактор эквивалентности соляной кислоты f экв (HCl) = 1, f экв (Na2CO3) =12.
Для окислительно-восстановительной реакции:
Для реакций комплексообразования фактор эквивалентности определяют из числа координационных мест у комплексообразователя:
Масса одного моль-эквивалента сложного вещества (Мэ), называемая молярной массой эквивалента, равна молярной массе вещества М, деленной на число реакционноспособных химических связей (n х.св):
Число реакционноспособных химических связей n х.св в зависимости от класса соединения можно определить следующим образом:
— для кислот — число протонов (n H +);
— для оснований — число гидроксильных групп (n OH –);
— для солей — произведение числа катионов на его заряд (nkt * Zkt).
Эквивалентность реагирующих и образующихся веществ отражает закон эквивалентов.
Титр раствора
Титр раствора характеризует его концентрацию. Это масса вещества в 1 мл раствора
Т = m в-ва / V р-р, г/мл.
Например, титр раствора соляной кислоты Т(HCl) = 0,003648 г/мл показывает, что в 1 мл раствора кислоты содержится 0,003648 г HCl.
Запись Т(HCl/NaOH) = 0,004000 г/мл означает, что 1 мл раствора кислоты реагирует с 0,004000 г NaOH.
Титр (Т) раствора вещества связан с молярной концентрацией вещества в растворе:
Таким образом, использование законов аналитической химии позволяет разрабатывать и идентифицировать состав пищевых продуктов, устанавливать механизм их воздействия на организм человека. Необходимость количественной и качественной оценки питания обусловлена его влиянием на здоровье и работоспособность человека. При количественной оценке суточного рациона определяется не его объем, а энергия, высвобождающаяся при метаболизме в организме основных пищевых веществ. Качественная характеристика рациона исходит из содержания в нем отдельных пищевых веществ (белков, жиров, углеводов, витаминов, минеральных веществ) и их соотношений. Только при количественной достаточности и благоприятных соотношениях пищевых веществ обеспечиваются наиболее полное проявление их биологических свойств и максимальное использование, а также оптимальное течение обменных процессов.