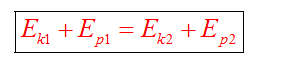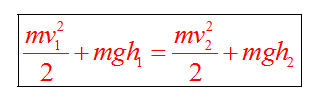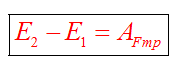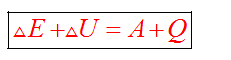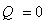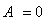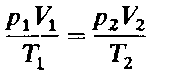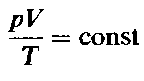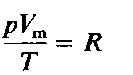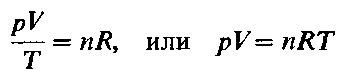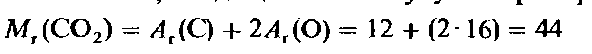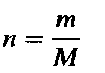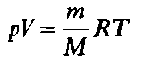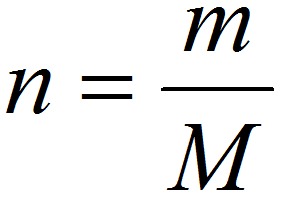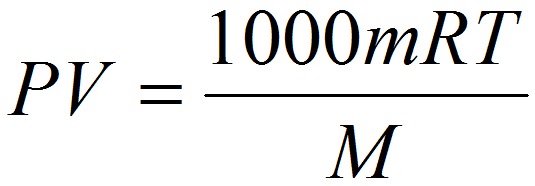Химия 10 класс кратко и понятно самое важное
Урок 17. Основные понятия органической химии
Известно, что все сложные вещества условно можно разделить на органические и неорганические.
В состав неорганических веществ может входить любой элемент периодической системы. Основными классами неорганических веществ являются оксиды, кислоты, основания и соли. Свойства этих веществ были рассмотрены в первых двух разделах.
В состав органических веществ обязательно входит атом углерода, который в подавляющем числе органических соединений образует цепи. Эти цепи имеют разную длину и разное строение, поэтому органических соединений теоретически может быть бесчисленное множество.
Основу любого органического соединения составляет углеводородная цепь, которая может соединяться с функциональными группами.
Свойства органического соединения описывают по схеме:
Прочитав очередной урок, попробуйте описать изучаемые соединения на любом примере, используя эту схему. И всё получится!
Предмет органической химии. Теория строения органических веществ
Органические вещества известны людям с давних пор. Ещё в древности люди использовали сахар, животные и растительные жиры, красящие и душистые вещества. Все эти вещества выделялись из живых организмов. Поэтому такие соединения стали называться органическими, а раздел химии, который изучал вещества, образующиеся в результате жизнедеятельности живых организмов, получил название «органическая химия». Это определение было дано шведским учёным Берцелиусом* в 1827 году.
* Берцелиус Йенс Якоб (20.08.1779–7.08.1848) — шведский химик. Проверил и доказал ряд основных законов химии, определил атомные массы 45 химических элементов, ввёл современное обозначение химических элементов (1814) и первые химические формулы, разработал понятия «изомерия», «катализ» и «аллотропия».
Уже первые исследователи органических веществ отмечали особенности этих соединений. Во-первых, все они при сжигании образуют углекислый газ и воду, значит, все они содержат атомы углерода и водорода. Во-вторых, эти соединения имели более сложное строение, чем минеральные (неорганические) вещества. В-третьих, возникали серьёзные затруднения, связанные со способами получения и очистки этих соединений. Полагали даже, что органические соединения невозможно получить без участия «жизненной силы», которая присуща только живым организмам, то есть органические соединения нельзя, казалось, получить искусственно.
И, наконец, были обнаружены соединения одинакового молекулярного состава, но различные по свойствам. Такое явление не было характерно для неорганических веществ. Если для неорганического вещества известен состав, то известны и его свойства.
А химики-органики обнаружили, что вещество состава С2Н6О у одних исследователей является достаточно инертным газом, а у других — жидкостью, активно вступающей в разнообразные реакции. Как это объяснить?
К середине 19-го века было создано немало теорий, авторы которых пытались объяснить эти и другие особенности органических соединений. Одной из таких теорий стала теория химического строения Бутлерова*.
* Бутлеров Александр Михайлович (15.09.1928–17.08.1886) — русский химик. Создал теорию химического строения органических веществ, лежащей в основе современной химии. Предсказал изомерию многих органических соединений, заложил основы учения о таутомерии.
Некоторые её положения были изложены А. М. Бутлеровым в 1861 году на конференции в г. Шпейере, другие были сформулированы позже в научных работах А. М. Бутлерова. В целом, основные положения этой теории в современном изложении можно сформулировать так.
1. Атомы в молекулах располагаются в строгом порядке, согласно их валентности.
2. Атом углерода в органических молекулах всегда имеет валентность равную четырём.
3. Порядок соединений атомов в молекуле и характер химических связей между атомами называется химическим строением.
4. Свойства органических соединений зависят не только от того, какие атомы и в каких количествах входят в состав молекулы, но и от химического строения:
5. Изучая свойства органических соединений, можно сделать вывод о строении данного вещества и описать это строение одной-единственной химической формулой.
6. Атомы в молекуле влияют друг на друга, и это влияние сказывается на свойствах вещества.
При изучении органической химии нужно чаще вспоминать эти положения и, прежде чем описывать свойства какого-либо вещества, следует указать его строение при помощи химической формулы, в которой будет показан порядок соединения атомов в молекуле — графическая формула.
Особенности строения органических соединений
Органическая химия изучает строение молекул и свойства соединений углерода, кроме самых простых (угольная и синильная кислоты и их соли).
В состав неорганических соединений могут входить любые из 114 известных в настоящее время химических элементов. Сейчас известно более 0,5 млн неорганических веществ.
В состав органических молекул обычно входят атомы 6 химических элементов: C, H, O, N, P, S. И тем не менее в настоящее время известно более 20 миллионов органических соединений.
Почему органических веществ так много?
Поскольку в состав любого органического соединения входит атом углерода, попробуем найти ответ на этот вопрос, рассмотрев особенности строения атома углерода.
Углерод — химический элемент 2-го периода, IV группы Периодической системы химических элементов Менделеева, следовательно, строение его атома можно изобразить так:
Таким образом, на внешнем уровне атома углерода находится четыре электрона. Являясь неметаллом, атом углерода может и отдавать четыре электрона, и принимать до завершения внешнего уровня также четыре электрона. Поэтому:
В состав углеродных цепочек может входить разное число атомов углерода: от одного до нескольких тысяч. Кроме того, цепочки могут иметь разное строение:
Между атомами углерода могут возникать химические связи разного типа:
Поэтому всего лишь четыре (!) атома углерода могут образовать более 10 соединений разного строения, даже если в состав таких соединений будут входить только атомы углерода и водорода. Эти соединения будут иметь, например, следующие «углеродные скелеты»:
Задание 17.1. Попробуйте составить сами 2–3 цепочки атомов углерода иного строения из четырёх атомов углерода.
Выводы
Способность атомов углерода образовывать УГЛЕРОДНЫЕ ЦЕПИ разного состава и строения — главная причина многообразия органических соединений.
Классификация органических соединений
Поскольку органических соединений очень много, их классифицируют по разным признакам:
В данном пособии будут рассмотрены свойства соединений различных классов, поэтому определения и примеры будут даны позднее.
Формулы органических соединений
Формулы органических соединений можно изображать по-разному. Состав молекулы отражает молекулярная (эмпирическая) формула:
Но эта формула не показывает расположения атомов в молекуле, т. е. строения молекулы вещества. А в органической химии это понятие — химическое строение молекулы вещества — самое главное! Последовательность соединения атомов в молекуле показывает графическая (структурная) формула. Например, для вещества строения С4Н10 можно написать две такие формулы:
Можно показать все химические связи:
Такие развёрнутые графические формулы наглядно показывают, что атом углерода в органических молекулах четырёхвалентен. При составлении графических формул нужно сначала изобразить углеродную цепь, например:
Затем чёрточками обозначить валентность каждого атома углерода:
У каждого атома углерода должно быть четыре чёрточки!
Затем заполнить «свободные» валентности атомами водорода (или другими одновалентными атомами или группами).
Теперь можно переписать эту формулу в сокращённом виде:
Если вы хотите сразу написать такую формулу для бутана — ничего сложного нет, нужно только считать до четырёх. Изобразив углеродный «скелет», нужно задать себе вопрос: сколько валентностей (чёрточек) имеет данный конкретный атом углерода?
Две. Значит, нужно добавить 2 атома водорода:
Следует помнить, что графические формулы можно записывать по-разному. Например, графическую формулу бутана можно записать так:
Поскольку последовательность расположения атомов не нарушилась, то это формулы одного и того же соединения(!) Проверить себя можно, составив названия этих соединений (см урок 17.7). Если названия веществ совпадают, то это — формулы одного и того же вещества.
Изомерия
К середине 19-го века, когда было получено и изучено достаточно много органических соединений, химики-органики обнаружили непонятное явление: соединения, имеющие одинаковый состав, имели разные свойства! Например, газ, который с трудом вступает в реакции и не реагирует с Nа, имеет состав C2H6O. Но существует жидкость, имеющая тот же состав и очень активная в химическом отношении. В частности, эта жидкость состава C2H6O активно реагировала с Na, выделяя водород. Совершенно разные по физическим и химическим свойствам вещества имеют одинаковую молекулярную формулу! Почему? Ответ на этот вопрос можно получить при помощи теории строения органических соединений Бутлерова, одно из положений которой утверждает: «Свойства органических соединений зависят от химического строения их молекул».
Так как химические свойства рассматриваемых соединений различны, значит, их молекулы имеют разное строение. Попробуем составить графические формулы этих соединений. Для вещества состава C2H6O можно предложить только два вида цепочек:
Заполнив эти «скелеты» атомами водорода, получаем:
Вопрос. Какое из этих соединений способно реагировать с Nа, выделяя водород?
Очевидно, к такому взаимодействию способно только вещество (I), содержащее связь «О–Н», которой нет в молекуле (II). И газ Н2 выделяется потому, что разрушается связь «О–Н». Если бы для образования водорода нужно было бы разрушить связь «С–Н», то поскольку такие связи есть в обоих веществах, газ Н2 выделялся бы в обоих случаях. Таким образом, формула (I) отражает строение молекулы жидкости, а формула (II) — газа.
Существование соединений, которые имеют одинаковый состав, но разное химическое строение, называется изомерией.
ИЗОМЕРЫ — это соединения, которые имеют одинаковый состав, но разное химическое строение, а значит, и разные свойства.
Поэтому молекулы органических соединений следует изображать при помощи графических (структурных) формул, так как в этом случае будет видно строение изучаемого вещества, а значит, будет видно, как и за счёт чего происходит химическая реакция.
Упражнение 17.1. Среди следующих соединений найдите изомеры:
Решение. Поскольку изомеры имеют одинаковый состав, определим состав (молекулярные формулы) всех этих соединений, то есть пересчитаем число атомов углерода и водорода:
Ответ. Соединения а) и б) изомерны друг другу, так как имеют одинаковый состав C4H10, но различное химическое строение.
Соединения в) и г) изомерны друг другу, так как имеют одинаковый состав C5H12, но различное химическое строение.
Задание 17.2. Среди следующих соединений найдите изомеры:
Гомологи
Из того же положения теории строения органических соединений Бутлерова следует, что вещества, имеющие похожее (сходное) строение молекул, должны иметь и похожие (сходные) свойства. Органические соединения, которые имеют похожее строение, а, значит, и похожие свойства, образуют гомологические ряды.
Например, углеводороды, в составе молекул которых есть только одна двойная связь, образуют гомологический ряд алкенов:
Углеводороды, в молекулах которых имеются только простые связи, образуют гомологический ряд алканов:
Члены любого гомологического ряда называются ГОМОЛОГАМИ.
Гомологи — это органические соединения, которые похожи по химическому строению и, значит, по свойствам. Гомологи отличаются друг от друга по составу на группу СН2 или (СН2)n.
Убедимся в этом на примере гомологического ряда алкенов:
Задание 17.3. Сравните состав членов гомологического ряда алканов (гомологов алканов) и убедитесь, что по составу они отличаются на группу СН2 или (СН2)n.
Выводы
Гомологи похожи по строению, а значит, и по свойствам; гомологи отличаются по составу на группу СН2. Группа СН2 называется гомологической разностью.
Названия углеводородов. Правила международной номенклатуры
Для того чтобы понимать друг друга, нужен язык. Люди говорят на разных языках и не всегда понимают друг друга. Химики же, для того чтобы понимать друг друга, пользуются одним и тем же международным языком. Основу этого языка составляют названия соединений (номенклатура).
Правила номенклатуры (названий) органических соединений были приняты в 1965 году. Они называются правилами ИЮПАК (IUPAC)*.
* IUPAC — International Union of Pure and Applied Chemistry — Международный союз чистой и прикладной химии.
За основу названий органических соединений принимаются названия гомологов-алканов:
** Для этих соединений имеется ввиду, что они имеют линейное строение.
В этих названиях КОРНИ слов (полужирный шрифт) — мет-, эт-, проп- и так далее — указывают на число атомов углерода в цепи:
Задание 17.4. Сколько атомов углерода содержит углеродная цепь соединений:
Суффикс в названии указывает на характер (тип) связей. Так, суффикс -ан- показывает, что все связи между атомами углерода простые.
Задание 17.5. Вспомните, что такое гомологи, и установите, являются ли гомологами алканов следующие вещества:
В названиях могут быть и другие суффиксы:
Упражнение 17.2. Попробуйте составить графические формулы ЭТана, ЭТена и ЭТина.
Решение. Все эти вещества имеют корень -ЭТ-, то есть в состав этих веществ входит . атома углерода. В первом веществе имеется . связь, так как суффикс -ан-:
Рассуждая аналогично, Вы получите:
Предположим, нужно изобразить графическую формулу пропина.
1. Корень -проп- указывает, что в цепи 3 атома углерода:
2. Суффикс -ин- указывает, что имеется одна тройная связь:
3. Каждый атом углерода имеет валентность IV. Поэтому допишем недостающие атомы водорода:
Задание 17.6. Составить графическую формулу пропена.
Теперь, предположим, нужно составить графическую формулу бутена. Корень -бут- означает, что в цепи имеется 4 атома углерода, суффикс -ен- указывает, что имеется двойная связь. Но где расположена эта связь? Возможны варианты:
Значит, в этом случае необходимо обозначить место двойной связи. Для этого атомы углерода нумеруют. Нумерацию начинают с того конца углеродной цепи, к которому ближе кратная двойная связь:
Хотя двойная связь в каждом случае соединяет два атома углерода, после суффикса -ен- записывают меньший номер.
Задание 17.7. Составьте графические формулы соединений: а) пентен-2; б) бутин-1.
Ранее было сказано, что углеродные цепи могут быть линейными и разветвлёнными. Мы научились составлять названия линейных углеводородов. Теперь рассмотрим правила составления названий разветвлённых углеводородов. Для этого вспомним, что разветвлённые углеводороды имеют ответвления (боковые цепи, радикалы) от основной цепи:
Ответвления от основной (главной) цепи называются радикалами.
Радикалы по составу отличаются от соответствующего углеводорода на один атом водорода:
Названия радикалов предельных углеводородов имеют суффикс -ил-:
Правила составления названий углеводородов:
1) выбрать главную цепь: она должна быть самой длинной и самой разветвлённой (содержать максимальное число радикалов);
2) атомы углерода, которые не вошли в состав главной цепи, образуют боковые цепи (радикалы);
3) нумерацию атомов главной (основной) цепи начинают с того конца, от которого ближе кратная связь, а для предельных углеводородов — с того конца, к которому ближе радикал. В любом случае сумма номеров, которые появились в названии, должна быть наименьшей;
4) перед названием радикала ставят номер атома углерода (адрес), с которым он соединён;
5) если одинаковых радикалов несколько, то их число обозначают так:
6) затем записывают названия соответствующих радикалов (начиная с самых простых) и в конце названия записывают название углеводорода — основной цепи, указывая тип связи и место положения этой связи.
Упражнение 17.3. Назвать углеводород:
1. Выберем самую длинную цепь; в данном случае она содержит 5 атомов углерода: корень — пент.
2. Все связи простые: суффикс -ан-. Получается: пентан.
3. Нумеруем главную цепь слева направо, так как к левому концу ближе радикал «метил-»:
4. У второго атома углерода и у третьего атома углерода имеется по одному радикалу «метил-», то есть всего два радикала «метил-»; обозначим их «ди»; получаем: 2,3-диметил…
5. У третьего атома углерода есть ещё один радикал «этил-», поэтому получаем:
Упражнение 17.4. Назвать:
Пример. Составить графическую формулу углеводорода: 3,3-диметилбутен-1.
1. Определим число атомов углерода в основной цепи:
2. Определим тип химической связи в основной цепи:
3. Составляем «углеродный скелет»:
4. У атома углерода № 3 имеется два (ДИ) радикала «метил», т. е. каждый радикал имеет один атом углерода:
5. Допишем атомы водорода согласно валентности:
Задание 17.8. Составьте структурные (графические) формулы:
Химия
План урока:
Что такое органическая химия?
Современное определение органической химии:
– это раздел химической науки, который изучает способы получения углеводородов и их производных, а также свойства, полученных веществ.
Не стоит думать, что предмет органической химии очень узкий, раз объект его исследований можно описать только 2 словами, поскольку количество углеводородов и их производных достаточно превышает все неорганические вещества вместе взятые.
История изучения органической химии
Развитие органической химии, как отдельной науки, началось недавно, но с предметом ее исследования люди были знакомы очень давно.
Первые вещества органической химии получались из живых организмов – растений и животных. Например, духи изготавливались из растительных масел, спирт синтезировали благодаря брожению винограда, а красные красители и вовсе из специальных червей. Поскольку получить искусственно такие вещества из неорганических материалов люди не могли, то предположили, что для их создания нужна «живая сила».
В 1827 году понятие органической химии было введено шведским ученым Й.Я. Берцелиусом.
В 1845 году немецким ученым Г. Кольбе было доказано, что органическое вещество можно добыть из неорганических соединений, и в качестве примера он показал получение уксусной кислоты из углерода, воды, серы и хлора.
В мире стал развиваться новый предмет, получивший название «химия органического синтеза».
С помощью химического анализа было показано, что при сжигании любого органического вещества, продуктами будут вода и углекислый газ, а в отдельных случаях чистая сажа или копоть, основу которых составляет уголь.
Современная задача органической химии – изучить вещества, молекулы которых образованы связями атомов углерода.
Характеристика основного элемента органической химии
Чтобы определить свойства и потенциальные возможности вступления в химические превращения какого-либо элемента, необходимо знать особенности его строения. Какие будут образовываться химические связи и каким образом их можно разорвать зависит от элемента.
Общее строение атома углерода
Зная эти основные цифры, можно подробно разобрать схему строения углеродного атома. У него 2 составляющие: ядро,заряженное положительно и электроны, которые заряжены отрицательно и находятся в пространстве вокруг него.
Порядковый номер элемента численно равен заряду ядра и числу в нем электронов. Число нейтронов вычисляется по формуле:
где А – массовое число, Nп – число протонов, Nн – число нейтронов.
Получаем, что количество нейтронов равно: Nн = А – Nп = 12-6 = 6
На рисунке 1 видно наглядно, какое строение у атома углерода.
Рисунок 1. – Строение атома углерода
Подробное электронное строение атома углерода
Ядро элемента не несет интереса в описаниях химических реакций, так как связи образуются при объединении электронных оболочек. При их связывании и перераспределении электронной плотности образуются новые молекулы.
Электронная структура
По расположению в ПСХЭ наглядно видно, что углерод имеет:
На первом энергетическом уровне в s-орбитали у всех элементов находятся 2 электрона. (см.рис.1). Второй уровень, он же и внешний для углерода, состоит из одной s и трех p орбиталей, и расположение электронов в них зависит от того, в каком состоянии находится атом.
Основное и возбужденное состояние
В основном состоянии на s и p орбиталях расположено по 2 электрона.
Если электрону, находящемуся на s-орбитали, добавить некоторое количество энергии из вне, то он может «перескочить» в пустую p-орбиталь с большей энергией.
Возбужденное состояние атома углерода представляет собой такую конфигурацию, при которой на внешнем уроне каждая его орбиталь имеет по 1 электрону.
Переход из основного состояния в возбужденное называется активацией.
На рисунке 2 схематически изображен процесс активации.
Рисунок 2. – Переход электрона с 2s-орбитали на 2p-орбиталь под действием дополнительной энергии
Атом углерода образует связи с другими элементами и между собой благодаря объединению неспаренных электронов. Если сравним конфигурацию атома углерода в возбужденном состоянии с конфигурацией в основном, можно сделать вывод о том, что в возбужденном состоянии он способен образовать больше ковалентных связей. В этом состоянии ему нужно быстро находить в окружении себя другие элементы и химически с ними связываться, так как при отсутствии дополнительной энергетической подпитки электрон снова перейдет с p-орбитали на s.
Знание о возбужденном состоянии атома углерода позволило в дальнейшем описывать механизмы реакций, рисовать структурные формулы веществ и описывать расположение молекул в пространстве.Полученные знания в 1861 году обобщил А.М. Бутлеров.
Степень окисления
В любых соединениях степень окисления определяет, какой условный заряд имеет тот или иной элемент в молекуле, если бы все связи были ионные.
Таблица 1. – Постоянные степени окисления элементов
Молекула спирта имеет формулу СH3-CН2-ОН, найдите значения степеней окисления атомов углерода в ней.
Разбиваем молекулу по связям С-С на участки. Получаем частицы СН3— и –СН2OH.
Для тренировки постарайтесь найти степень окисления углерода в соединениях, формулы которых: СH3CH2CH3, CH2CHCOH; CH3C(NH2)CH2CH2OH.
Валентность атома углерода
Под валентностью понимают, что это то количество связей, которые образовывает химический элемент. Один из основополагающих законов органической химии гласит, что в органических соединениях у атома углерода валентность постоянна и равняется 4 (т. к. в возбужденном состоянии у него 4 неспаренных электрона)
Углеродные связи в органических веществах
В ходе протекания химической реакции органические вещества претерпевают изменения, поскольку происходит разрушение старых и образование новых связей. Глядя на молекулу, опытный химик-органик скажет, какая именно связь разрушится, под действием каких факторов и предскажет, какие продукты и какого строения получатся в конце превращения.
Одинарные химические связи углерода
При объединении 2 неспаренных электронов 2 разных элементов, образуется одинарная связь.
Рассмотрим на конкретном примере, каким образом можно изобразить на бумаге структурные формулы веществ,имеющих состав С4H9Cl.
Помня о том, сколько связей может образовывать атом углерода, рисуем углеродный скелет органической молекулы (см. рис.3 а). Связи между атомами углерода ковалентные неполярные, т.к. образованы элементами с одинаковой электроотрицательностью.
Затем добавим к этому углеродному скелету атомы водорода и хлора (см. рис 3 б). Образовавшиеся связи хлор-углерод и углерод-водород – ковалентные полярные, т.к. образованы элементами с разной электроотрицательностью.Кроме изображенной на рисунке структурной формулы, для вещества состава С4H9Cl можно записать и некоторые другие (см. рис. 3 в). Ковалентные связи, образуемые атомом углерода, позволяют создать огромное количество соединений, у которых физические и химические свойства будут уникальны.
Рисунок 3. – Этапы построения органической молекулы
Формулу органического соединения, представленного на рисунке 3 б, можно записать проще, не изображая столько разветвлений.
Кратные связи углерода
В некоторых молекулах атомы углерода могут образовывать двойные и даже тройные связи. Это такой тип связей, на которые стоит обращать внимание, изучая строение веществ, потому что их наличие в молекуле придает соединению определенные свойства. Например, соединения с чередующимися кратными и одинарными связями могут проводить электрический ток.
Помимо кратных связей между собой, атом углерода образует двойные связи и с другими элементами (N, P, O, S). На схеме ниже представлен пример органической молекулы, которая содержит связи разных типов.
Разнообразие органических молекул
Молекулы органических соединений являются «кирпичиками» в построении живой материи и различных веществ. На свойства таких веществ влияет количество атомов в молекуле и их расположение друг относительно друга в пространстве. По строению органических молекул определяют их реакционные способности, цвет и токсичность.
Знание строения материалов позволило выбирать самые качественные для использования в постройке домов, автомобилей, ракет и многих других конструкций.
Одна из задач химиков-органиков получить материалы с определенным порядком расположения молекул.
Форма, объем, а также расположение молекулы в пространстве, зависят от того, в каких направлениях в ней связаны атомы. Это может быть объемная структура, расположение в одной плоскости или линяя.
Если бы мы рассмотрели расположение орбиталей в возбужденном состоянии атома углерода, и присоединили другие элементы к его s и p орбиталям, то все получившиеся молекулы имели бы строго объемное строение, однако на практике это не так. Чтобы объяснить расположение атомов в молекуле и пространстве, было предложено понятие гибридизации.
Гибридизация
Гибридизация – объединение орбиталей атома, которые имеют разные формы (s и p). Объединенные орбитали получаются с одинаковой формой, размером и энергией (рисунок 4).
Объединяться могут не только s и p орбитали, но и d и f, однако в атоме углерода таких нет, поэтому на уроках органической химии их объединения рассматриваться не будут.
Рисунок 4. – Образование гибридных орбиталей из s и p
Основные типы гибридизации атома углерода в молекулах
Наглядно разберемся, как можно представить объединение орбиталей.
Предположим, что у нас есть синяя краска и белая краска, и мы в палитре их объединяем, т.е. смешиваем. При «смешении» мы получили краску нового голубого цвета. Тоже самое происходит и с орбиталями в атоме, только смешиваются не цвета, а формы и энергии.
Объединение орбиталей в углероде может проходить по 3 путям:
Зная, как гибридизация влияет на взаимное расположение атомов друг относительно друга, можно изобразить схематически строение молекулы любого органического вещества.
Рассмотрим молекулу, в которой есть участки с одинарными, двойными и тройными связями, и изобразим ее в пространстве (см.рис. 5).
Рисунок 5. – Пространственное расположение молекулы, в которой есть одинарные и кратные связи.
Стоит отметить, что представленные типы гибридизаций атомов в молекулах, характерны не только органическим соединением, но многим неорганическим веществам.
Важнейшие представители органических соединений
Соединения, у которых небольшое количество атомов в молекуле, простые структурные формулы и из которых путем последовательных химических реакций можно получить все остальные химические вещества, называют фундаментальными.
Самые простые органические соединения
Вещества, состоящие только из 2 видов атомов, называются простейшими. В органической химии соединения, образованные только атомами углерода и водорода, называют простыми. На их основе можно создавать другие классы органических веществ, путем замены водорода на другие группы, называемые функциональными.
Общая классификация органических молекул
Классификация органических соединений начинается с анализа углеродного скелета молекулы. Он может быть замкнутый в «кольцо» или в виде цепочки (по-научному: циклический и ациклический).
Циклические соединения делятся на те, в которых цикл состоит только из атомов углерода (тогда такие называются карбоциклические) и на те, у которых помимо него есть еще другой элемент (тогда такие соединения называют гетероциклические).
Карбоциклические подразделяются по наличию кратных связей в цикле на ароматические (когда цикл содержит кратные связи) и алициклические (в которых кратных связей не содержится).
Ациклические делятся на соединения, которые состоят только из одинарных связей (такие соединения называются предельными) и те, которые содержат в структуре углеродного скелета кратные связи (такие соединения называют непредельными).
Классификация углеводородов
Углеводороды можно разделить на разные группы по аналогичным признакам классификации органических соединений.По видам связей углеводороды делятся на те, в которых:
Каждый класс соединений вступает в химические реакции по определенным механизмам и будет рассмотрен более подробно на последующих уроках.
Агрегатные состояния простых органических веществ
Органические вещества выпускаются в мире в промышленных масштабах. Поступающие на завод вещества, называются сырьем, а выпускаемые из него – целевым продуктом.
В зависимости от того, какое сырье использует предприятие, его доставка может осуществляться разными способами: трубопроводами или с помощью транспортировочных машин.
Основная сырьевая база для производства сложных веществ и материалов – углеводороды, которые впоследствии претерпевают химические изменения и превращаются в другие вещества, которые используют для создания более сложных продуктов, например лекарств, пластмасс, клеев, пленок и др.
Самыми востребованными веществами из углеводородов являются этен и этин (вещества, в которых содержится только 2 атома углерода, которые соединены двойной и тройной связью).
Газообразные углеводороды
Этен и этин представляют собой газообразные органические вещества и для их транспортировки используют специальные газовые трубопроводы и баллоны, где они хранятся в сжиженном виде.
Изготавливают из них полимеры, например, полиэтиленовые пакеты или реактивы для более узкого органического синтеза.
Обычно, вещества в газообразном состоянии имеют в составе молекул от 1 до 4 углеродных атомов.
Жидкие органические вещества класса углеводородов
Состав таких веществ обычно подразумевает наличие атомов в своем составе больше, чем в молекулах газообразных веществ. Из-за утяжеления молекул их подвижность падает и в них могут образовываться межмолекулярные связи.
Для их транспортировки используют бочки, трубопроводы и цистерны. В составе молекул в жидком состоянии содержится от 5 до 18 атомов углерода.
Твердые углеводороды
Если увеличивать количество углеродных атомов в структуре органической молекулы, то углеводороды будут представлять из себя твердые, но пластичные материалы. Примером такого органического вещества является воск или парафин, в состав которых входят тяжелые углеводороды.
Для их транспортировки используют грузовые машины, а складывают их в коробки или ящики.
Кратко примеры агрегатных состояний органических веществ представлены в таблице 2.
Таблица 2. – Агрегатные состояния органических веществ
Бесплатные видеоуроки для учеников 1‑11 классов и дошкольников
Большая коллекция из 3243 видеоурока по 20 предметам и различным темам
Предмет химии. Вещества
Предмет органической химии
Химические уравнения
Основные сведения о строении атомов
Степень окисления. Бинарные соединения
Взаимодействие атомов элементов-неметаллов между собой
Строение электронных оболочек атомов
Оксиды, их классификация и свойства
Электролитическая диссоциация
Ионные уравнения
Количество вещества. Молярная масса
Электроотрицательность. Ковалентная полярная связь
Не нашли нужный видеоурок?
Давайте закроем пробел в знаниях вместе. Наши специалисты с удовольствием Вам помогут! Первое вводное занятие бесплатно!
Нам важен каждый Ваш отзыв о репетиторах
Отличный учитель, который всегда вовлекает ученика в процесс, и сам проявляет заинтересованность в успехах ученика. Интересно слушать и работать!
Очень качественные и продуктивные занятия. Занимаюсь не долго, но уже чувствуется прогресс. Очень милый и добрый преподаватель. Всё понятно объясняет. Мне, очень нравится заниматься математикой с Елизаветой Владимировной.
Мне понравилось заниматься с Андреем Юрьевичем. Впервые встречаю репетитора, который прежде учить языку, рассказывает про его истоки – географию, культуру, историю. Мне очень откликается такой подход. Видно, что преподаватель с большим опытом. Я очень довольна первым занятием! Буду продолжать заниматься с данным преподавателем.
Ответственная, настойчивая, харизматичная, пунктуальная, высокий уровень проф подготовки, терпеливая. Наша девочка довольна, проявляет явный интерес к урокам и продвинулась в изучаемой теме. Большое спасибо вам и преподавателю Татьяне Александровне.
Прекрасный преподаватель. После восьми занятий английский стал намного лучше, многое узнала. Все понятно в объяснении, уроки на позитиве. Благодарна за работу. Искренне рекомендую.
Все понравилось приятно работать с учителем. Как по мне лучше чем Елена Александровна я еще не видела учителя по русскому языку.
У Дианы Михайловны занимаются английским языком две дочери: Есения и Ксения. Девочкам очень нравится преподаватель и наполнение уроков, материал преподносится в очень интересной форме, а все объяснения понятны и доступны. Девочки уже показали успехи в изучении английского языка в школе.
Дмитрий прошел со Светланой Анатольевной 4 занятия и уже виден прогресс! Мальчик по натуре немного застенчивый, поначалу был немногословен, но уже хорошо разговаривает на уроках, что говорит о профессионализме педагога.
Спасибо огромное. Очень рады, что нашли этот ресурс для занятий. Ирина Сергеевна объясняет все быстро, понятно и динамично. Всего за несколько занятий наверстали упущенное по химии и прошли дальше. Обязательно будем обращаться в дальнейшем.
У Елизаветы есть успехи, занимается с удовольствием и заинтересованностью. Римма Николаевна очень интересно преподносит материал. Очень нравится учитель, занимаемся с удовольствием.
Нам понравилась Нина Ивановна, хороший человек и прекрасный педагог. Очень ответственная, трудолюбивая и толковая. Сразу нашла подход к ученику. Доходчиво объяснит любую тему. Преподаватель, в отличии от многих репетиторов не просто отбывает время, а действительно помогает.
Замечательный педагог, нашла подход с первых занятий. Все очень доходчиво и понятно объясняет. Ребенку очень нравится, просит дополнительные часы для занятий.
Добрый день! Рита Ивановна очень профессионально оценила все пробелы моего сына и нам бы хотелось продолжить с ней обучение! Занятия очень хорошие, учитель понятно все объясняет, всем рекомендую.
Спасибо Ольге Олеговне за проведённый урок в праздничный день. Здоровья, процветания, побольше радостных событий в жизни, благополучия, успехов и удачи в таком не лёгком и таком нужном труде. Спасибо за урок, всё понравилось!
Очень грамотный педагог, хорошо подходит к вопросам с которыми обращаемся, подход к ребенку очень понравился, буквально на 5-8 урок у ребенка был уже прогресс и теперь любит математику. На урок математики приходим с удовольствием, подтянули свои недочеты, решаем быстро примеры, а главное сами. Спасибо за знания!
Светлана Михайловна очень хороший учитель, за урок мы разбираем много вопросов и обсуждаем правила русского языка в каждом конкретном примере. Занимаюсь с удовольствием!
Замечательный, приятный и внимательный преподаватель. Ребенок сначала засмущался от непривычного формата урока, но Дарья Александровна, в итоге, смогла завоевать внимание и доверие дочери. Обязательно будем продолжать обучение! Спасибо!
Репетитор быстро оценила проблемы, порекомендовала способы восполнения пробелов. Продолжим заниматься дальше, так как Светлана Васильевна доступно объясняет материал, и все сразу становится понятным. Классный репетитор, советую!
На уроке педагог работала по индивидуальной программе, выявила пробелы в знаниях и все доходчиво разъяснила. Сложные темы, объяснили легко и понятно, сыну все очень понравилось!
Замечательный педагог и очень доброжелательный человек. Тамара Иосифовна очень доходчиво объяснила непонятные для меня моменты, причем из разных тем, за один урок. Урок проходил в спокойной и дружественной обстановке. Спасибо большое. Очень понравилось.
Спасибо большое, Вы лучший преподаватель по информатике. Как хорошо, что есть такая замечательная платформа. Спасибо всем, кто ее организовал и Вам лично. Всем друзьям и знакомым буду рекомендавать! онлайн-уроки.
Очень понравился урок! Ирина Ивановна с первых минут расположил к себе ребёнка так, что даже мой непоседливый и не очень настроенный на учебу пятиклассник увлекся так, что не заметил, как пролетели 45мин. Спасибо! С удовольствием продолжим занятия!
Мне очень понравилось вводное занятие, спасибо большое. За пол часа Марина Михайловна с помощью разговора поняла все мои слабые места и помогла многие из них подправить и понять. Я хочу заниматься с ней и далее.
Здравствуйте! У нас был пробный урок с Галиной Дмитриевной по математике. Занимались именно логическими задачами. Учитель имеет очень хороший подход к детям и у нее есть своя отработанная хорошая методика. Хорошо объясняет, приятная. Спасибо!
Благодарим за интересное и познавательное занятие! Преподаватель четко и внимательно ведет занятие, обращает внимание на моменты, которые необходимо доработать. Профессионально! Приятно общаться.
Добрый день! Мы безумно рады, что нам посчастливилось найти такого замечательного и удивительного педагога, как Анастасия Сергеевна! Она очень интересно проводит урок, ребёнок безумно рад. Сразу чувствуется, что человек талантливый. С нетерпением ждём новый урок.
Спасибо за урок! Занятие очень понравилось, Сергей Васильевич все понятно и интересно обьясняет, во время урока была доброжелательная атмосфера. Также учитель посоветовал некоторые книги и способы подготовки к экзамену. Спасибо.
Нравятся все педагоги с которыми мы занмаемся, все обладают высоким уровнем профессионализма,используют интересные и современные методы и технологии обучения. Имеет хороший уровень научно-методической подготовки. Ребенок занимается с большим интересом. Будем заниматься с Вами до окончания школы, сейчас мы в 4 классе)
За 45 минут узнала и поняла больше, чем за полгода в школе. Учитель объясняет очень понятно, доходчиво, выше школьного уровня. Однозначно этот урок не последний. С Уважением, Феона.
Спасибо, Наталья Васильевна! Профессионально, четко, по делу. Педагог очень терпеливая, спокойная, уверенная. Занятие очень понравилось и ребенку и мне, маме.
Николай Васильевич помог за короткий срок восполнить пробелы в знаниях, за что очень благодарны! Уроки очень интересные! Будем обращаться еще к нему.
Занятия ребенку с Александром Сергеевичем очень нравятся. Все схватывает, доволен уроками. С репетитором нашли общий язык. Мы очень благодарны Александру Сергеевичу! Хороший педагог. Спасибо.
Дети понимают всё, абсолютно. В школе не понимают ничего, а с Вашими репетиторами понимают всё. Сдвиги очень большие. Алёна Игоревна хороший педагог. Все занятия результативные.
Плохо знаю русский язык, и постоянно делаю многие ошибки в тексте и в работе. Только благодаря достуным объяснениям учителя я мог самостоятельно находить ошибки. Большое спасибо за Вашу работу и сердечные помощи в изучении русского языка!
Мой сын занимался с Ириной Алексеевной, очень понравилось, всё спокойно и понятно было показано, рассказано. Очень профессионально и качественно выстроены занятия, учитель доброжелателен, ребенку интересно заниматься.
До этого никогда не занимался у репетиторов, думал что буду сидеть ничего не понимать и всё время уйдёт зря. Однако Сарвар Шодиевич очень понятно объясняет, не подчёркивает ваши «незнания» и до упора старается всё разъяснить. Могу с уверенностью посоветовать этого репетитора каждому, кто хочет разобраться в алгебре и геометрии.
Выражаю благодарность центру где есть такие сильные и ответственные учителя. Отдельная благодарность Людмиле Евгеньевне за опыт за знания.
Ольга Александровна отлично объясняет темы, с ребенком нашла общий язык моментально. Дочь занимается с удовольствием, пробелы подтянули за пару уроков. Спасибо Вам большое!
Сыну очень понравилось заниматься с Гузалией Робертовной. Очень внимательный и доброжелательный педагог, который сразу видит слабые стороны. Всячески поощряет ребёнка и помогает поднять самооценку. Большое спасибо!
Нравится, как преподает Мария Никитична (по программе школы + присутствует игровая минутка, ученице на занятиях не бывает скучно) Уровень знаний повысили до 5-ки, значительно расширили словарный запас. Все устраивает, рекомендует знакомым и в целом рада, что такая платформа существует.
Спасибо. Урок понравился. Даниил Станиславович заинтересовал английским языком. Составили предположительные темы для занятий после новогодних праздников
Грамотный, добрый, располагающий к себе педагог. С ребёнком Екатерина Станиславовна установила хороший контакт. Преподносит информацию очень доступно. Занятие проходит разнообразно, в том числе в игровой форме. Рекомендуем 5+
Алла Валентиновна отличный преподаватель! Выявила все пробелы в знаниях Константина по русскому языку и работает над их устранением. Также помогает в работе над текущими темами урока. Уже прошли несколько занятий и продолжаем заниматься. нашла общий язык с сыном. Все нравится. Хотим заниматься дальше!
Классный репетитор, все темы разбираются на 5+, будем обязательно продолжать обучение, также рекомендуем всем ученикам!
Замечательный педагог, с которым нравится заниматься. Максим готовится к сдаче ОГЭ по русскому языку и занимается с репетитором с начала ноября прошлого года. За это время успели повторить пройденный материал и изучить несколько тем нового материала. Надежда Викторовна объясняет материал в доступной форме. Максим продолжит с ней занятия.
Преподаватель компетентный, объясняет понятно, выше школьного уровня. Быстро заполняет пробелы в знаниях. Будем сотрудничать. С Уважением, Феона.
Очень чётко и понятно объяснила Мария Анатольевна. Спасибо вам. Не смотря первый раз, пробную занятия, она прям очень понравилась дочке и естественно мне💐. В дальнейшем обязательно будем заниматься с ней и подниматься.
Отличный учитель, который всегда вовлекает ученика в процесс, и сам проявляет заинтересованность в успехах ученика. Интересно слушать и работать!
Очень качественные и продуктивные занятия. Занимаюсь не долго, но уже чувствуется прогресс. Очень милый и добрый преподаватель. Всё понятно объясняет. Мне, очень нравится заниматься математикой с Елизаветой Владимировной.
Мне понравилось заниматься с Андреем Юрьевичем. Впервые встречаю репетитора, который прежде учить языку, рассказывает про его истоки – географию, культуру, историю. Мне очень откликается такой подход. Видно, что преподаватель с большим опытом. Я очень довольна первым занятием! Буду продолжать заниматься с данным преподавателем.
Урок 1. Основные понятия и законы предмета «Химия»
Простейшие понятия: вещество, молекула, атом, химический элемент
Что такое химия? Где мы встречаемся с химическими явлениями? Везде. Сама жизнь — это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов…
Что изучает химия? Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество — понятно: это то, из чего состоит окружающий нас мир и мы сами. Но что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество (оно стало другим!), — изменились его свойства:
Все эти изменения — следствие сложных и многообразных химических процессов. Итак,
химия — это наука о веществах и их превращениях.
При этом исследуются не всякие превращения, а только такие, при которых
В этом определении встречаются такие понятия, как «вещество», «молекула», «атом». Разберём их подробнее.
Вещество — это то, из чего состоят окружающие нас предметы. Каждому абсолютно чистому веществу (таких в природе, кстати, не существует) приписывают определённую химическую формулу, которая отражает его состав, например:
Выше приведены молекулярные формулы двух веществ. Следует отметить, что далеко не все вещества состоят из молекул, так как существуют вещества, которые состоят из атомов или ионов. Например, алмаз состоит из атомов углерода, а обычная поваренная соль — из ионов Na + и ионов Cl – (условная «молекула» — NaСl).
Наименьшая частица вещества, которая отражает его качественный и количественный состав, называется молекулой.
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака):
Число атомов в молекуле обозначают при помощи индекса:
Но! Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента:
Аналогично изображают число молекул:
Почему атомы водорода и кислорода имеют разное название, разный символ? Потому что это атомы разных химических элементов.
Химический элемент — это частицы с одинаковым зарядом ядер их атомов.
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях? Из чего состоит атом*?
* Подробнее о строении атома будет рассказано в уроке 3.
Атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:
В ходе химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ!
Поэтому заряд ядра атома — своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием «водород». Атомы с зарядом ядра +8 составляют химический элемент «кислород».
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева (порядковый номер равен заряду ядра атома); определённое название и, для некоторых химических элементов, особое прочтение символа в химической формуле (табл. 1).
Подведём итог. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Но, если вещество состоит из молекул, то любое изменение состава или строения молекулы приводит к изменению самого вещества, его свойств.
Вопрос. Чем отличаются химические формулы веществ: Н2О и Н2О2?
Хотя по составу молекулы этих веществ отличаются на один атом кислорода, сами вещества по свойствам сильно отличаются друг от друга. Воду Н2О мы пьём и жить без неё не можем, а Н2О2 — перекись водорода, пить нельзя, а в быту её используют для обесцвечивания волос.
Вопрос. А чем отличаются химические формулы веществ:
Состав этих веществ — аллозы (А) и глюкозы (Б) — одинаков — С6Н12О6. Отличаются они строением молекул, в данном случае — расположением групп ОН в пространстве. Глюкоза — универсальный источник энергии для большинства живых организмов, а аллоза практически не встречается в природе и не может быть источником энергии.
Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
* В 2002 г. появилось сообщение о существовании ещё одного простого вещества кислорода — O4.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:
В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).
Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
Строго говоря, по нижеизложенным правилам определяют не валентность, а степень окисления (см. урок 7). Но поскольку в некоторых соединениях числовые значения этих понятий совпадают, то иногда по формуле можно определять и валентность.
При этом следует учитывать изложенное выше правило о химической связи.
Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:
Задание 1.2. Определите валентности элементов в соединениях:
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях.
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
Задание 1.4. Составьте химические формулы соединений:
Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково! Это правило — следствие Закона сохранения массы вещества: масса исходных веществ равна массе продуктов реакции. Закон был открыт в 18-м веке М. В. Ломоносовым и, независимо от него, А. Л. Лавуазье.
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:
Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
Теперь между правой и левой частями уравнения можно поставить знак равенства:
Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:
Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:
2. Перенесём эти числа в правую часть уравнения:
3. Составим химические формулы полученных веществ по валентностям составных частей:
4. Обратим внимание на состав «самого сложного» соединения: Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:
Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Химические реакции бывают разных типов. Основными являются:
1. Реакции соединения:
Здесь из двух и более веществ образуется одно вещество:
2. Реакции разложения:
Здесь из одного вещества получаются два вещества и более веществ:
3. Реакции замещения:
Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:
4. Реакции обмена:
Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:
Выводы
Вещества бывают простые и сложные. Состав веществ показывают при помощи химических формул. Формулы веществ составляют, учитывая валентности составных частей этих веществ. Запись химического процесса при помощи формул называется уравнением химической реакции. Химические реакции бывают разных типов: обмена, замещения, разложения, соединения и другие.
Основные понятия химии
Атом — мельчайшая, химически неделимая, электронейтральная частица вещества. Состоит из ядра и электронной оболочки.
Вещество — вид материи с определёнными химическими и физическими свойствами. Совокупность атомов, атомных частиц или молекул, находящаяся в определённом агрегатном состоянии. Из веществ состоят физические тела (медь — вещество, а медная монета — физическое тело).
Валентность — количество химических связей, которое образует один атом.
Молекула — наименьшая частица вещества, сохраняющая его химические свойства. Состоит из атомов.
Свойства — совокупность признаков по которым одни вещества отличаются от других, они бывают химическими и физическими.
Физические свойства — признаки вещества, при характеристике которых вещество не изменяет свой химический состав (плотность, агрегатное состояние, температуры плавления и кипения и т. п.)
Химические свойства — способность веществ взаимодействовать с другими веществами или изменяться под действием определённых условий. Результатом является превращение одного вещества или веществ в другие вещества.
Агрегатные состояния а веществ— состояние вещества, характеризующееся определенными свойствами (способность сохранять форму, объем). Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состояниям причисляют плазмуw. Существуют и другие агрегатные состояния, например, жидкие кристаллыw или конденсат Бозе — Эйнштейнаw.
Моль — мера количества вещества, содержащая Число Авогадроw (NA ≈ 6,02 × 1023) любых структурных частиц. (NA — количество атомов в 12 граммах углерода 12Cw.)
Периодический закон — фундаментальный закон природы, открытый Д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс. В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов». Особенность Периодического закона среди других фундаментальных законов заключается в том, что он не имеет выражения в виде математического уравнения. Графическим (табличным) выражением закона является Периодическая система химических элементовw, первоначальный вариант которой был разработан Д. И. Менделеевым в 1869—1871 годах.
Простое вещество — вещество, состоящее из атомов одного химического элемента: водород, кислород и т. д.
Сложное вещество — вещество, состоящее из атомов разных химических элементов: кислоты, вода и др.
Относительная атомная масса — масса (а. е. м.) 6,02 × 1023 молекул простого вещества, где а. е. м. — атомная единица массыw.
Относительная молекулярная масса — масса (а. е. м.) 6,02 × 1023 молекул сложного вещества. Численно равна молярной массе, но отличается размерностью.
Химическая связь — это взаимодействие атомов, обуславливающее устойчивость молекулы или кристаллаw как целого. Химическая связь определяется взаимодействием между заряженными частицамиw (ядрамиw и электронамиw).
Полимеры — высокомолекулярные соединения, молекулы которых состоят из повторяющихся фрагментов (структурных звеньев).
Степень полимеризации — число структурных звеньев, входящих в состав макромолекулы.
Гомополимеры — полимеры, образованные из одинаковых по составу и строению мономеровw.
Мономер — низкомолекулярное вещество, образующее полимер в реакции полимеризацииw.
Сополимеры — полимеры, образованные из двух и более мономеров.
Сополимеризация — реакция полимеризации с участием двух или более различных мономеров.
Электрохимия — раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и в ионных проводниках (электролитах). Электрохимия исследует процессы окисления и восстановления, протекающие на пространственно-разделённых электродах, перенос ионов и электронов.
Электродный потенциал — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом.
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Электролит — вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или движения ионов в кристаллических решётках твёрдых электролитов.
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Гомологический ряд — ряд химических соединений одного структурного типа (например, алканы или алифатические спирты — спирты жирного ряда), отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — так называемую «гомологическую разность».
Изомерия — явление, заключающееся в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Изомеры — соединения, обладающие одинаковым элементарным составом, но различным химическим строением.
Химическое равновесие — это такое состояние системы, когда скорость прямой реакции равна скорости обратной реакции.
Тепловой эффект реакции — это теплота, которая выделяется или поглощается системой при течении в ней химической реакции. В зависимости от того, происходит реакция с выделением теплоты или сопровождается поглощением теплоты, различают экзо-и эндотермические реакции. К первым, как правило, относятся все реакции соединения, а ко вторым — реакции разложения.[1]
Катализатор — это вещество, которое изменяет скорость химической реакции, но количественно при этом не расходуется и в состав продуктов не входит.
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства.
Термохимия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов.
Теплота — количественная мера хаотичного движения частиц данной системы, при этом не происходит переноса вещества от одной системы к другой.
Тепловой эффект — выделение или поглощение тепловой энергии системой при протекании в ней химической реакции, при условии, что система не совершает никакой другой работы кроме работы расширения.
Внутренняя энергия системы — суммарная энергия внутренней системы, включающая энергию взаимодействия и движения молекул, атомов, ядер, электронов в атомах, внутриядерную и другие виды энергии, кроме кинетической и потенциальной энергии системы, как целого.
Энтальпия — это энергия расширенной системы (термодинамическая функция, характеризующая систему, находящуюся при постоянном давлении).
Стандартная энтальпия (теплота) образования сложного вещества — тепловой эффект реакции образования 1 моля этого вещества из простых веществ, находящихся в устойчивом агрегатном состоянии при стандартных условиях (= 298 К и давлении 101 кПа).
Гомогенная система — однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела). В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем.
Гетерогенная система — неоднородная система, состоящая из однородных частей (фаз), разделённых поверхностью раздела. Однородные части (фазы) могут отличаться друг от друга по составу и свойствам.
Скорость гомогенной реакции — количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
Скорость гетерогенной реакции — количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы.[
Термодинамика — раздел науки, изучающий соотношения и превращения теплоты и других форм энергии. Термодинамика — это феноменологическая наука, опирающаяся на обобщения опытных фактов. Она изучает макроскопические системы, состоящие из огромного числа частиц — термодинамические системы.
Термодинамическая система — некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом. Также обычно полагается, что такая система подчиняется статистическим закономерностям.
Первый закон термодинамики — для изолированной системы (для которой исключен любой материальный или энергетический обмен с окружающей средой) внутренняя энергия постоянна.
Химический элемент — это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек. В настоящее время известно 110 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем
Химическим эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса 1 эквивалента вещества называется эквивалентной массой (mэкв).
Эквивалентную массу соединения можно определить по его химической формуле, например,
m экв(оксида) = М (оксида)/(число атомов кислорода*2);
m экв(основания) = М (основания)/число гидроксильных групп;
m экв(кислоты) = М кислоты/число протонов;
m экв(соли) = М соли /(число атомов металла*валентность металла).
Аналогично можно дать определение понятию эквивалентный объем.
Эквивалентный объем – это тот объем, который при данных условиях занимает 1 эквивалент вещества. Так как эквивалент водорода равен 1 моль, а в 22,4 л Н2 содержатся 2 эквивалента водорода; тогда эквивалентный объем водорода равен 22,4/2=11,2 л/моль, для О2 эквивалентный объем равен 5,6 л/моль.
Определить эквивалент вещества можно также по его соединению с другим веществом, эквивалент которого известен.
Определить молярную массу эквивалента (эквивалентную массу) можно исходя из закона эквивалентов, который гласит, что химические элементы соединяются между собой или замещают друг друга в количествах, пропорциональных их молярным массам эквивалентов:
m1/m2=Мэкв1/ Мэкв2, где
где m1 и m2 — массы реагирующих или образующихся веществ, m экв1 и m экв2 — эквивалентные массы этих веществ.
Основные законы химии
Закон сохранения массы веществ
Закон сохранения массы теоретически был описан в 1748 году, а экспериментально подтверждён в 1756 году русским ученым М.В. Ломоносовым. Ломоносов определил, что если сосуд с металлом взвесить до и после нагревания, не вскрывая его, то масса останется неизменной.
В 1789 году французский учёный Антуан Лавуазье подтвердил выводы Ломоносова.
Закон сохранения массы веществ формулируется так:
Масса веществ, вступивших в реакцию, равна массе продуктов реакции.
Атомно-молекулярное учение объясняет этот закон так: при химической реакции общее количество участвующих атомов не изменяется, а происходит лишь их перегруппировка. Так как число атомов до и после реакции не изменяется, то их общая масса тоже не изменяется.
Модель химической реакции
На основе закона сохранения массы веществ проводят количественный химический анализ.
Приведём пример. Составим химическое уравнение реакции разложения воды:
Число атомов кислорода слева от стрелки, т.е. до реакции, меньше в два раза, чем справа, т.е. после реакции. Для уравнивания количества веществ до и после реакции, нужно поставить коэффициент 2 перед формулой воды в левой части уравнения:
Закон постоянства состава
Закон постоянства состава впервые сформулировал в 1808г. французский учёный-химик Жозеф Луи Пруст.
Закон постоянства состава формулируется так:
Вещество, независимо от способа его получения, всегда имеет постоянный качественный и количественный состав.
Вещества с постоянным составом названы дальтонидами в честь английского химика Джона Дальтона.
Состав дальтонидов описывается химическими формулами с целыми стехиометрическими коэффициентами, например Н2О, НCl, СН4, СO2, С2Н5ОН.
Из закона постоянства состава следует, что при образовании сложного вещества элементы простых веществ соединяются друг с другом в строго определенных массовых долях.
Массовая доля элемента ωЭ показывает, какую часть составляет масса данного элемента от массы всего вещества, где
n – число атомов;
ArЭ – относительная атомная масса элемента;
Mr – относительная молекулярная масса вещества.
Развитие химии показало, что наряду с веществами, имеющими постоянный состав, существуют вещества с переменным составом, который зависит от способа получения. Такие вещества назвали в честь французского химика Клода Бертолле – бертоллидами.
Бертоллиды не подчиняются законам стехиометрии. Примеры бертоллидов есть в классах оксидов, сульфидов, карбидов, гидридов и пр.
Исходя из вышеизложенного, уточним формулировку закона постоянства состава:
Состав соединений с молекулярной структурой является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Периодический закон
Периодический закон сформулирован Д. И. Менделеевым в году. К этому времени было известно химических элемента. В качестве основного свойства элементов Менделеев выбрал относительную атомную массу. Учитывал также состав, физические и химические свойства образованных элементом простых и сложных веществ.
Расположив все известные химические элементы в порядке возрастания атомных масс, Менделеев обнаружил, что свойства повторяются через определённое число элементов.
Повторим действия Менделеева с учётом того факта, что благородные газы в его время ещё не были известны. Расположим элементы по возрастанию атомной массы (вторая строчка таблицы), укажем металлические и неметаллические свойства, формулы и свойства высших оксидов и гидроксидов, а также формулы газообразных водородных соединений.
Если внимательно проанализировать полученные последовательности, то можно увидеть повторяемость металлических и неметаллических свойств, состава и свойств соединений. Через семь элементов от щелочного металла лития в ряду располагается щелочной металл натрий, а через семь элементов от галогена фтора — галоген хлор. Через семь элементов появляются одинаковые формулы оксидов и водородных соединений, так как повторяются значения валентностей в соединениях с кислородом и водородом. Можем составить их общие формулы.
Таким образом Менделеев установил периодичность изменения свойств с возрастанием атомной массы. В статье «Периодическая закономерность химических элементов» Д. И. Менделеев дал следующую формулировку периодического закона:
«Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от атомного веса».
В переводе на современный научный язык это звучит так:
«Свойства химических элементов и их соединений находятся в периодической зависимости от зарядов атомных ядер».
Для правильного написания химических формул надо знать валентность элементов или степень окисления. Валентностью называется способность атомов данного элемента присоединять или замещать определенное число других атомов. max вал. = 8.
Закон сохранения массы
Закон сохранения энергии можно представить в виде:
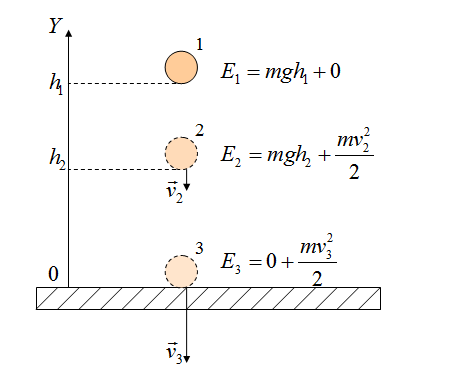
Если между телами действуют силы трения, то закон сохранения энергии видоизменяется. Изменение полной механической энергии равно работе сил трения.
Полные механические энергии равны между собой
А куда потом исчезает кинетическая энергия? Исчезает бесследно? Опыт показывает, что механическое движение никогда не исчезает бесследно и никогда оно не возникает само собой. Во время торможения тела произошло нагревание поверхностей. В результате действия сил трения кинетическая энергия не исчезла, а превратилась во внутреннюю энергию теплового движения молекул.
При любых физических взаимодействиях энергия не возникает и не исчезает, а только превращается из одной формы в другую.
Общая форма закона сохранения и превращения энергии имеет вид:
Изучая тепловые процессы, мы будем рассматривать формулу
При исследовании тепловых процессов не рассматривается изменение механической энергии, то есть
В механике процессы теплопередачи не принимают во внимание, то есть
Закон эквивалентов
Эквивалент (Э) – реальная или условная частица вещества, которая может присоединить, заместить в кислотно-основных реакциях один ион водорода (или другого одновалентного элемента), а в окислительно-восстановительных реакциях – присоединить или высвободить один электрон.
Под условной частицей вещества подразумевается реально существующие частицы (молекулы, ионы, электроны и т.д.), доли этих частиц (например, 1 /2 иона) или их группы.
Фактор эквивалентности fэ (х) – число, обозначающее, какая доля реальной частицы вещества X эквивалентна одному иону водорода в кислотно-основной реакции или одному электрону в реакции окисления-восстановления.
Фактор эквивалентности – величина безразмерная. Принимает значения 1 или меньше единицы.
Для простых веществ и элементов в соединении fэ(х) = 1/В, где В – валентность элемента.
Например, для водорода или натрия fэ= 1/1 = 1. Для магния или кислорода fэ = 1/2.
Молярная масса эквивалента вещества Мэ(х) – масса одного моля эквивалента этого вещества, равная произведению фактора эквивалентности fэ(х) на молярную массу вещества Мх.
Например, молярные массы эквивалентов простых веществ:
Мэ(Na) = 1· 23 = 23 г/моль;
Мэ(Mg) = ½ · 24 = 12 г/моль;
Если одно из реагирующих веществ – газ, то для него вводится понятие объема эквивалента вещества – Vэ(х), который рассчитывается на основании следствия из закона Авогадро:
1 моль газа массой М занимает объем 22,4 л, при нормальных условиях (н.у.):
Р o = 1 атм.; Т о = 273 К
1 эквивалент газа массой Мэ занимает объем Vэ при н.у.
Например, при нормальных условиях 1 моль эквивалентов водорода занимает объем, равный:
Для кислорода эта величина составляет
Закон эквивалентов: массы (или объемы) реагирующих веществ пропорциональны молярным массам эквивалентов (или эквивалентным объемам) этих веществ.
Если одно из этих веществ представляет собой газ, то закон эквивалентов записывается в виде
Закон кратных отношений
Относительные атомные и молекулярные массы являются мерой масс атомов и молекул, поэтому они позволяют сделать вывод о соотношении масс атомов различных элементов в молекуле сложного вещества.
Пример: Относительная атомная масса водорода и кислорода соответственно равна 1,00794 и 15,9994, откуда следует, что соотношение масс атомов водорода и кислорода составляет 1 : 16. В молекуле воды H2O содержится два атома водорода и один атом кислорода, следовательно, массовое отношение водорода и кислорода в воде равно 2 : 16 или 1 : 8.
Соотношение атомных масс элементов в соединениях устанавливает закон постоянства состава, вывел его в начале XIX в. французский химик Жозеф Луи Пруст (1754-1826) на основании анализа химических соединений.
Его современная формулировка такова:
Каким бы способом ни было получено вещество, его химический состав остается постоянным
Отсюда следует, что если два или несколько простых веществ соединяются с образованием некоторого сложного вещества, то и массовое отношение реагирующих веществ постоянно для данного продукта. Так, при взаимодействии водорода и кислорода могут быть получены вода H2O и пероксид водорода H2O2; очевидно, что не только в самих продуктах массовое отношение водорода и кислорода равно соответственно 1 : 8 и 1 : 16, но и массовые отношения реагентов будут такими же.
На основании закона постоянства состава и закона кратных отношений английский исследователь Джон Дальтон (John Dalton, 1766-1844) в 1807 г. высказал атомную гипотезу (основу атомно-молекулярного учения о строении вещества):
Из атомной гипотезы вытекает, что закон постоянства состава отражает именно атомный состав вещества: в молекулу вещества объединяется определенное число именно атомов одного или различных элементов.
Закон кратных отношений, открытый Дальтоном, гласит:
Если два элемента образуют между собой несколько соединений, то массы атомов одного элемента, приходящиеся на одну и ту же массу атомов другого элемента, соотносятся между собой как небольшие целые числа.
Закон кратных отношений является фактическим объединением закона сохранения массы и закона постоянства состава на базе атомной гипотезы строения вещества.
Закон объемных отношений (закон Гей-Люссака)
Закон объёмных отношений впервые сформулировал в 1802 г французский учёный-химик Жозеф Луи Гей-Люссак.
Закон объёмных отношений формулируется так:
Объёмы вступающих в реакцию газов относятся друг к другу и к объёмам образующихся продуктов реакции как небольшие целые числа.
При этом подразумевается, что давление и температура неизменны.
Другими словами, стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объёмных отношениях реагируют и получаются газообразные вещества.
При взаимодействии 2 объёмов водорода и 1 объёма кислорода образуются 2 объёма водяного пара.
Закон Авогадро
Изучение свойств газов позволило итальянскому физику А. Авогадро в 1811г. высказать гипотезу, которая впоследствии была подтверждена опытными данными, и стала называться законом Авогадро:
В равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Из закона Авогадро вытекает важное следствие: моль любого газа при нормальных условиях (0
Из закона Авогадро также следует, что массы равных объемов различных газов при одинаковых температуре и давлении относятся друг к другу как молярные массы этих газов:
М1 и М2 – молекулярные массы первого и второго газов.
Поскольку масса вещества определяется по формуле
где ρ – плотность г аза,
то плотности различных газов при одинаковых условиях пропорциональны их молярным массам. На этом следствии из закона Авогадро основан простейший метод определения молярной массы веществ, находящихся в газообразном состоянии.
Закон Авогадро позволяет рассчитать плотность газа при нормальных условиях, на основании отношения молярной массы М к объему моля:
Из этого уравнения можно определить молярную массу газа:
Следствия из закона Авогадро
Из закона Авогадро вытекают два важных следствия.
Следствие 1 из закона Авогадро. Один моль любого газа при одинаковых условиях занимает одинаковый объем.
В частности при нормальных условиях объем одного моля идеального газа равен 22,4 л. Этот объем называют молярным объемом
Следствие 2 из закона Авогадро. Отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта величина называется относительной плотностью
Объединенный газовый закон
Реальные газы обычно хорошо подчиняются законам идеальных газов при давлениях, менее или несущественно превышающих атмосферное, и при температурах близких к температуре окружающей среды или более высоких. Поэтому законы идеальных газов находят широкое применение в природопользовании, в частности при расчетах количества, состава газов, выделяющихся при горении, и в других технологических процессах, сопровождаемых их образованием.
Объединенный газовый закон можно также записать в другой форме:
Точное значение постоянной в правой части этого уравнения зависит от количества газа. Если количество газа равно одному молю (см. гл. 4), то соответствующая постоянная обозначается буквой R и называется молярная газовая постоянная, или просто газовая постоянная. Если давление выражено в атмосферах, постоянная R имеет значение
Объединенный газовый закон для одного моля газа приобретает вид:
где Vm- объем одного моля газа. Для п молей газа получается уравнение:
В такой форме объединенный газовый закон называется уравнением состояния идеального газа. Уравнение состояния это уравнение, связывающее между собой параметры состояния газа-давление, объем и температуру.
Газ, который полностью подчиняется уравнению состояния идеального газа, называется идеальный газ. Такой газ не существует в действительности. Реальные газы хорошо подчиняются уравнению состояния идеального газа при низких давлениях и высоких температурах. Отклонения в поведении реальных газов от предписываемш уравнением состояния идеального газа подробно обсуждаются ниже.
Вычисление относительной молекулярной массы с помощью уравнения состояние идеального газа. Уравнение состояния идеального газа позволяет проводить прямые вычисления относительной молекулярной массы газа M1. Введем понятие относительной молекулярной массы, основываясь на уже знакомом нам (из гл. 1) определении относительной атомной массы A1. Для газа, состоящего из простых молекул, относительная молекулярная масса представляет собой сумму относительных атомных масс всех атомов, входящих в молекулу. Например, для диоксида углерода.
где n-количество вещества в молях (т.е. число молей данного вещества), т-масса вещества в граммах, a M-его молярная масса.
Подстановка полученного выражения для п в уравнение состояния идеального газа (4) дает:
Это уравнение позволяет, зная массу и объем газа при определенных температуре и давлении, вычислить его молярную массу М. А поскольку
M = M (г/моль), то полученный результат непосредственно дает относительную молекулярную массу М.
Уравнение Клайперона—Менделеева (для идеального газа)
n – число молей газа;
P – давление газа, Па;
T – абсолютная температура газа, К;
R – универсальная газовая постоянная 8,314 Дж/моль×K.
Если объём газа выражен в литрах, то уравнение Клапейрона-Менделеева записывается в виде:
Из уравнения Клапейрона-Менделеева следует три закона:



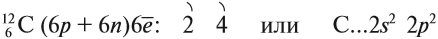

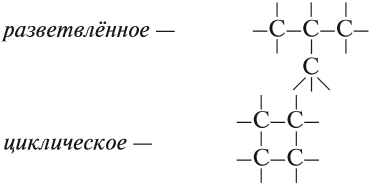
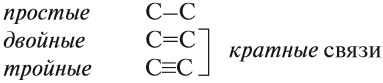


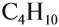
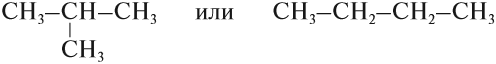
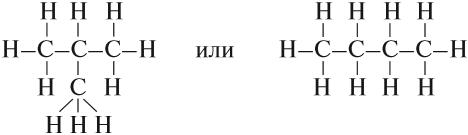
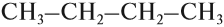
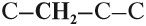
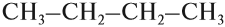
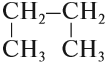
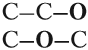
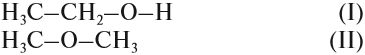
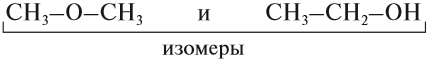
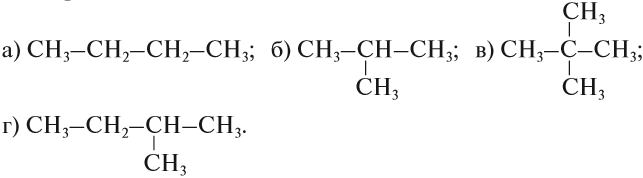
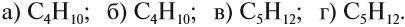
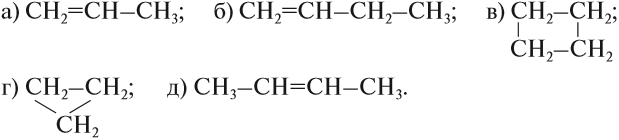

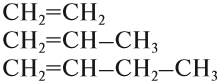
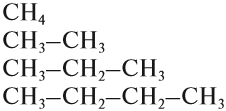
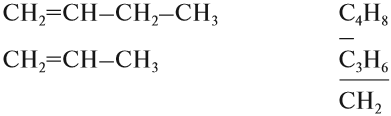

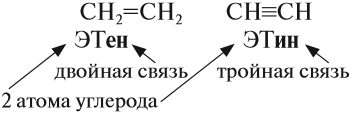
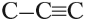
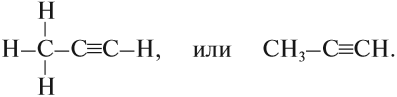
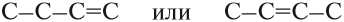

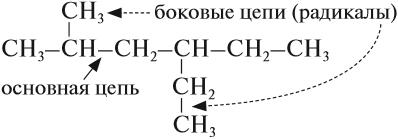
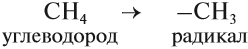
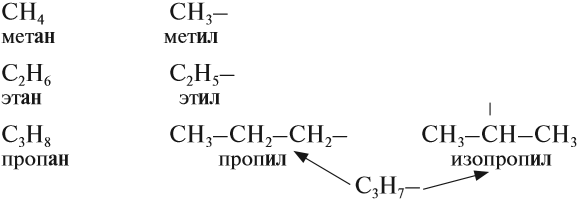
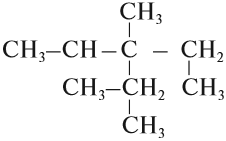
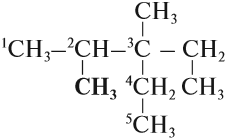
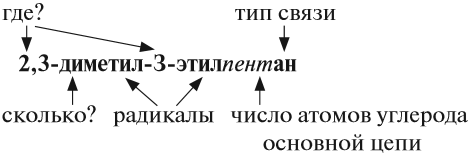
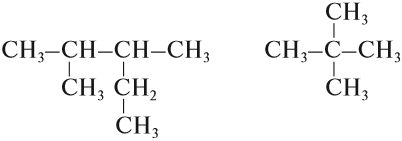
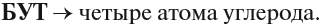
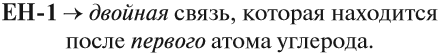
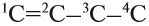
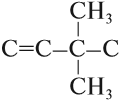
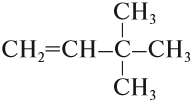














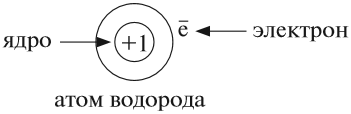
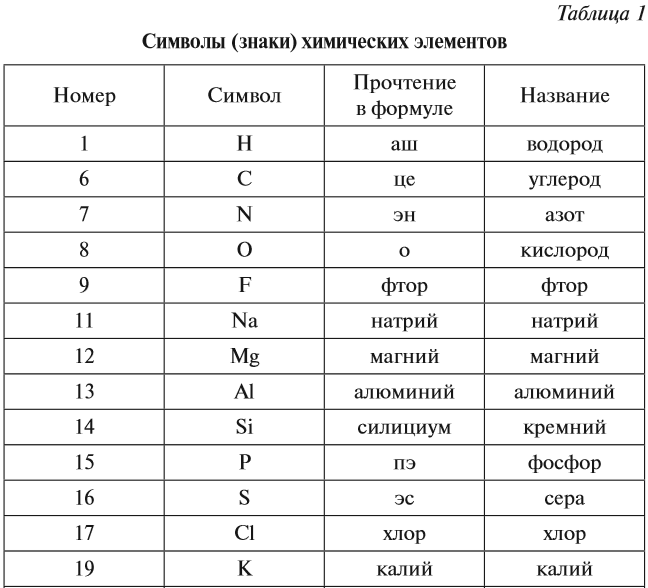
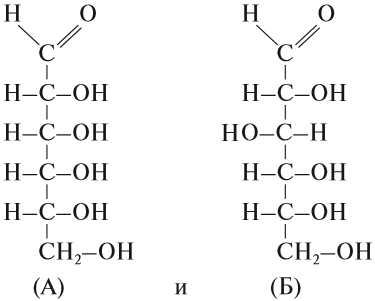

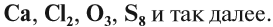

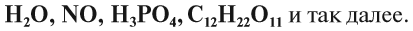




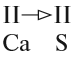
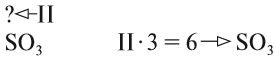

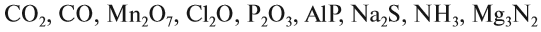
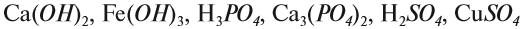
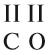
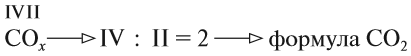
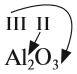
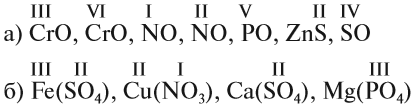

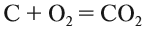
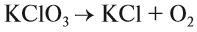
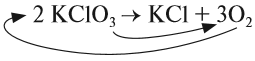
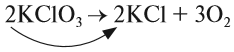
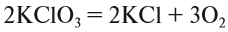
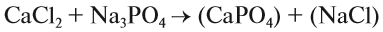
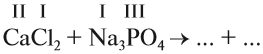
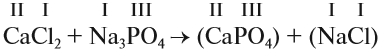
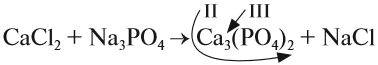
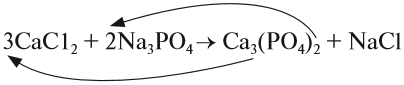
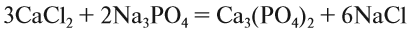
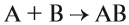
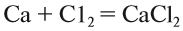
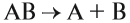
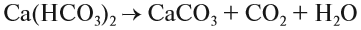

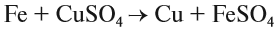
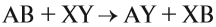
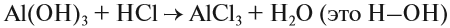

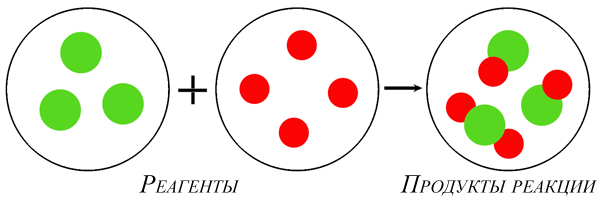

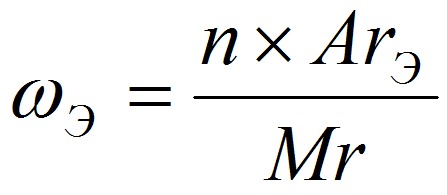
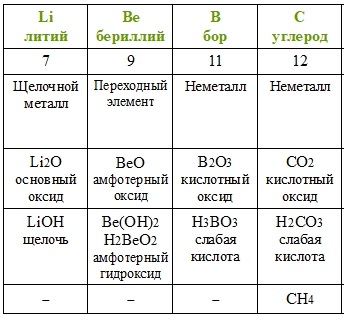
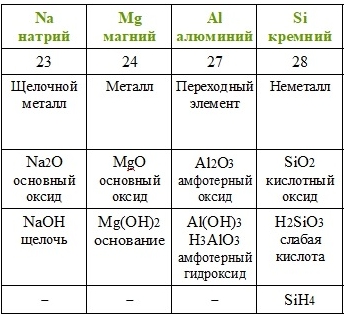
.png)
.png)