Химия с самого начала кратко и понятно
Самоучитель по химии
Пособие для тех, кто не знает, но хочет узнать и понять химию
Часть I. Элементы общей химии
(первый уровень сложности)
Я, Френкель Евгения Николаевна, заслуженный работник высшей школы РФ, выпускница химического факультета МГУ 1972 г., педагогический стаж 34 года. Кроме того, я мать троих детей и бабушка четырех внуков, старший из которых школьник.
Меня волнует проблема школьных учебников. Главная беда многих из них – тяжелый язык, который требует дополнительного «перевода» на понятный школьнику язык изложения учебного материала. Ко мне часто обращаются ученики средней школы с такой просьбой: «Переведите текст учебника, чтобы понятно было». Поэтому я написала «Самоучитель по химии», в котором многие сложные вопросы изложены вполне доступно и в то же время научно. На основе этого «Самоучителя», который был написан в 1991 г., я разработала программу и содержание подготовительных курсов. На них обучались сотни школьников. Многие из них начинали с нуля и за 40 занятий понимали предмет настолько, что сдавали экзамены на «4» и «5». Поэтому в нашем городе мои пособия-самоучители расходятся как горячие пирожки.
Может, и другим пригодятся мои наработки?
Предисловие
Уважаемые читатели! Предлагаемый вашему вниманию «Самоучитель по химии» – не обычный учебник. В нем не просто излагаются какие-то факты или описываются свойства веществ. «Самоучитель» объясняет и учит даже в том случае, если вы, к сожалению, не знаете и не понимаете химии, а к учителю обратиться за разъяснениями не можете или стесняетесь. В виде рукописи эта книга используется школьниками с 1991 г., и не было ни одного ученика, который бы провалился на экзамене по химии и в школе, и в вузах. Причем многие из них совсем не знали химии.
«Самоучитель» рассчитан на самостоятельную работу ученика. Главное – отвечать по ходу чтения на те вопросы, которые встречаются в тексте. Если вы не смогли ответить на вопрос, то читайте внимательнее текст еще раз – все ответы имеются рядом. Желательно также выполнять все упражнения, которые встречаются по ходу объяснения нового материала. В этом помогут многочисленные обучающие алгоритмы, которые практически не встречаются в других учебниках. С их помощью вы научитесь:




В пособии два уровня сложности. Самоучитель первого уровня сложности состоит из трех частей.
I часть. Элементы общей химии (публикуемая).
II часть. Элементы неорганической химии.
III часть. Элементы органической химии.
Книг второго уровня сложности тоже три.
Теоретические основы общей химии.
Теоретические основы неорганической химии.
Теоретические основы органической химии.
Глава 1. Основные понятия химии.
Глава 2. Важнейшие классы неорганических соединений.
Упражнения к главе 2.
Глава 3. Элементарные сведения о строении атома. Периодический закон Д.И.Менделеева.
Глава 4. Понятие о химической связи.
Глава 6. Электролитическая диссоциация.
6.1. Понятие о рН (водородном показателе).
Упражнения к главе 6.
Глава 7. Понятие об окислительно-восстановительных реакциях.
Глава 8. Расчеты по химическим формулам и уравнениям.
8.2. Задачи, решаемые по стандартным формулам.
8.2.1. Задачи по теме «Газы».
8.2.2. Задачи по теме «Способы выражения концентрации растворов».
8.2.3. Задачи по теме «Количественный состав вещества».
8.3. Задачи, решаемые по уравнениям реакций.
8.3.1. Оформление расчетов по уравнениям реакций.
8.3.2. Задачи по теме «Количественный состав растворов и смесей».
8.3.3. Задачи на установление формулы вещества.
8.4. Задачи для самостоятельного решения.
Глава 1. Основные понятия химии
Что такое химия? Где мы встречаемся с химическими явлениями?
Химия – везде. Сама жизнь – это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов.
Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество?
Вещество – это то, из чего состоит окружающий нас мир и мы сами.
Что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество*. Изменились молекулы – изменилось вещество (оно стало другим), изменились его свойства. Например, свежее молоко стало кислым, зеленые листья стали желтыми, сырое мясо при обжаривании изменило запах.
Все эти изменения – следствие сложных и многообразных химических процессов. Однако признаки простых химических реакций, в результате которых изменяется состав и строение молекул, такие же: изменение цвета, вкуса или запаха, выделение газа, света или тепла, появление осадка.
Что же такое молекулы, изменение которых влечет за собой столь разнообразные проявления?
Молекулы – это мельчайшие частицы вещества, отражающие его качественный и количественный состав и его химические свойства.
Изучая состав и строение одной молекулы, можно предсказать многие свойства данного вещества в целом. Такие исследования – одна из главных задач химии.
Как устроены молекулы? Из чего они состоят?
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака). Например, Н – атом водорода, О – атом кислорода.
Число атомов в молекуле обозначают при помощи индекса – цифры внизу справа после символа.
О2 – это молекула вещества кислорода, состоящая из двух атомов кислорода;
Н2О – это молекула вещества воды, состоящая из двух атомов водорода и одного атома кислорода.
Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента – цифры перед символом:
Аналогично изображают число молекул:
2Н2 – две молекулы водорода;
3Н2О – три молекулы воды.
Почему атомы водорода и кислорода имеют разные названия и разные символы? Потому что это атомы разных химических элементов.
Химический элемент – это вид атомов с одинаковым зарядом ядер.
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях, из чего состоит атом?
Нейтральный атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:
В ходе химических реакций число электронов любого атома может изменяться, а вот заряд ядра атома не меняется. Поэтому заряд ядра атома – своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием водород. Атомы с зарядом ядра +8 относятся к химическому элементу кислороду.
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Д.И.Менделеева (порядковый номер равен заряду ядра атома), определенное название, а для некоторых химических элементов – особое прочтение символа в химической формуле (табл. 1).
| № п/п | № в таблице Д.И.Менделеева | Символ | Прочтение в формуле | Название |
| 1 | 1 | H | аш | Водород |
| 2 | 6 | C | це | Углерод |
| 3 | 7 | N | эн | Азот |
| 4 | 8 | O | о | Кислород |
| 5 | 9 | F | фтор | Фтор |
| 6 | 11 | Na | натрий | Натрий |
| 7 | 12 | Mg | магний | Магний |
| 8 | 13 | Al | алюминий | Алюминий |
| 9 | 14 | Si | силициум | Кремний |
| 10 | 15 | P | пэ | Фосфор |
| 11 | 16 | S | эс | Сера |
| 12 | 17 | Cl | хлор | Хлор |
| 13 | 19 | K | калий | Калий |
| 14 | 20 | Ca | кальций | Кальций |
| 15 | 23 | V | ванадий | Ванадий |
| 16 | 24 | Cr | хром | Хром |
| 17 | 25 | Mn | марганец | Марганец |
| 18 | 26 | Fe | феррум | Железо |
| 19 | 29 | Cu | купрум | Медь |
| 20 | 30 | Zn | цинк | Цинк |
| 21 | 35 | Br | бром | Бром |
| 22 | 47 | Ag | аргентум | Серебро |
| 23 | 50 | Sn | станнум | Олово |
| 24 | 53 | I | йод | Йод |
| 25 | 56 | Ba | барий | Барий |
| 26 | 79 | Au | аурум | Золото |
| 27 | 80 | Hg | гидраргирум | Ртуть |
| 28 | 82 | Pb | плюмбум | Cвинец |
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, это простое вещество. Простые вещества – Са, Сl2, О3, S8 и т. д.
Молекулы сложных веществ состоят из атомов разных химических элементов. Сложные вещества – H2O, NO, H3PO4, C12H22O11 и т. д.
Задание 1.1. Укажите число атомов в молекулах сложных веществ H2O, NO, H3PO4, C12H22O11, назовите эти атомы.
Возникает вопрос: почему для воды всегда записывается формула Н2О, а не НО или НО2? Опыт доказывает, что состав воды, полученной любым способом или взятой из любого источника, всегда соответствует формуле Н2О (речь идет о чистой воде).
Дело в том, что атомы в молекуле воды и в молекуле любого другого вещества соединены при помощи химических связей. Химическая связь соединяет как минимум два атома. Поэтому, если молекула состоит из двух атомов и один из них образует три химические связи, то другой также образует три химические связи.
Число химических связей, образуемых атомом, называют его валентностью.
Если обозначить каждую химическую связь черточкой, то для молекулы из двух атомов АБ получим А
В данной молекуле атомы А и Б трехвалентны.
Известно, что атом кислорода двухвалентен, атом водорода одновалентен.
В о п р о с. Сколько атомов водорода может присоединиться к одному атому кислорода?
О т в е т. Два атома. Состав воды описывают формулой Н–О–Н, или Н2О.
П о м н и т е! В устойчивой молекуле не может быть «свободных», «лишних» валентностей. Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).
Символы элементов
Для других атомов валентность** можно определить (вычислить) из химической формулы вещества. При этом нужно учитывать изложенное выше правило о химической связи. Например, определим валентность x марганца Mn по формуле вещества MnO2:
Общее число химических связей, образуемых одним и другим элементом (Mn и О), одинаково:
x · 1 = 4; II · 2 = 4. Отсюда х = 4, т.е. в этой химической формуле марганец четырехвалентен.
П р а к т и ч е с к и е в ы в о д ы
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т.е. валентность одного элемента равна индексу другого элемента:
Задание 1.2. Определите валентности элементов в соединениях:
П о д с к а з к а. Сначала укажите валентность атомов, у которых она постоянная. Аналогично определяется валентность атомных групп ОН, РО4, SО4 и др.
Задание 1.3. Определите валентности атомных групп (в формулах подчеркнуты):
(Обратите внимание! Одинаковые группы атомов имеют одинаковые валентности во всех соединениях.)
Зная валентности атома или группы атомов, можно составить формулу соединения. Для этого пользуются следующими правилами.
• Если валентности атомов одинаковы, то и число атомов одинаково, т.е. индексы не ставим:
• Если валентности кратны (обе делятся на одно и то же число), то число атомов элемента с меньшей валентностью определяем делением:
• В остальных случаях индексы определяют «крест-накрест»:
Задание 1.4. Составьте химические формулы соединений:
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково. Это правило – следствие закона сохранения массы вещества. Закон сохранения массы: масса исходных веществ равна массе продуктов реакции.
Закон был открыт в XVIII в. М.В.Ломоносовым и, независимо от него, А.Л.Лавуазье.
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли KClO3 получается соль KСl и кислород О2:
KClO3 
Число атомов калия и хлора одинаково, а кислорода – разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
Наконец, между правой и левой частями уравнения можно поставить знак равенства:
Полученная запись показывает, что при разложении сложного вещества KClO3 получаются два новых вещества – сложное KСl и простое – кислород O2. Числа перед формулами веществ в уравнениях химических реакций называют коэффициентами.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым. Составим уравнение реакции веществ CaCl2 и Na3PO4:
П о с л е д о в а т е л ь н о с т ь д е й с т в и й
1) Определим валентность исходных атомов и группы PO4:
2) Напишем правую часть уравнения (пока без индексов, формулы веществ в скобках надо уточнить):
3) Составим химические формулы полученных веществ по валентностям составных частей:
4) Обратим внимание на состав самого сложного соединения Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
5) Число атомов натрия и хлора до реакции теперь стало равным шести. Поставим соответствующий коэффициент в правую часть схемы перед формулой NaCl:
Пользуясь такой последовательностью, можно уравнять схемы многих химических реакций (за исключением более сложных окислительно-восстановительных реакций, см. главу 7).
Типы химических реакций. Химические реакции бывают разных типов. Основными являются четыре типа – соединение, разложение, замещение и обмен.
1. Реакции соединения – из двух и более веществ образуется одно вещество:
А + В 
2. Реакции разложения – из одного вещества получаются два вещества или более:
АВ 
Ca(HCO3)2 
3. Реакции замещения – реагируют простое и сложное вещества, образуются также простое и сложное вещества, причем простое вещество замещает часть атомов сложного вещества:
А + ВХ 
4. Реакции обмена – здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
АВ + XY 
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в схемах реакций:
Na + Cl2 
NaHCO3 
Fe + AgNO3 
Fe(OH)3 + HCl 
Задание 1.6. Расставьте коэффициенты и определите типы химических реакций:
Fe(OH)3 
Al + H2SO4 
HNO3 + Cu(OH)2 
P + O2 
Выводы по главе 1. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Вещества бывают простые и сложные. Состав веществ показывают при помощи химических формул. Формулы веществ составляют, учитывая валентности составных частей. Запись химического процесса при помощи формул называется уравнением химической реакции. Химические реакции бывают разных типов: обмена, замещения, разложения, соединения и др.
Упражнения к главе 1
1. Выучите табл. 1. Проверьте себя, напишите химические символы: серы, цинка, олова, магния, марганца, калия, кальция, свинца, железа и фтора.
2. Напишите символы химических элементов, которые в формулах произносятся как: «аш», «о», «купрум», «эс», «пэ», «гидраргирум», «станнум», «плюмбум», «эн», «феррум», «це», «аргентум». Назовите эти элементы.
3. Укажите число атомов каждого химического элемента в формулах соединений:
4. Определите, какие из веществ – простые, а какие – сложные:
Прочитайте формулы этих веществ.
5. Выучите табл. 2. Составьте химические формулы веществ по известной валентности элементов и атомных групп:
6. Определите валентность химических элементов в соединениях:
7. Расставьте коэффициенты и укажите типы химических реакций:
а) Mg + O2 
б) Al + CuCl2 
в) NaNO3 
г) AgNO3 + BaCl2 
д) Al + HCl 
е) KOH + H3PO4 
ж) CH4 
* Существуют вещества, построенные не из молекул. Но об этих веществах речь пойдет позже (см. главу 4).
** Строго говоря, по нижеизложенным правилам определяют не валентность, а степень окисления (см. главу 7). Однако во многих соединениях числовые значения этих понятий совпадают, поэтому по формуле вещества можно определять и валентность.
Подборка онлайн-ресурсов для «прокачки» химии
Наглядные онлайн-учебники, сайты с инфографикой, youtube и виртуальные лаборатории
Химия — не только один из предметов, по которому школьники сдают ЕГЭ. Это логичная и захватывающая наука о том, как устроен мир вокруг нас. Вместе с преподавателем химии в «Фоксфорде» Еленой Валишиной мы собрали полезные ресурсы, которые помогут изучать этот предмет с интересом и удовольствием.
Онлайн-учебники
Собственная википедия «Фоксфорда». Мы собрали всю школьную программу и немного больше в лаконичную структуру из отдельных статей. В учебнике есть понятные иллюстрации, видео-тьюториалы, возможность сохранять избранные статьи и много другое. И так по всем предметам — не только по химии.
Справочник, который в 2006 году выпустил Томский государственный университет. «Неорганическая химия» — базовый раздел, с которого начинается изучение химии в восьмом классе, поэтому ресурс пригодится для подготовки к ОГЭ, ЕГЭ и олимпиадам.
Больше нужен олимпиадникам и старшеклассникам, которые готовятся к ЕГЭ: органическая химия начинается только в конце девятого класса. Однако в ОГЭ есть один вопрос из органики, поэтому девятиклассникам учебник тоже пригодится.
Сборник авторских лекций, которые подготовил профессор Южного федерального университета Сергей Иванович Левченков. Отличный ресурс для того, чтобы понять логику науки: в какой последовательности происходили самые важные открытия в химии и как они связаны между собой.
Химическая википедия. Этому ресурсу можно доверять, потому что разработчики перевели в электронный вид хорошие справочники по химии. Также они сделали удобный поиск по сайту.
Ещё одно преимущество «Химика» — сервисы, которые помогают школьникам разобраться в сложных темах с помощью наглядных схем. Вот два самых важных из них:
Приложение для проверки своих знаний по строению атома: вводите символ элемента и приложение сразу выдаёт все возможные записи электронной конфигурации его атома.
Сервис помогает разобраться, какие вещества реагируют друг с другом, при каких условиях и что образуется в результате. Например, если ввести в строку поиска уравнение Cl2 + NaOH, можно получить все возможные реакции этих соединений с коэффициентами.
Виртуальные лаборатории
Российский портал, на котором эксперименты из школьной программы можно смоделировать онлайн.
Международный ресурс, которые разрабатывают учёные со всего мира. Позволяет ставить более серьёзные опыты.
Проект по доставке на дом наборов для экспериментов. Также на сайте есть подробные и корректные инструкции по выполнению опытов. Многие ингредиенты для этих опытов можно самостоятельно купить в аптеке или продовольственном магазине. В дополнение к опытам на Mel Science полезно смотреть видео, которые объясняют суть химических явлений.
На портале есть множество полезных статей, подробные разборы опытов, инструкции, как проводить их в домашних условиях и где брать для них реактивы.
Бесплатные видеоуроки для учеников 1‑11 классов и дошкольников
Большая коллекция из 3243 видеоурока по 20 предметам и различным темам
Предмет химии. Вещества
Предмет органической химии
Химические уравнения
Основные сведения о строении атомов
Степень окисления. Бинарные соединения
Взаимодействие атомов элементов-неметаллов между собой
Строение электронных оболочек атомов
Оксиды, их классификация и свойства
Электролитическая диссоциация
Ионные уравнения
Количество вещества. Молярная масса
Электроотрицательность. Ковалентная полярная связь
Не нашли нужный видеоурок?
Давайте закроем пробел в знаниях вместе. Наши специалисты с удовольствием Вам помогут! Первое вводное занятие бесплатно!
Нам важен каждый Ваш отзыв о репетиторах
Отличный учитель, который всегда вовлекает ученика в процесс, и сам проявляет заинтересованность в успехах ученика. Интересно слушать и работать!
Очень качественные и продуктивные занятия. Занимаюсь не долго, но уже чувствуется прогресс. Очень милый и добрый преподаватель. Всё понятно объясняет. Мне, очень нравится заниматься математикой с Елизаветой Владимировной.
Мне понравилось заниматься с Андреем Юрьевичем. Впервые встречаю репетитора, который прежде учить языку, рассказывает про его истоки – географию, культуру, историю. Мне очень откликается такой подход. Видно, что преподаватель с большим опытом. Я очень довольна первым занятием! Буду продолжать заниматься с данным преподавателем.
Ответственная, настойчивая, харизматичная, пунктуальная, высокий уровень проф подготовки, терпеливая. Наша девочка довольна, проявляет явный интерес к урокам и продвинулась в изучаемой теме. Большое спасибо вам и преподавателю Татьяне Александровне.
Прекрасный преподаватель. После восьми занятий английский стал намного лучше, многое узнала. Все понятно в объяснении, уроки на позитиве. Благодарна за работу. Искренне рекомендую.
Все понравилось приятно работать с учителем. Как по мне лучше чем Елена Александровна я еще не видела учителя по русскому языку.
У Дианы Михайловны занимаются английским языком две дочери: Есения и Ксения. Девочкам очень нравится преподаватель и наполнение уроков, материал преподносится в очень интересной форме, а все объяснения понятны и доступны. Девочки уже показали успехи в изучении английского языка в школе.
Дмитрий прошел со Светланой Анатольевной 4 занятия и уже виден прогресс! Мальчик по натуре немного застенчивый, поначалу был немногословен, но уже хорошо разговаривает на уроках, что говорит о профессионализме педагога.
Спасибо огромное. Очень рады, что нашли этот ресурс для занятий. Ирина Сергеевна объясняет все быстро, понятно и динамично. Всего за несколько занятий наверстали упущенное по химии и прошли дальше. Обязательно будем обращаться в дальнейшем.
У Елизаветы есть успехи, занимается с удовольствием и заинтересованностью. Римма Николаевна очень интересно преподносит материал. Очень нравится учитель, занимаемся с удовольствием.
Нам понравилась Нина Ивановна, хороший человек и прекрасный педагог. Очень ответственная, трудолюбивая и толковая. Сразу нашла подход к ученику. Доходчиво объяснит любую тему. Преподаватель, в отличии от многих репетиторов не просто отбывает время, а действительно помогает.
Замечательный педагог, нашла подход с первых занятий. Все очень доходчиво и понятно объясняет. Ребенку очень нравится, просит дополнительные часы для занятий.
Добрый день! Рита Ивановна очень профессионально оценила все пробелы моего сына и нам бы хотелось продолжить с ней обучение! Занятия очень хорошие, учитель понятно все объясняет, всем рекомендую.
Спасибо Ольге Олеговне за проведённый урок в праздничный день. Здоровья, процветания, побольше радостных событий в жизни, благополучия, успехов и удачи в таком не лёгком и таком нужном труде. Спасибо за урок, всё понравилось!
Очень грамотный педагог, хорошо подходит к вопросам с которыми обращаемся, подход к ребенку очень понравился, буквально на 5-8 урок у ребенка был уже прогресс и теперь любит математику. На урок математики приходим с удовольствием, подтянули свои недочеты, решаем быстро примеры, а главное сами. Спасибо за знания!
Светлана Михайловна очень хороший учитель, за урок мы разбираем много вопросов и обсуждаем правила русского языка в каждом конкретном примере. Занимаюсь с удовольствием!
Замечательный, приятный и внимательный преподаватель. Ребенок сначала засмущался от непривычного формата урока, но Дарья Александровна, в итоге, смогла завоевать внимание и доверие дочери. Обязательно будем продолжать обучение! Спасибо!
Репетитор быстро оценила проблемы, порекомендовала способы восполнения пробелов. Продолжим заниматься дальше, так как Светлана Васильевна доступно объясняет материал, и все сразу становится понятным. Классный репетитор, советую!
На уроке педагог работала по индивидуальной программе, выявила пробелы в знаниях и все доходчиво разъяснила. Сложные темы, объяснили легко и понятно, сыну все очень понравилось!
Замечательный педагог и очень доброжелательный человек. Тамара Иосифовна очень доходчиво объяснила непонятные для меня моменты, причем из разных тем, за один урок. Урок проходил в спокойной и дружественной обстановке. Спасибо большое. Очень понравилось.
Спасибо большое, Вы лучший преподаватель по информатике. Как хорошо, что есть такая замечательная платформа. Спасибо всем, кто ее организовал и Вам лично. Всем друзьям и знакомым буду рекомендавать! онлайн-уроки.
Очень понравился урок! Ирина Ивановна с первых минут расположил к себе ребёнка так, что даже мой непоседливый и не очень настроенный на учебу пятиклассник увлекся так, что не заметил, как пролетели 45мин. Спасибо! С удовольствием продолжим занятия!
Мне очень понравилось вводное занятие, спасибо большое. За пол часа Марина Михайловна с помощью разговора поняла все мои слабые места и помогла многие из них подправить и понять. Я хочу заниматься с ней и далее.
Здравствуйте! У нас был пробный урок с Галиной Дмитриевной по математике. Занимались именно логическими задачами. Учитель имеет очень хороший подход к детям и у нее есть своя отработанная хорошая методика. Хорошо объясняет, приятная. Спасибо!
Благодарим за интересное и познавательное занятие! Преподаватель четко и внимательно ведет занятие, обращает внимание на моменты, которые необходимо доработать. Профессионально! Приятно общаться.
Добрый день! Мы безумно рады, что нам посчастливилось найти такого замечательного и удивительного педагога, как Анастасия Сергеевна! Она очень интересно проводит урок, ребёнок безумно рад. Сразу чувствуется, что человек талантливый. С нетерпением ждём новый урок.
Спасибо за урок! Занятие очень понравилось, Сергей Васильевич все понятно и интересно обьясняет, во время урока была доброжелательная атмосфера. Также учитель посоветовал некоторые книги и способы подготовки к экзамену. Спасибо.
Нравятся все педагоги с которыми мы занмаемся, все обладают высоким уровнем профессионализма,используют интересные и современные методы и технологии обучения. Имеет хороший уровень научно-методической подготовки. Ребенок занимается с большим интересом. Будем заниматься с Вами до окончания школы, сейчас мы в 4 классе)
За 45 минут узнала и поняла больше, чем за полгода в школе. Учитель объясняет очень понятно, доходчиво, выше школьного уровня. Однозначно этот урок не последний. С Уважением, Феона.
Спасибо, Наталья Васильевна! Профессионально, четко, по делу. Педагог очень терпеливая, спокойная, уверенная. Занятие очень понравилось и ребенку и мне, маме.
Николай Васильевич помог за короткий срок восполнить пробелы в знаниях, за что очень благодарны! Уроки очень интересные! Будем обращаться еще к нему.
Занятия ребенку с Александром Сергеевичем очень нравятся. Все схватывает, доволен уроками. С репетитором нашли общий язык. Мы очень благодарны Александру Сергеевичу! Хороший педагог. Спасибо.
Дети понимают всё, абсолютно. В школе не понимают ничего, а с Вашими репетиторами понимают всё. Сдвиги очень большие. Алёна Игоревна хороший педагог. Все занятия результативные.
Плохо знаю русский язык, и постоянно делаю многие ошибки в тексте и в работе. Только благодаря достуным объяснениям учителя я мог самостоятельно находить ошибки. Большое спасибо за Вашу работу и сердечные помощи в изучении русского языка!
Мой сын занимался с Ириной Алексеевной, очень понравилось, всё спокойно и понятно было показано, рассказано. Очень профессионально и качественно выстроены занятия, учитель доброжелателен, ребенку интересно заниматься.
До этого никогда не занимался у репетиторов, думал что буду сидеть ничего не понимать и всё время уйдёт зря. Однако Сарвар Шодиевич очень понятно объясняет, не подчёркивает ваши «незнания» и до упора старается всё разъяснить. Могу с уверенностью посоветовать этого репетитора каждому, кто хочет разобраться в алгебре и геометрии.
Выражаю благодарность центру где есть такие сильные и ответственные учителя. Отдельная благодарность Людмиле Евгеньевне за опыт за знания.
Ольга Александровна отлично объясняет темы, с ребенком нашла общий язык моментально. Дочь занимается с удовольствием, пробелы подтянули за пару уроков. Спасибо Вам большое!
Сыну очень понравилось заниматься с Гузалией Робертовной. Очень внимательный и доброжелательный педагог, который сразу видит слабые стороны. Всячески поощряет ребёнка и помогает поднять самооценку. Большое спасибо!
Нравится, как преподает Мария Никитична (по программе школы + присутствует игровая минутка, ученице на занятиях не бывает скучно) Уровень знаний повысили до 5-ки, значительно расширили словарный запас. Все устраивает, рекомендует знакомым и в целом рада, что такая платформа существует.
Спасибо. Урок понравился. Даниил Станиславович заинтересовал английским языком. Составили предположительные темы для занятий после новогодних праздников
Грамотный, добрый, располагающий к себе педагог. С ребёнком Екатерина Станиславовна установила хороший контакт. Преподносит информацию очень доступно. Занятие проходит разнообразно, в том числе в игровой форме. Рекомендуем 5+
Алла Валентиновна отличный преподаватель! Выявила все пробелы в знаниях Константина по русскому языку и работает над их устранением. Также помогает в работе над текущими темами урока. Уже прошли несколько занятий и продолжаем заниматься. нашла общий язык с сыном. Все нравится. Хотим заниматься дальше!
Классный репетитор, все темы разбираются на 5+, будем обязательно продолжать обучение, также рекомендуем всем ученикам!
Замечательный педагог, с которым нравится заниматься. Максим готовится к сдаче ОГЭ по русскому языку и занимается с репетитором с начала ноября прошлого года. За это время успели повторить пройденный материал и изучить несколько тем нового материала. Надежда Викторовна объясняет материал в доступной форме. Максим продолжит с ней занятия.
Преподаватель компетентный, объясняет понятно, выше школьного уровня. Быстро заполняет пробелы в знаниях. Будем сотрудничать. С Уважением, Феона.
Очень чётко и понятно объяснила Мария Анатольевна. Спасибо вам. Не смотря первый раз, пробную занятия, она прям очень понравилась дочке и естественно мне💐. В дальнейшем обязательно будем заниматься с ней и подниматься.
Отличный учитель, который всегда вовлекает ученика в процесс, и сам проявляет заинтересованность в успехах ученика. Интересно слушать и работать!
Очень качественные и продуктивные занятия. Занимаюсь не долго, но уже чувствуется прогресс. Очень милый и добрый преподаватель. Всё понятно объясняет. Мне, очень нравится заниматься математикой с Елизаветой Владимировной.
Мне понравилось заниматься с Андреем Юрьевичем. Впервые встречаю репетитора, который прежде учить языку, рассказывает про его истоки – географию, культуру, историю. Мне очень откликается такой подход. Видно, что преподаватель с большим опытом. Я очень довольна первым занятием! Буду продолжать заниматься с данным преподавателем.
Органическая химия для «чайников»: история, понятия
Базовые основы органической химии для чайников
Если вы поступили в университет, но к этому времени так и не разобрались в этой нелегкой науке, мы готовы раскрыть вам несколько секретов и помочь изучить органическую химию с нуля (для «чайников»). Вам же остается только читать и внимать.
Основы органической химии
Органическая химия выделена в отдельный подвид благодаря тому, что объектом ее изучения является все, в составе чего есть углерод.
Органическая химия – раздел химии, который занимается изучением соединения углерода, структуру таких соединений, их свойства и методы соединения.
Органические соединения, количество которых сегодня достигает 20 млн, очень важны для полноценного существования всех живых организмов. Впрочем, никто и не сомневался, иначе человек просто закинул бы изучение этого непознанного в долгий ящик.
Чтобы хотя бы минимально понять органическую химию, приготовьтесь много читать
Цели, методы и теоретические представления органической химии представлены следующим:
Немного из истории органической химии
Вы можете не верить, но еще в далекой древности жители Рима и Египта понимали кое-что в химии.
Как мы знаем, они пользовались натуральными красителями. А нередко им приходилось использовать не готовый естественный краситель, а добывать его, вычленяя из цельного растения (например, содержащиеся в растениях ализарин и индиго).
Органическая химия зародилась давно, просто люди называли это иначе
Можем вспомнить и культуру употребления алкоголя. Секреты производства спиртных напитков известны в каждом народе. Причем многие древние народы знали рецепты приготовления «горячей воды» из крахмал- и сахарсодержащих продуктов.
Так продолжалось долгие, долгие годы, и только в 16-17 веках начались какие-то изменения, небольшие открытия.
В 18 веке некто Шееле научился выделять яблочную, винную, щавелевую, молочную, галловую и лимонную кислоту.
Дальше – интереснее: в 1773 году его коллега по ремеслу Руэль сумел выделить мочевину из человеческой мочи.
Тогда всем стало ясно, что продукты, которые удалось выделить из растительного или животного сырья, имели много общих черт. В то же время они сильно отличались от неорганических соединений. Поэтому служителям науки нужно было срочно выделить их в отдельный класс, так и появился термин «органическая химия».
Несмотря на то, что сама органическая химия как наука появилась лишь в 1828 году (именно тогда господину Вёлеру удалось выделить мочевину путем упаривания цианата аммония), в 1807 году Берцелиус ввел первый термин в номенклатуру в органической химии для чайников:
Раздел химии, который изучает вещества, полученные из организмов.
Следующий важный шаг в развитии органический химии – теория валентности, предложенная в 1857 году Кекуле и Купером, и теория химического строения господина Бутлерова от 1861 года. Уже тогда ученые стали обнаруживать, что углерод – четырехвалентен и способен образовывать цепи.
В общем, с эти самых пор наука регулярно испытывала потрясения и волнения благодаря новым теориям, открытиям цепочкам и соединениям, что позволяло так же активно развиваться органической химии.
У углерода четыре валентности
Но это уже совсем другая история, которую вы можете изучить сами. Далее мы предлагаем вам посмотреть научно-популярное видео про органическую химию для чайников:
Ну а если вам некогда и срочно нужна помощь профессионалов, вы всегда знаете, где их найти.
Наталья – контент-маркетолог и блогер, но все это не мешает ей оставаться адекватным человеком. Верит во все цвета радуги и не верит в теорию всемирного заговора. Увлекается «нейрохиромантией» и тайно мечтает воссоздать дома Александрийскую библиотеку.
Урок 3. Молекулы и простые вещества
В уроке 3 «Молекулы и простые вещества» из курса «Химия для чайников» рассмотрим, что такое молекулы, простые вещества, а также металлы и неметаллы. Напоминаю, что в прошлом уроке «Относительная атомная масса химических элементов» мы рассмотрели разные способы выражения массы химических элементов.
Атомы химических элементов существуют в природе как в свободном, так и в связанном состоянии. Например, благородные газы — гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe — находятся в воздухе в виде одиночных атомов. Атомы всех остальных элементов в природе не существуют изолированно друг от друга. Они всегда стремятся соединиться, связаться с другими атомами за счет особых сил. Почему? Так они достигают более устойчивого состояния. Это одна из иллюстраций всеобщего принципа природы — стремления к максимально устойчивому состоянию.
Что такое молекула?
Из курса физики вы уже немного знаете о молекулах — частицах вещества, состоящих обычно из двух и более атомов. Что же такое молекула?
Молекула — наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
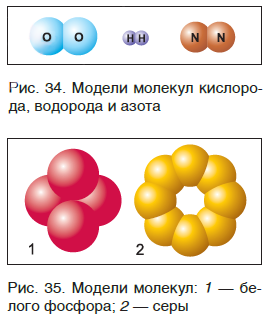
Молекулы благородных газов одноатомны, а молекулы таких веществ, как кислород, водород, азот, хлор, бром, состоят из двух атомов (рис. 34). Молекула фосфора содержит четыре атома, а серы — восемь (рис. 35).
Простые вещества
Если вещества состоят из атомов одного вида, то они относятся к простым веществам.
Простыми называются вещества, которые образованы атомами одного химического элемента.
Простые вещества — одна из форм существования химических элементов в природе. Простые вещества, состоящие из молекул, относятся к веществам молекулярного строения. При обычных условиях среди них есть газы (водород, кислород, азот, фтор, хлор, благородные газы), жидкости (бром) и твердые вещества (сера, иод, фосфор).
Элемент кислород существует в виде двух простых веществ молекулярного строения: одно из них (просто кислород) состоит из двухатомных молекул, а второе (озон) — из трехатомных.
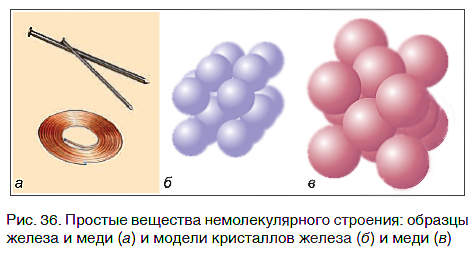
Связываясь друг с другом, атомы образуют не только молекулы. Гораздо больше простых веществ, которые имеют немолекулярное строение. Они обычно представляют собой твердые кристаллические вещества, построенные из атомов, например кристаллы алмаза, графита, меди, железа (рис. 36).
Металлы и неметаллы
Простые вещества по их свойствам делят на металлы и неметаллы.
Все металлы при комнатной температуре являются твердыми веществами (за исключением ртути), которые проводят электрический ток и теплоту, имеют характерный металлический блеск. Многие из металлов пластичны, т. е. меняют свою форму при механическом воздействии. Благодаря этому свойству металлы можно ковать, расплющивать, вытягивать в проволоку.
Большинство простых веществ — металлы, и все они имеют немолекулярное строение.

Хотя простых веществ неметаллов гораздо меньше, по своим свойствам они различаются между собой значительно сильнее, чем металлы. Почти все они плохо проводят электрический ток и теплоту. Многие из неметаллов при обычных условиях являются хрупкими твердыми веществами (рис. 37), другие — газами (рис. 38), а бром — жидкостью (рис. 39). Большинство неметаллов существует в виде молекул, но некоторые имеют немолекулярное строение, например бор, углерод, кремний.
Алмаз и графит — это простые вещества, состоящие из атомов одного и того же химического элемента — углерода. Хотя они оба имеют немолекулярное строение, свойства этих веществ сильно отличаются: алмаз — прозрачное, самое твердое в природе вещество, а графит — темно-серое, непрозрачное, мягкое вещество (рис. 40). Их свойства различны потому, что различно строение их кристаллов, хотя состоят эти кристаллы из одних и тех же атомов — атомов углерода.
Названия простых веществ
В настоящее время известно более 400 простых веществ, хотя элементов пока открыто только 118. Названия большинства простых веществ такие же, как и названия соответствующих химических элементов. Только у элемента углерода простые вещества (как вы уже знаете) имеют собственные названия, да еще у элемента кислорода есть простое вещество озон.
Необходимо различать понятия простое вещество и химический элемент, поскольку в большинстве случаев их названия совпадают.
Химический элемент — это определенный вид атомов. Поэтому название химического элемента — это то, что объединяет атомы данного вида. У всех таких атомов есть общие черты. Каждый химический элемент обозначается с помощью соответствующего химического знака.
В то же время понятие простое вещество обозначает конкретное химическое вещество, образованное атомами одного вида. Оно характеризуется определенными составом, строением, физическими и химическими свойствами.
Например, если говорят о том, что в состав какого-то вещества входит азот, то имеют в виду атомы этого химического элемента, а когда говорят об азоте, который входит в состав воздуха, то, конечно, речь идет о простом веществе.
Более подробно о различии понятий «простое вещество» и «химический элемент» вы узнаете в главах 2, 3.
Краткие выводы урока:
Надеюсь урок 3 «Молекулы и простые вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.