Пликация вены что это
Пликация глубоких вен нижних конечностей и таза как метод хирургической профилактики тромбоэмболии легочной артерии
Дата доклада: 19.05.2015
Секция: Секционное заседание «Новые подходы и решения в лечении сосудистой патологии»
1 ГБУЗ НО ГКБ №13; 2 ГБУ РМЭ Республиканская клиническая больница;
Тромбоз глубоких вен (ТГВ) нижних конечностей и вызванная им тромбоэмболия легочной артерии (ТЭЛА) представляют собой одну из важных проблем медицины. Частота ТГВ в общей популяции составляет около 160 на 100 000 с частотой фатальной ТЭЛА 60 на 100 000 населения в год. Более 25% случаев ТГВ и ТЭЛА напрямую связаны с хирургическими вмешательствами.
ЦЕЛЬ: оценка эффективности хирургического лечения ТГВ с флотирующим тромбом в условиях ГБУ РМЭ «Республиканская клиническая больница» при отсутствии возможности имплантации кава-фильтра.
МЕТОДЫ: На базе отделения сосудистой хирургии ГБУ РМЭ РКБ с 2010 по 2014 год выполнено 43 операции пациентам с флотацией головки тромба глубоких вен нижних конечностей. Более половины пациентов (27 пациентов, 62,8%) составляли пациенты гинекологического и травматологического профиля, у которых ТГВ протекал бессимптомно и был выявлен в ходе предоперационного УЗДС вен нижних конечностей. 28 операций (65,15%) выполнено на уровне бедренного сегмента, 13 операций (30,2%) на уровне подвздошного сегмента и 2 операции (4,65%) на нижней полой вене. Операция пликации вены заключалась в наложении 1-3 (в зависимости от диаметра вены) отдельных П-образных швов с захватом обеих стенок, швы накладывались вдоль вены нитью пролен 5/0, расстояние между швами 2-3 мм. У 26 пациентов (60,5%) пликация вены комбинировалась с тромбэктомией из дистальных отделов венозного русла.
РЕЗУЛЬТАТЫ: Тромбозов выше уровня пликации и эпизодов ТЭЛА не было ни у одного из прооперированных больных. После операции наблюдалось 37 пациентов (86%). На отдаленных сроках при УЗ-контроле было выявлено сохранение пликации у всех пациентов на сроке 3 месяца, у 19 пациентов (44,2%) произошла реканализациия, то есть прорезывание швов с восстановлением просвета вены, на сроке до 6 месяцев, у 35 пациентов (81,4%) реканализация на сроке до 12 месяцев, у 36 пациентов из 37 (97,3%) реканализация наступила через 24 месяца. У 9 пациентов из 37 (24,3%) произошла эмболия пликации оторвавшейся головкой тромба с последующей реканализацией.
ВЫВОДЫ: Пликацию вены выше уровня флотирующей головки тромба (с тромбэктомией из дистальных отделов венозного русла), следует считать операцией выбора при отсутствии возможности имплантации временного кава-фильтра. Преимущества пликации вены перед перевязкой заключается в сохранении кровотока по вене после выполнения пликации, при этом не происходит усугубления явлений венозной недостаточности. При отсутствии тромбоза на уровне пликации происходит прорезывание швов с полным восстановлением просвета вены на отдаленных сроках. Также пликация вен технически возможна на различных уровнях венозной системы, от уровня бедренной вены до нижней полой вены для минимизации гемодинамических нарушений. Операция выполнима сосудистым хирургом в условиях общехирургического отделения, в ЦРБ, не требует технически сложного и дорогостоящего оборудования, но вместе с тем эффективно защищает пациента от тромбоэмболии легочной артерии.
Тромбэктомия и пликация вен как метод профилактики тромбоэмболии легочной артерии в многопрофильном хирургическом стационаре
Галкин С.В., Пашин Н.В., Дедюхин И.Г., Александров А.Г., Лебедева М.В.
Отделение торакально-сосудистой хирургии, Республиканская клиническая больница, Республика Марий-Эл, Йошкар-Ола, Россия
Проведена оценка эффективности и безопасности операции пликации глубоких вен нижних конечностей, вен таза, нижней полой вены как метода профилактики фатальной тромбоэмболии легочной артерии. Оперировано 48 больных, в т.ч. больных травматолого-ортопедического профиля – 23, общехирургического – 3, гинекологического – 4, сосудистого (изолированный тромбоз глубоких вен) – 18. Длина флотирующей головки тромба составляла от 2 до 10 см. Наличие флотирующего тромба у больных травматологического, хирургического и гинекологического профилей, независимо от длины флотирующей части, являлось абсолютным показанием к тромбэктомии и пликации вены. Сосудистые больные оперированы согласно Национальным рекомендациям (при длине флотирующей части тромба не менее 4 см).
Во всех случаях хирургическое лечение предполагало прямую и непрямую тромбэктомию. Пликацию всегда выполняли выше уровня венотомии.
Показано, что тромбэктомия в сочетании с пликацией магистральных вен является надежным и безопасным методом профилактики, а в некоторых случаях – единственно возможным способом предотвратить фатальную тромбоэмболию легочной артерии. Операция пликации позволяет не отменять запланированное хирургическое вмешательство у больных с выявленным флотирующим тромбом магистральных вен. Операцию тромбэктомии и пликации выше уровня флотирующей головки тромба можно считать операцией выбора в условиях отсутствия возможности использования эндоваскулярных методов лечения (имплантация кава-фильтра, эндоваскулярная катетерная тромбэктомия), а также у беременных женщин. Восстановление просвета вены происходит на безопасных сроках самостоятельно и не требует повторного хирургического вмешательства. Симультанное выполнение пликации вены не осложняет течение послеоперационного периода основного хирургического вмешательства. Тромбэктомия и пликация не вызывают развития тяжелой хронической венозной недостаточности.
КЛЮЧЕВЫЕ СЛОВА: тромбоэмболия легочной артерии, венозные тромбоэмболические осложнения, тромбоз глубоких вен, тромбэктомия, пликация вен.
Синдром нижней полой вены

Нижняя полая вена (НПВ) находится с правой стороны от аорты; затем она проходит позади тонкой кишки и поджелудочной железы; проникает через диафрагму в средний отдел грудной полости и в полость правого предсердия. Через систему кровообращения нижней полой вены проходит 70% всей венозной крови. Поэтому нарушение проходимости по этому крупному сосуду ведёт к системным нарушениям гемодинамики и ухудшению венозного оттока из нижних конечностей.
Классификация
Различают две формы синдрома НПВ:
Развивается при травме НПВ или тромбозе ранее установленного кава-фильтра. Иногда может произойти на фоне компрессии полой вены опухолью и увеличении степени свёртываемости крови. Характеризуется внезапным отёком обеих нижних конечностей, может сопровождаться болями в ногах и вздутием подкожных вен. При острой закупорке НПВ возможно развитие циркуляторного шока из-за внезапного уменьшения венозного возврата («пустой» выброс из сердца).
Развивается на фоне синдрома сдавливания НПВ опухолью или рубцовых изменениях после установленного кава-фильтра. Хроническая окклюзия сопровождается медленным развитием хронической венозной недостаточности, появлением вторичного варикозного расширения вен на брюшной стенке и нижних конечностях. С течением времени возможно развитие трофических язв на обеих голенях.
 Причины возникновения и факторы риска
Причины возникновения и факторы риска
Синдром нижней полой вены может быть вызван такими заболеваниями как:
Симптомы заболевания
Симптоматика закупорки почечного сегмента НПВ:
Прогноз
При остром развитии клинической картины окклюзии нижней полой вены прогноз для жизни неблагоприятен. Необходимо рассчитывать на эффективность лечения методами тромболизиса или тромбэктомии из нижней полой вены. В случае восстановления кровотока необходимо длительно наблюдаться у флеболога и искать причины развития заболевания, чтобы не допустить рецидива.
Хроническая окклюзия НПВ протекает с постепенным ухудшением венозного оттока. При успешном выполнении реканализации нижней полой вены возможно обратное развитие симптоматики хронической венозной недостаточности.
Преимущества лечения в клинике
Диагностика
Дифференциальный диагноз
Необходимо проводить различие с отёком на фоне хронической сердечной недостаточности и асцитом, связанным с циррозом печени. Для сердечной недостаточности характерны другие симптомы, такие как одышка, низкая толерантность к физической нагрузке. Инфаркты или мерцательная аритмия в анамнезе. Для цирроза печени более характерно скопление жидкости в животе, в то время как ноги остаются обычного объёма. Желтуха и расширение подкожных вен живота характерны для цирроза, в тоже время крупный варикоз передней брюшной стенки чаще встречается при синдроме нижней полой вены, а лечение у этих двух заболеваний разное.
Ультразвуковое исследование глубоких вен
Имея в наличии современные аппараты ультразвуковой диагностики можно достоверно оценить проходимость нижней полой вены и подвздошных вен. В зависимости от степени поражения сосуда может наблюдаться сужение или полная закупорка нижней полой вены. УЗИ может помочь с определением проходимости почечных вен и печёночного сегмента. Диагностический алгоритм включает исследование поверхностных и глубоких вен нижних конечностей, системы вен малого таза. Нередко УЗИ позволяет выявить патологию, которая привела к развитию венозного тромбоза. С помощью ультразвука возможно оценить проходимость кава-фильтра в НПВ и корректность его установки по отношению к почечным венам. Данных ультразвукового исследования обычно бывает достаточно для назначения консервативного лечения.
Если предполагается хирургическое лечение, то необходима точная визуализация поражённых венозных сегментов. Современная медицина располагает для этого большими возможностями.
Это бесконтрастное исследование глубоких вен при помощи магнитно-резонансного томографа. В сильном магнитном поле протоны отклоняются и затем, возвращаясь в обычное положение, выделяют электромагнитный сигнал. Так как организм состоит преимущественно из воды, изучение энергии протонов позволяет выявить структуру органов и тканей. С помощью МРТ можно оценить проходимость глубоких вен нижних конечностей и брюшной полости, выявить состояние окружающих внутренних органов. Исследование позволяет не только обнаружить сосудистую патологию, но и причины её вызывающие (сдавление опухолями малого таза, почек и забрюшинного пространства).
Это рентгеновское контрастное исследование глубоких вен с помощью компьютерного томографа. В отличие от обычной компьютерной томографии флебография должна выполняться специально обученным персоналом, так как контраст, вводимый в подкожные вены ног должен быть чётко дозирован для лучшей визуализации проблемной области.
Флебография
Это контрастное исследование, выполняемое через введение контраста непосредственно в глубокие вены нижних конечностей к зоне хирургического интереса. Применяется перед выполнением эндоваскулярной операции в качестве окончательного метода диагностики.
Лечение

Острый тромбоз нижней полой вены требует лечения в условиях специализированного стационара сосудистой хирургии. Задачей лечения является восстановление проходимости НПВ. Эта задача успешно решается с помощью методов эндоваскулярной хирургии. Существуют современные тромболитические препараты и эндоваскулярные зонды для удаления тромботических масс.
Тромболизис
 Ангиопластика и стентирование
Ангиопластика и стентирование
Консервативная терапия
Наиболее частым вариантом лечения является консервативная терапия с применением антикоагулянтов. К препаратам, применяемым при синдроме нижней полой вены, относят антикоагулянт варфрин или ксарелто. Для улучшения оттока крови из ног применяют детралекс или флебодию. Основным средством консервативного лечения является постоянное ношение компрессионных колготок 2-3 класса компрессии. Их необходимо менять каждые 3 месяца, так как они теряют свои свойства при длительной носке.
Лечение симптомов синдрома нижней полой вены лекарственными препаратами и компрессией способно уменьшить хроническую венозную недостаточность. Учитывая техническую сложность хирургического лечения, консервативные методы являются преобладающими в современной медицинской практике.
Тромбоз глубоких вен
Тромбоз глубоких вен, наряду с тромбофлебитом подкожных вен и тромбоэмболией легочных артерий объединяют в единое понятие – венозные тромбоэмболические осложнения (ВТЭО).
Венозный тромбоз – острое заболевание, характеризующееся образованием тромба в просвете вены с более или менее выраженным воспалительным процессом и нарушением тока крови. Наличие воспалительного компонента в зоне тромбоза определяет другое название этой болезни – тромбофлебит.
Тромбоз глубоких вен (ТГВ) – заболевание, негативно отражающееся не только на системе венозного и лимфатического возврата, но и ухудшающее функцию сердечно-сосудистой системы в целом.
Если не предпринимать активных действий к устранению данной патологии, дальнейшее течение патологического процесса принимает стойкий, склонный к саморазвитию и необратимый характер.
История изучения флеботромбоза
Изучение флеботромбоза глубоких вен насчитывает более 400 лет.
Окклюзия магистральных вен как причина гангрены впервые была описана F.Hildanus в 1593 г. Первое упоминание об илеофеморальном флеботромбозе появилось в медицинской литературе 300 лет назад, оно было сделано Mauriceau.
Понятие «тромбофлебита» впервые ввел в медицину английский хирург Джон Хантер (1728-1793), который много оперировал огнестрельные и иные ранения и отмечал частоту воспалительных процессов, сочетающихся с образованием тромбов в венах.
Интерес к флеботромбозу глубоких вен значительно возрос после создания теории венозного тромбоэмболизма выдающимся немецким патологоанатомом Р.Вирховым. Вскрывая в 1844 г. труп молодого человека, внезапно погибшего после того, как у него появились боли в бедре, Вирхов обнаружил тромб в правой бедренной вене и скрученный тромб в легочной артерии. После этого он ввел в медицинскую терминологию понятия «тромб» и «эмбол». В 1845 году, обнаружив в 18 случаях венозных тромбов из 76 аутопсий, в 11 случаях выявив наличие тромбоэмболии в легочную артерию, он пришел к заключению, что тромбы образуются в венах и переносятся с током крови в легочную артерию. Им же была сформулирована классическая триада, по-прежнему являющаяся наиболее полным отражением звеньев патогенеза локального сосудистого тромбообразования.
Первой русскоязычной монографией, посвященной этой проблеме, был труд И.Ф. Клейна «О тромбозе, эмболии и ихорремии», опубликованный в 1863 году.
Несмотря на то, что острые глубокие флеботромбозы в различных вариантах локализации и клинического течения существенно между собой различаются, объединяет их общность основных этиопатогенетических процессов. В основе представлений о флеботромбозах как нозологической группе лежит классическая триада Вирхова.
Несмотря на то, что тромботический процесс может развиться на любом уровне магистральных вен, более чем в половине случаев исходной точкой его развития в центростремительном направлении являются вены голени.
В подавляющем большинстве случаев тромбоз первично локализуется в венах голени, а в дальнейшем нарастает в проксимальном направлении в подколенную, бедренную и подвздошные вены.
Достаточно подробно исследован вопрос о значении факторов риска и пусковых факторах тромбозов :
Симптомы тромбоза
К симптомам острого флеботромбоза глубоких вен относятся:
Впрочем, местная гипертермия и боли походу более характерны для поверхностных тромбофлебитов. Последние же следует относить скорее к факторам риска по развитию тромбозов глубоких вен.
Классические симтомы ТГВ:
Oбщая чувствительность/специфичность этих симптомов от 3 до 91%.
Наличие симптомов не подтверждает ТГВ. Отсутствие симптомов не исключает ТГВ (до 50% пациентов не имеют ни одного клинического симптома).
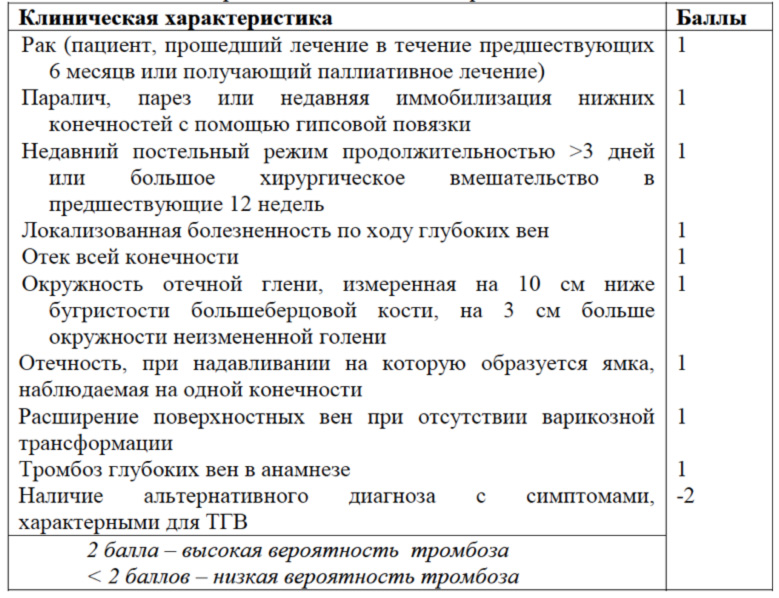
Расчет вероятности тромбоза
В 1997 году Wells и соавторы разработали и протестировали клиническую модель вероятности ТГВ
Наличие каждого признака оценивается в 1 балл:
При физикальном исследовании обнаруживаются положительные симптомы:
Однако, те же симптомы будут положительными и при любом другом воспалительном процессе в исследуемой конечности.
При вовлечении в процесс бедренной вены больные отмечают ноющие боли по медиальной поверхности конечности соответственно проекции Гюнтерова канала.
Тромбоз общей бедренной вены проявляется более выраженным увеличением объема голени и даже бедра, цианозом кожных покровов, интенсивность которого возрастает по направлению к периферии. Отмечается расширение подкожных вен в дистальной части бедра и на голени. Если тромбоз распространяется на устье большой подкожной вены бедра, то развивающаяся в поверхностной венозной системе гипертензия приводит к выключению перекрестных с контралатеральной конечностью анастомозов. При этом наблюдается усиление рисунка подкожных вен в области лобка и паха. При пальпации сосудистый пучок болезненен на всем протяжении бедра. Период выраженного венозного стаза длится 3-4 дня, после чего наступает медленное уменьшение отека. Этот феномен обусловлен включением в кровообращение коллатеральных систем. Таким образом, снижение болевого синдрома и невыраженность отека могут создавать мнимое благополучие и часто влекут за собой позднее обращение к специалисту. Кроме того, флеботромбоз может протекать вообще без каких-либо жалоб со стороны пациента (бессимптомно), особенно у послеоперационных больных.
Из более или менее характерных симптомов:
Наибольшее значение в плане постановки предварительного диагноза имеет отек. Однако, ни один из перечисленных клинических симптомов не может считаться абсолютно достоверным в диагностике данной нозологии. Любые, даже самые минимальные жалобы пациента (например: на простой дискомфорт в дистальных сегментах нижней конечности), особенно в сочетании с наличием факторов риска, требуют дополнительного обследования пациента на наличие флеботромбоза.
Таким образом, можно заключить, что наличие флеботромбоза на основании анамнеза, жалоб пациента и клинических симптомов можно лишь заподозрить с тем, чтобы в ходе дальнейшего обследования подтвердить или исключить его существование, определить локализацию и эмбологенную опасность. Отсутствие патогномоничной симптоматики и наличие периода мнимого улучшения являются причиной поздней госпитализации больных, что во многих случаях ограничивает возможность эффективного хирургического лечения.
Диагностические тесты у пациентов с подозрением на ТГВ
Лечение тромбоза
Задачи или цели проводимого лечения предельно конкретно сформулированы на сегодня:
1. Остановить распространение тромбоза.
2. Предотвратить тромбоэмболию легочных артерий.
3. Не допустить прогрессирования отека и предотвратить венозную гангрену.
4. Восстановить проходимость вен и функции клапанного аппарата с тем, чтобы в дальнейшем избежать развития посттромбофлебитической болезни.
5. Предупредить рецидив тромбоза.
Условно современные подходы к лечению пациентов с острыми флеботромбозами в бассейне нижней полой вены можно разделить на три основных:
3. Хирургическая агрессия.
Консервативная терапия
В комплекс мероприятий данного подхода входят:
При своевременном применении вышеуказанных методов удается восстановить проходимость вен и минимизировать проявления посттромботической болезни.
Малоинвазивные методы
На сегодняшний день это самая распространенная в клиническом применении группа методов, призванная решать все из перечисленных выше задач или целей лечения больных с глубокими флеботромбозами.
Здесь необходимо выделить три подгруппы методов:
1. Установка кава-фильтров и парциальная кавапликация.
2. Регионарный и системный тромболизис.
3. Катетерная тромбэкстракция и фармакомеханическая тромбэктомия.
Установка кава-фильтров и парциальная кавапликация
В настоящее время предпочтительно применять временные кава-фильтры. Извлекается временный кава-фильтр не позднее третьей недели.
В подавляющем большинстве случаев установка кава-фильтра вообще не требуется.
Почему не желательно устанавливать постоянный кава-фильтр?
Всегда нужно помнить, что постоянный кава-фильтр – это пожизненный прием антикоагулянтных препаратов и пожизненный риск тромбоза фильтра (инородное тело в просвете вены часто осложняется тромбозом).
Уже неоднократно отмечено, что в результате установки кава-фильтров в ближайшем периоде с частотой 1,5-8% могут возникать ТЭЛА, а в сроки до 3 лет с частотой 12-25% возникает тромбоз нижней полой вены.
При тромбозах ниже паховой связки установка кава-фильтра нецелесообразна, поскольку существуют другие методы профилактики ТЭЛА.
Регионарный и системный тромболизис, катетерная тромбэкстракция, реолитическая тромбэктомия
Тромболитическая терапия. Метод основан на введении препаратов, активирующих эндогенный фибринолиз (стрептокиназа, урокиназа, ТАП и др.).
Видимо потому, что используемые в данном методе средства воздействия на тромб могут быть эффективными только в относительно свежих участках тромба (до 3-5 суток), так низка его эффективность. Между тем, применение регионарного катетерного тромболизиса в 44% случаев позволило некоторым авторам сохранить клапанную функцию и тем самым предотвратить развитие посттромботической болезни.
Катетерная тромбэкстракция. Сразу следует уточнить, что данный метод применяется только к высоким сегментам бассейна нижней полой вены, так как сама технология не позволяет применить его в инфраингвинальной позиции за счет препятствий, образованных клапанным аппаратом вен на этом и ниже лежащих уровнях. Метод основан на захвате в специальный мешок-контейнер тромбомасс из доступных сегментов нижней полой и подвздошных вен и удалении их путем выведения через флеботомическое отверстие.
Фармакомеханическая тромбэктомия. Самая новая из всех интервенционных и хирургических технологий. Пока в литературе имеются описания отдельных случаев. Метод основан на эффекте Бернулли, где скорость гидродинамической струи создает области отрицательного давления в окружающих средах. Метод имеет ту же область применения, что и катетерная тромбэктомия.
Хирургические вмешательства при бедренно-подколенных флеботромбозах
Известно, что наиболее эффективная тромбэктомия возможна только при тромбах давностью не более 3-7 суток.
В настоящее время большинство авторов все же придерживается осторожной тактики при хирургическом удалении тромбомасс из бедренно-подколенного сегмента, завершая операцию перевязкой или резекцией приустьевого сегмента собственно-бедренной вены, оценивая ближайшие результаты как хорошие по невыраженности симптомов хронической венозной недостаточности. Расчет при таком подходе ведется на переключение основного венозного потока, на глубокую вену бедра, которая и должна обеспечить устойчивый магистральный отток. В ряде случаев, в качестве профилактики ретромбоза применяются артериовенозные фистулы.
Рядом исследователей применяется тактика хирургической антеградной тромбэктомии и без последующей перевязки или лигирования собственно бедренной вены, в некоторых случаях дополняемая пликацией собственно бедренной вены или без таковой.
Пликация вены что это
Цель исследования — улучшить результаты хирургического лечения флотирующего тромба наружной подвздошной вены.
Материал и методы. С 2011 по 2013 г. хирургическому лечению подверглись 20 пациентов с флотирующим тромбом в наружной подвздошной вене. Им выполнялось ультразвуковое дуплексное сканирование, по данным которого флотирующая часть головки тромба располагалась в наружной подвздошной вене и исходила из поверхностной бедренной вены, длина флотирующей части тромба варьировала от 6 до 20 см. В экстренном порядке выполнялось оперативное лечение — тромбэктомия флотирующей части тромба из наружной подвздошной вены. В зависимости от метода профилактики тромбоэмболии легочной артерии (ТЭЛА) все пациенты были разделены на две группы. В 1-ю (основную) группу вошли 6 (30%) пациентов, которым после тромбэктомии и восстановления целостности бедренной вены наложен разработанный нами пликационный шов ниже устья глубокой вены бедра, во 2-ю (контрольную) группу — 14 (70%) пациентов, которым выполнена традиционная резекция бедренной вены ниже уровня впадения глубокой вены бедра с наложением бокового пристеночного шва. Критерием применения указанной методики явились давний тромбоз с выраженным асептическим воспалением стенки бедренной вены и окружающих тканей.
Результаты. В раннем послеоперационном периоде при дуплексном сканировании пристеночный тромбоз бедренной вены установлен у 1 (16,6%) пациента 1-й группы, у 3 (24,1%) — 2-й группы. После резекции бедренной вены во 2-й группе у 4 (28,5%) пациентов отмечена непродолжительная лимфорея из послеоперационной раны, в основной группе подобного осложнения не было. Случаев кровотечения, гематом, нагноения послеоперационных ран, ТЭЛА и летальных исходов не было в обеих группах.
В отдаленном послеоперационном периоде в сроки от 6 мес до 2 лет результаты лечения сравнивались по классу хронической венозной недостаточности (ХВН). В 1-й группе у 2 (33,3%) из 6 обследованных пациентов ХВН достигла С4, у остальных 4 (66,6%) не превышала С3. У пациентов 2-й группы тяжесть ХВН была более выраженной у 4 (40%) из 10 обследованных пациентов, симптомы сХВН прогрессировали до С5, у остальных 6 (60%) не превышали С3. По данным ультразвукового дуплексного сканирования, в 1-й группе у 4 (66,6%) пациентов реканализация вен наступила в более ранние сроки в течение 2 мес, у остальных 2 (33,3%) пациентов в сроки более 4 мес. У пациентов 2-й группы реканализация подколенно-берцового сегмента наступила позже, через 6—10 мес. Случаев ТЭЛА, летальных исходов в отдаленном периоде не отмечено.
Вывод. Выполнение тромбэктомии из наружной подвздошной вены при флотирующих тромбозах с последующим наложением пликационного шва на бедренную вену способствует надежному предотвращению ТЭЛА и снижению степени хронической венозной недостаточности в отдаленном периоде.
Хирургическая тактика при наличии флотирующего тромба вен нижних конечностей
Борисов В.А., Красовский В.В., Фролов А.А..
В настоящее время хирургическая тактика при наличии флотирующего тромба четко не определена. За период 2009—2013 гг. нами наблюдались 1443 больных с венозными тромбозами, из них 767 (53,2%) — в системе глубоких вен и 676 (46,8%) — в системе поверхностных вен. Диагноз ставился с учетом клинических проявлений (отечность, гиперемия, синюшность, болезненность), а у 13% больных тромбозы протекали без ярко выраженной клинической картины, и диагноз подтверждался результатами инструментальных методов диагностики, среди которых основным, по нашему мнению, является ультразвуковое сканирование. Грозным осложнением венозного тромбоза является эмболия легочной артерии (ТЭЛА), которую выявили у 87 (6%) пациентов: 1-я группа наблюдения, без ТЭЛА — 1356 (94%) — 2-я группа. Важным прогностическим моментом мы считали наличие флотации верхушки тромба, обнаруженную в 184 случаях от общего количества. В 1-й группе выявили 47 тромбов с флотацией, во второй —137. Комплекс лечебных мероприятий включал обязательное использование антикоагулянтов, дезагрегантов и флеботоников. Хирургическая тактика в группах пациентов зависела от нескольких, на наш взгляд, важных обстоятельств. В первую очередь учитывали наличие флотирующего тромба, особенно протяженностью свыше 3 см, наличие тромбоэмболии легочной артерии в анамнезе, а также расположение последнего в подвздошно-бедренном сегменте. Хирургическая тактика в 1-й группе была более активной, оперировали 38 (43,7%) пациентов. Во 2-й группе прибегли к хирургическому вмешательству у 29 (2,9%) больных. Чаще от операции воздерживались у пациентов 2-й группы, в связи с выявленной положительной динамикой при ультразвуковом сканировании: отсутствие признаков его нарастания, фиксация тромба через 2—3 сут на фоне проводимой антикоагулянтной терапии. Активная хирургическая тактика предпринималась также у больных с рецидивирующим характером тромбоэмболии легочной артерии даже без флотации тромба — 96 (7,6%). По поводу флотирующего тромба и профилактики рецидива ТЭЛА выполнены следующие операции: пликация или лигирование венозного сосуда выше места тромбообразования, тромбэктомия в ряде случаев с последующей пликацией или лигированием, операция Троянова. Тромбэктомия с пликацией выполнялась при наличии флотирующей части тромба в месте венозного конфлюэнса в бедренном и подвздошном сегментах.
Вывод. Анализируя вышеизложенное, мы считаем, что хирургическая тактика при наличии флотирующего тромба должна быть более активной, особенно это утверждение касается пациентов с протяженностью тромба 3—4 см и более, ТЭЛА в анамнезе, а также с локализацией в подвздошно-бедренном сегменте.
Значение ультразвукового дуплексного сканирования для выбора тактики хирургического лечения при тромбозах вен нижних конечностей
Борисов В.А., Лукьянова Л.В., Карпова О.В., Фролов А.А..
Ультразвуковое дуплексное сканирование является основным методом исследования при патологии вен, которое отличается высокой информативностью и безопасностью для пациента.
Материал и методы. В нашей клинике этот метод используется с 1998 г. С 2009 по 2013 г. было выполнено 10 509 исследований. В 2821 случае подтверждена варикозная болезнь, в 964 — посттромботическая болезнь, в 1740 — венозный тромбоз. Ультразвуковое дуплексное сканирование — это также основной метод обследования при подозрении на венозный тромбоз. Важнейшей задачей исследования в этой группе пациентов явилось выявления тромбированных вен. Тромбоз чаще был протяженным и захватывал один или несколько венозных сегментов. При исследовании в В-режиме просвет вены частично или полностью заполнялся гиперэхогенными неоднородными структурами. Окклюзия сосуда чаще сопровождалась увеличением диаметра вены, отсутствием движения ее стенок при глубоком дыхании и компрессии датчиком. Самым важным этапом диагностики, на наш взгляд, являлась визуализация головки тромба, которую удалось оценить в 1122 случаях. У 246 (21,9%) пациентов выявлена флотация головки тромба. Достоверным признаком флотирующего тромба в В-режиме мы считаем отсутствие фиксации к стенкам вены и выявление его движений в просвете сосуда в поперечном и продольном направлениях. В ряде случаев выявлению флотации способствовало проведение исследования в вертикальном положении (если позволяло состояние больного) или осторожное проведение пробы Вальсальвы, а также компрессия проксимально расположенных мышечных массивов конечностей. В прогнозировании эмбологенности головки тромба большое значение придавали протяженности ее флотации и диаметру основания. Широкое основание и длину до 3 см мы расценивали как прогностически благоприятные признаки, позволявшие у некоторых пациентов отсрочить оперативное лечение, а в 167 (68%) случаев воздержаться от него.
Вывод. Таким образом, современное хирургическое лечение патологии вен нижних конечностей должно быть не только обоснованным и максимально радикальным, но и оптимально малотравматичным. Исходя из этих требований, операции должна предшествовать точная топическая диагностика. Кроме того, выявление и оценка в динамике тромба, особенно флотирующего, с помощью ультразвукового дуплексного сканирования позволяет корректировать хирургическую тактику.
Особенности церебральной гемодинамики у больных с тромбозом сигмовидного и поперечного синусов головного мозга
В настоящее время остается малоизученным вопрос об изменениях внутримозговой гемодинамики при венозном тромбозе сигмовидных и поперечных синусов головного мозга.
Цель исследования — изучение и сравнение особенностей церебральной гемодинамики по данным транскраниального дуплексного сканирования (ТКДС) внутримозговых сосудов и экстракраниальных сосудов (ЭКДС) у больных с ишемическим инсультом (ИИ) и тромбозом сигмовидных и поперечных синусов (ТСПС).
Материал и методы. В 1-ю группу, состоящую из исследуемых, были включены 4 больных с ТСПС, во 2-ю (контрольную) группу — 4 больных с И.И. Критериями включения являлись: возраст 40—60 лет; неврологический дефицит по NIHSS от 5 до 10 баллов. Для подтверждения ИИ использовались методы: спиральная компьютерная томография (СКТ) и магниторезонансная томография (МРТ). Для подтверждения ТСПС применялась МРТ в режиме бесконтрастной венозной ангиографии. Всем больным проведено дуплексное сканирование экстра- и интракраниальных артерий. Также обязательным условием являлось отсутствие выраженных атеросклеротических изменений экстракраниальных артерий.
Результаты. Сравнительные данные по ТКДС по группам: в 1-й группе, по данным ТКДС, показатели линейной скорости кровотока и индекс периферического сопротивления находились в пределах нормы, либо наблюдались незначительные повышения показателей без межполушарной ассиметрии, что свидетельствовало о состоятельности перетоков. Во 2-й группе, по данным ТКДС, практически все показатели линейной скорости кровотока были снижены, а периферическое сопротивление, наоборот, было повышенным. Наблюдалось увеличение линейной скорости кровотока (свыше 25 см/с) по вене Розенталя на контралатеральной стороне тромбоза. Помимо снижения скорости кровотока, в парных артериях (средняя (СМА) и задняя (ЗМА) мозговые артерии) стала более выраженной асимметрия кровотока на стороне тромбоза. Сравнительные данные по ЭКДС по группам: в 1-й группе показатели линейной скорости кровотока по сонным артериям и индекс периферического сопротивления находились в пределах нормы. Линейная скорость кровотока по внутренней яремной вене находилась в пределах нормы. Во 2-й группе показатели линейной скорости кровотока по сонным артериям и индекс периферического сопротивления находились в пределах нормы. Наблюдалось увеличение размеров яремной вены с одновременным увеличением скорости кровотока на контралатеральной стороне тромбоза.
Вывод. Выявлена взаимосвязь в виде недостаточности артериального и венозного звеньев церебрального кровообращения при ТСПС. Снижение линейной скорости кровотока в парных артериях (СМА и ЗМА) более выражено на стороне тромбоза, в сочетании с увеличением линейной скорости кровотока по вене Розенталя явилось характерным признаком затруднения венозного оттока при контралатеральном тромбозе сигмовидного и поперечного синусов. По разнице между скоростями в венах Розенталя можно предположить локализацию тромбоза поперечных синусов — в контралатеральной тромбозу вене Розенталя.
Операция пликации бедренной вены в лечении флотирующего тромбоза глубоких вен
Бредихин Р.А., Малясев Д.В..
Межрегиональный клинико-диагностический центр, Казанский медицинский университет, Казань, Россия
Цель исследования — оценить безопасность и эффективность операции пликации бедренной вены (БВ) у пациентов с острым эмбологенным тромбозом глубоких вен (ТГВ) бедренно-подколенного сегмента.
Материал и методы. В основу работы легли результаты диагностики и лечения 29 пациентов в возрасте от 26 до 83 лет (средний возраст 53,2±14,03 года) с флотирующим ТГВ бедренно-подколенного сегмента, которые находились на лечении в отделении сосудистой хирургии МКДЦ с марта 2012 г. по декабрь 2013 г. Диагностику ТГВ проводили методом ультразвукового дуплексного ангиосканирования (УЗДС) всем пациентам. Мультиспиральную компьютерную томографию (МСКТА) с целью диагностики тромбоэмболии легочной артерии (ТЭЛА) выполнили в 18 случаях. Выполнено 11 операций пликации БВ (основная группа) и 18 операций перевязки БВ (контрольная группа), в сочетании с тромбэктомией из общей бедренной вены (ОБВ) в случае ее тромбоза (2 — в основной и 4 — в контрольной группах). Консервативное лечение в послеоперационном периоде в обеих группах было стандартным и включало назначение непрямых антикоагулянтов на 6 мес, компрессионного трикотажа и прием микронизированной очищенной флавоноидной фракции — на 3 мес. Выраженность симптомов хронической венозной недостаточности (ХВН) оценивали с использованием шкалы Venous Clinical Severity Score — VCSS. Проводилась оценка динамики маллеолярного объема.
Результаты. Из 29 случаев ТГВ тромбоз подколенной вены выявлен у 4 (14%) пациентов, тромбоз БВ — у 19 (65%) и ОБВ — у 6 (21%). ТГВ левой нижней конечности выявлен в 17 (59%) случаях, правой — в 12 (41%). Из 18 проведенных МСКТА ТЭЛА выявлена в 14 (77,7%) случаях, причем клиника ТЭЛА присутствовала только у 6 (42%). Случаев ТЭЛА после операции не выявлено. Отдаленные результаты лечения на сроках до 1 года отслежены у 22 пациентов (8 из основной группы и 14 из группы контроля). Зафиксирован один летальный исход у пациентки контрольной группы вследствие Cr легкого. Тромбоз в области пликации не выявлен. По шкале VCSS интегральный показатель у пациентов с пликацией БВ составил 4,88±0,83 против 7,50±0,94 в группе с ее перевязкой (t=6,5; p 0,05). В верхней трети голени — 1,3±0,7 и 2,85±0,5 (t=3,3; p
Структура госпитальной летальности проделывает эволюцию, обусловленную изменениями возрастных категорий пациентов и нарастанием их коморбидности. Наиболее обсуждаемыми патологическими состояниями, приводящими к смерти хирургических больных, являются венозные тромбоэмболические осложнения (ВТЭО) и хирургический сепсис.
Цель исследования — определить удельный вес ВТЭО и сепсиса в структуре летальности пациентов хирургического профиля по данным аутопсий МАУ ГКБ № 40 в 2011 г.
Материал и методы. Проанализированы протоколы вскрытий 140 пациентов хирургического профиля, умерших в 2011 г. Выделены три группы пациентов: 1-я группа — умершие от сепсиса — 76 (54,2%), 2-я группа — верифицированы ВТЭО без явлений сепсиса — 10 (7,1%), 3-я группа — найдена конкурирующая патология (сепсис + ВТЭО) — 20 (14,2%). 34 пациента исключены из обработки, так как не имели вышеуказанных патологических отклонений. Каждая группа проанализирована по полу, возрасту, основному заболеванию, наличию и отсутствию хирургических вмешательств, фоновым и сопутствующим заболеваниям. Выборка материала осуществлена по специально разработанным формам. Анализ и обобщение полученных данных производились в программе Microsoft Office Exel (2009) с использованием стандартной статистики.
Результаты. Во всех группах умерших преобладали женщины, средний возраст превысил 60 лет. По основному заболеванию все пациенты были поделены на основные блоки: с гнойно-септической патологией, онкологическими заболеваниями и нарушениями кровообращения. Распределение по основной патологии демонстрирует, что в 1-й группе пациентов значимо преобладали гнойные процессы (78,3%), хотя и в 3-й группе имелась та же тенденция (63%). Основное место в этом блоке заболеваний занимал перитонит: 1-я группа — 48,5% и 3-я группа — 37%. Онкологические заболевания осложнялись прежде всего ВТЭО. Во 2-й группе онкологические заболевания составили 45%, в 3-й группе — 26%. Тромбозы мезентериальных и церебральных сосудов часто осложнялись смертельными ТЭЛА, однако и удельный вес сепсиса здесь был достаточно весом. Из всех умерших были прооперированы 83 (78,3%) человека: в 1-й группе — 64 (84,2%), во 2-й — 3 (30,0%), в 3-й — 16 (80,0%). Наименьшее количество оперированных во 2-й группе объясняется крайней тяжестью пациентов при поступлении, вся летальность в этой группе больных была досуточной. Среди всех оперированных более половины составили пациенты, хирургические вмешательства у которых были выполнены по поводу перитонита, — 60 (72,3%). Эти больные составили наибольшее количество умерших при явлениях хирургического сепсиса (1-я группа) — 47 (78,3%).
Вывод. В структуре летальности пациентов хирургического профиля сепсис как непосредственная причина смерти зарегистрирован в 3 раза чаще, чем ВТЭО. У пациентов, умерших от сепсиса, в 70% случаев причиной его развития была разнообразная гнойно-септическая патология, прежде всего перитонит (48,5%). Коморбидный фон больных, умерших от сепсиса, ВТЭО или сочетания «сепсис + ВТЭО» был очень тяжелым, представленный сердечно-сосудистой патологией (100%), заболеваниями желудочно-кишечного тракта (80%), ожирением и сахарным диабетом 2-го типа.
Наш первый опыт применения ривароксабана в лечении больных с идиопатическим тромбозом глубоких вен
Варданян А.В., Баданян А.Л., Мумладзе Р.Б., Патрушев Л.И., Ройтман Е.В., Ананко В.А., Шагинян А.Р.,
По эпидемиологическим данным во всем мире более 3 млн смертей обусловлены развитием венозных тромбоэмболических осложнений (ВТЭО), наиболее частой причиной которых является тромбоз глубоких вен (ТГВ). При этом тактика лечения как в России, так и за рубежом не стандартизирована.
Цель исследования — анализ полученных нами результатов лечения больных с идиопатическим ТГВ ривароксабаном.
Материал и методы. Проведен анализ результатов лечения 35 больных (16 (45,7%) мужчин и 19 (54,3%) женщин) в возрасте 23—65 лет с идиопатическим ТГВ за период с октября 2013 г. Методом диагностики тромбозов системы нижней полой вены (НПВ) явилось ультразвуковое ангиосканирование (УЗАС), проведенное на всех этапах контроля за эффективностью лечения. Лабораторная диагностика системы гемостаза включала общепринятые тесты, в том числе диагностику тромбинемии. У 28 (80%) больных проведено молекулярно-генетическое исследование полиморфизмов: мутации FV Leiden, мутации G20210A в гене протромбина, С10034Т в гене фибриногена-γ, C677T в гене метилентетрагидрофолатредуктазы МТГФР, 4G/5G-полиморфизма в гене PAI. В условиях стационара лечение пациентов с ТГВ включало подкожное введение лечебных доз гепаринов различной молекулярной массы с переходом на оральный ингибитор Ха фактора ривароксабан в фиксированной начальной дозе 15 мг и дальнейшей профилактической дозе 20 мг, не требующий лабораторного мониторинга. В амбулаторном порядке среди 35 больных с ТГВ 29 (82,8%) были переведены с варфарина на ривароксабан вследствие неконтролируемых целевых значений МНО и развитием геморрагических осложнений.
Результаты. При УЗАС системы НПВ у 27 (77,1%) больных был обнаружен проксимальный ТГВ, а у 8 (22,9%) — дистальный. При этом у 7 (20%) пациентов имела место двусторонняя локализация ТГВ. При гемостазеологическом исследовании у 12 (34,3%) больных с ТГВ исходно отмечались признаки тромбинемии — повышение концентрации РФМК, а повышение уровня D-димера — у 32 (91,4%) пациентов. По данным ДНК-диагностики выявлены различные ДНК-ассоциированные тромбофилии, носившие мультигенный характер: гомо- и гетерозиготные мутации FV Leiden — у 1 (3,5%) и у 6 (21,4%) пациентов, в гене протромбина — у 7 (25%), фибриногена — у 18 (64%), МГТФР — у 21 (75%), PAI 1 — у 12 (42,8%) больных. Следует отметить, что выявлена взаимосвязь между степенью распространения тромбоза и мутацией FV Leiden: при мультигенной форме тромбофилии, сочетании мутации FV Leiden с мутациями в генах протромбина, либо РАI-1 присутствовал двусторонний тромбоз с распространением преимущественно на проксимальные глубокие вены. Многососудистая локализация тромбоза в бассейне НПВ в сочетании с острым тромбозом подключичной вены (синдром Педжета—Шреттера) диагностирована у 3 (10,7%) больных с мультигенной формой тромбофилии в присутствии мутации FV Leiden. В отдаленных результатах проведенной антитромботической терапии 35 пациентов в разные сроки лечения рецидива ТГВ и геморрагических осложнений не отмечалось. Полная реканализация просвета сосуда по данным УЗАС выявлена у 9 (25,7%) больных, частичная — у 25 (71,4%).
Вывод. Использование нового орального антикоагулянта ривароксабана стало эволюционным шагом в лечении больных с ТГВ, особенно в клинических ситуациях при нерегулируемых целевых значениях МНО, послуживших причиной рецидивов ТГВ, либо геморрагических осложнений. Вторичная длительная профилактика ВТЭО у больных с мутацией FV Leiden, перенесших ТГВ, предпочтительна в современных условиях также ривароксабаном.
Оценка эффективности реолитической тромбэктомии в зависимости от сроков тромбоза в системе нижней полой вены
Волков С.В., Коробков А.О., Соколов А.Л., Луценко М.М., Мостовой И.В., Багин С.А., Лядов К.В..
Цель исследования — оценить влияние сроков манифестации флотирующего тромбоза в системе нижней полой вены на эффективность реолитической тромбэктомии (РТ) устройством AngioJet 9000 (Possis Medical).
Материал и методы. Проведен ретроспективный анализ 38 случаев флотирующих тромбозов в системе нижней полой вены. У 34 пациентов (1-я группа) давность тромбоза не превышала 7 дней, у 4 пациентов (2-я группа) — от 7 до 14 дней с момента манифестации. Диагноз подтверждался по данным УЗАС вен нижних конечностей. Всем пациентам проводилась антикоагулянтная терапия.
Результаты. У всех 34 (89,5%) больных 1-й группы был достигнут технический успех — флотирующие части тромбов были удалены полностью. Во 2-й группе технического успеха достигнуто не было: у 2 (5,2%) пациентов удалены только фрагменты тромба, у остальных 2 (5,2%) — флотирующие части удалить не удалось. Во 2-й группе выявлена тромбоэмболия в предварительно имплантированный кава-фильтр (2,6%), что потребовало выполнения РТ из кава-фильтра. В обеих группах интра- и послеоперационных тромбоэмболий легочных артерий отмечено не было.
Вывод. Реолитическая эндоваскулярная тромбэктомия является быстрым, эффективным и малотравматичным методом в устранении эмболоопасных тромбозов вен нижних конечностей. Одним из преимуществ данной технологии является возможность реолитической тромбэктомии даже из имплантированного кава-фильтра, в случае возникновения такой необходимости. У больных с эмболоопасным тромбозом в системе нижней полой вены наибольшая эффективность РТ наблюдалась в первые 7 дней от момента манифестации. При длительности тромбоза более 7 дней РТ оказалась малоэффективна.
Индивидуальная оценка пользы и риска проведения антикоагулянтной терапии при лечении пациентов с венозными тромбозами
Илюхин Е.А., Демехова М.Ю., Шонов О.А., Золотухин И.А..
Санкт-Петербург, Москва, Россия
Венозные тромбоэмболические осложнения (ВТЭО) являются распространенной причиной смертности и инвалидизации пациентов. Летальность, вероятность рецидива ВТЭО, развития посттромботического синдрома зависят от адекватного характера, интенсивности и продолжительности антикоагуляции. Ввиду отсутствия систематизированной информации принятие решения о проведении стартовой антикоагуляции и особенно о целесообразности продления антикоагуляции в различные сроки от первичного ТГВ может представлять значительные трудности для клиницистов.
Цель исследования — провести обзор литературы актуальных исследований по оценке эффективности и безопасности проведения или отмены антикоагулянтной терапии ВТЭО для последующего создания алгоритма индивидуальной оценки риск/польза натикоагуляции.
Материал и методы. Проведен поиск и анализ публикаций результатов клинических исследований по оценке риска геморрагических осложнений при проведении антикоагулянтной терапии и риска рецидива ВТЭО по базе Medline без ограничения по срокам публикаций. Критерии отбора — рандомизированные контролируемые исследования, проспективные когортные исследования, обзоры с метаанализом данных по частным вопросам ведения ВТЭО или систематические обзоры. Дополнительно учтены Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений, 2010 г., Handbook of Venous Disorders Guidelines of the American Venous Forum, 2009 г., рекомендации Международнго общества по изучению тромбозов и гемостаза 2012 г., UpToDate версия 19.3, 2013 г.
Вывод. Целесообразность проведения, интенсивность и длительность антикоагулянтной терапии зависит от характера тромбоза (идиопатический или спровоцированный), уровня поражения, а также риска развития кровотечения на фоне антикоагулянтной терапии. В принятии решения о проведении антикоагуляции следует учитывать ценности и предпочтения пациента. В настоящее время отсутствуют данные высокой доказательности об эффективности и безопасности антикоагуляции свыше 3 мес. Продление терапии свыше этого срока основывается на оценке специалистом конкретной клинической ситуации. Данный обзор и разработанный алгоритм могут использоваться в качестве справочного материала при индивидуальной оценке польза/риск продления антикоагуляции.
Использование очищенной микронизированной флавоноидной фракции диосмина для коррекции эндотелиальной дисфункции при моделировании экспериментального венозного тромбоза
Калинин Р.Е., Сучков И.А., Новиков А.Н., Пшенников А.С..
В настоящее время эндотелиальная дисфункция (ЭД) занимает центральное место в этиологии и патогенезе широкой группы заболеваний, в том числе различных поражений венозной системы. Очищенная микронизированная флавоноидная фракция (МОФФ) является представителем препаратов группы выбора с доказанными эффектами на проницаемость капилляров, активацию лейкоцитов и свободнорадикальное окисление.
Материал и методы. Эксперимент выполнен на 35 самках крыс линии Wistar с массой 250—350 г. Животным под наркозом выполнялась перевязка правой общей подвздошной вены и введение дистальнее лигатуры 0,3 мл подогретого до 37—37,5 °С раствора тромбина (40 ЕД/кг). C 11-х суток от момента оперативного вмешательства и на протяжении 6 мес животным энтеральным путем вводилась водная суспензия МОФФ в дозе 100 мг/кг в сутки. Выведение животных из эксперимента в количестве 7 особей производилось на 10-е сутки, 1, 2, 3 и 6 мес с момента оперативного вмешательства с последующим определением биохимических показателей ФСЭ.
Результаты. Как видно из таблицы, колебания основных биохимических показателей ФСЭ позволяют с уверенностью говорить, что воспроизведение венозного тромбоза влияет на ФСЭ, с заметными изменениями биохимического профиля.

Как следует из таблицы, во всех моделях после их постановки отмечаются сопоставимые в количественном отношении результаты. Наблюдается достоверное снижение метаболитов оксида азота (II), повышение уровня МДА и, как следствие, компенсаторная активация антиоксидантной системы, проявляющейся в увеличении уровня СОД. Применение препарата МОФФ вызывает достоверное (р
 Причины возникновения и факторы риска
Причины возникновения и факторы риска Ангиопластика и стентирование
Ангиопластика и стентирование